Антибиотикорезистентность: How to make antibiotics great again*?
23 октября 2017
Антибиотикорезистентность: How to make antibiotics great again*?
- 7520
- 0
- 19
«Независимо от их популярности антибиотики никогда не станут вирусными».
сайт twitter.com
-
Автор
-
Редактор
-
Иллюстратор
Устойчивость бактериальных инфекций к антибиотикам уже влияет на систему мирового здравоохранения. Если действенные меры не будут приняты, то ближайшее будущее станет похоже на Апокалипсис: из-за резистентности к лекарствам погибнет больше людей, чем умирает сейчас от рака и диабета вместе взятых. Однако обилия новых антибиотиков на рынке так и не появляется. О том, какие есть способы улучшить работу уже использующихся антибиотиков, что такое «ахиллесова пята» бактерий и как личинки мух помогают ученым, читайте в этой статье. Также «Биомолекуле» удалось получить информацию от компании «Superbug solutions Ltd» об их открытии — антибактериальном агенте M13, который уже прошел первые испытания на животных. Его комбинация с известными антибиотиками помогает эффективно бороться против грамположительных и грамотрицательных бактерий (в том числе — антибиотикорезистентных), замедлять развитие устойчивости бактерий к антибиотикам и предотвращать образование биопленок.
Антибиотикорезистентность

Спецпроект о борьбе человечества с патогенными бактериями, возникновении устойчивости к антибиотикам и новой эре в антимикробной терапии.
Спонсор спецпроекта — Superbug Solutions Ltd. — разработчик новых высокоэффективных бинарных антимикробных препаратов.
На сайте Forbes спецпроект представляет статья под названием «Борьба за выживание. Погибнет ли человечество из-за устойчивости к антибиотикам».
Что делать, если инфекции, которые человечество уже умеет лечить, выходят из-под контроля и вновь становятся опасными? Есть ли жизнь в постантибиотической эре? Именно о том, что мы можем вступить в эту эпоху, объявила в апреле 2014 года ВОЗ. Особую тревогу вызывает то, что антибиотикорезистентность уже стала одной из основных проблем для врачей во всем мире (об ее истоках подробно рассказано в первой части спецпроекта — «Антибиотики и антибиотикорезистентность: от древности до наших дней» [1]). Особенно это распространено в отделениях интенсивной терапии, где есть микроорганизмы с множественной лекарственной устойчивостью. Наиболее часто встречающиеся внутрибольничные патогены с резистентностью даже окрестили ESKAPE: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acetinobacter baumanni, Pseudomonas aeruginosa и Enterobacter spp. На английском языке тут получается каламбур: escape означает «побег», то есть это патогены, которые сбегают от антибиотиков [2]. Трудности возникли в первую очередь именно с грамотрицательными бактериями, поскольку структура их оболочки затрудняет проникновение лекарств внутрь, а те молекулы, что уже смогли «прорваться», выкачиваются из бактерии обратно специальными молекулами-насосами [3].
В мире энтерококковая резистентность уже появилась к часто используемым ампициллину и ванкомицину. Устойчивость развивается даже к антибиотикам последнего поколения — даптомицину и линезолиду [4]. Для обработки данных по России наши соотечественники уже создают карту чувствительности микроорганизмов к антибиотикам по всей стране, основываясь на исследованиях ученых из НИИ антимикробной химиотерапии НИИАХ и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии МАКМАХ (данные постоянно обновляются).
Профилактические меры уже не способны бороться с распространением антибиотикорезистентности, особенно в отсутствие новых лекарств [5]. Новых же антибиотиков крайне мало — в том числе и потому, что интерес фармкомпаний к их разработкам снизился. Ведь кто будет делать бизнес на том препарате, который скоро может уйти с рынка, если и к нему разовьется устойчивость (а развиться она может в некоторых случаях всего за два года)? Это банально экономически невыгодно.
Несмотря на это, новые средства борьбы с бактериями нужны как никогда — страдают от сложившейся ситуации в первую очередь обычные люди. Устойчивость к антибиотикам уже влияет на заболеваемость, смертность и стоимость лечения пациентов. Этот процесс может затронуть любого: тратится больше средств на лечение, удлиняется время пребывания в больнице, а риски осложнений и летального исхода растут. Британцы оценивают глобальную ежегодную смертность минимум в 700 тысяч человек. По последним данным ВОЗ, в списке десяти ведущих причин смертности в мире три места занимают бактериальные инфекции и/или болезни, ими опосредованные. Это респираторные инфекции нижних дыхательных путей (3 место по данным последнего бюллетеня — за 2015 год — 3,19 млн человек), диарейные болезни (8 место — 1,39 млн человек) и туберкулез (9 место — 1,37 млн человек). От 56,4 млн случаев смерти во всем мире это составляет более 10%.
Только в США, по оценкам Центров по контролю и профилактике заболеваний (CDC), антибиотикорезистентные инфекции поражают более 2 миллионов человек. Кроме того, к этому числу стоит прибавить 250 000 тысяч — это минимальная оценка количества пациентов в США с Clostridium difficile (заболеваемость этой инфекций тоже связана с нечувствительностью к антибиотикам, но опосредованно).
Учитывая растущую антибиотикорезистентность, эти люди могут оказаться неизлечимы. Причем улучшением диагностики и методов лечения, направленных только на палочки Коха, вызывающие туберкулез, можно спасти более 770 000 жизней за ближайшие 10 лет. Скольких же смертей можно было бы избежать, если это отнести ко всем инфекциям? По оценкам британских ученых, если ситуация не изменится, 100 миллионов человек к 2030 году умрут преждевременно, а за 35 лет эта цифра достигнет 300 миллионов.
Помимо очевидных проблем со здоровьем населения, для государства это означает и дополнительные затраты из бюджета. В год дополнительно требуется более $20 млрд на здравоохранение. Страдает и экономика: потери из-за снижения производительности труда оценивают в $35 млрд [6].
По оценкам масштабного исследования Review on Antimicrobial Resistance, заказанного британским правительством, будущее выглядит еще более пугающим. Мировая ежегодная смертность из-за антибиотикорезистентности достигнет к 2050 году десяти миллионов — суммарно это больше, чем сейчас смертей от онкологических заболеваний и сахарного диабета (8,2 миллиона и 1,5 миллиона соответственно — см. рис. 1). Затраты обойдутся миру в огромную сумму: до 3,5% от его общего ВВП или до $100 триллионов. В более же обозримой перспективе мировой ВВП уменьшится на 0,5% к 2020 году и на 1,4% к 2030 году.
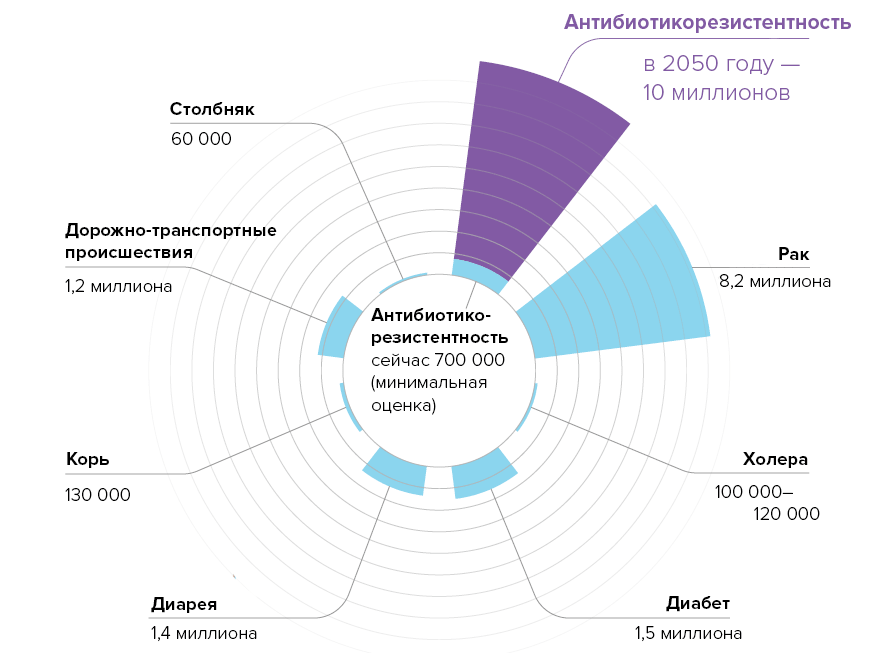
Рисунок 1. Мировая смертность к 2050 году по расчетам британского исследования Review on Antimicrobial Resistance: от антибиотикорезистентности будет умирать больше людей, чем от онкологий и диабета вместе взятых.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Елены Беловой на основе amr-review.org
«Если мы не сможем никак на это повлиять, то мы сталкиваемся с почти немыслимым сценарием, в котором антибиотики перестают работать, а мы возвращаемся в темные века медицины», — прокомментировал Дэвид Кэмерон, действующий на тот момент премьер-министр Великобритании.
Другое видение: новые антибиотики, не подверженные резистентности
Как же справиться с устойчивостью патогенных бактерий к антибиотикам? Первая мысль, которая приходит в голову, — это сделать новые антибиотики, устойчивость к которым не будет развиваться. Этим ученые сейчас и занимаются: главной мишенью препаратов для них стала клеточная стенка бактерий.
Его Величество Липид-II
Липид-II — это молекула плазматической мембраны бактерий. Его функция в биосинтезе бактериальной стенки заключается в том, что он переносит «строительные блоки» пептидогликанов (рис. 2). Использовать его в качестве мишени очень удобно, поскольку липид-II считается довольно консервативной молекулой для бактерий, а у эукариот его вовсе нет. За это некоторые исследователи даже окрестили его «ахиллесовой пятой» патогенов [7–9]. К сожалению, как выяснилось со временем, и к антибиотикам, нацеленным на липид-II, может возникнуть резистентность.
Подробнее про взаимодействия липида-II с другими молекулами и его работу можно почитать в статье на «Элементах» [10].
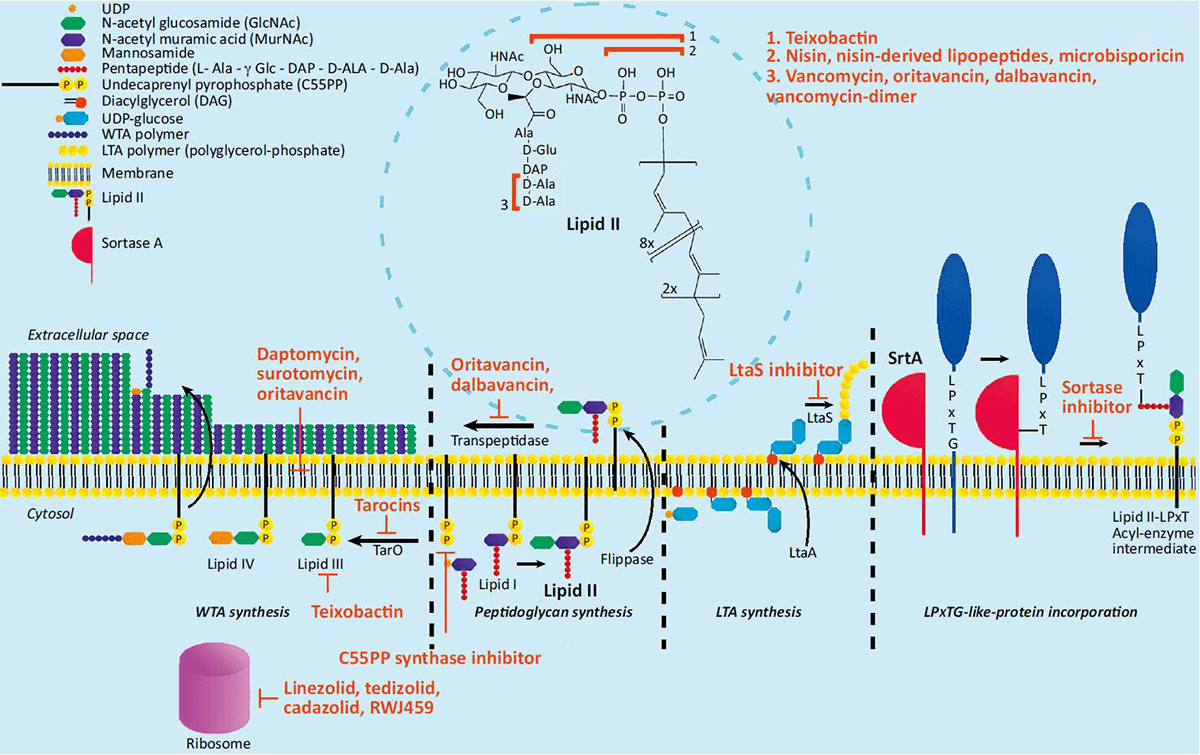
Рисунок 2. Биосинтез бактериальной клеточной стенки и мишени новых антибиотиков, нацеленных на разные звенья этого механизма.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Один из самых известных антибиотиков, действующих на липид-II и использующихся в клинической практике, — это ванкомицин. Долгое время его монотерапия помогала бороться с энтерококками, но сейчас бактерии уже вырабатывают к нему резистентность (хронологию можно посмотреть в первой статье цикла [1]). Особенно в этом преуспели E. faecium.
Ванкомицин, подвинься
Новым антибиотиком, который может успешно заменить ванкомицин, считают тейксобактин. Публикация Кима Льюиса (Kim Lewis) и коллег, где о нем впервые рассказывалось, прогремела в Nаture в 2015 году [12]. Помог совершить это открытие разработанный учеными новый метод iChip: бактерии из почвы рассеивали по отдельным ячейкам на металлической пластине и затем возвращали в ту же почву и к тем же условиям окружающей среды, откуда бактерии «были родом». Так удавалось воспроизвести рост всех микроорганизмов, которые живут в почве, в естественных условиях (рис. 3).
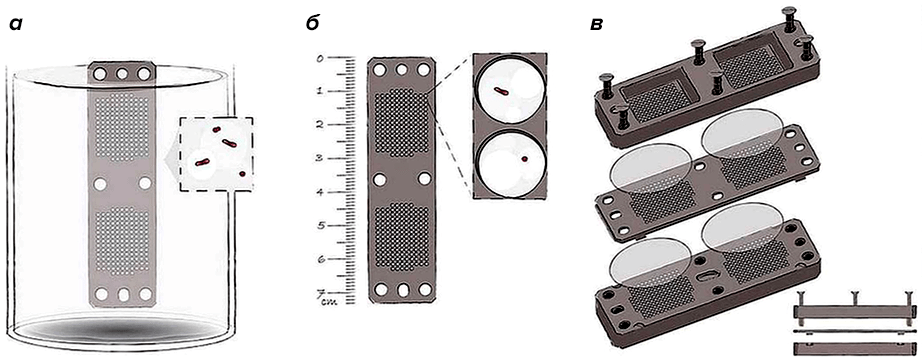
Рисунок 3. Общий вид iChip (a) и его составные части: центральная пластина (б), в которую помещены растущие микроорганизмы, и полупроницаемые мембраны с каждой из сторон, отделяющие пластину от окружающей среды, а также две поддерживающие боковые панели (в). Краткое описание метода — в тексте.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Этот метод Фрэнсис Коллинз (Francis Collins), директор Национального института здоровья США (NIH) (штат Мэриленд) назвал «гениальным», поскольку он расширяет возможности поиска новых антибиотиков в почве — одном из самых богатых источников этих лекарств [13]. До iChip выделение новых потенциальных антибиотиков из бактерий грунта было ограничено из-за сложного процесса выращивания их в лаборатории: в искусственных условиях могут расти не более 0,5% бактерий.
Тейксобактин обладает более обширным действием, чем ванкомицин. Он связывает не только липид-II даже у ванкомицинорезистентных бактерий, но и липид-III, предшественника WTA — стеночной тейхоевой кислоты. Этим двойным ударом он может еще сильнее мешать синтезу клеточной стенки. Пока что в опытах in vitro токсичность тейксобактина для эукариот была низкой, а развитие резистентности бактерий к нему не выявлено. Однако публикаций о его действии против грамположительных энтерококков in vivo пока нет [4], а на грамотрицательные бактерии он не действует [13].
Раз липид-II — настолько хорошая мишень для антибиотиков, то неудивительно, что тейксобактин — отнюдь не единственная молекула, нацеленная на него. Другие перспективные соединения, борющиеся с грамположительными бактериями, — низин-подобные липопептиды. Сам низин — член семейства антимикробных пептидов лантибиотиков [7]. Он связывает пирофосфатный фрагмент липида-II и формирует поры в бактериальной мембране, что приводит к лизису и гибели клеток. К сожалению, эта молекула обладает плохой стабильностью in vivo и по своим фармакокинетическим характеристикам не подходит для системного введения. По этой причине ученые «усовершенствовали» низин в нужном для них направлении, и свойства полученных низин-подобных липопептидов сейчас изучают в лабораториях [4].
Другая молекула с хорошими перспективами — это микробиспорицин, блокирующий биосинтез пептидогликана и вызывающий накопление его предшественника в клетке [14]. Микробиспорицин называют одним из самых сильных из известных лантибиотиков, и он может воздействовать не только на грамположительные бактерии, но и на некоторых грамотрицательных патогенов.
Оритаванцин — еще один антибиотик, структурно подобный ванкомицину и связывающийся с липидом-II. Он уже одобрен в США для лечения кожных инфекций. Одно из его главных преимуществ — это длительный период полувыведения in vivo: применять его надо не ежедневно, а всего лишь раз в неделю [4].
Не липидом-II единым
Всем хорош липид-II, и особенно перспективны молекулы, нацеленные на неизменяемый пирофосфат в его составе. Однако изменением пептидной части липида-II бактерии добиваются развития резистентности к терапии. Так, препараты, нацеленные на нее (например, ванкомицин) перестают работать. Тогда вместо липида-II приходится искать в клеточной стенке другие мишени для лекарств. Это, например, ундекапренилфосфат — важнейшая часть пути биосинтеза пептидогликана [15]. Сейчас изучают несколько ингибиторов ундекапренилфосфатсинтазы — они могут неплохо работать на грамположительных бактериях [4].
Антибиотики также можно нацеливать и на другие молекулы, например, на тейхоевые кислоты клеточных стенок (wall teichoic acid, WTA — она упоминалась выше), липотейхоевые кислоты (lipoteichoic acid, LTA) и поверхностные белки с аминокислотным мотивом LPxTG (лейцин (L) — пролин (P) — любая аминокислота (X) — треонин (T) — глицин (G)) [16]. Их синтез не является жизненно необходимым для энтерококков, в отличие от производства пептидогликана. Однако нокаут генов, вовлеченных в эти пути, приводит к серьезным нарушениям роста и жизнеспособности бактерий, а также снижает их вирулентность. Препараты, нацеленные на эти поверхностные структуры, могли бы не только вернуть чувствительность к обычным антибиотикам и предотвратить развитие резистентности, но и стать независимым классом лекарств.
Из совсем новых агентов можно назвать группу оксазолидинонов и ее представителей: линезолид, тедизолид, кадазолид. Эти синтетические антибиотики связывают молекулу 23S рРНК бактериальной рибосомы и мешают нормальному синтезу белков — без чего, конечно, микроорганизму приходится худо. Некоторые из них уже используют в клинике.
Так различные компоненты бактериальной клетки предоставляют ученым богатый выбор мишеней для разработки лекарств. Но определить, из каких «вырастет» продукт, готовый для рынка, сложно. Небольшая часть перечисленных — например, тедизолид — уже используется в клинической практике. Однако большинство еще находится на ранних стадиях разработки и даже не было проверено в клинических испытаниях — а без них конечные безопасность и эффективность препаратов трудно предсказать [4].
Личинки против бактерий
Внимание привлекают и другие антимикробные пептиды (АМП). На «Биомолекуле» уже выходили большой обзор об антимикробных пептидах [17] и отдельная статья про лугдунин [18].
АМП называют «естественными антибиотиками», поскольку они вырабатываются в организмах животных. Например, различные дефензины — одна из групп АМП — встречаются у млекопитающих, беспозвоночных и растений [19]. Только что вышло исследование, которое идентифицировало молекулу в маточном молочке пчел, которое успешно используют в народной медицине для заживления ран. Оказалось, что это как раз дефензин-1 — он способствует реэпителизации in vitro и in vivo [20].
Удивительно, что один из человеческих защитных пептидов — кателицидин — оказался крайне похожим на бета-амилоид, который долгое время «винили» в развитии болезни Альцгеймера [21].
Дальнейшие исследования природных АМП могут помочь найти новые лекарства. Возможно, они даже посодействуют в решении проблемы резистентности к лекарственным средствам [22] — ведь к некоторым подобным соединениям, встречающимся в природе, не развивается резистентность. Например, только что обнаружили новый пептидный антибиотик при изучении Klebsiella pneumoniae subsp. ozaenae — оппортунистической человеческой бактерии, одного из возбудителей пневмонии [23]. Его назвали клебсазолицин (klebsazolicin, KLB). Механизм его работы таков: он ингибирует синтез белка, связываясь с бактериальной рибосомой в «тоннеле» выхода пептида, пространства между субъединицами рибосомы. Его эффективность уже показали in vitro. Что примечательно, авторы открытия — русские исследователи из различных научных учреждений России и США.
Однако, пожалуй, из всего животного мира сейчас изучают больше всего насекомых. Сотни их видов широко использовали в народной медицине с древности — в Китае, Тибете, Индии, Южной Америке и других частях мира. Более того, даже сейчас можно услышать о «биохирургии» — лечении ран личинками Lucilia sericata или других мух. Как ни удивительно это современному больному, но раньше посадить личинок в рану было популярной терапией. При попадании в зону воспаления насекомые поедали отмершие ткани, стерилизовали раны и ускоряли их заживление [24].
Схожей темой сейчас активно занимаются исследователи из Санкт-Петербургского государственного университета под руководством Сергея Черныша — только без живых копошащихся личинок. Ученые изучают комплекс АМП, производимый личинками красноголовой синей падальницы Calliphora vicina (взрослая особь — на рис. 4) [25]. Он включает в себя комбинацию пептидов из четырех семейств: дефензинов, цекропинов, диптерицинов и пролин-богатых пептидов. Первые нацелены преимущественно на мембраны грамположительных бактерий, вторые и третьи — на грамотрицательных, а последние направлены на внутриклеточные мишени. Возможно, данный микс возник в ходе эволюции мух как раз для того, чтобы повысить эффективность иммунного ответа и защитить от развития резистентности.

Рисунок 4. Красноголовая синяя падальница Calliphora vicina. Ее личинки, возможно, снабдят человечество антимикробными пептидами, не вызывающими резистентности.
Как рассказывает Сергей Черныш, его группа разработала «технологию параллельного биосинтеза, в которой весь необходимый набор пептидов синтезируется клетками иммунной системы насекомых и подвергается очистке с сохранением состава и соотношения природных антимикробных пептидов». Работа получила грант Российского научного фонда в конкурсе 2015 года на «Проведение фундаментальных научных исследований и поисковых научных исследований по приоритетным тематическим направлениям исследований».
Было показано, что у многих бактериальных штаммов не развивается резистентность при использовании этой комбинации антибактериальных пептидов. Это может быть обусловлено как конкретными механизмами действия отдельных составляющих, так и тем, что таких составляющих много [22].
Более того, подобные АМП оказываются эффективными против биопленок — колоний скрепленных между собой микроорганизмов, живущих на какой-либо поверхности. Именно такие сообщества ответственны за большинство бактериальных инфекций и за развитие многих серьезных осложнений у человека, включая хронические воспалительные заболевания. При возникновении в такой колонии резистентности к антибиотикам победить ее становится крайне трудно [26]. Препарат, в который входят личиночные АМП, российские ученые назвали FLIP7. Пока что эксперименты показывают, что он может с успехом пополнить ряды противомикробных препаратов. Подтвердят ли это будущие опыты, и выйдет ли это лекарство на рынок — вопрос будущего [24].
Новое — переработанное старое?
Помимо изобретения новых лекарств возникает и еще одна очевидная опция — изменить уже имеющиеся лекарства так, чтобы они заработали снова, либо поменять стратегию их применения. Конечно, ученые рассматривают оба эти варианта для того, чтобы, перефразируя слоган действующего президента США, to make antibiotics great again.
Серебряная пуля — или ложка?
Джеймс Коллинз (James Collins) из Бостонского университета (штат Массачусетс, США) с коллегами исследует то, как повысить эффективность антибиотиков добавлением серебра в виде растворенных ионов. Этот металл использовали в антисептических целях тысячелетиями, и американская команда решила, что древний метод может помочь справиться с опасностью антибиотикорезистентности. Как утверждают исследователи, современный антибиотик при добавлении небольшого количества серебра может убить в 1000 раз больше бактерий!
Такой эффект достигается двумя путями.
Во-первых, добавление серебра повышает проницаемость мембраны для препаратов даже у грамотрицательных бактерий. Как рассказывает сам Коллинз, серебро оказывается не столько «серебряной пулей», убивающей «нечисть» — бактерии, — сколько серебряной ложкой, которая «помогает грамотрицательным бактериям принимать лекарства».
Во-вторых, оно нарушает метаболизм микроорганизмов, в результате чего образуется слишком большое количество реактивных форм кислорода, которые, как известно, своим агрессивным поведением уничтожают все вокруг [27], [28].
Круговорот антибиотиков
Другой метод предлагает Мириам Барлоу (Miriam Barlow) из Калифорнийского университета (город Мерсед, США). Часто по эволюционным причинам резистентность к одному антибиотику делает бактерии более уязвимыми к другим антибиотикам, утверждает их команда. Из-за этого при использовании уже существующих антибиотиков в точно определенном порядке можно вынудить популяцию бактерий развиваться в обратном направлении. Группа Барлоу изучала у E. coli определенный ген устойчивости, кодирующий бактериальный фермент β-лактамазу в различных генотипах [29]. Для этого они создали математическую модель, которая выявила, что существует 60–70% вероятности возвращения к первоначальному варианту гена устойчивости. Иными словами, при правильном применении лечения бактерия вновь станет чувствительна к препаратам, против которых уже выработалась устойчивость. В некоторых больницах уже пытаются реализовать подобную идею «антибиотического цикла» со сменой лечения, но пока что, по словам исследовательницы, этим попыткам не хватало выверенной стратегии.
Клин клином — бактериальные методы
Еще одна интересная разработка, которая могла бы помогать антибиотикам в их нелегком труде, — так называемые «микробные технологии» (microbial technology). Как выяснили ученые, заражение антибиотикорезистентными инфекциями зачастую может быть связано с нарушением функции кишечного микробиома — совокупности всех микроорганизмов в кишечнике .
О нем, кстати, неоднократно писали на «Биомолекуле»: «Микробиом кишечника: мир внутри нас» [30], «Клетчатка на пользу потомкам» [31] и «Новые функции кишечной микрофлоры» [32].
В здоровом кишечнике проживает великое множество бактерий. При использовании антибиотиков это разнообразие уменьшается, и освободившиеся «места» могут занять патогены. Когда их становится слишком много, целостность кишечного барьера нарушается, и болезнетворные бактерии могут пробраться через него. Так, значительно повышается риск подхватить инфекцию изнутри и, соответственно, заболеть. Более того, возрастает и вероятность передачи резистентных болезнетворных микробов другим людям.
Чтобы бороться с этим, можно пытаться избавиться от конкретных патогенных штаммов, вызывающих хронические инфекции, например, с помощью бактериофагов, вирусов самих бактерий. Второй вариант — прибегнуть к помощи комменсальных бактерий, гасящих рост патогенов, и восстанавливать здоровую микрофлору кишечника.
Данный метод уменьшил бы риск побочных эффектов лечения и развития хронических проблем, связанных с нездоровым микробиомом. Также он мог бы продлить срок работы антибиотиков, поскольку не повышается опасность развития резистентности. Наконец, опасность заболеть снизилась бы как у самого пациента, так и у других людей. Однако пока трудно точно сказать, использование штаммов каких бактерий принесло бы бóльшую выгоду пациенту с точки зрения безопасности и эффективности. Более того, ученые сомневаются, удастся ли на современном уровне технологий наладить производство и культивирование микроорганизмов в нужных масштабах [33].
Кстати, интересно, что бактерии микробиома человека сами производят вещества, убивающие других бактерий. Их называют бактериоцинами, и о них «Биомолекула» рассказывала отдельно [18].
Агент M13 — что скрывается под кодовым именем?
Еще одна перспективная разработка, которая сможет дополнить уже существующие препараты, — фенольный липид под названием M13, результат исследований российских ученых из компании Superbug Solutions Ltd, зарегистрированной в Британии.
Как и АМП, вещества этого класса используются многими видами для защиты в природе. Например, фенольные липиды растительного и микробного происхождения защищают хозяев от патогенов и паразитов — они могут содействовать погружению микроорганизмов в спячку: обезвоживать протопласты и блокировать их метаболизм [34] (интересующимся можно почитать подробнее об этом [35]). Сейчас же антимикробные свойства фенольных липидов изучают и в лабораториях. Неудивительно, что ими начала заниматься и Superbug Solutions, ведь компания специализируется на поиске веществ, которые потенциально могут вернуть антибиотикам способность бороться с инфекциями, вызываемыми антибиотикорезистентными патогенными бактериями.
Начало исследованиям, завершившимся разработкой М13, было положено в конце 80-х годов в Институте микробиологии РАН (сейчас он входит в состав ФИЦ «Фундаментальные основы биотехнологии» РАН), когда под руководством Галины Эль-Регистан (сейчас — научного консультанта Superbug Solutions) в СССР открыли факторы дифференцировки (факторы d1) — внеклеточные метаболиты, регулирующие рост и развитие микробных популяций и образование покоящихся форм. По своей химической природе факторы d1 — это изомеры и гомологи алкилоксибензолов класса алкилрезорцинов, одной из разновидностей фенольных липидов. Выяснили, что они исполняют роль ауторегуляторов, выделяемых микроорганизмами в окружающую среду для координации взаимодействий клеток популяции между собой и для коммуникации с клетками других видов, входящих в состав ассоциации или участвующих в симбиозе.
Способов воздействия алкилрезорцинов на бактерии множество. На молекулярном уровне они модифицируют биополимеры [39]. Так, в первую очередь страдает ферментный аппарат клетки. При связывании алкилрезорцинов с ферментами у последних изменяются конформация, гидрофобность и флуктуация доменов белковой глобулы. Оказалось, что в такой ситуации меняется не только третичная, но и четвертичная структура белков из нескольких субъединиц! Подобный результат добавления алкилрезорцинов приводит к модификации каталитической активности белков. Физико-химические характеристики неферментных белков также меняются. Кроме того, алкилрезорцины действуют и на ДНК. Они вызывают ответ клеток на стресс на уровне активности генетического аппарата, что приводит к развитию дистресса.
На субклеточном уровне алкилрезорцины нарушают нативную структуру мембраны клетки. Они увеличивают микровязкость мембранных липидов и ингибируют NADH-оксидазную активность мембран. Дыхательная активность микроорганизмов оказывается заблокированной. Целостность мембраны под воздействием алкилрезорцинов нарушается, и в ней появляются микропоры. Из-за того что по градиенту концентрации из клетки выходят ионы К+ и Na+ с гидратными оболочками, происходят дегидратация и сжатие клетки. В итоге, мембрана под воздействием этих веществ становится мало- или неактивной, а энергетический и конструктивный метаболизм клетки нарушается. Бактерии переходят в состояние дистресса. Их способность противостоять неблагоприятным факторам, включая воздействие антибиотиков, падает.
Как говорят ученые, похожий эффект на клетки достигается воздействием низких температур, к которому они не могут полностью адаптироваться. Это позволяет предположить, что к воздействию алкилрезорцинов бактерии тоже не смогут привыкнуть. В современном мире, когда антибиотикорезистентность беспокоит все научное сообщество, такое качество крайне важно.
Лучшего результата от применения алкилрезорцинов можно добиться при комбинировании одного или нескольких таких молекул с антибиотиками. По этой причине на следующем этапе эксперимента ученые Superbug Solutions изучали эффект комбинированного воздействия алкилрезорцинов и антибиотиков, различающихся по химическому строению и по мишеням в микробной клетке.
Сначала исследования провели на чистых лабораторных культурах непатогенных микроорганизмов. Так, минимальная ингибирующая концентрация (самая низкая концентрация препарата, которая полностью угнетает рост микроорганизмов в опыте) для антибиотиков семи различных химических групп против основных видов микроорганизмов снижалась в 10–50 раз в присутствии исследованных алкилрезорцинов. Подобный эффект продемонстрировали для грамположительных и грамотрицательных бактерий и грибов. Количество бактерий, выживающих после обработки ударной комбинацией высоких доз антибиотика + алкилрезорцина, оказалось ниже на 3–5 порядков по сравнению с действием антибиотика в одиночку.
Последующие опыты на клинических изолятах патогенных бактерий показали, что и тут комбинация работает: минимальная ингибирующая концентрация в некоторых случаях снижалась в 500 раз. Что интересно, усиление эффективности антибиотика наблюдали и у чувствительных к лекарству, и у резистентных бактерий. Наконец, вероятность образования антибиотикорезистентных клонов также снижалась на порядок. Иными словами, риск развития антибиотикорезистентности снижается или сводится на нет.
Так, разработчики установили, что эффективность лечения инфекционных заболеваний с помощью их схемы — «суперпуль» (superbullet) — повышается, даже если болезнь была вызвана антибиотикорезистентными патогенами.
Изучив множество алкилрезорцинов, исследователи выбрали самый перспективный из них — М13. Соединение действует на клетки и бактерий, и эукариот, но в разных концентрациях. Резистентность к новому агенту также развивается гораздо медленнее, чем к антибиотикам. Основные механизмы его антимикробного действия, как и у остальных представителей этой группы, — воздействие на мембраны и ферментные и неферментные белки.
Выяснили, что сила эффекта добавления М13 к антибиотикам варьирует в зависимости как от вида антибиотика, так и от вида бактерий. Для лечения конкретного заболевания придется подбирать свою пару «антибиотик + М13 или иной алкилрезорцин». Как показали исследования in vitro, чаще всего М13 проявлял синергизм при взаимодействии с ципрофлоксацином и полимиксином. В целом же совместное действие отмечали реже в случае грамположительных бактерий, чем в случае грамотрицательных.
Помимо этого, использование М13 минимизировало образование антибиотикорезистентных мутантов патогенных бактерий. Полностью предотвратить их появление нельзя, однако можно существенно, на порядки, снизить вероятность их появления и повысить чувствительность к антибиотику, с чем и справился агент компании Superbug Solutions.
По итогам опытов «в пробирке» можно заключить, что перспективнее всего выглядят эксперименты по применению комбинации М13 и антибиотиков против грамотрицательных бактерий, что и было изучено в дальнейшем.
Так, провели эксперименты in vivo для определения, изменяется ли эффективность лечения зараженных мышей комбинацией М13 с известными антибиотиками — полимиксином и амикацином. В качестве патогена выбрали летальную клебсиеллёзную инфекцию, вызванную Klebsiella pneumoniae. Как показали первые результаты, эффективность антибиотиков в комбинации с М13 действительно повышается. При лечении мышей М13 и антибиотиком (но не одним антибиотиком) бактеримию в селезенке и крови не наблюдали. В дальнейших опытах на мышах подберут самые эффективные комбинации М13 и других алкилрезорцинов с определенными антибиотиками для лечения конкретных инфекций. Затем проведут стандартные этапы исследования токсикологии и клинические испытания 1 и 2 фаз.
Сейчас компания оформляет патент на разработку и надеется на будущее ускоренное одобрение препарата от FDA (американского Управления по контролю за продуктами и лекарствами). Superbug Solutions запланировала и будущие эксперименты по изучению алкилрезорцинов. Разработчики собираются и дальше развивать свою платформу по поиску и созданию новых комбинированных антимикробных препаратов. При этом многие фармкомпании фактически отказались от подобных разработок, и сегодня больше других заинтересованы в подобных исследованиях именно ученые и конечные потребители. Их и намерена привлекать для поддержки и развития компания Superbug Solution и в результате создать некое комьюнити вовлеченных и заинтересованных людей. Ведь кому же, как не прямому потребителю потенциального препарата, выгоден его выход на рынок?
Что же дальше?
Хотя прогнозы по борьбе с антибиотикорезистентностью инфекций пока не очень утешительные, мировое сообщество пытается принять меры, чтобы избежать той мрачной картины, которую рисуют нам эксперты. Как было рассмотрено выше, многие научные группы занимаются разработкой новых антибиотиков или тех препаратов, которые в комбинации с антибиотиками могли бы успешно убивать инфекции.
Казалось бы, перспективных разработок сейчас много. Доклинические опыты дают надежду, что однажды на фармацевтический рынок все-таки «дойдут» новые препараты. Однако уже ясно, что вклада только разработчиков потенциальных антибактериальных лекарств мало. Необходимо также заняться разработкой вакцин от определенных патогенных штаммов, пересмотреть методы, используемые в животноводстве, улучшить гигиену и методы диагностики заболеваний, рассказывать общественности о наличии проблемы и, самое главное, — объединить усилия по борьбе с ней (рис 5). О многом этом шла речь в первой части цикла [1].
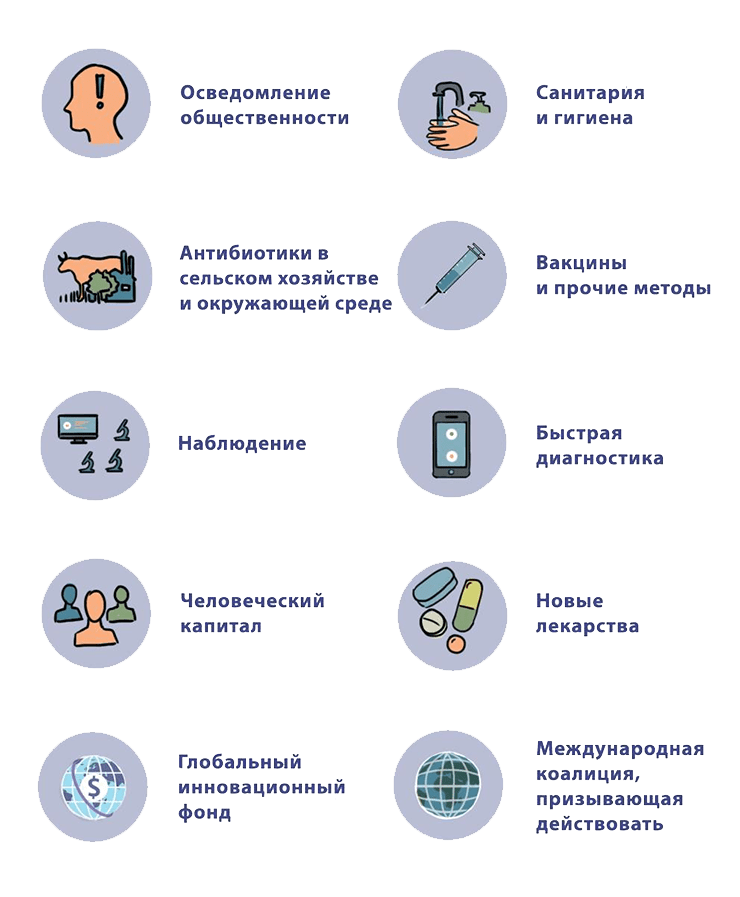
Рисунок 5. Методы борьбы c лекарственной резистентностью по всем фронтам: стратегия, предложенная по результатам британского исследования Review in Antimicrobial Resistance.
рисунок Елены Беловой на основе amr-review.org
Неудивительно, что Инициатива по инновационным лекарственным средствам (Innovative Medicines Initiative, IMI) Европейского союза, которая помогает сотрудничеству фармпромышленности с ведущими научными центрами, объявила о запуске программы «Новые лекарства против плохих микробов» (New Drugs 4 Bad Bugs, ND4BB). «Программа IMI против резистентности к антибиотикам — это гораздо больше, чем клиническая разработка антибиотиков, — рассказывает Ирен Норстедт (Irene Norstedt), исполняющая обязанности директора IMI. — Она охватывает все области: от фундаментальной науки о резистентности к антибиотикам (в том числе и о внедрении антибиотиков внутрь бактерий) через ранние стадии открытия и разработки лекарств и до клинических испытаний и создания общеевропейской группы по клиническим испытаниям». По ее словам, большинству вовлеченных в разработку лекарств сторон, включая промышленность и ученых, уже ясно: проблемы такого масштаба, как антимикробная резистентность, могут быть решены только путем всеобщего сотрудничества. Программа предусматривает и поиск новых способов избежать устойчивости к антибиотикам [13].
Среди других инициатив — «Глобальный план действий по устойчивости к противомикробным препаратам» и ежегодная кампания «Антибиотики: используйте осторожно!» по повышению осведомленности о проблеме медицинского персонала и общественности . Похоже, чтобы избежать постантибиотической эры, небольшой вклад может потребоваться от любого. Готовы ли вы к этому?
Подробнее можно прочесть в статье «Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее» [40].
Литература
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Sirijan Santajit, Nitaya Indrawattana. (2016). Mechanisms of Antimicrobial Resistance in ESKAPE Pathogens. BioMed Research International. 2016, 1-8;
- Laura J. V. Piddock. (2015). Teixobactin, the first of a new class of antibiotics discovered by iChip technology?. J. Antimicrob. Chemother.. 70, 2679-2680;
- Roel M. van Harten, Rob J.L. Willems, Nathaniel I. Martin, Antoni P.A. Hendrickx. (2017). Multidrug-Resistant Enterococcal Infections: New Compounds, Novel Antimicrobial Therapies?. Trends in Microbiology. 25, 467-479;
- Mariela Segura, Han Zheng, Astrid de Greeff, George F Gao, Daniel Grenier, et. al.. (2014). Latest developments on Streptococcus suis: an emerging zoonotic pathogen: part 1. Future Microbiology. 9, 441-444;
- Wing Fei Wong, Marina Santiago. (2017). Microbial approaches for targeting antibiotic-resistant bacteria. Microb. Biotechnol.. 10, 1047-1053;
- Anna Müller, Anna Klöckner, Tanja Schneider. (2017). Targeting a cell wall biosynthesis hot spot. Nat. Prod. Rep.. 34, 909-932;
- Евсеев А. (2015). Ахиллесова пята бактериальной мембраны. Сайт ИБХ РАН;
- Anton Chugunov, Darya Pyrkova, Dmitry Nolde, Anton Polyansky, Vladimir Pentkovsky, Roman Efremov. (2013). Lipid-II forms potential “landing terrain” for lantibiotics in simulated bacterial membrane. Sci Rep. 3;
- Элементы: «Компьютерное моделирование мембран, липид-II и покрывало Пенелопы»;
- Vivian Ng, Weng C. Chan. (2016). New Found Hope for Antibiotic Discovery: Lipid II Inhibitors. Chem. Eur. J.. 22, 12606-12616;
- Losee L. Ling, Tanja Schneider, Aaron J. Peoples, Amy L. Spoering, Ina Engels, et. al.. (2015). A new antibiotic kills pathogens without detectable resistance. Nature. 517, 455-459;
- Tony Kirby. (2015). New antibiotic development hailed as game changing. The Lancet Infectious Diseases. 15, 271-272;
- Franca Castiglione, Ameriga Lazzarini, Lucia Carrano, Emiliana Corti, Ismaela Ciciliato, et. al.. (2008). Determining the Structure and Mode of Action of Microbisporicin, a Potent Lantibiotic Active Against Multiresistant Pathogens. Chemistry & Biology. 15, 22-31;
- Thierry TouzÉ, Dominique Mengin-Lecreulx. (2008). Undecaprenyl Phosphate Synthesis. Unknown journal title.. 3;
- F. M. Roche. (2003). Characterization of novel LPXTG-containing proteins of Staphylococcus aureus identified from genome sequences. Microbiology. 149, 643-654;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Антибиотики прямо под нашим носом;
- Sabine F. Oppedijk, Nathaniel I. Martin, Eefjan Breukink. (2016). Hit 'em where it hurts: The growing and structurally diverse family of peptides that target lipid-II. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858, 947-957;
- Marcela Bucekova, Martin Sojka, Ivana Valachova, Simona Martinotti, Elia Ranzato, et. al.. (2017). Bee-derived antibacterial peptide, defensin-1, promotes wound re-epithelialisation in vitro and in vivo . Sci Rep. 7;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Sergey Chernysh, Natalia Gordya, Tatyana Suborova. (2015). Insect Antimicrobial Peptide Complexes Prevent Resistance Development in Bacteria. PLoS ONE. 10, e0130788;
- Mikhail Metelev, Ilya A Osterman, Dmitry Ghilarov, Nelli F Khabibullina, Alexander Yakimov, et. al.. (2017). Klebsazolicin inhibits 70S ribosome by obstructing the peptide exit tunnel. Nat Chem Biol. 13, 1129-1136;
- S. I. Chernysh, N. A. Gordja. (2011). The immune system of maggots of the blow fly (Calliphora vicina) as a source of medicinal drugs. J Evol Biochem Phys. 47, 524-533;
- Один в поле не воин: природная антимикробная система эффективнее антибиотика;
- Natalia Gordya, Andrey Yakovlev, Anastasia Kruglikova, Dmitry Tulin, Evdokia Potolitsina, et. al.. (2017). Natural antimicrobial peptide complexes in the fighting of antibiotic resistant biofilms: Calliphora vicina medicinal maggots. PLoS ONE. 12, e0173559;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Brian Owens. (2013). Silver makes antibiotics thousands of times more effective. Nature;
- Portia M. Mira, Kristina Crona, Devin Greene, Juan C. Meza, Bernd Sturmfels, Miriam Barlow. (2015). Rational Design of Antibiotic Treatment Plans: A Treatment Strategy for Managing Evolution and Reversing Resistance. PLoS ONE. 10, e0122283;
- Микробиом кишечника: мир внутри нас;
- Клетчатка на пользу потомкам;
- Новые функции кишечной микрофлоры;
- Wing Fei Wong, Marina Santiago. (2017). Microbial approaches for targeting antibiotic-resistant bacteria. Microb. Biotechnol.. 10, 1047-1053;
- M. M. Bespalov, A. I. Kolpakov, N. G. Loiko, E. V. Doroshenko, A. L. Mulyukin, et. al.. (2000). The role of microbial dormancy autoinducers in metabolism blockade. Microbiology. 69, 174-179;
- Yu. A. Nikolaev, I. A. Borzenkov, M. V. Kalinin, N. G. Loiko, A. L. Tarasov, et. al.. (2010). Antimicrobic features of phenolic lipids. Appl Biochem Microbiol. 46, 159-165;
- Jiao Chen, Xiaohui Shang, Feng Hu, Xingzhen Lao, Xiangdong Gao, et. al.. (2013). β-Lactamase Inhibitors: An Update. MRMC. 13, 1846-1861;
- S. M. Drawz, K. M. Papp-Wallace, R. A. Bonomo. (2014). New -Lactamase Inhibitors: a Therapeutic Renaissance in an MDR World. Antimicrobial Agents and Chemotherapy. 58, 1835-1846;
- Thomas P Zabawa, Michael J Pucci, Thomas R Parr, Troy Lister. (2016). Treatment of Gram-negative bacterial infections by potentiation of antibiotics. Current Opinion in Microbiology. 33, 7-12;
- Yu. A. Nikolaev, N. G. Loiko, I. Yu. Stepanenko, E. F. Shanenko, E. I. Martirosova, et. al.. (2008). Changes in physicochemical properties of proteins, caused by modification with alkylhydroxybenzenes. Appl Biochem Microbiol. 44, 143-150;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее.