Глицин: часть 1. Мал да удал: глицин в живой природе
14 августа 2018
Глицин: часть 1. Мал да удал: глицин в живой природе
- 9205
- 0
- 9
Молекула глицина на фоне шелка, в состав которого глицин входит в больших количествах
-
Автор
-
Редакторы
Темы
Эта статья о глицине — самой маленькой аминокислоте в природе, чья роль, тем не менее, огромна. Вы узнаете, в состав каких белков и пептидов входит глицин, как синтезируется в организме и предшественником каких веществ является.
Введение в курс дела
Аминокислоты — это одни из самых важных веществ в живой природе. Будучи довольно небольшими молекулами, они играют огромную роль в живых организмах. Подобно жемчужинам в ожерелье, они слагают большие молекулы — белки, из которых построены все живые существа — от мала до велика. Функция аминокислот не исчерпывается только тем, что они становятся строительным материалом для белков. Аминокислоты могут специализироваться на других задачах. Общая формула аминокислот приведена на рисунке 1.
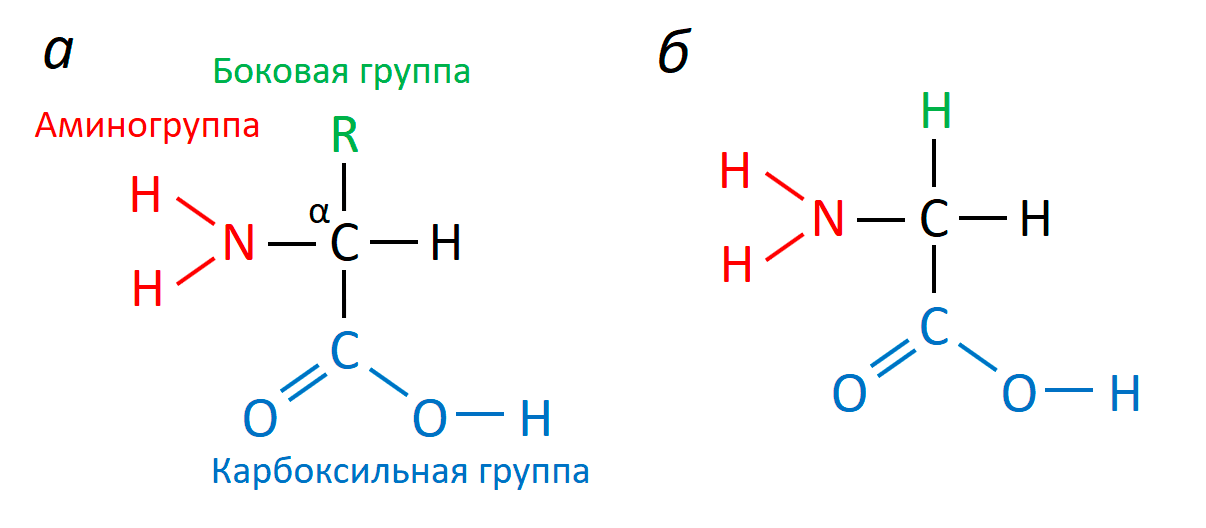
Рисунок 1. Структура аминокислот. а — Общая формула α-аминоксилот. Компонентами этих соединений являются углеродный скелет, карбоксильная и аминогруппы, а также боковая группа, определяющая индивидуальные свойства разных аминокислот. Важно, что почти во всех природных аминокислотах аминогруппа расположена слева от углеродного скелета (L-изомеры). α-L-аминокислоты — основа природных белков. б — Формула глицина. Боковая группа в этой молекуле представлена протоном. Таким образом, глицин — самая простая аминокислота из всех возможных.
Эта статья посвящена глицину — самой маленькой из всех теоретически возможных аминокислот. Но, несмотря на свою крохотную боковую группу, представленную одним протоном, глицин — неотъемлемый компонент белков и участник нескольких важных процессов. Поговорка «мал, да удал» — это про глицин!
В первой части статьи мы рассмотрим некоторые белки и пептиды, для которых глицин имеет большое значение, а также разберем, откуда глицин в организме вообще берется и в чем, кроме белков, используется. Мы не будем претендовать на абсолютную полноту картины функций глицина, но остановимся на наиболее важных моментах.
Глицин в белках и пептидах
Глицин — вещество не редкое. Почти ни один белок не обходится без него. В среднем глицин составляет чуть больше 7% аминокислотных остатков («жемчужин») в белках [1]. При этом давайте учтем, что разнообразие белковых аминокислот довольно велико, поэтому названная цифра — почти рекорд! А уж где глицина действительно много — так это в коллагене.
Коллаген — сложно устроенный белок, являющийся одним из основных компонентов соединительной ткани. Он присутствует в сухожилиях, коже, кровеносных сосудах, роговице, костях и хрящах, а также в чешуе рыб и шерсти млекопитающих, выполняя структурную роль и составляя до 30% массы позвоночных животных [2]. Таким образом, это один из самых распространенных животных белков. Существует несколько типов коллагена.
Коллаген обеспечивает прочность соединительных тканей, а потому и сам обладает свойством устойчивости к растяжению, и это качество определяется его структурой (рис. 2) [2].
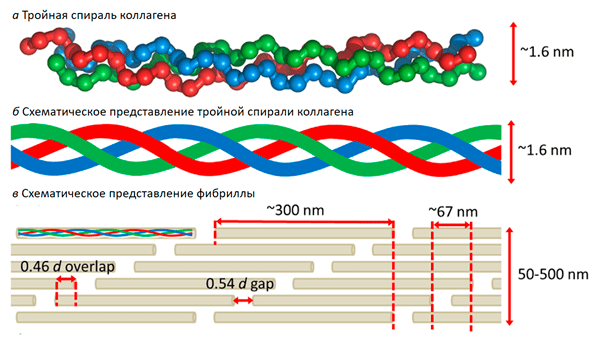
Рисунок 2. Структура коллагена. Три обвивающие друг друга нити образуют суперспираль, как пряди волос — косу. Суперспирали, располагаясь друг относительно друга строго определенным образом, формируют фибриллу. Такое устройство белка способствует его механической устойчивости: кости ломаться не должны.
[2], рисунок с изменениями
Но причем же тут глицин? Дело в том, что полипептидные нити молекул коллагена, как орнамент, состоят из повторяющегося «узора» — паттерна из трех аминокислотных остатков: Gly—Pro—X и Gly—X—Hyp [3]. Здесь Gly — глицин, Pro — пролин, Hyp — 4-гидроксипролин, X — другая аминокислота.
Из этой формулы видно, что глицин составляет треть аминокислот коллагена! Природа не стала бы играть такими цифрами просто забавы ради. Присутствие глицина — одна из предпосылок к формированию прочных фибрилл и волокон коллагена, необходимых для многих тканей. Три нити, формирующие коллагеновую суперспираль, переплетаются настолько плотно, что между ними нет свободного пространства. И только лишь один глицин со своей крохотной боковой группой способен интегрироваться в эту систему, как кусочек мозаики. Замена глицина на какую-то другую аминокислоту, имеющую более объемную боковую группу (например, серин), может привести к серьезным патологиям, например, к синдрому Элерса—Данлоса (это гетерогенная группа наследственных нарушений соединительной ткани) [4], [5].
Глицином богат еще один структурный белок — фиброин — основной компонент паутины и шелка. Почти половина аминокислотных остатков фиброина — глицин! Как и в случае с коллагеном, там он входит в состав повторяющейся последовательности.
Белкам близка еще одна группа биологических веществ — пептиды. Они тоже сложены из аминокислот, только меньше белков по размерам (но граница между белками и пептидами размыта).

Рисунок 3. Pyrrhocoris apterus. Это известный многим клоп-солдатик — яркий (во всех смыслах этого слова) представитель отряда полужесткокрылые, или клопы (Hemiptera). При внедрении бактерий в его гемолимфе обнаруживаются несколько антимикробных пептидов, включая богатый глицином гемиптерицин [8]. Не только он, но и многие другие животные борются с патогенами с помощью глицин-богатых пептидов.
Посмотрим на так называемые антимикробные пептиды. Это, как правило, положительно заряженные (катионные) молекулы, которые участвуют в иммунном ответе, воздействуя на мембраны бактерий или других патогенов [6]. С помощью этих относительно небольших молекул человек и другие животные, включая разнообразных букашек, борются с болезнетворными организмами, которым удалось пробраться во внутреннюю среду. До сих пор не разработано единой классификации антимикробных пептидов, но известно, что те или иные из них характеризуются определенными структурными особенностями. В частности, в них может в большом количестве присутствовать какая-то аминокислота, в том числе и глицин.
К глицин-богатым антимикробным пептидам относят акалолептины из гемолимфы жука-дровосека Acalolepta luxuriosa, акантоскуррин из гемоцитов паука Acanthoscurria gomesiana, аттацины из насекомых отрядов чешуекрылые и двукрылые, гемиптерицин из известного многим клопа-солдатика Pyrrhocoris apterus (рис. 3) и другие (гименоптецин, гловерины, колеоптерицины, риноцерозин, холотрицин-2 и −3). Глицин-богатые домены имеют пептиды гиастатин и крустины [7], [8].
Конечно, глицин присутствует и во многих других белках и пептидах. Это делает его одной из самых распространенных природных аминокислот.
Откуда берется глицин в организме?
Конечно, эта чудесная аминокислота попадает к нам с пищей в составе белков. Тем не менее основной источник глицина — процессы синтеза, проходящие в нашем теле, что позволяет отнести глицин к заменимым аминокислотам.
Главный его предшественник — серин. Это тоже аминокислота, только в ее молекуле на один атом углерода больше. Что же с ним сделать? Здесь природа идет по проторенной дорожке: она передает его на вещество-кофермент тетрагидрофолат, который «любит» одноуглеродные фрагменты. В результате реакции на свет рождается глицин (рис. 4).
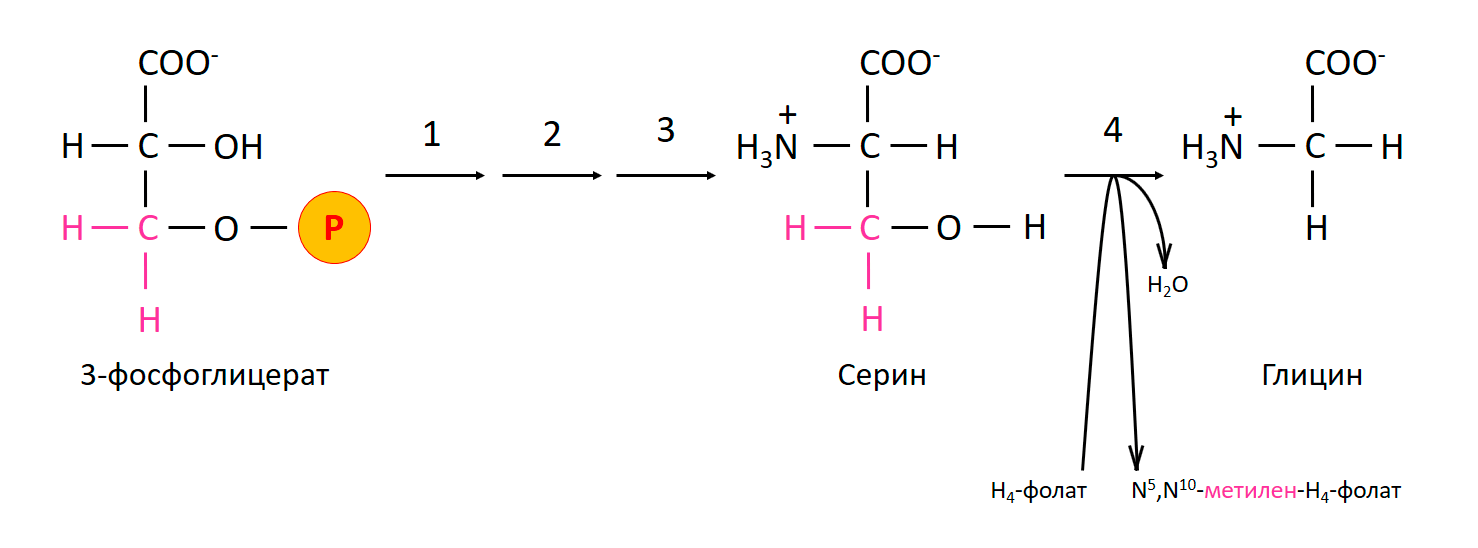
Рисунок 4. Синтез глицина из 3-фосфоглицерата через серин. Цифрами обозначены ферменты: 1 — фосфоглицератдегидрогеназа; 2 — фосфосеринаминотрансфераза; 3 — фосфосеринфосфатаза; 4 — серин-гидроксиметилтрансфераза.
У позвоночных животных, включая и нас любимых, есть еще один любопытный способ произвести глицин. Исходными веществами в реакции, катализируемой ферментом глицинсинтазой, являются довольно простые вещества — углекислый газ и аммиак (в виде иона). Эта реакция тоже не обходится без уже известного нам «любителя» одноуглеродных фрагментов:
Voilà! (Извините за мой французский.) Образовавшийся глицин поступает на службу организму.
Гиперактивация серинглицинового биосинтетического пути способна привести к развитию рака, ведь этот путь важен для получения большого количества «строительных» веществ (нуклеиновых кислот, белков, липидов), которые так необходимы активно делящимся раковым клеткам. Антифолатная химиотерапия широко используется в лечении рака [9].
Глицин — предшественник гема
Почему кровь красная? Потому что в ней есть гемоглобин — красный белок, имеющий в своем составе гем. Это железосодержащая порфириновая система, на которую и садится кислород, от легких с кровью поступающий к разным тканям. Глицин является одним из предшественников гема у животных. Реакция с участием глицина представлена на рисунке 5.
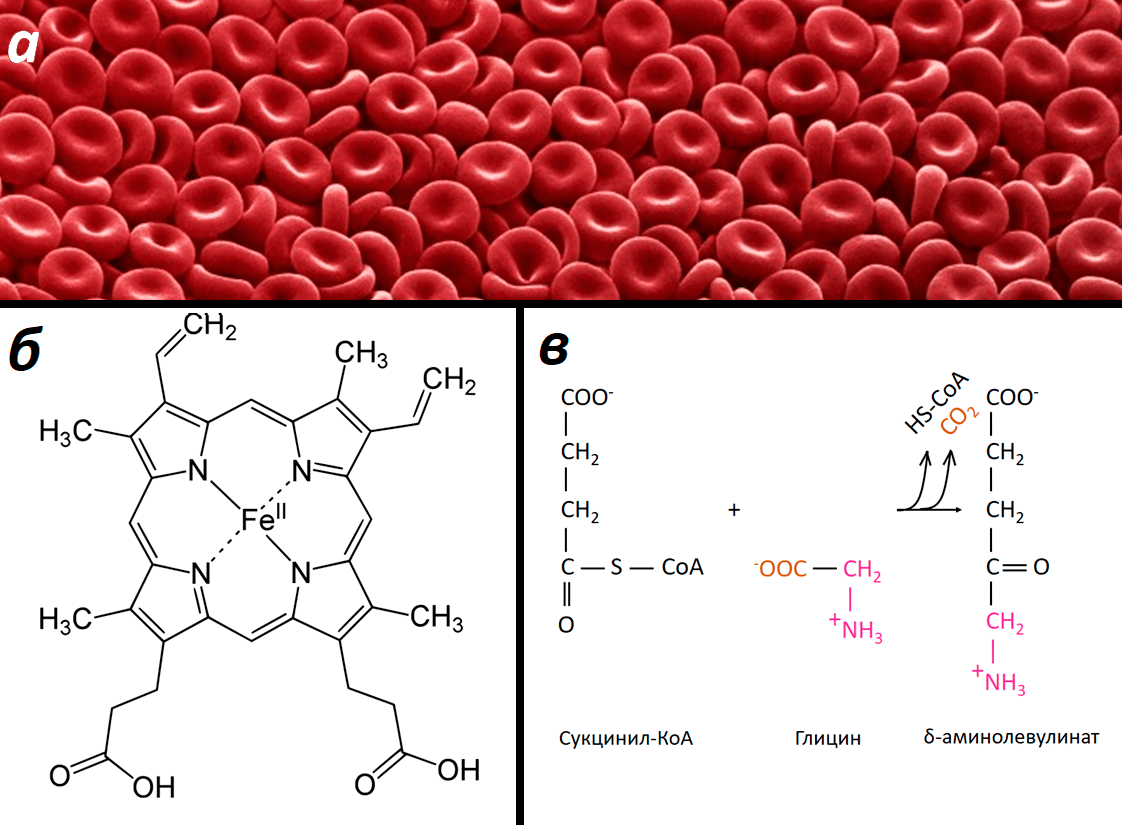
Рисунок 5. Роль глицина в синтезе гема. а — Эритроциты («красные кровяные тельца») — клетки, содержащие красный белок гемоглобин. б — Цвет гемоглобина, а также его транспортная функция обеспечиваются присутствием гема. в — Синтез дельта-аминолевулиновой кислоты из сукцинил-КоА и глицина — первая реакция в синтезе порфириновых систем у животных.
Синтез порфиринов — отдельная большая «опера», причем глицин участвует только в первой «арии», и в этой статье мы не будем изучать полную «партитуру». Тем не менее роль глицина в этом фундаментальном процессе огромна.
Глицин как участник других жизненно важных реакций
Что такое ДНК? Правильно! Химический субстрат наследственности. Это знают все. Но не все знают, что каждая из цепей ДНК состоит из «кирпичиков», называемых нуклеотидами. Каждый нуклеотид включает в себя, помимо прочего, азотистое основание. Азотистые основания ДНК бывают двух типов — пуриновые (аденин и гуанин) и пиримидиновые (тимин и цитозин). Глицин принимает участие в синтезе нуклеотидов с пуриновыми основаниями (рис. 6).
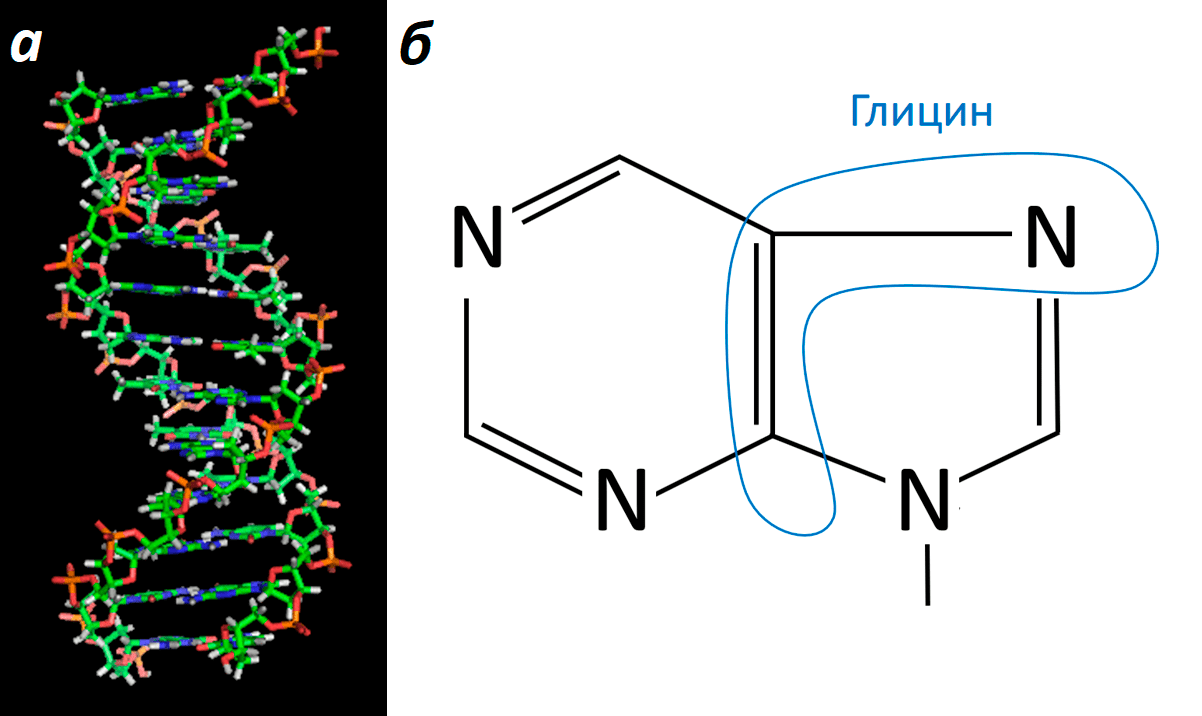
Рисунок 6. ДНК и схема пуринового азотистого основания. а — Модель знаменитой «двойной спирали», на которой хорошо видны «кирпичики» (нуклеотиды), формирующие каждую из двух цепей. б — Схема пуринового азотистого основания, которое соединяется с пентозой в составе нуклеотида; часть этой конструкции формируется за счет глицина.
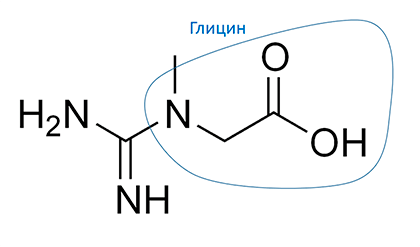
Рисунок 7. Одним из предшественников креатина является глицин
При синтезе пуриновых нуклеотидов de novo азотистое основание «садится» на уже готовую связь с пентозой и наращивается постепенно. На одном из начальных этапов в дело вступает глицин, благодаря которому в состав структуры входят два углеродных атома и один азотный.
Разнообразие комбинаций азотистых оснований в молекуле ДНК является основой биологического разнообразия на планете.
Кроме этого, глицин участвует в синтезе креатина (рис. 7) — вещества-аккумулятора энергии в мышцах и нервных клетках, то есть в тех местах организма, где требуется поддерживать высокий уровень энергии.
Литература
- Doolittle R.F. Redundancies in protein sequences. In: Predictions of protein structure and the principles of protein conformation / ed. by Fasman G.D. NY: Plenum Press, 1989. — P. 599–623;
- Vincent R. Sherman, Wen Yang, Marc A. Meyers. (2015). The materials science of collagen. Journal of the Mechanical Behavior of Biomedical Materials. 52, 22-50;
- Paul Szpak. (2011). Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis. Journal of Archaeological Science. 38, 3358-3372;
- Нельсон Д. и Кокс М. Основы биохимии Ленинджера (т. 1, изд. 3, испр.). М.: «Лаборатория знаний», 2017. — 696 с.;
- Paolo Narcisi, Allan J.Richards, Stanley D. Ferguson, F.Michael Pope. (1994). A family with Ehlers — Danlos syndrome type III/articular hypermobility syndrome has a glycine 637 to serine substitution in type III collagen. Hum Mol Genet. 3, 1617-1620;
- Кокряков В.Н. Очерки о врожденном иммунитете. СПб.: «Наука», 2006. — стр. 137–146;
- С. В. Баландин, Т. В. Овчинникова. (2016). Антимикробные пептиды беспозвоночных. Часть 1. Строение, биосинтез и эволюция (Обзорная статья). Биоорган. химия. 42, 255-275;
- S Cociancich, A Dupont, G Hegy, R Lanot, F Holder, et. al.. (1994). Novel inducible antibacterial peptides from a hemipteran insect, the sap-sucking bugPyrrhocoris apterus. Biochem. J.. 300, 567-575;
- Ivano Amelio, Francesca Cutruzzolá, Alexey Antonov, Massimiliano Agostini, Gerry Melino. (2014). Serine and glycine metabolism in cancer. Trends in Biochemical Sciences. 39, 191-198.