Как избавиться от РНК за несколько минут
12 августа 2013
Как избавиться от РНК за несколько минут
- 5490
- 2
- 3
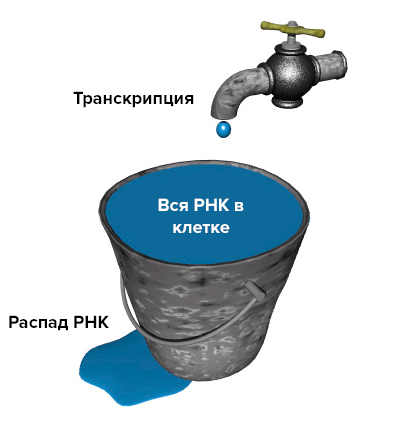
Модель «протекающего ведра». Уровень РНК в клетке (количество воды в ведре) зависит и от скорости ее распада (скорости вытекания воды из ведра), и от интенсивности транскрипции (потока воды в кране).
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: РНК — рибонуклеиновая кислота — это один из основных типов молекул в клетке. Различных видов РНК существует огромное количество, и их синтез идет постоянно. Но если бы РНК только накапливалась, то очень скоро она бы заполнила собой всю клетку. Поэтому параллельно с синтезом в клетке постоянно происходит противоположный процесс — распад РНК. Причем процесс этот сложный и тщательно регулируемый. Именно о нем и пойдет речь в статье.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
РНК — неотъемлемый участник большинства клеточных процессов. Прежде всего, РНК обеспечивают трансляцию: с матричных РНК (мРНК) считываются последовательности аминокислот в белке, транспортные РНК (тРНК) «поставляют» аминокислоты к месту синтеза, а саму реакцию осуществляют рибосомы, основной компонент которых, — рибосомные РНК (рРНК). Но роль РНК не ограничивается этими наиболее известными функциями. В последующие годы после открытия первых некодирующих РНК (тех, которые не кодируют белок, то есть всех не-мРНК) — рРНК и тРНК, — стало появляться множество новых данных об участии некодирующих РНК в самых разнообразных клеточных процессах. Оказалось, что РНК участвуют в таких важнейших клеточных процессах, как репликация (Y РНК), транскрипция (U1 РНК, 7SK РНК), сплайсинг (малые ядерные РНК U1, U2, U4, U5 и U6), процессинг (ряд малых ядрышковых РНК), клеточный транспорт (7SL РНК). Не так давно открытые микро-РНК и малые интерферирующие РНК участвуют в регуляции экспрессии генов и помогают в защите клетки от чужеродного генетического материала [2–5]. А некоторые молекулы РНК — рибозимы — даже могут осуществлять биохимические реакции, т.е. выступать в роли ферментов, что всегда считалось прерогативой белков. Так что, нет такой сферы клеточной деятельности, в которую не проникли молекулы РНК.
Как РНК образуются в клетке, изучено довольно хорошо. Но как эти молекулы разрушаются? И когда? Ведь некоторые РНК живут в клетке очень долго, другие же разрушаются за несколько минут. От чего это зависит?
Общие правила распада РНК
Рассмотрим сначала самый известный класс РНК — мРНК. У эукариот большинство мРНК имеет на 3’-конце «хвост» из многочисленных остатков аденина (обозначается как поли(А)). Присоединение поли(А)-хвоста к мРНК происходит в ядре с помощью определенного фермента. Для того, чтобы произошло полиаденилирование, необходимо, чтобы в составе мРНК был специальный сигнал — AAUAAA. В клетках млекопитающих поли(А)-хвост, достигающий длины 250 нуклеотидов, взаимодействует с поли(А)-связывающими белками (poly-A-binding protein, PABP). Поли(А)-хвост в комплексе с PABP очень важен: он участвует в транспорте мРНК из ядра в цитоплазму, в трансляции и защищает мРНК от распада, т.е. придает ей стабильность. Один белок PABP связывается с 12 аденозинами, но закрывает при этом 25–27 оснований. В цитоплазме плавают специальные ферменты — деаденилазы, — которые откусывают кусочки от поли(А)-хвостов. Если у мРНК поли(А)-хвост сократился до длины, недостаточной для связывания хотя бы одной молекулы PABP, то она подвергается быстрой деградации. Соответственно, первый шаг на пути деградации большинства мРНК — разрушение поли(А)-хвоста [6], [7].
После того, как мРНК потеряла свой хвост, она начинает сокращаться с одного из двух концов, или сразу с обоих. Один конец РНК называется 5’-концом, другой — 3’. За укорочение и постепенное разрушение РНК ответственны специализированные ферменты — экзонуклеазы. Приставка экзо означает, что данный тип нуклеаз действует с концов молекулы, постепенно «съедая» ее, в отличие от эндонуклеаз, которые разрезают РНК посередине. Интересно, что для сокращения РНК с каждой из двух сторон используются абсолютно разные экзонуклеазы. Если данной РНК суждено быть съеденной с 5’-конца, то сначала от нее отрезают кэп (модифицированный нуклеотид, который присоединен к большинству мРНК эукариот с 5’-конца), а потом уже в процесс вступает экзонуклеаза (чаще всего Xrn1). При деградации с 3’-конца основная роль принадлежит белковому комплексу экзосоме. Экзосома состоит из 10–12 белков (в том числе нескольких экзонуклеаз), которые образуют комплекс в форме бублика. Экзосома консервативна, она встречается у всех на данный момент исследованных эукариот; более того, схожие по структуре и функции белковые комплексы имеются и в клетках прокариот и архей (рис. 1) [8].
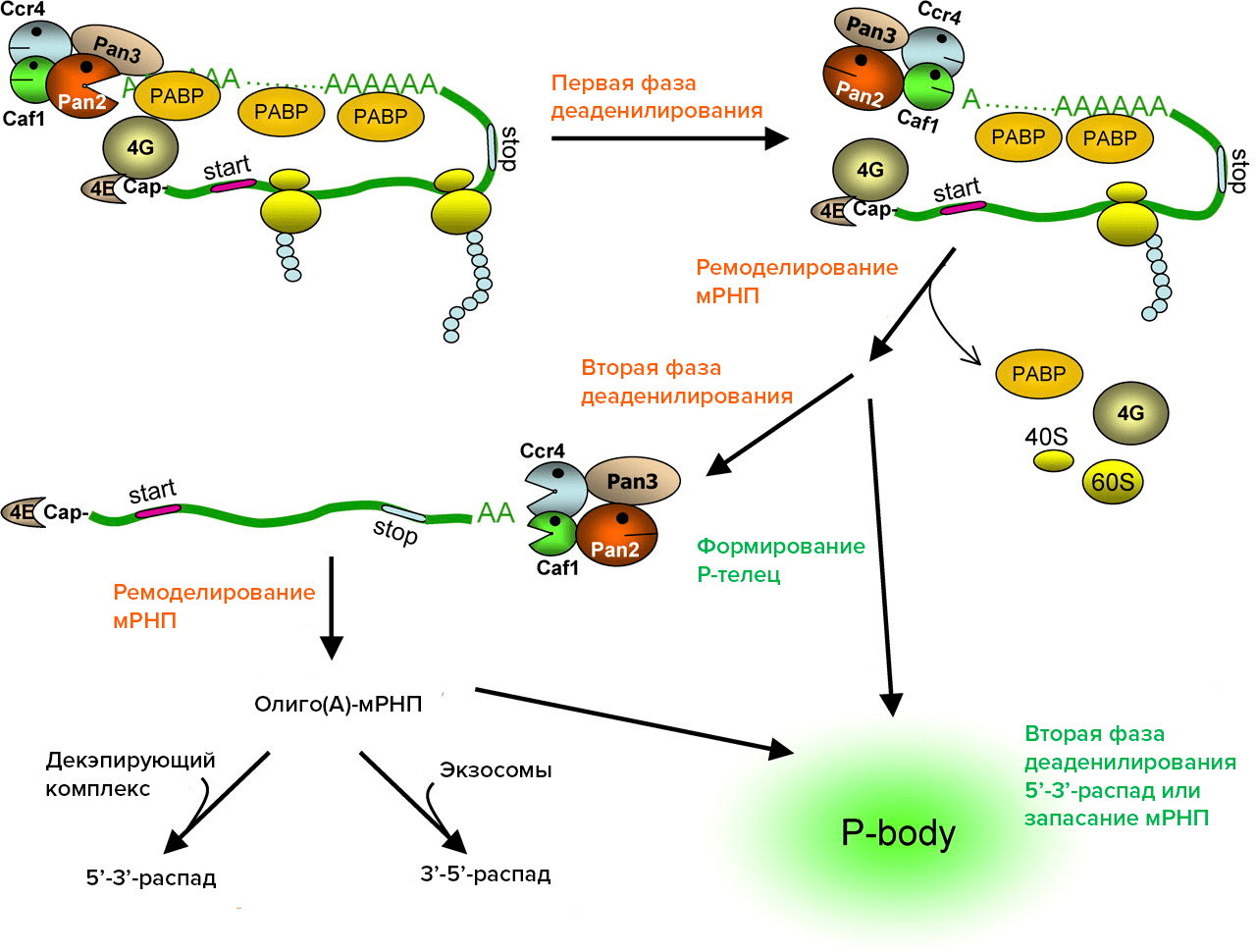
Рисунок 1. Этапы распада мРНК в клетках млекопитающих. Деаденилирование осуществляется с помощью ферментов CCR4, Caf1, Pan2-3. После первой фазы деаденилирования поли(А)-хвост мРНК укорачивается до размеров небольшого олиго(А)-участка, мРНК перестает транслироваться (теряет PABP, факторы инициации трансляции, рибосомы). На второй фазе деаденилирования мРНК полностью теряет поли(А), после чего подвергается декэпированию и деградации с 5’-конца или с 3’-конца с помощью экзосомы или же отправляется в Р-тельце для временного хранения в нетранслируемом состоянии.
Где происходит разрушение РНК? Ферменты, участвующие в этом процессе, присутствуют и в цитоплазме, и в ядре. Причем цитоплазматические и ядерные белки, выполняющие одинаковые функции при деградации РНК, несколько отличаются. Основная экзонуклеаза, которая съедает РНК с 5’-конца в цитоплазме — это Xrn1, в ядре такую же роль играет Xrn2. Цитоплазматическая и ядерная экзосомы отличаются по набору ассоциированных с ними ферментов, хотя состав структурообразующих белков у них одинаков.
В цитоплазме почти все факторы, участвующие в распаде РНК (ферменты, разрушающие поли(А)-хвост, отрезающие кэп, различные экзонуклеазы), сконцентрированы в специальных гранулах — Р-тельцах. По сути, они представляют собой скопления белков и недораспавшихся РНК. Согласно последним данным, в Р-тельцах происходит не только разрушение мРНК, но также и их накопление, и временное хранение. Такая изоляция в Р-тельцах защищает клетку от случайной трансляции не успевших деградировать молекул. Таким образом, мРНК в цитоплазме может пребывать в двух состояниях: в транслируемом, и тогда она связана в комплексы с рибосомами, и нетранслируемом — в составе Р-телец [9], [10].
Существует большое количество механизмов распада РНК, характерных для определенных обстоятельств или специфических молекул РНК. Некоторые из них будут описаны ниже. Однако стоит подчеркнуть, что несмотря на отличия на начальных этапах процесса, в любом случае дело заканчивается разрушением РНК с помощью все тех же белков — экзонуклеаз или экзосом, а в случае мРНК еще и ферментов, удаляющих кэп, и избавляющих РНК от поли(А)-хвоста. Далее все эти белки я буду называть «факторами деградации».
Хвост нужен для деградации
В клетках прокариот разрушение и мРНК, и стабильных рРНК и тРНК происходит сходным образом. Принципиальное отличие от эукариот заключается в том, что у прокариот деградация РНК всегда начинается с внутреннего разреза молекулы эндонуклеазой, и только потом получившиеся фрагменты РНК деградируют до отдельных нуклеотидов с помощью экзонуклеаз. Что самое интересное, РНК прокариот перед деградацией приобретают поли(А)-хвосты, хотя раньше считалось, что полиаденилированные РНК есть только у эукариот. Прокариотам поли(А)-хвост нужен исключительно как платформа, с которой связываются экзонуклеазы перед началом деградации РНК. Учитывая этот факт, можно предположить, что и у эукариот поли(А)-хвост — это затравка для распада мРНК, которая в процессе эволюции приобрела дополнительные, теперь уже неотъемлемые, защитные и транспортные функции [6], [11].
У мРНК гистонов другие хвосты
Следует отдельно сказать об мРНК гистонов. Гистоны — белки, обеспечивающие компактную упаковку ДНК в хромосомы. Важно, что в клетке они транслируются только во время S-фазы клеточного цикла, когда происходит репликация ДНК: гистоны нужны для упаковки вновь синтезированной ДНК. После этого их мРНК необходимо разрушить. Регуляция синтеза гистонов и распада их мРНК очень важна, т.к. любые нарушения упаковки ДНК в хромосомы могут иметь катастрофические последствия для клетки. Поэтому для деградации мРНК гистонов существует независимый от всех других РНК механизм, который включается исключительно во время S-фазы.
В клетках эукариот мРНК гистонов уникальны, потому что они не имеют интронов (участков РНК, которые вырезаются из нее в процессе сплайсинга — одного из важнейших этапов созревания мРНК у эукариот) и поли(А)-хвоста. Отсутствие поли(А)-хвоста, видимо, тоже связано со спецификой созревания этих мРНК: у них нет сигнала полиаденилирования, и их 3’-конец образуется просто благодаря эндонуклеотическому разрезу. Но как же происходит распад, если у мРНК гистонов отсутствует платформа в виде поли(А)-хвоста для привлечения необходимых ферментов? Эта задача решается очень просто: вместо поли(А)-хвоста на конце мРНК синтезируется поли(U)-хвост, причем происходит это уже не в ядре, как у остальных мРНК, а в цитоплазме. Зрелый 3’-конец мРНК гистонов состоит из так называемой стебельно-петлевой структуры и АСС-хвостика. Эта структура выполняет роль стабилизатора — как поли(А)-хвост для других мРНК. С ней взаимодействует белок, который привлекает ферменты, синтезирующие поли(U)-хвост на конце мРНК. А дальше распад мРНК гистонов проходит уже без особенностей. То есть, у мРНК гистонов поли(U)-хвосты выполняют ту же функцию при распаде РНК, что и поли(А)-хвосты у прокариот [6].
Контроль качества
Зачем же все-таки нужно уничтожать РНК? Прежде всего, с помощью механизмов распада клетка избавляется от «испорченных» РНК. Ошибка в одной мРНК в конечном счете приводит к синтезу многих неправильных белковых молекул, а те, в свою очередь, тоже не могут выполнять свою работу. Нарушения в некодирующих РНК (рРНК, тРНК и др.) не менее опасны: часто такие молекулы просто перестают нормально функционировать. Поэтому в клетке происходит постоянный контроль качества РНК от этапа синтеза молекул до их созревания и дальнейшей работы.
Куда деть непригодные матричные РНК?
Далеко не все из вновь синтезированных в ядре мРНК функционально пригодны. Многие из них с самого начала содержат ошибки. От таких «неправильных» мРНК необходимо избавляться. Первоочередная задача — определить, где произошла ошибка. Удобнее всего это делать во время синтеза белка: первый раунд трансляции, когда с данной мРНК впервые синтезируется белок, как бы служит проверкой мРНК на качество.
Один из вариантов мутаций, которые могут возникать при синтезе мРНК — появление терминирующего кодона в неположенном месте. Это происходит, если при синтезе мРНК полимераза вместо нужного нуклеотида вставила другой, в результате чего вместо значащего триплета появляется стоп-кодон. С таким кодоном связываются факторы терминации, и синтез белка заканчивается раньше времени. Чтобы избежать накопления таких «обрубленных» белков, существует NMD (nonsense-mediated decay) — деградация, обусловленная появлением преждевременного стоп-кодона.
Основная роль в этом механизме принадлежит маркерным белкам, которые расположены на мРНК выше, чем нормальный терминирующий кодон. Именно взаимодействие этих маркеров с аппаратом терминации трансляции и приводит к запуску процесса распада мРНК. В этом механизме ключевую роль играет первый раунд трансляции: если после него мРНК не разрушилась, то она приобретает «иммунитет» к NMD, потому что маркерные белки при первом прохождении рибосомы удаляются (рис. 2) [12], [13].
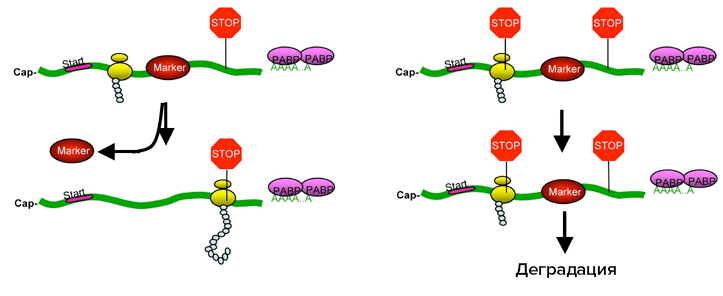
Рисунок 2. Система nonsense-mediated decay (NMD). В норме рибосома при синтезе белка сдвигает маркерные белки, и распада мРНК не происходит (слева). Если же мРНК содержит нонсенс-мутацию, то к тому моменту, когда рибосома дойдет до ложного стоп-кодона, и с ним свяжутся факторы терминации трансляции, маркерные белки будут все еще связаны с мРНК (справа).
Иногда из-за ошибок синтеза мРНК она, наоборот, теряет стоп-кодон, а не получает лишний. В этом случае вместо того, чтобы остановиться в нужном месте, рибосома продолжает синтез за пределы транслируемой области, и белок получается удлиненным. На этот случай у некоторых мРНК существует специальный механизм деградации — REMD (ribosome extension-mediated decay). Принцип этого механизма похож на предыдущий. С нетранслируемой областью мРНК связан комплекс белков. Если к концу синтеза он остается на своем месте, мРНК продолжает функционировать как матрица в последующих раундах трансляции. Сдвигание же этого комплекса (из-за прохождения рибосомы) сигнализирует о том, что от мРНК надо избавиться [14].
мРНК может потерять стоп-кодон и по другой причине — если ее синтез был прерван. Такая обрубленная мРНК все равно может участвовать в трансляции, но долго прожить ей не удается благодаря механизму NSD (nonstop decay). Поскольку нормальной терминации на недосинтезированной мРНК произойти не может, то, дойдя до ее конца, рибосома просто останавливается. К такой «повисшей» на краю мРНК рибосоме тут же подскакивают определенные белки, связываются с ней и привлекают факторы деградации (рис. 3) [15].
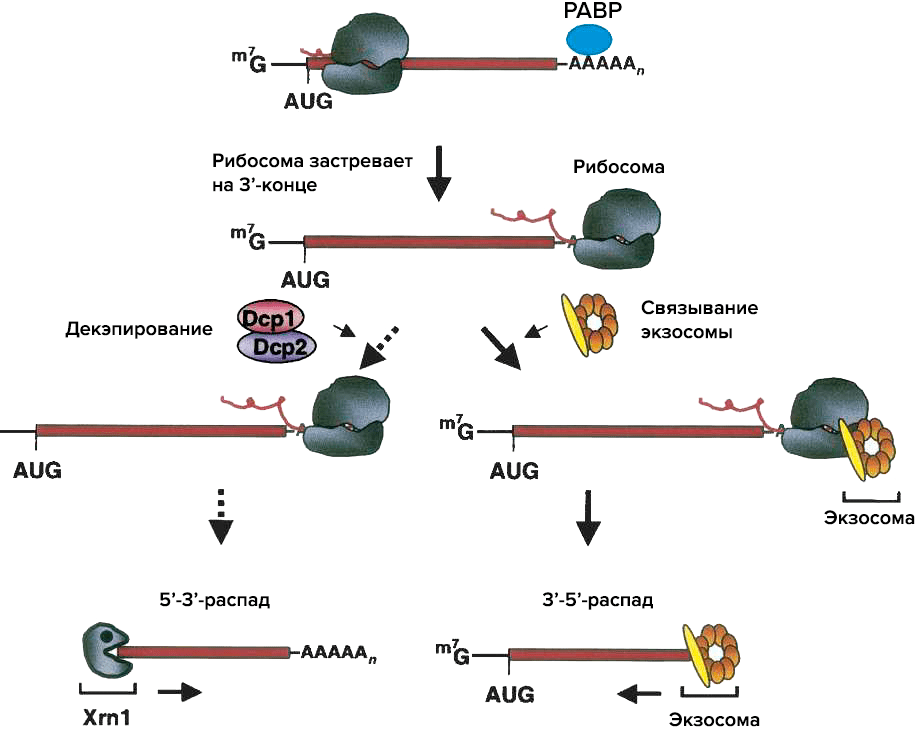
Рисунок 3. Схема non-stop decay (NSD)
В некоторых случаях на пути рибосомы при ее проходе по мРНК встают непреодолимые препятствия, опять же из-за нарушений в мРНК или рРНК (см. ниже). Такую рибосому узнают определенные белки, они в свою очередь привлекают эндонуклеазу, которая разрезает мРНК в месте остановки. Далее оставшиеся два куска мРНК подвергаются распаду с помощью экзонуклеаз. Этот механизм деградации называется NGD (no-go decay) (рис. 4) [15].
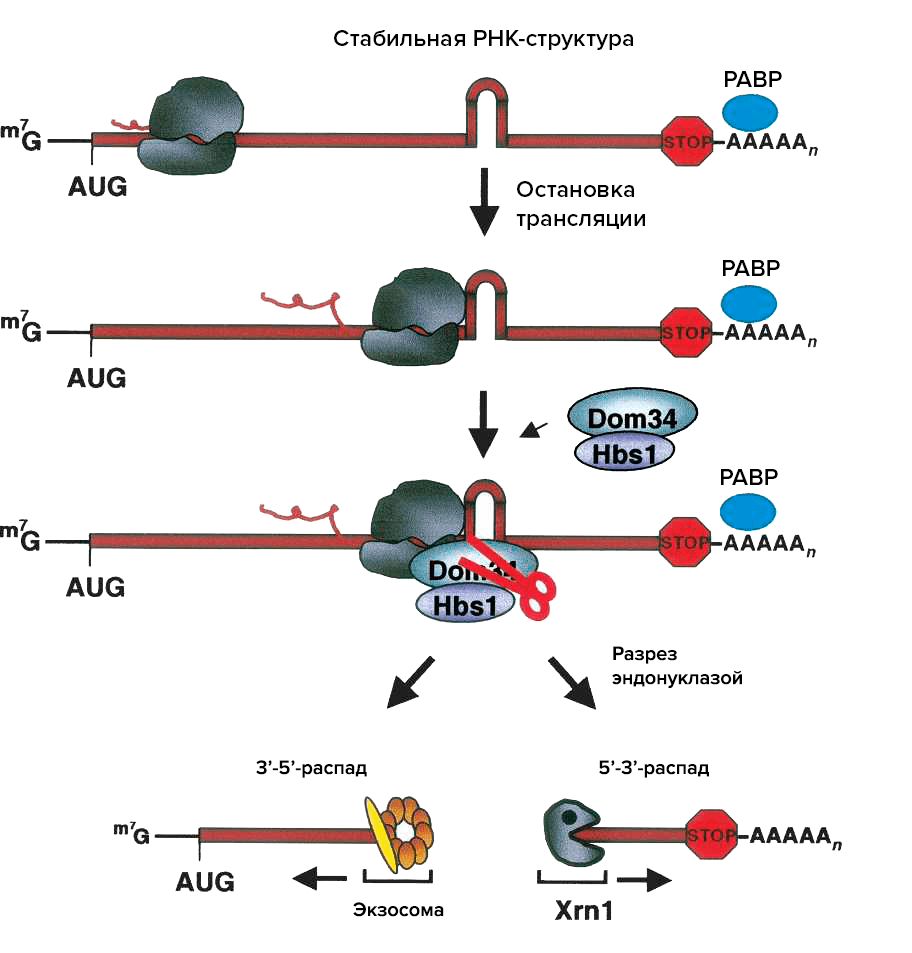
Рисунок 4. Схема no-go decay (NGD)
Долгоживущие РНК все-таки не вечны
Рано или поздно каждая РНК в клетке распадается. Даже некодирующие рРНК и тРНК, которые обычно живут долго, со временем все-таки отбраковываются по мере появления в них ошибок, то есть по мере «изнашивания».
От общего количества РНК в клетке наибольшую долю составляют рибосомные — 18S и 25S. Учитывая, что обе эти РНК входят в состав рибосом, логично было бы предположить, что нарушения в этих РНК выявляются в процессе синтеза белка. Это верно только для 18S рРНК — именно она занимается узнаванием кодонов мРНК при трансляции. Если во время синтеза белка рибосома останавливается, то 18S рРНК быстро разрушается, т.е. фактически используется такой же механизм выявления ошибки, что и при NGD. В обоих случаях сигналом к запуску распада выступает «застрявшая» во время синтеза рибосома. Очень может быть, что при этом ферменты разрушают и мРНК, и 18S рРНК без выяснения того, из-за которой из них произошла остановка синтеза. В данном случае надежнее сразу избавиться от обоих участников процесса. Однако это никак не касается 25S рРНК, в которой непосредственно находится ферментативный центр рибосомы. Распад 25S рРНК не зависит не только от трансляции, но и практически от всех белков, участвующих в различных типах распада РНК, кроме одной из экзосомных экзонуклеаз. Предполагается, что сигналом для распада 25S рРНК является невозможность связывания рибосомных белков с дефектной молекулой. Видимо, прежде всего, в деградации 25S рРНК участвуют ферменты распада белков. После диссоциации рибосомных белков от 25S рРНК и их распада сама теперь уже «оголенная» рРНК становится доступной для экзонуклеаз [16–19].
Время жизни тРНК измеряется часами и днями. В течение этого времени они постоянно участвуют в синтезе белка, проходя примерно через 40 циклов трансляции в минуту. Нуклеотиды в составе тРНК специфическим образом модифицированы. Мишенью для быстрого распада прежде всего становятся тРНК, по какой-либо причине потерявшие свои модификации. Такие тРНК менее компактны из-за нарушения структуры и являются легкой добычей для факторов деградации [20]. На 3’-хвосте гипомодифицированных тРНК синтезируется дополнительный тринуклеотид ССА, что является сигналом быстрого распада [21].
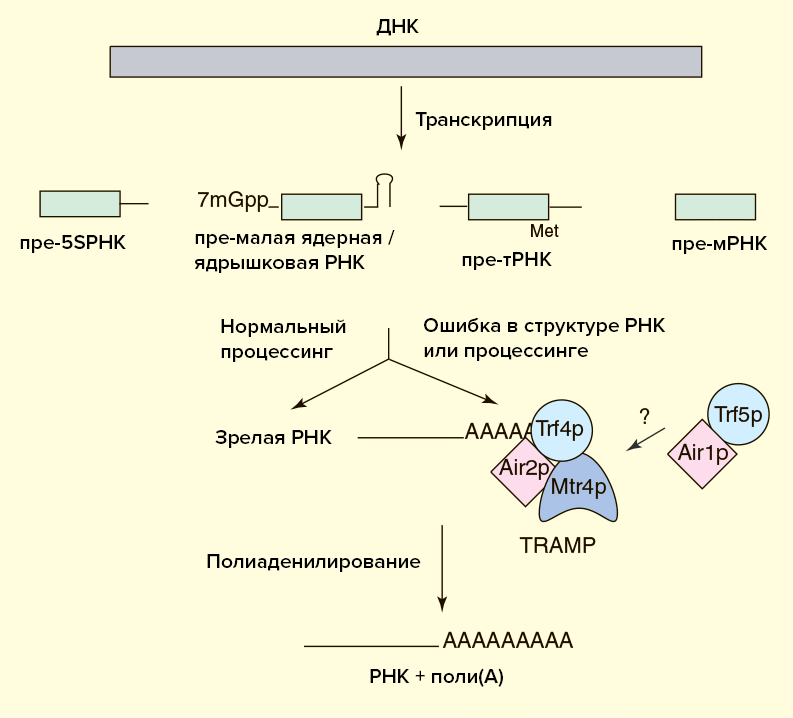
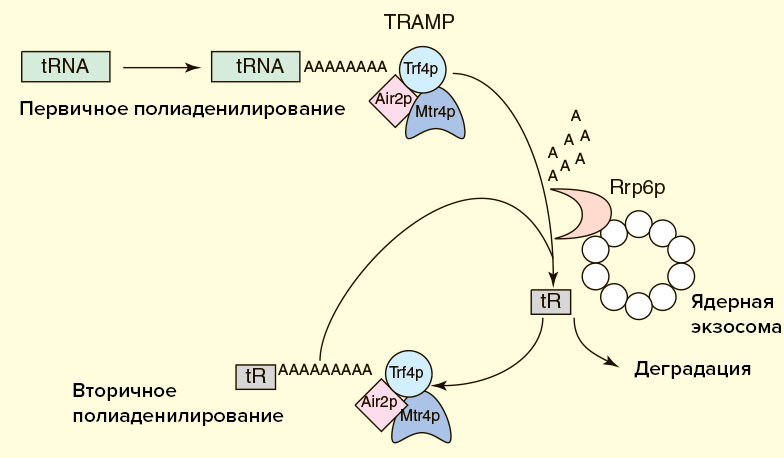
Контроль качества некодирующих РНК (рРНК, тРНК, ядерных и ядрышковых РНК) происходит еще на начальных этапах их существования — непосредственно в ядре. В ядре присутствует специальный белковый комплекс — TRAMP, в состав которого в том числе входит фермент полиаденилаза. Если оказывается, что вновь синтезированная РНК содержит ошибки (обычно это отражается на ее структуре), то TRAMP тут же присоединяет к ней поли(А)-хвост. Стоит напомнить, что длинный хвост защищает мРНК эукариот от распада. Однако для некодирующих РНК это украшение — вовсе не гарант стабильности, как для мРНК, а наоборот — сигнал для привлечения факторов деградации. Важнейшую роль среди этих факторов играет ядерная экзосома, которая и осуществляет разрушение негодной РНК (рис. 5) [22].
Известно, что TRAMP может стимулировать экзосомную деградацию и неполиаденилированной РНК, но в этом случае процесс идет медленнее. Зачем же нужен поли(А)-хвост? Дело в том, что некодирующие РНК вовсе не представляют собой одноцепочечную нить, а свернуты в сложные вторичные и третичные структуры. Иногда экзосома в процессе укорочения РНК «застревает» на высокоструктурированных участках. В этом случае TRAMP осуществляет дополнительные раунды полиаденилирования и деградации до тех пор, пока РНК не будет полностью разрушена. Видимо, для быстрой эффективной работы экзосоме необходима затравка в виде одноцепочечного участка РНК, роль которого как раз и играет поли(А)-хвост (рис. 5) [22].
Некоторым РНК нельзя позволять долго жить
Распад РНК — это не только способ контролировать качество работающих в клетке молекул, это также и мощный механизм регуляции. Известно, что в клетке есть РНК, которые распадаются очень быстро, за считанные минуты. Время жизни РНК напрямую связано с ее функцией. Быстрее всего распадаются мРНК, кодирующие регуляторные факторы. Количество этих молекул повышается в определенный момент клеточного цикла или в ответ на определенные стимулы, после чего они быстро распадаются. Такая система позволяет клетке оперативно реагировать на различные внутренние и внешние сигналы. Если этот процесс по каким-либо причинам нарушается, и РНК накапливаются в избыточном количестве, это может привести к сбою в работе всей клетки. Поэтому многие из генов таких мРНК являются протоонкогенами. Такие гены, как c-myc, c-fos, TNFα относятся к их числу.
Как оказалось, такие короткоживущие мРНК содержат специальные сигналы быстрого распада. Самый распространенный тип подобного сигнала — AU-богатый элемент (т.е., последовательность, богатая аденином и урацилом). AU-богатые элементы представляют собой последовательности в
Интересно, что многим короткоживущим мРНК одних AU-богатых элементов не хватает. Они содержат и другие последовательности, которые независимо от AU-богатых элементов ускоряют их разрушение. Так что, если по каким-то причинам один из двух механизмов деградации данной мРНК не сработал, то второй уж точно обеспечит ее распад. По-видимому, эта система двойной регуляции времени жизни возникла в эволюции особо важных, но при этом потенциально опасных в случае излишнего накопления мРНК. Кроме того, наличие двух элементов быстрой деградации дает большую гибкость при клеточном ответе на внешние и внутренние сигналы [25].
Чтобы не распасться, нужно стабилизироваться
А что, если мы зададимся не вопросом, почему какие-то РНК быстро распадаются, а почему другие живут долго? Может быть, РНК-долгожители не деградируют, потому что содержат сигналы, защищающие их от быстрого разрушения? Действительно, совсем недавно выяснилось, что многие долгоживущие мРНК имеют в своем составе определенные мотивы, с которыми взаимодействуют белки-стабилизаторы. Пока известно восемь таких элементов и изучена их связь с белком со сложным названием HNRPA2B1. Этот белок обеспечивает удлинение времени жизни соответствующей мРНК. Вероятно, существуют и другие подобные белки, которые еще только предстоит обнаружить. Кроме того, пока остается открытым вопрос, как именно работает механизм защиты РНК от деградации [26].
Разрушение? Нет, защита
РНК-интерференция — это механизм подавления экспрессии генов, который может вести к распаду соответствующей мРНК. В системе РНК-интерференции принимают участие два типа молекул РНК — микроРНК и малые интерферирующие РНК. Эти молекулы имеют очень малые размеры — около 22 нуклеотидов.
Эти маленькие РНК соединяются с комплементарными им последовательностями мРНК-мишеней, после чего происходит или разрезание мРНК-мишени и дальнейшее разрушение ее фрагментов, или просто блокировка трансляции с этой мРНК. Какие же РНК становятся жертвами РНК-интерференции? Микро-РНК чаще всего связываются с клеточными мРНК, распад которых необходим для регуляции экспрессии соответствующих генов. Малые интерферирующие РНК призваны защищать клетку от чужеродных РНК, попадающих в клетку из вирусов, а также от внутренних врагов — ретротранспозонов [27].
Что же такое распад РНК для клетки?
Подытожим, зачем нужен распад РНК.
Во-первых, это контроль качества РНК. Своевременный распад нефункциональной РНК препятствует накоплению ненужных и потенциально опасных для клетки молекул (как непосредственно РНК, так и белков). Неоценимую помощь в этом процессе оказывают разнообразные механизмы регистрации ошибок, заточенные под распознавание определенных типов нарушений РНК.
Во-вторых, это регуляция экспрессии генов. Экспрессия гена — это преобразование информации, хранящейся в генах, в функциональный продукт — РНК или белок. Но ведь количество той или иной РНК или белка в клетке в каждый момент времени определяется и уровнем синтеза этой молекулы, и уровнем распада. Поэтому быстрая деградация РНК — это очень важный механизм регуляции экспрессии, который позволяет клетке быстро отвечать на внутренние и внешние сигналы.
В-третьих, это защита от чужеродных и вредных молекул. Часто генетический материал вирусов оказывается в клетке именно в форме РНК, кроме того, некоторые транспозоны могут транскрибироваться, что также приводит к накоплению нежелательных молекул. Распознавание этих РНК и избавление от них клетки — необходимый защитный процесс, который также обеспечивается механизмами, основанными на распаде РНК.
Литература
- Wilusz Lab - What We Do;
- Обо всех РНК на свете, больших и малых;
- МикроРНК — чем дальше в лес, тем больше дров;
- МикроРНК впервые обнаружены в одноклеточном организме;
- МикроРНК участвуют в регуляции метастазирования опухолей;
- C. J. Wilusz, J. Wilusz. (2008). New ways to meet your (3') end oligouridylation as a step on the path to destruction. Genes & Development. 22, 1-7;
- Clare A Beelman, Roy Parker. (1995). Degradation of mRNA in eukaryotes. Cell. 81, 179-183;
- S. Lykke-Andersen, D. E. Brodersen, T. H. Jensen. (2009). Origins and activities of the eukaryotic exosome. Journal of Cell Science. 122, 1487-1494;
- Dinghai Zheng, Nader Ezzeddine, Chyi-Ying A. Chen, Wenmiao Zhu, Xiangwei He, Ann-Bin Shyu. (2008). Deadenylation is prerequisite for P-body formation and mRNA decay in mammalian cells. J Cell Biol. 182, 89-101;
- U. Sheth. (2003). Decapping and Decay of Messenger RNA Occur in Cytoplasmic Processing Bodies. Science. 300, 805-808;
- M. P. Deutscher. (2006). Degradation of RNA in bacteria: comparison of mRNA and stable RNA. Nucleic Acids Research. 34, 659-666;
- Ann-Bin Shyu, Miles F Wilkinson, Ambro van Hoof. (2008). Messenger RNA regulation: to translate or to degrade. EMBO J. 27, 471-481;
- Oliver Mühlemann. (2008). Recognition of nonsense mRNA: towards a unified model: Figure 1. Biochm. Soc. Trans.. 36, 497-501;
- Jian Kong, Stephen A Liebhaber. (2007). A cell type–restricted mRNA surveillance pathway triggered by ribosome extension into the 3′ untranslated region. Nat Struct Mol Biol. 14, 670-676;
- O. Isken, L. E. Maquat. (2007). Quality control of eukaryotic mRNA: safeguarding cells from abnormal mRNA function. Genes & Development. 21, 1833-3856;
- Sarah E. Cole, Frederick J. LaRiviere, Christopher N. Merrikh, Melissa J. Moore. (2009). A Convergence of rRNA and mRNA Quality Control Pathways Revealed by Mechanistic Analysis of Nonfunctional rRNA Decay. Molecular Cell. 34, 440-450;
- Meenakshi K. Doma, Roy Parker. (2006). Revenge of the NRD: Preferential Degradation of Nonfunctional Eukaryotic rRNA. Developmental Cell. 11, 757-758;
- Kotaro Fujii, Makoto Kitabatake, Tomoko Sakata, Mutsuhito Ohno. (2012). 40S subunit dissociation and proteasome-dependent RNA degradation in nonfunctional 25S rRNA decay. The EMBO Journal. 31, 2579-2589;
- Frederick J. LaRiviere, Sarah E. Cole, Daniel J. Ferullo, Melissa J. Moore. (2006). A Late-Acting Quality Control Process for Mature Eukaryotic rRNAs. Molecular Cell. 24, 619-626;
- Andrei Alexandrov, Irina Chernyakov, Weifeng Gu, Shawna L. Hiley, Timothy R. Hughes, et. al.. (2006). Rapid tRNA Decay Can Result from Lack of Nonessential Modifications. Molecular Cell. 21, 87-96;
- J. E. Wilusz, J. M. Whipple, E. M. Phizicky, P. A. Sharp. (2011). tRNAs Marked with CCACCA Are Targeted for Degradation. Science. 334, 817-821;
- James T. Anderson. (2005). RNA Turnover: Unexpected Consequences of Being Tailed. Current Biology. 15, R635-R638;
- C. Barreau. (2005). AU-rich elements and associated factors: are there unifying principles?. Nucleic Acids Research. 33, 7138-7150;
- A B Shyu, M E Greenberg, J G Belasco. (1989). The c-fos transcript is targeted for rapid decay by two distinct mRNA degradation pathways.. Genes & Development. 3, 60-72;
- C Y Chen, Y You, A B Shyu. (1992). Two cellular proteins bind specifically to a purine-rich sequence necessary for the destabilization function of a c-fos protein-coding region determinant of mRNA instability.. Mol. Cell. Biol.. 12, 5748-5757;
- Hani Goodarzi, Hamed S. Najafabadi, Panos Oikonomou, Todd M. Greco, Lisa Fish, et. al.. (2012). Systematic discovery of structural elements governing stability of mammalian messenger RNAs. Nature. 485, 264-268;
- Richard W. Carthew, Erik J. Sontheimer. (2009). Origins and Mechanisms of miRNAs and siRNAs. Cell. 136, 642-655.