Модельные организмы: ксенопус
01 сентября 2020
Модельные организмы: ксенопус
- 1772
- 1
- 3
Сентябрь со шпорцевой лягушкой — животным, элегантным в своей нелепости
иллюстрация Ксении Сайфулиной
-
Автор
-
Редакторы
-
Иллюстратор
Темы
В живых уголках и зоомагазинах читатели могли видеть этих странных больших лягушек, застывших в аквариумах с растопыренными лапами. Окрашенные в природные серо-зеленые тона или альбиносы, они безучастны к наблюдателю и оживляются, лишь когда им пинцетом подают кусочки еды, которые они с жадностью заглатывают, помогая передними лапками. Хотя ксенопусы скучноваты на вид, у них увлекательная естественная история, а также заметная роль в развитии экспериментальной науки — а потому ими мы продолжим наш цикл о модельных организмах.
Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!

Партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Необычный гибрид — Живой тест на беременность — Икра как огромная модельная клетка — Ближе к человеку! — Искусственный мини-организм
Гладкая шпорцевая лягушка (Xenopus laevis), более известная под своим латинским именем «ксенопус», — это обычное экзотическое животное. Экзотическое — потому что живет оно в экваториальной и субэкваториальной Африке. Почти всю жизнь эта лягушка проводит в воде. Лишь изредка перемещается по суше из водоема в водоем — для нее это как для человека переезд в другой город. Обычное — потому что в африканских джунглях и болотах лягушек много.
У нее есть только одна биологическая необычность: тетраплоидный геном. То есть набор хромосом не двойной, как у нас, а четверной. Впрочем, и эта черта необычна лишь для амниот — животных, умеющих создавать в своих яйцах (или внутри самих себя) замкнутую невысыхающую водную среду для зародыша за счет заключения его в амнион (отсюда название). Для анамний, к которым относятся и земноводные, это почти обычное дело. Интереснее то, что геном ксенопуса аллотетраплоидный, то есть два набора хромосом у него разные и происходят... от разных видов (рис. 3) [1]! Этим она отличается от своего близкого родственника когтистой шпорцевой лягушки (Xenopus tropicalis, рис. 2) — у нее обычный диплоидный набор хромосом.

Рисунок 2. Гладкая шпорцевая лягушка (сверху) трогательно обнимает двух когтистых шпорцевых лягушек (снизу). На этом снимке хорошо видны различия в размере и окраске двух видов.
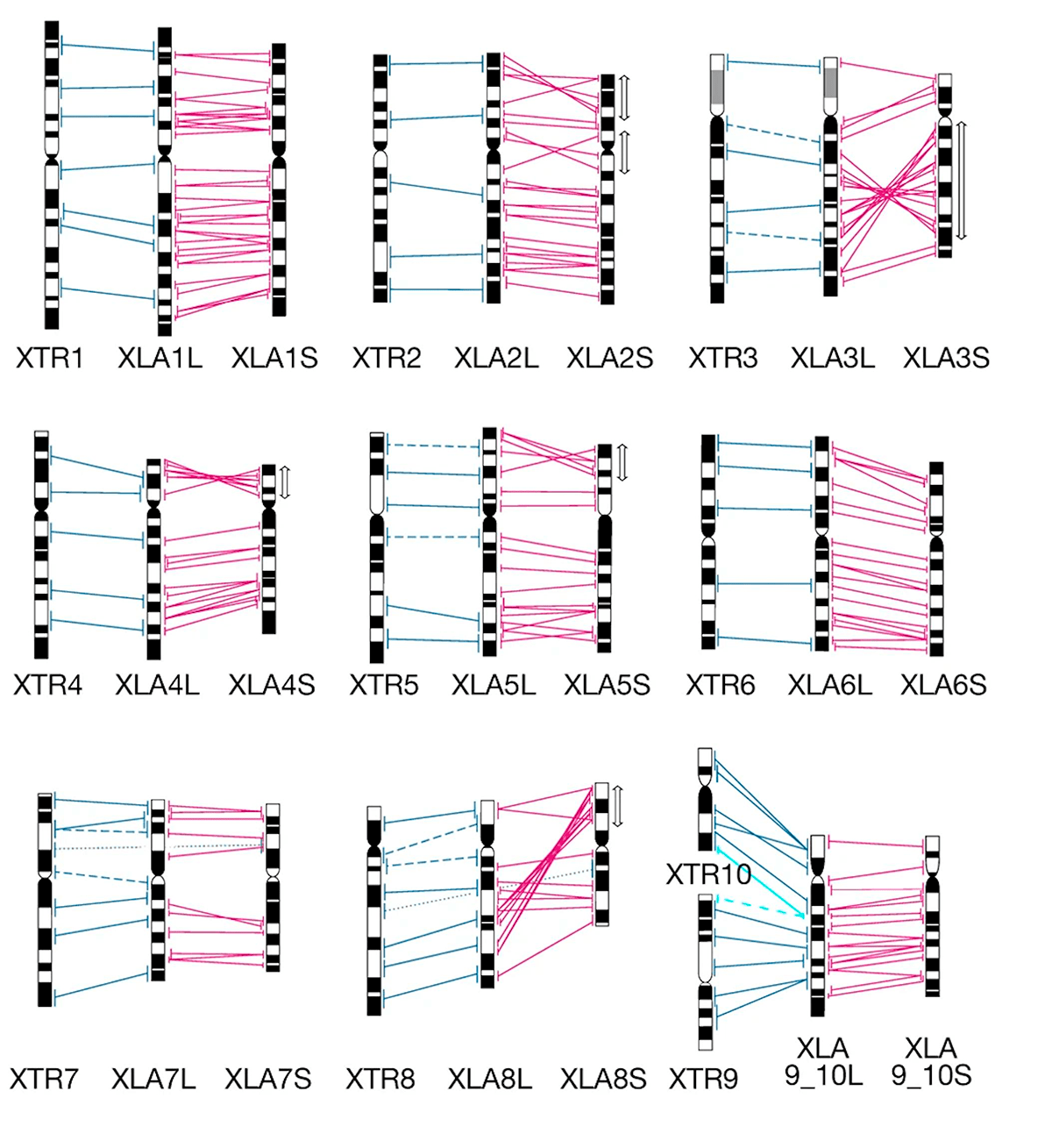
Рисунок 3. Сравнение хромосом Xenopus tropicalis (XTR) и Xenopus laevis (XLA). Хромосомы обозначены в виде черно-белых полос, отражающих их окрашивание на цитогенетическом препарате. Тонкие линии обозначают гомологию. Видно, что каждой хромосоме X. tropicalis соответствуют две хромосомы X. laevis. Но при этом сами хромосомы X. laevis — разные.
Используя методы молекулярной филогенетики, ученые подсчитали, что гладкая и когтистая шпорцевые лягушки разошлись 48 миллионов лет назад. С тех пор с когтистой ничего особо впечатляющего не происходило, а вот гладкой не повезло. 34 миллиона лет назад филогенетическая веточка, ведущая к ней, разделилась на два вида (рис. 4). Эти два вида, похоже, частично сохранили способность скрещиваться. Возможно, что скрещивание произошло случайно, да еще и с образованием нередуцированных гамет — яйцеклеток и сперматозоидов с диплоидным, а не гаплоидным набором хромосом. Такое редко, но бывает. Это геномное «несчастье» случилось около 17 миллионов лет назад [1]. В итоге получился тетраплоидный гибрид. Этот гибрид дал начало двум новым видам — знаменитой на весь мир гладкой шпорцевой лягушке и безвестной марсабитской шпорцевой лягушке (Xenopus borealis, рис. 5) — про нее нет даже статьи в «Википедии».
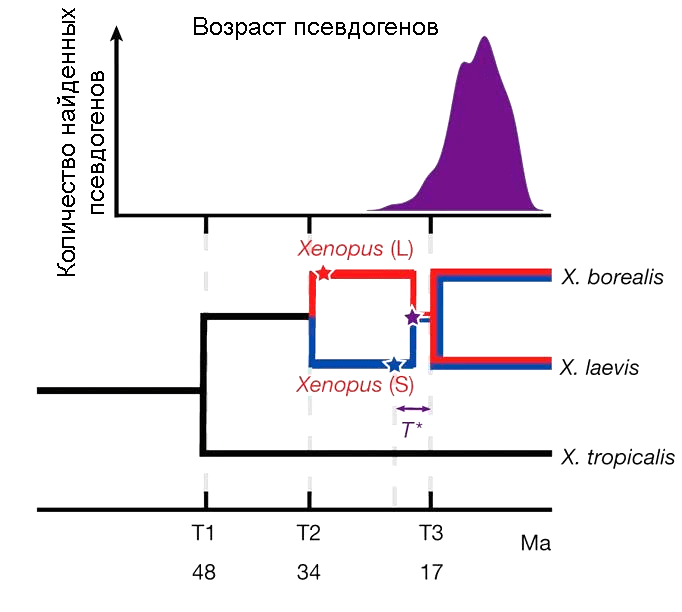
Рисунок 4. Эволюционная история трех видов рода Xenopus. В том же временном масштабе сверху показано число псевдогенов в геноме X. laevis — оно всегда увеличивается после полиплоидизации, так как часть генов оказывается избыточной и теряет функцию.

Рисунок 5. Марсабитская шпорцевая лягушка (Xenopus borealis)
Можно сказать, что природа сама поставила масштабный эксперимент на ксенопусе. Сейчас его с интересом изучают генетики [1]. Вполне возможно, что все мы полиплоиды. Предполагается, что в начале эволюции позвоночных, когда мы были даже еще не рыбами, произошли две полиплоидизации, и набор хромосом увеличился с 2N до 8N [2]. Только следы этого генетического изменения сейчас можно увидеть лишь при пристальном изучении генома — с течением времени они «стерлись». А ксенопус с его недавней полиплоидизацией — это хорошая модель того, что случилось со всеми нами гораздо раньше [3].
Дупликация у Xenopus позволяет нам изучить относительно свежую геномную дупликацию, взглянув на относительно краткосрочный эволюционный ответ на удвоение. Древние дупликации у позвоночных гораздо старше, и могут быть замаскированы хромосомными перестройками и потерями генов. В сущности, большинство удвоенных генов, созданных ранними дупликациями у позвоночных, быстро утратились, так как были избыточны. На лягушке мы можем изучать текущий процесс утраты.
После этой генетической встряски 17 миллионов лет назад никто не ставил над гладкой шпорцевой лягушкой никаких экспериментов. Пока в 1920-е годы за нее не взялся британский ученый Ланселот Томас Хогбен и не стал изучать ее эндокринологию. Он удалял лягушке весь гипофиз, переднюю долю, подсаживал железу обратно, впрыскивал гормоны... В общем, проделывал примерно то же, что профессор Преображенский делал с Шариковым в «Собачьем сердце». (Как можно облегчить страдания животного при таких экспериментах — читайте ниже во врезке.)
Нет, в царевну лягушка так и не превратилась. Но Хогбен по результатам экспериментов открыл, что эндокринология ксенопуса, в частности регуляция репродуктивного цикла, очень похожа на человеческую — и это несмотря на довольно большое эволюционное расстояние. Оказывается, лягушка способна реагировать на человеческие гормоны так же, как на свои [4]. В конце 1930-х — начале 1940-х гг. открытие перевели в практическую плоскость и показали, что инъекция мочи беременной женщины под кожу самке ксенопуса вызывает у последней метание икры. Теперь мы знаем, что всему виной хорионический гонадотропин (ХГЧ), выделяющийся у беременных с мочой. Лягушка способна реагировать на него почти так же, как человек... только вот беременности у нее нет — не забываем, что это яйцекладущая анамния. Поэтому на человеческий «гормон беременности» амфибия отвечает вполне успешно — но так, как умеет.
В итоге в первой половине XX века наша амфибия использовалась на потоке в качестве живого теста на беременность. Это обусловило ее популярность в качестве экспериментального животного: ксенопусы изначально были доступны исследователям, так как всегда закупались лабораториями как живой реактив. Сыграло роль также и то, что лягушка довольно неприхотлива: устойчива к голоданию, многим болезням и другим неблагоприятным воздействиям. То есть содержать ее в неволе довольно просто [5], а цены на нее относительно низкие.
Само исследовательское использование ксенопуса оказалось обусловлено всё той же его способностью — метать икру «по запросу» . За один раз от самки ксенопуса можно получить тысячи яйцеклеток. А яйцеклетка — это такой хороший исследовательский материал!
Для стимуляции метания икры давно не используют мочу беременных женщин. Эти времена давно прошли — сейчас доступны рекомбинантные препараты гормонов — как ХГЧ, так и лютеинизирующего гормона. Их и вводят сейчас лягушке, чтобы получить яйцеклетки. Какие еще сегодня существуют возможности сделать эксперимент гуманнее? Об этом читайте выше во врезке от компании «Диаэм».
Начнем с того, что яйцеклетка амфибии — это крупная клетка. Да и вообще, ооциты — одни из самых крупных известных клеток. Яйцеклетка гладкой шпорцевой лягушки достигает более 1 мм в диаметре (можно видеть невооруженным глазом!), а ее ядро в 100 000 раз больше ядра обычной клетки. Поэтому по удобству манипуляции они могут посоперничать с гигантскими аксонами кальмара лолиго, про которые мы писали в нашей июньской статье [6]. Как и на аксонах лолиго, на них можно изучать работу ионных каналов. И есть одно преимущество. На аксонах кальмара можно изучить только работу тех каналов, которые уже находятся в их мембране! Заставить нейрон кальмара экспрессировать на аксонах не свойственный ему канал практически невозможно. А яйцеклетку ксенопуса — можно! Впрыснув в нее нужные матричные РНК, можно получить большую модельную клетку, в мембране которой находятся ионные каналы из сердца человека, мозга морской свинки или, скажем, почек египетской летучей собаки. На этой гигантской клетке удобно замерять изменения мембранного потенциала в ответ на различные воздействия — скажем, добавление лекарственного препарата (рис. 6) [7].
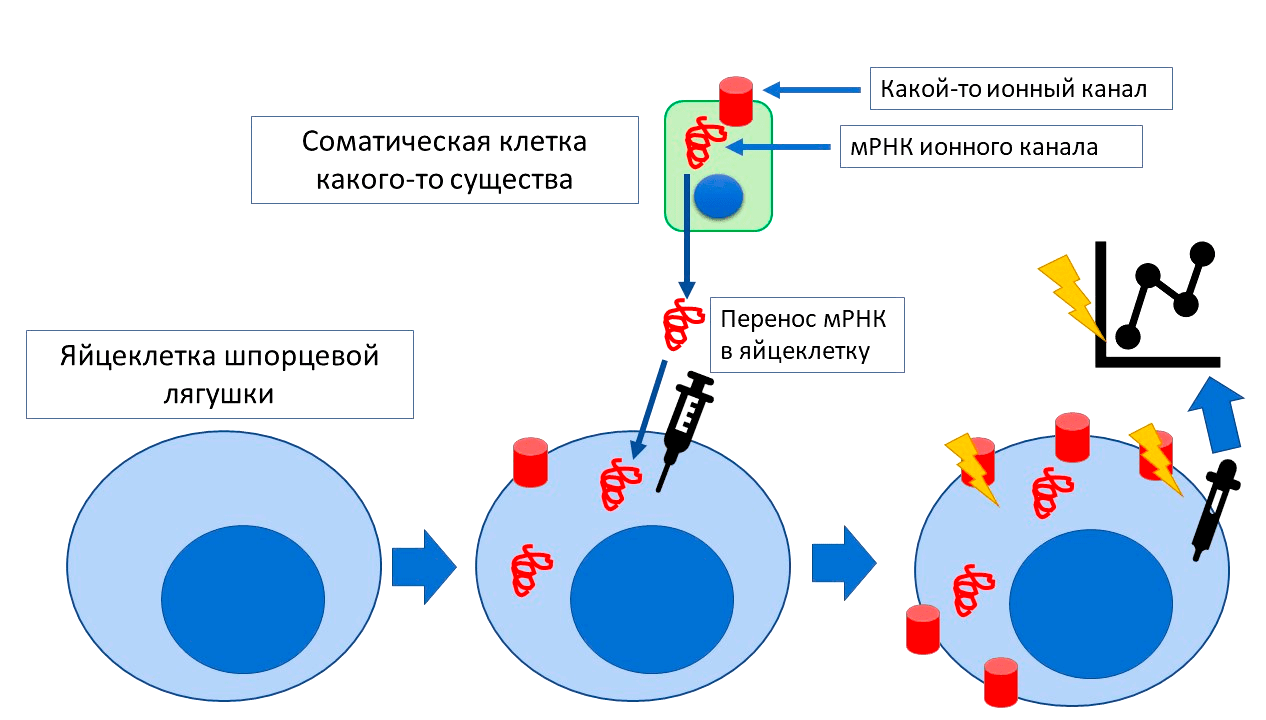
Рисунок 6. Способ изучения работы ионных каналов на яйцеклетке ксенопуса. Допустим, какой-то ионнный канал экспрессируется на соматических клетках какого-то существа. Но эти клетки слишком маленькие для непосредственного измерения тока и для манипуляций. В таком случае нам потребуются: 1) яйцеклетки ксенопуса; 2) мРНК изучаемого канала, которую мы возьмем из соматической клетки. мРНК инъецируется внутрь яйцеклетки, и с нее начинает «считываться» и синтезироваться белок. Он встраивается в мембрану яйцеклетки и начинает в ней работать, как работал в родной клетке. А так как яйцеклетка ксенопуса большая, на ней относительно легко изучать работу канала . Например, с помощью специальных микроэлектродов замерить проходящий через него ток.
Кстати, именно для таких опытов в 2015 году предложили использовать яйцеклетки не от известной на весь мир X. laevis [8], а ее обделенной славой сестры X. borealis. Яйцеклетка у марсабитской шпорцевой лягушки меньше, чем у гладкой, но имеет меньшую плотность «своих», эндогенных кальциевых каналов, которые при опыте создают лишний ток и мешают считыванию сигнала с «чужого» канала, встроенного в мембрану. Как знать? Может, приходит время X. borealis?
Однако даже это не придало бы большой ценности яйцеклеткам ксенопуса, если бы они славились только размером и ионными каналами. Есть у них еще одна особенность — из оплодотворенных яйцеклеток ведь развиваются эмбрионы! Напомню, что у амфибий оплодотворение внешнее — самка откладывает яйцеклетки в воду, и уже там самец обливает их семенной жидкостью. И если получить от лягушки тысячи яйцеклеток путем гормональной стимуляции, а затем единовременно оплодотворить всю кладку... то можно получить тысячи эмбрионов, развивающихся синхронно (видео 1)! Приятный сюрприз — с этого момента до вылупления головастиков пройдет всего 37 часов (не то что наши 9 месяцев!). За этот «скоростной» синхронный эмбриогенез ксенопус и полюбился исследователям, работающим в области биологии развития. И именно в ней это основной экспериментальный объект. Что для генетиков дрозофила [9], то для биологов развития ксенопус.
Видео 1. Потрясающе синхронное развитие эмбрионов ксенопуса — от зиготы до гаструлы
К этому стоит добавить, что эмбриогенез ксенопуса крайне прост для наблюдения — на протяжении всего процесса прозрачной остается как оболочка икринки, так и сам эмбрион. Поэтому для изучения эмбриогенеза совсем не обязательно рассматривать под микроскопом окрашенные препараты нарезанного тонкими пластиками эмбриона — можно вживую наблюдать все стадии его развития (видео 2 и 3) и даже работу внутренних органов на поздних стадиях (видео 4).
Видео 2. Гаструляция и нейруляция у эмбриона ксенопуса. Такую красивую гаструляцию, по типу «впячивания», можно видеть только на ксенопусе — на мыши или собаке не получилось бы, даже при возможности наблюдать эмбрион в реальном времени. Всё потому, что у млекопитающих два зародышевых листка образуются расщеплением (деламинацией) одного листочка бластулы. Рот просто прорывается. А вот нейруляция (образование и смыкание нервной трубки) у ксенопуса вполне себе «человеческая». Хорошо видно смыкание нервных валиков. Нарушение этого процесса приводит к тяжелым порокам развития.
Видео 3. Своеобразное продолжение видео 2 — здесь показано развитие ксенопуса от формирования нервной трубки до вылупления
Видео 4. На прозрачном головастике Xenopus tropicalis видны биение сердца и движение крови по брюшной аорте. Обратите внимание, что сердце у головастика в области глотки (там же оно закладывается у эмбриона человека, только впоследствии опускается вниз), оно двухкамерное и имеет S-образную форму (как у рыбы).
Конечно, современной науке недостаточно наблюдения за прозрачным эмбрионом. Конфокальная микроскопия с красителями на основе антител к определенным белкам позволяет рассмотреть не просто анатомию, а «молекулярную анатомию» эмбриона и сформировавшегося животного (рис. 7). Но и здесь ксенопус — один из самых популярных лабораторных организмов. Нет проблем наделать препаратов из лягушки, если новых лягушат можно производить быстро и оптом. Был бы под рукой рекомбинантный ХГЧ...
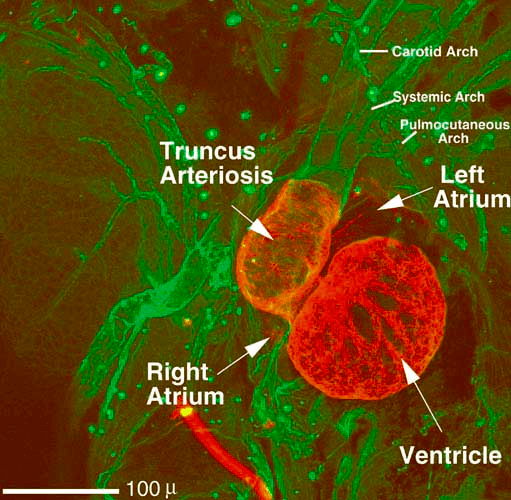
Рисунок 7. Конфокальная микроскопия сердца ксенопуса на финальной стадии развития позволяет понять некоторые медицинские вещи. Сейчас у ксенопуса один большой желудочек (Ventricle) и два небольших предсердия (Left Atrium, Right Atrium). Напомню, что сердце у взрослой лягушки так и останется трехкамерным — дополнительная стадия развития с формированием перегородки эволюционно появится только у «продвинутых» рептилий вроде крокодилов. Препарат окрашен моноклональными антителами к тропонину T (красные) и к фибриллину (зеленые). Окрашенный красным тропонин T расположен там, где толстый миокард, — это сократительный белок. Теперь понятно, почему он выделяется в кровь при инфаркте и является биохимическим маркером этого состояния. Окрашенный зеленым фибриллин обрисовывает контуры крупных артерий — он служит каркасом для основного компонента их стенки, эластина. Теперь понятно, почему при мутации гена фибриллина поражаются в том числе крупные сосуды. Возникает и много других аномалий соединительной ткани — такое состояние называется синдромом Марфана.
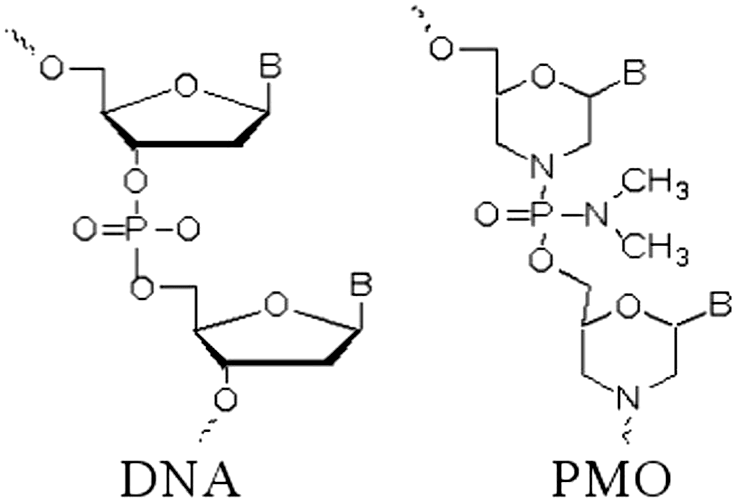
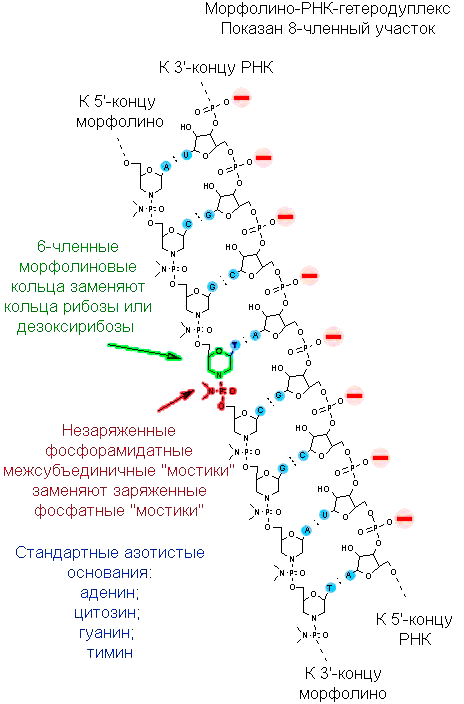
Но эмбриология так и не превратилась бы в биологию развития, если бы оставалась описательной наукой и изучала только анатомию тех эмбрионов, что есть. Настоящая биология развития — это экспериментальные манипуляции над эмбрионами с целью изменить их программу развития и изучить последствия. И ксенопус опять оказался удачным объектом: его эмбрионами очень легко манипулировать — не только хирургически (это уже вчерашний день), но и на генном уровне. Особенно любима исследователями методика выключения у эмбриона отдельных генов. Выключать гены теоретически можно и с помощью обычных антисмысловых РНК, но для ксенопуса обычно используются химически модифицированные олигонуклеотиды: циклические молекулы рибозы заменены на шестичленные кольца морфолина, а свободные гидроксильные группы в фосфате заменены на амидные.
Нуклеиновые кислоты обозначают обычно по углеводному компоненту: если рибоза — то кислота рибонуклеиновая, если дезоксирибоза — то кислота дезоксирибонуклеиновая. Так как здесь вместо сахара морфолин, то ничего не оставалось бы, как назвать молекулу морфолиновой нуклеиновой кислотой или морфолинонуклеиновой кислотой. Впрочем, так как цепочка короткая, в ходу название «морфолиновый олигонуклеотид», а в англоязычной литературе такие молекулы называются просто «морфолино» (morpholino) (рис. 8а). Они комплементарно связываются с мРНК «выключаемого» гена (рис. 8б) и механически блокируют связывание ее с рибосомой или со сплайсосомой. Соответствующий белок прекращает синтезироваться. Такой прием называется нокдауном гена .
Нокдаун отличается от нокаута гена, когда в клетку вводится антисмысловая РНК, активируя разрушение мРНК «выключаемого» гена. Такой эффект эпигенетически наследуется, то есть ген выключается более надежно и надолго. Отсюда и такие названия.
Морфолиновые олигонуклеотиды имеют важное преимущество перед антисмысловыми РНК — из-за нестандартного строения остова они не разрушаются нуклеазами, не уничтожаются защитными системами клетки, не вызывают иммунной реакции у модельного животного. Сейчас существует даже отдельная база данных по морфолиновым олигонуклеотидам, с помощью которых можно выключить тот или иной ген ксенопуса.
Нокдауны генов у ксенопуса широко используются для моделирования человеческих наследственных заболеваний и подтверждения вовлечения того или иного гена [10]. Этому способствует относительная филогенетическая близость лягушки к человеку: она куда более похожа на него, чем дрозофила [9] или рыбка данио рерио [11], про которых мы писали раньше. На ней можно воспроизвести нарушение развития кожи, лица и носа, почек — даже на рыбке это было бы сделать труднее.
На этом значимость ксенопуса не заканчивается. Обычно при разговоре о клонировании мы вспоминаем овечку Долли, а ведь подлинная слава первого клонированного позвоночного должна была достаться ксенопусу. Здесь сыграл роль опять-таки большой размер яйцеклеток, легкость их получения и манипулирования ими. В 1958 году Джон Гердон пересадил в яйцеклетку ксенопуса ядро из соматической клетки головастика, тем самым клонировав лягушку. Кроме того, именно он в 1971 году открыл способность яйцеклеток ксенопуса транслировать впрыснутую в них РНК [12] — с чего и началась история дальнейшего использования шпорцевых лягушек как модельных организмов.
Помимо этого, из большого количества яйцеклеток ксенопуса можно приготовить бесклеточную смесь (правильнее будет сказать: «бесклеточную систему»), которая умеет в пробирке транскрибировать гены, синтезировать белки по заданной мРНК, производить посттрансляционную модификацию белков и еще много полезных вещей. Мечта биохимика — им тоже есть, за что любить ксенопуса! Для транскрипции в пробирке делают экстракт из ядер [13], а для трансляции и посттрансляционных модификаций — из цитоплазмы [14]. Благо клетка большая и цитоплазмы много.
А в январе 2020-го в журнале PNAS вышла статья [15], где авторы собирали из эмбриональных клеток ксенопуса примитивные организмы с заданными свойствами. Авторы проектировали их на компьютере с использованием эволюционной модели, а затем пытались воссоздать получившийся дизайн из настоящих клеток эпителия и сердечной мышцы эмбриона (рис. 9, видео 5). Что интересно — организмы собирались и успешно двигались! И даже обладали способностью к регенерации. Пока единственное, что они умеют — это передвигаться, но кто знает, что будет дальше? И чем еще нас удивят лягушки из африканских прудов?
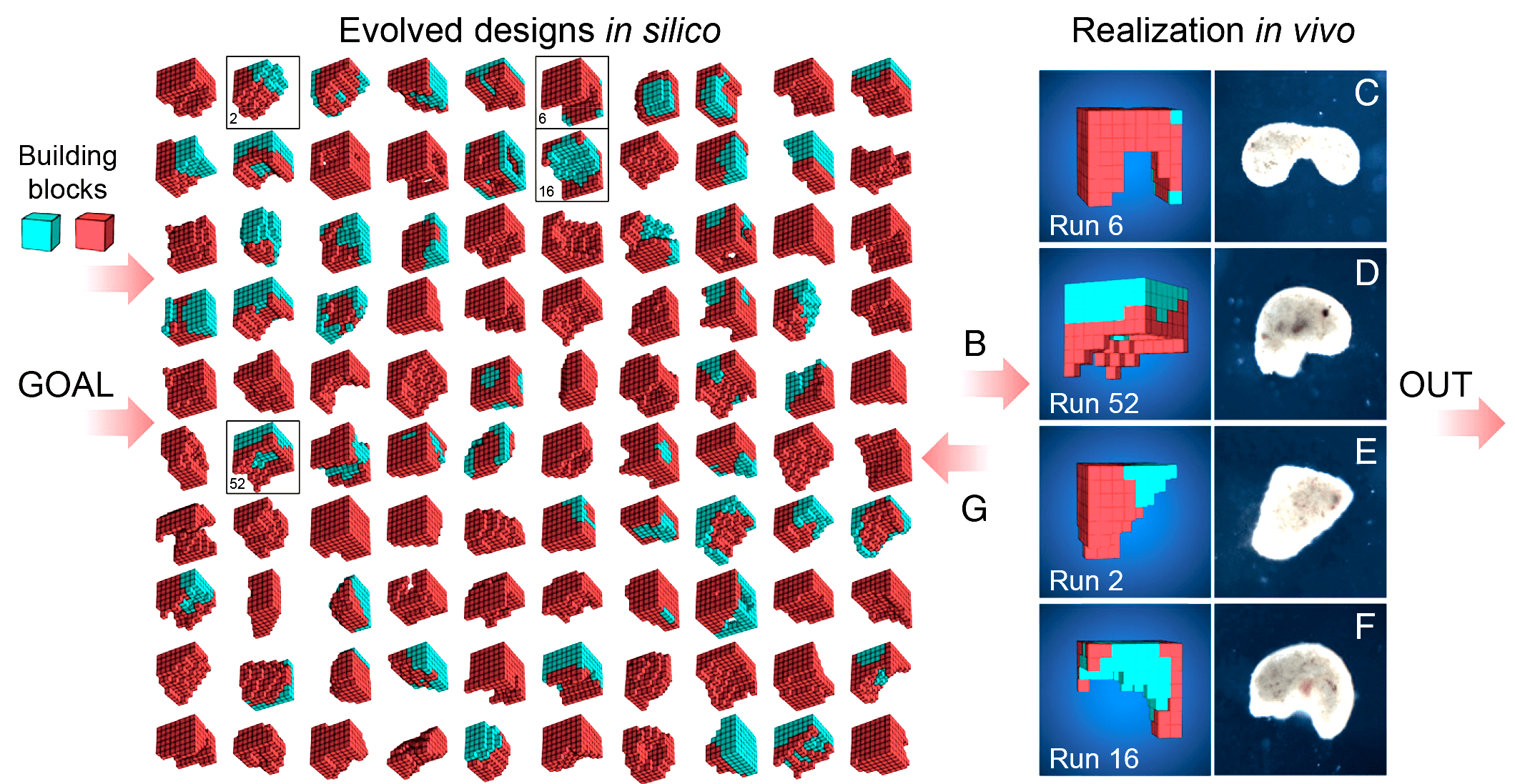
Рисунок 9. Искусственные организмы: компьютерные модели и их живые «сборки» из клеток эмбриона ксенопуса
Видео 5. Процесс создания искусственного организма и его передвижение
Рисунок 10. Ксенопус — герой календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. У тех, кто успел приобрести календарь, данио рерио уже зеленеет на стенке, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте над столом! Ну а кто всё же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
иллюстрация Ксении Сайфулиной
Литература
- Adam M. Session, Yoshinobu Uno, Taejoon Kwon, Jarrod A. Chapman, Atsushi Toyoda, et. al.. (2016). Genome evolution in the allotetraploid frog Xenopus laevis. Nature. 538, 336-343;
- Кребс Дж., Голдштейн Э., Килпатрик С. Гены по Льюину. М.: «Лаборатория знаний», 2018. — 919 с.;
- Lab frog Xenopus laevis genome sequence shows what happens when genomes collide. (2016). EurekAlert!;
- Gurdon J.B. and Hopwood N. (2000). The introduction of Xenopus laevis into developmental biology: of empire, pregnancy testing and ribosomal genes. Int. J. Dev. Biol. 44: 43–50;
- John B. Wallingford, Karen J. Liu, Yixian Zheng. (2010). Xenopus. Current Biology. 20, R263-R264;
- Модельные организмы: моллюски;
- Nathan Dascal. (1987). The Use ofXenopusOocytes for the Study of Ion Channel. Critical Reviews in Biochemistry. 22, 317-387;
- Ben Cristofori-Armstrong, Ming S. Soh, Sahil Talwar, Darren L. Brown, John D. O. Griffin, et. al.. (2015). Xenopus borealis as an alternative source of oocytes for biophysical and pharmacological studies of neuronal ion channels. Sci Rep. 5;
- Модельные организмы: дрозофила;
- Martin Blum, Tim Ott. (2018). Xenopus: An Undervalued Model Organism to Study and Model Human Genetic Disease. Cells Tissues Organs. 205, 303-313;
- Модельные организмы: данио рерио;
- J. B. GURDON, C. D. LANE, H. R. WOODLAND, G. MARBAIX. (1971). Use of Frog Eggs and Oocytes for the Study of Messenger RNA and its Translation in Living Cells. Nature. 233, 177-182;
- John K. Barrows, David T. Long. (2019). Cell-free transcription in Xenopus egg extract. J. Biol. Chem.. 294, 19645-19654;
- Glenn Matthews, Alan Colman. (1991). A highly efficient, cell-free translation/translocation system prepared fromXenopuseggs. Nucl Acids Res. 19, 6405-6412;
- Sam Kriegman, Douglas Blackiston, Michael Levin, Josh Bongard. (2020). A scalable pipeline for designing reconfigurable organisms. Proc Natl Acad Sci USA. 117, 1853-1859;
- Sandra J Kolker, Urszula Tajchman, Daniel L Weeks. (2000). Confocal Imaging of Early Heart Development in Xenopus laevis. Developmental Biology. 218, 64-73;
- Yuchen Nan, Yan-Jin Zhang. (2018). Antisense Phosphorodiamidate Morpholino Oligomers as Novel Antiviral Compounds. Front. Microbiol.. 9.