
Настоящее и будущее генетических тестов
17 октября 2023
Настоящее и будущее генетических тестов
- 990
- 3
- 3
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: За последние 10–15 лет в мире появились компании, которые на основе анализа ДНК сообщают клиенту информацию о его персональной предрасположенности к большому количеству различных заболеваний, о склонностях к каким-либо видам спорта или об особенностях характера. Эти компании дают оценку вашего персонального риска, в основном используя информацию из опубликованных научных работ. Например, о том какие участки ДНК и как сильно ассоциированы с болезнью или признаком. Однако на сегодняшний день для большинства многофакторных болезней и признаков генетики умеют оценивать риски с достаточно ограниченной точностью. Основная причина в том, что мы еще достаточно мало знаем о том, как работает наша ДНК. Ниже я расскажу, какие точности у этих тестов, чем вы рискуете, проходя их, что думает об этом экспертное сообщество и мое видение того, как эти тесты войдут в нашу жизнь в ближайшие 10 лет.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Речь в этой статье пойдет о компаниях, которые дают оценки для широкого спектра многофакторных заболеваний и признаков: онкологических и сердечно-сосудистых, психических расстройствах, успешности в спорте, правильном выборе питания и многих других признаков на основе ДНК. Такие тесты в англоязычной литературе называют direct-to-consumer tests. Как это устроено: вы присылаете компании образец, например, эпителия внутренней стороны щеки, из которого выделяется ДНК. Далее эта ДНК оцифровывается и анализируется. После чего в своем личном кабинете на сайте компании вы видите, какие у вас предрасположенности к различным заболеваниям. Direct-to-consumer здесь означает, что между вами и компанией отсутствует специалист, который бы назначил тест по медицинским или другим показаниям, объяснил бы результаты теста, сформировал бы рекомендации, основываясь на результатах тестирования. В сервис часто входит консультирование после тестирования, однако делается это удаленно.
Первая такая компания под названием 23andme запустила свой сервис в Калифорнии в 2007 году. Начиная со следующего года и на протяжении следующих пяти лет Министерство здравоохранения США в лице своего агентства под названием Food and Drug Administration (FDA) регулярно пыталось добиться от 23andme каких-либо данных, подтверждающих достоверность генетических тестов. Не получив такой информации, в 2013 году FDA запретила компании продавать своим клиентам в США генетические тесты на все заболевания. И только в 2017 году был снят запрет на тестирование десяти заболеваний. На сегодняшний день компания тестирует на предрасположенности к 20+ болезням, 30+ признакам, на наличие генетического риск-варианта к 40+ болезням и на эффективность к трем лекарствам.
Подробнее об этой компании и за что именно она подверглась критике можно прочитать в статьях «В генетическом контакте» [1] и «Генетическое тестирование и патернализм в медицине» [2].
В России есть несколько компаний, предлагающих более-менее схожий сервис. Например, компании Genotek, MyGenetics и «Атлас» предлагают оценить риски некоторых заболеваний, предрасположенности к видам спорта, особенностям питания, даже чертам характера, эффективности лекарств, а также посмотреть на происхождение — откуда родом предки тестируемого. После всех разбирательств c 23andme на сайте FDA появился документ, который описывает ограничения, имеющиеся у таких тестов. Ниже приведу выдержки из этого документа (выделены жирным) с моими комментариями и ссылками на научные работы, чтобы показать, как экспертное сообщество смотрит на такого рода сервис.
В ДНК тестах используются не все генетические варианты, которые влияют на многофакторную болезнь. Таким образом, риск заболевания, который вам сообщается компанией, не является вашим действительным полным риском заболеть (раздел i, параграф A).
Дело в том, что, несмотря на огромное количество денег и усилий, которые были закачаны мировой наукой в исследования генетической составляющей многофакторных болезней, наше понимание большинства болезней все еще достаточно ограничено, и, как следствие, предсказательная способность моделей для оценки рисков невысокая. Генетикам все еще предстоит открыть много неизвестных на сегодня генетических вариантов, как защищающих от болезней, так и повышающих их риск развития. Из публикаций в рецензируемых научных журналах видно, что большая часть научного сообществе относится скептически к таким ДНК тестам из-за их низкой точности. Ниже я приведу несколько примеров и пояснений, из-за чего это происходит. Только лишь последние несколько лет с появлением больших генетических баз данных (например, таких, как UK Biobank) в мировой научной литературе осторожно стала звучать мысль (например, в статьях за 2018 и 2019 гг. [3], [4]), что сегодня мы можем начать думать о внедрении в клиническую практику моделей оценки риска с использованием генетики.
Для большинства болезней точность предсказания на основе генетики варьируется от AUC = 0,6 до AUC = 0,7 [5]. AUC — это критерий точности модели. AUC = 0,5 — нулевая предсказательная способность модели, AUC = 1 — это 100% точность модели (рис. 1). Сегодня врач намного точнее может диагностировать и предсказывать развитие многих болезней без использования генетической информации. Например, в статье за 2020 год показано, что информация о возрасте, поле, расе, курении, уровне холестерина, кровяном давлении и статусе диабета пациента дает намного более высокую точность предсказания (AUC=0,76) ишемической болезни сердца, чем только генетика (AUC=0,61), а объединение этой информации дает AUC=0,78 [6].
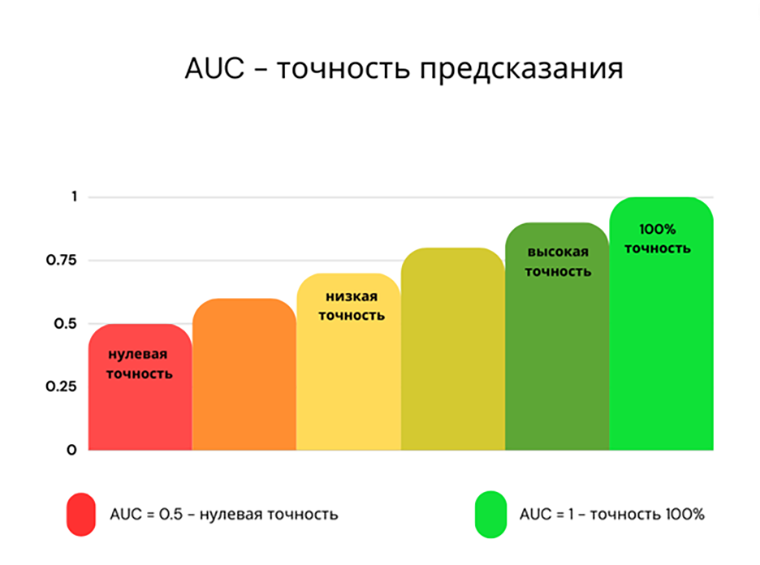
Рисунок 1. AUC — точность предсказания заболевания.
Многофакторные болезни — это такие, за которые отвечают десятки и даже сотни тысяч генетических вариантов, каждый из которых имеет малый эффект на болезнь [7], [8]. Сегодня мы знаем из самых масштабных исследований только о сотнях или тысячах из них и только для небольшого количества болезней. По этой причине точности существующих моделей для многофакторных болезней относительно низкие. Существуют еще моногенные болезни, в которых одна или небольшое количество мутаций дает очень большой эффект и, как правило, приводит к развитию очень серьезного заболевания (например, болезнь Гентингтона, муковисцидоз, гемиплегическая мигрень). Причины таких заболеваний — мутации в кодирующих частях генов, которые приводят к тому, что ген перестает правильно работать. Такие заболевания редки и имеют яркое проявление. Если мутация известна, то ее легко детектировать.
Стоит заметить, что генетический тест на моногенные заболевания имеет большое значение для новорожденных [9]. Существуют моногенные заболевания, которые проявляются спустя определенное время после рождения. Например, новорожденные с болезнью под названием фенилкетонурия рождаются здоровыми, однако из-за нарушения усвоения фенилаланина это вещество накапливается в организме и повреждает нервную систему. Если начать лечение сразу же после рождения, не дожидаясь проявления болезни, то можно существенно улучшить качество и продолжительность жизни ребенка. По этой же причине имеет смысл тестироваться на моногенные заболевания парам, которые планируют детей, чтобы оценить риск рождения ребенка с генетическим заболеванием.
Различные компании используют разное количество генетических вариантов для оценки риска. Таким образом, ваш риск заболеть может быть различным в зависимости от того, в какой компании вы пройдете тест (раздел i, параграф B).
Много мутаций, ассоциированных с болезнями, были найдены методом под названием «полногеномный анализ ассоциаций» (англ. Genome-Wide Association Study, или GWAS). Идея метода заключается в том, чтобы все мутации в геноме протестировать на наличие корреляции (ассоциации) с заболеванием. GWAS — это статистический метод и поэтому указывает на наличие ассоциации между мутацией и заболеванием с некоторой вероятностью, которая обозначается как p-value. Для генома человека принято считать наличие корреляции при p-value ниже 5×10–8. Обнаружение мутации с p-value ниже этого значения только лишь указывает на возможное наличие ассоциации и ни в коем случае не говорит о том, что мутация действительно влияет на болезнь. Необходимо повторить это же исследование на другой выборке людей, другой исследовательской группой и на другом оборудовании, чтобы исключить влияние различных факторов. GWAS сейчас делается в рамках больших консорциумов, куда входят десятки и сотни исследовательских групп со всего мира. Только в рамках консорциумов с суммарной выборкой в сотни тысяч индивидуумов можно получать валидные результаты. Самым большим GWAS на сегодня является анализ роста человека, где была проанализирована выборка размером 5,4 млн человек и найдено 12 111 ассоциированных мутаций [10]. Чуть более подробно про GWAS можно прочитать в посте моего телеграм-канала про геномику.
Мутации часто называют «снипами», от английского SNP — Single Nucleotide Polymorphism. Давайте посмотрим, какие снипы, например, компания «Генотек» включила в модель для расчета риска предрасположенности к никотиновой зависимости. Наберем в графе поиска на сайте компании слова Nicotine addiction. На рис. 2 показан скриншот сайта. Видим, что компания использует семь снипов из региона CHRNB3: rs1451240, rs4736835, rs10958725, rs6474413, rs1955185, rs4950 и rs7004381. В колонке Publication показано, что часть этих снипов взяты из публикации за 2012 год с номером PMID=22524403. Идем в эту публикацию [11] и видим, что в Таблице 2 первые семь снипов соответствуют тем, что компания взяла для оценки риска никотиновой зависимости. Из этой таблицы видим, что у снипов rs4950 и rs7004381 значения p-value (последняя колонка) равняются 9,5×10–8 и 9,93×10–8 , соответственно. Эти p-value превышают пороговое значение 5×10–8, поэтому возникает вопрос — зачем их используют для оценки риска.
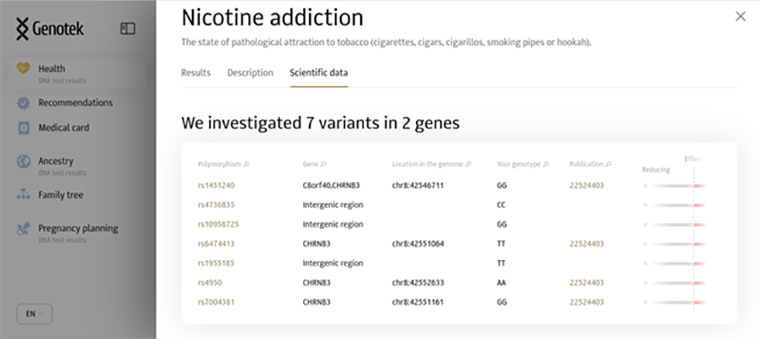
Рисунок 2. Скриншот сайта «Генотек».
Также после 2012 года вышло несколько статей по никотиновой зависимости: в 2018 нашли снип rs910083-C (DNMT3B) [12], в 2019 нашли нашли 566 снипа [13], в 2023 нашли 32 новых снипа [14]. Эти снипы не используются для расчета риска, если судить по сайту компании. Для сравнения, компания Mygenetics использует только три снипа в оценке риска. Для компании «Атлас» модель для оценки риска не нашел, однако обнаружил, что они используют также и факторы среды для оценки рисков, что, кстати, увеличивает точность.
Подытоживая, можно сказать, что модели оценки рисков у компаний для одних и тех же заболеваний различаются и некоторые последние научные данные могут не использоваться. Этот вывод наводит на размышления.
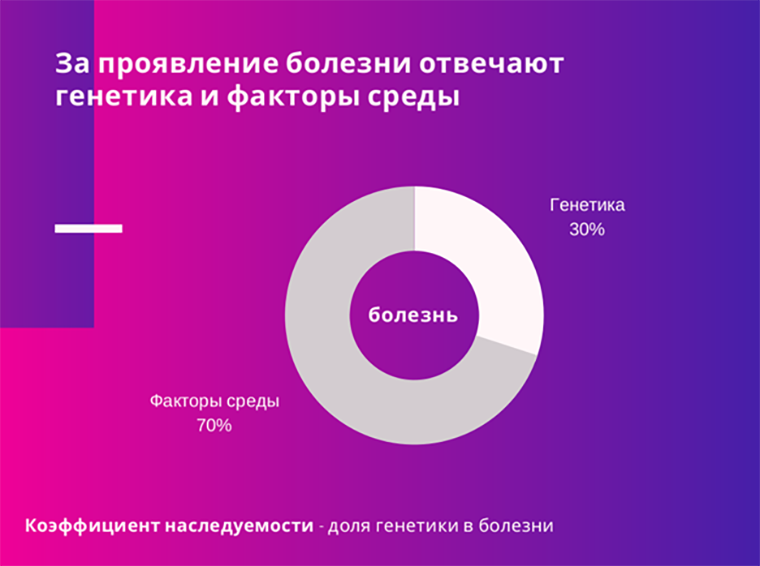
Рисунок 3. Коэффициент наследуемость—пропорция вклада генетических факторов в заболевание или признак.
Кроме генетических факторов, на развитие заболевания могут влиять факторы среды (раздел i, параграф C).
В генетике есть такой параметр, как коэффициент наследуемости. Он говорит о том, какая пропорция дисперсии признака описывается генетическими факторами (рис. 3). Коэффициент, равный 0%, говорит о том, что за признак отвечают только факторы среды (такие, как питание, экология, курение и т.д.). На такую болезнь можно влиять, меняя только внешнюю среду. Коэффициент, равный 100%, говорит о том, что за признак отвечают только генетические факторы.
Метаанализ большинства научных публикаций за последние полвека показал, что коэффициент наследуемости для 18 000 изученных заболеваний равен примерно 50% [15]. Это означает, что в среднем только лишь 50% вашего риска заболеть описывается генетикой. Вполне возможна ситуация, когда у вас «плохие гены», но в тоже время «хорошие факторы среды». Например, у вас сбалансированное питание, отсутствуют вредные привычки, вы живете в месте с хорошей экологией. Из-за этого ваш риск заболеть может быть намного ниже, чем у людей с «хорошими генами». Поэтому дешевле и практичнее бывает сначала подумать об изменении своей окружающей среды, чем о ДНК-тестировании.
Данные тесты не рассчитаны, чтобы диагностировать болезни, сообщать вам о вашем текущем состоянии здоровья, использовать для принятия медицинских решений, например, стоит или нет принимать лекарства и в каком количестве (раздел i, параграф F).
Все это может сделать только врач. Даже если ваш тест показывает наличие высокого риска какого-либо заболевания, есть вероятность, что это ошибка из-за неправильного взятия ДНК, ошибка генотипирования или интерпретации генома. Например, в недавней статье описаны несколько случаев, в которых тест дал ошибочный результат [16]. В одном из них тест показал наличие у 12-летней девочки генетического варианта, связанного с заболеванием под названием Синдром Элерса—Данлоса. Пациент посетил семь кардиологов, два гинеколога, офтальмолога, гастроэнтеролога, шесть терапевтов, медицинского генетика, в дополнение обследовали четырех других членов семьи и провели повторное генотипирование. В результате, после большого количества усилий, болезнь не была подтверждена. В исследовании за 2020 год показали, что тест может ошибочно показать наличие в среднем пяти генетических вариантов, ассоциированных с заболеваниями [17]. Таким образом, стоит осторожно относиться к результатам тестов.
В противоположность случаю, описанному выше, многие не предпринимают никаких действий после того, как тест показал высокий риск какого-либо заболевания. Например, в этом исследовании большинство из тех, кто получил результаты с увеличенным риском заболевания онкологией, не предпринял никаких попыток по изменению своей диеты, физических нагрузок, каких-либо других действий для уменьшения риска заболевания [18]. Это указывает на то, что для большинства людей ценность таких тестов нулевая. Вероятно, это происходит из-за того, что большинство из нас и так знают, что нужно вести здоровый образ жизни, и результаты генетического теста слабо влияют на наше поведение.
Важный момент — это политика работы с данными, которой в настоящее время придерживаются компании и которой они будут придерживаться в будущем. Известно, что одна из самых больших компаний в США, FamilyTreeDNA, делится генетическими данными своих клиентов с ФБР. В 2018 году исследование показало, что 79% пользователей ДНК-тестов в США согласны с тем, чтобы полиция имела доступ к их генетическим данным.
Другая проблема — это безопасность хранения данных. Мы все видим, как много утечек происходит из организаций, которые вроде бы должны иметь лучшие системы защиты данных. Например, здесь сообщается об утечке информации о 100 000 клиентов «Сбербанка». Те, кто работал в подобных организациях, прекрасно знает, что невозможно установить преграды таким утечкам. Всегда найдется сотрудник, который из мести, желания заработать или просто по ошибке сольет данные на сторону. Это всего лишь вопрос времени, когда появится черный рынок генетических данных. Здесь компаниями следует разработать свои собственные жесткие протоколы работы с данными. Необходимо контролировать, кто, когда, для чего и по чьей санкции использовал генетические данные клиента. Это очень трудная и почти невозможная задача для компании, так как, по моему опыту, компании, мягко говоря, вольно обращаются с данными клиентов.
Сегодня мы достаточно мало можем узнать о человеке по ДНК, но спустя 10 лет, я уверен, предсказательная способность моделей будет достаточно высока, чтобы многое рассказать о вашем характере, привычках и болезнях. Как было упомянуто выше, одним из основных инструментов поиска новых мутаций, ассоциированных с болезнями и признаками, является GWAS. Было показано, что увеличение размера выборки приводит к увеличению статистической мощности метода и тем самым позволяет открывать все больше новых мутаций. Первые GWAS проводились на выборках размером в сотни или тысячи людей. GWAS на выборке размером 13 665 человек в 2008 выявил 20 мутаций, ассоциированных с ростом человека [20]. Увеличение выборки до 5,4 млн человек в 2022 привело к открытию 12 111 новых мутаций [10]. На сегодняшний день только для небольшого количества заболеваний сделаны GWAS на выборке, превышающей 1 млн человек. Однако в ближайшие 10 лет будет обнаружено большое количество новых мутаций для многих заболеваний и признаков человека. Это приведет к увеличению точности предсказания риска развития многих заболеваний и признаков.
Есть еще вопрос — на сколько вы имеете право самостоятельно распоряжаться информацией о своем геноме. Мы знаем, что 50% генома у нас совпадает с нашими родителями и нашими детьми, 25% — с нашими внуками, дедушками и бабушками, 12,5% — с нашими правнуками, прадедушками и прабабушками и т.д. Это означает, что, делясь своим генетическим материалом с коммерческими компаниями, человек автоматически отдает часть информации о геноме своих родственников. Таким образом, используя сервис генетического тестирования, вы передаете часть персональной информации ваших родственников без их согласия. Возможно, стоит получать разрешение от своих родственников перед передачей своего генома (а, следовательно, и части их генома) другим лицам.
Еще один момент касается этической составляющей таких тестов. Известно, что примерно 6% населения является носителями мутаций, вызывающих моногенные заболевания [21]. Как мы знаем, почти все такие заболевания не лечатся или, точнее, лечатся симптоматически. Наличие такой мутации — это запрограммированная в геноме гарантированная смерть или, по меньшей мере, серьезные проблемы [22]. Возникает вопрос, насколько этично сообщать человеку, что у него обнаружена мутация, из-за которой у него высокий риск ранней смерти, скажем, от болезни Гентингтона, приводящей к постепенной гибели клеток мозга и от которой не существует лечения. После такого сообщения у человека, вероятно, повысится тревожность, что потенциально может привести к серьезным психическим расстройствам. У человека могут начаться проблемы с физическим здоровьем от психологических проблем задолго до того, как начнутся проблемы из-за плохой мутации. Если проблема не имеет решения, то, может быть, не стоит о ней беспокоиться? Другими словами, если болезнь не лечится, может, не стоит сообщать о ней и знать о ее наличии до ее проявления? Мы можем много обсуждать результаты генетических тестов, их ограничения и будущее, но на самом деле большой вопрос в том — а хочется ли знать свои потенциальные риски развития заболеваний? Априори кажется, что хочется, но если задуматься...
Перечисленные выше проблемы указывают на достаточно низкую ценность таких генетических тестов для индивидуального потребителя в настоящее время. Однако наука движется вперед, и в ближайшие 10 лет многие из этих проблем будут решены. Основная трудность, которая останется — это предсказание риска развития многофакторных болезней. И всё потому, что большая часть риска определяется не только генетикой, но и факторами среды. Надо сказать, что подавляющая часть смертей в мире приходится как раз на многофакторные болезни. На их профилактику и лечение, соответственно, уходит наибольшее количество ресурсов. Было показано, что генетический тест на многофакторную болезнь имеет смысл только для 5–10% населения с высоким генетическим риском. Этим людям абсолютно точно стоит вести здоровый образ жизни и регулярно проходить медицинский осмотр. Учитывая, что основные выгодоприобретатели от теста — это небольшая часть людей, то, следовательно, получается, что для подавляющего большинства генетический тест бесполезен.
Возникает логичный вопрос — стоит ли вообще делать такой генетический тест? Я уверен, есть небольшая вероятность, что этот тест вам будет полезен. Например, покажет у вас наличие «плохой» мутации. Однако на сегодняшний день, как мне кажется, это больше похоже на интересное времяпровождение, чем решение каких-то задач. Сами компании декларируют, что это тесты для развлекательных и образовательных целей. Проблемы со здоровьем решаются улучшением качества жизни и медициной, а не генетическим тестами с сайта. Я опросил десять своих знакомых, делавших такие тесты, о том, какую пользу они принесли им. Девять из них ответили, что никакую. Один ответил, что польза была, но затруднился ответить, какая конкретно.
Мне видится польза от применения этих тестов, только если тестируется вся популяция целиком, либо большая ее часть. Выгодоприобретателями опосредованно является каждый из нас, даже если ваш индивидуальный генетический тест показывает низкие риски заболевания. Показано, что знание риска развития ишемической болезни сердца в 45 лет сокращает медицинские расходы в среднем около 4000 долларов на человека в течение следующих 10 лет [23]. Так как расходы на лечение распределены равномерно между всеми нами, то сокращение расходов на терапию пациентов с высоким риском выгодно каждому из нас. Лет через десять, когда ученые намного лучше изучат генетику многих заболеваний, внедрение генетических тестов с рождения позволит значительно сократить расходы на здравоохранение.
Литература
- В генетическом контакте;
- Генетическое тестирование и патернализм в медицине;
- Amit V. Khera, Mark Chaffin, Krishna G. Aragam, Mary E. Haas, Carolina Roselli, et. al.. (2018). Genome-wide polygenic scores for common diseases identify individuals with risk equivalent to monogenic mutations. Nat Genet. 50, 1219-1224;
- Louis Lello, Timothy G. Raben, Soke Yuen Yong, Laurent C. A. M. Tellier, Stephen D. H. Hsu. (2019). Genomic Prediction of 16 Complex Disease Risks Including Heart Attack, Diabetes, Breast and Prostate Cancer. Sci Rep. 9;
- Nilanjan Chatterjee, Jianxin Shi, Montserrat García-Closas. (2016). Developing and evaluating polygenic risk prediction models for stratified disease prevention. Nat Rev Genet. 17, 392-406;
- Joshua Elliott, Barbara Bodinier, Tom A. Bond, Marc Chadeau-Hyam, Evangelos Evangelou, et. al.. (2020). Predictive Accuracy of a Polygenic Risk Score–Enhanced Prediction Model vs a Clinical Risk Score for Coronary Artery Disease. JAMA. 323, 636;
- David B. Goldstein. (2009). Common Genetic Variation and Human Traits. N Engl J Med. 360, 1696-1698;
- Teri A. Manolio, Francis S. Collins, Nancy J. Cox, David B. Goldstein, Lucia A. Hindorff, et. al.. (2009). Finding the missing heritability of complex diseases. Nature. 461, 747-753;
- Pourfarzam M.,Zadhoush F. (2013). Newborn Screening for inherited metabolic disorders; news and views. J Res Med Sci. 18, 801–808;
- Loïc Yengo, Sailaja Vedantam, Eirini Marouli, Julia Sidorenko, Eric Bartell, et. al.. (2022). A saturated map of common genetic variants associated with human height. Nature. 610, 704-712;
- John P. Rice, Sarah M. Hartz, Arpana Agrawal, Laura Almasy, Siiri Bennett, et. al.. (2012).
CHRNB 3 is more strongly associated withF agerströmT est forC igaretteD ependence‐based nicotine dependence than cigarettes per day: phenotype definition changes genome‐wide association studies results. Addiction. 107, 2019-2028; - D B Hancock, Y Guo, G W Reginsson, N C Gaddis, S M Lutz, et. al.. (2018). Genome-wide association study across European and African American ancestries identifies a SNP in DNMT3B contributing to nicotine dependence. Mol Psychiatry. 23, 1911-1919;
- Mengzhen Liu, 23andMe Research Team, Yu Jiang, Robbee Wedow, Yue Li, et. al.. (2019). Association studies of up to 1.2 million individuals yield new insights into the genetic etiology of tobacco and alcohol use. Nat Genet. 51, 237-244;
- Bryan C. Quach, Michael J. Bray, Nathan C. Gaddis, Mengzhen Liu, Teemu Palviainen, et. al.. (2020). Expanding the genetic architecture of nicotine dependence and its shared genetics with multiple traits. Nat Commun. 11;
- Tinca J C Polderman, Beben Benyamin, Christiaan A de Leeuw, Patrick F Sullivan, Arjen van Bochoven, et. al.. (2015). Meta-analysis of the heritability of human traits based on fifty years of twin studies. Nat Genet. 47, 702-709;
- Tia Moscarello, Brittney Murray, Chloe M. Reuter, Erin Demo. (2019). Direct-to-consumer raw genetic data and third-party interpretation services: more burden than bargain?. Genetics in Medicine. 21, 539-541;
- Xiaoming Liu, Deborah Cragun, Jinyong Pang, Swamy R. Adapa, Renee Fonseca, Rays H. Y. Jiang. (2020). False Alarms in Consumer Genomics Add to Public Fear and Potential Health Care Burden. JPM. 10, 187;
- Stacy W. Gray, Sarah E. Gollust, Deanna Alexis Carere, Clara A. Chen, Angel Cronin, et. al.. (2017). Personal Genomic Testing for Cancer Risk: Results From the Impact of Personal Genomics Study. JCO. 35, 636-644;
- Christi J. Guerrini, Jill O. Robinson, Devan Petersen, Amy L. McGuire. (2018). Should police have access to genetic genealogy databases? Capturing the Golden State Killer and other criminals using a controversial new forensic technique. PLoS Biol. 16, e2006906;
- Michael N Weedon, Diabetes Genetics Initiative, Hana Lango, Cecilia M Lindgren, Chris Wallace, et. al.. (2008). Genome-wide association analysis identifies 20 loci that influence adult height. Nat Genet. 40, 575-583;
- Versha Prakash, Marc Moore, Rafael J Yáñez-Muñoz. (2016). Current Progress in Therapeutic Gene Editing for Monogenic Diseases. Molecular Therapy. 24, 465-474;
- Joseph H. Friedman, Martha E. Trieschmann, Richard H. Myers, Hubert H. Fernandez. (2005). Monozygotic Twins Discordant for Huntington Disease After 7 Years. Arch Neurol. 62;
- Patrick A. Gladding, Malcolm Legget, Diane Fatkin, Peter Larsen, Robert Doughty. (2020). Polygenic Risk Scores in Coronary Artery Disease and Atrial Fibrillation. Heart, Lung and Circulation. 29, 634-640.








