Неуловимый грипп
01 сентября 2020
Неуловимый грипп
- 16223
- 2
- 3
Вирус гриппа так быстро меняется, что всегда оказывается на шаг впереди врачей и ученых. Нам приходится участвовать в этой погоне, регулярно создавая новые вакцины и лекарства. Рисунок в оригинальном разрешении.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Эпидемии гриппа накрывают нас ежегодными волнами. Мы уже воспринимаем их как обыденность и забываем о таящейся опасности. В этой статье спецпроекта «Вакцинация» мы расскажем во всех подробностях о вирусе гриппа; что будет, если им заразиться; и почему не стоит пренебрегать очередной вакцинацией.
Вакцинация

Генеральный партнер спецпроекта — Zimin Foundation.

Партнер публикации этой статьи — «Национальная иммунобиологическая компания», фармацевтический холдинг, созданный госкорпорацией Ростех в 2013 году с целью развития производства важных для национальной безопасности иммунобиологических лекарственных препаратов.
Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
Для соблюдения объективности мы пригласили стать кураторами спецпроекта Александра Соломоновича Апта — доктора биологических наук, профессора МГУ, заведующего лабораторией иммуногенетики Института туберкулеза (Москва), — Сусанну Михайловну Харит — доктора медицинских наук, профессора, руководителя отдела профилактики НИИ детских инфекций (Санкт-Петербург), — а также Сергея Александровича Бутрия — педиатра, автора блога «Заметки детского врача».
Современные медицинское и научное сообщества уже очень много знают про грипп, но едва ли могут с ним справиться. По оценкам Всемирной организации здравоохранения (ВОЗ), во время ежегодных эпидемий гриппа в тяжелом состоянии оказываются от 3 до 5 миллионов человек и от 290 до 650 тысяч — умирают. Только в США за прошлый сезон (2019 год) зарегистрировано до 740 тысяч госпитализаций и до 62 тысяч смертей, связанных с гриппом. При этом вирус так быстро мутирует, что мы с трудом успеваем за ним угнаться в создании новых лекарств и вакцин. Хотя здоровому взрослому человеку часто грипп не страшен — неделька в постели и ты здоров, — мы все участвуем в его распространении и отвечаем за последствия. И правда в том, что для предупреждения эпидемий у нас нет ничего более эффективного, чем противогриппозная вакцина.
Есть разные гипотезы о происхождении названия «грипп». Согласно одной из них, оно заимствовано из французского языка (grippe) и трактуется как производное от глагола gripper — «схватить». По другой версии, исконный источник названия — слово «хрип» («хрипеть») [1]. Столь же сложно проследить и историю эпидемий и пандемий, вызванных вирусом гриппа. Для времени, предшествовавшего развитию вирусологии, это было практически невозможно, поскольку симптомы гриппа очень похожи на симптомы многих других заболеваний, не говоря уже о том, что до конца XVIII века никто не вёл систематических наблюдений и учета больных [2].
Наверняка мы можем говорить только о двенадцати пандемиях, которые возникали, начиная с 1510 года. Их можно опознать по задокументированным случаям лихорадки и проявлениям простудных симптомов, быстрому и взрывоопасному распространению по нескольким географическим регионам, заболеваемости в широком возрастном диапазоне и повышенной смертности среди пожилых, детей, беременных и людей с ослабленным здоровьем [2].
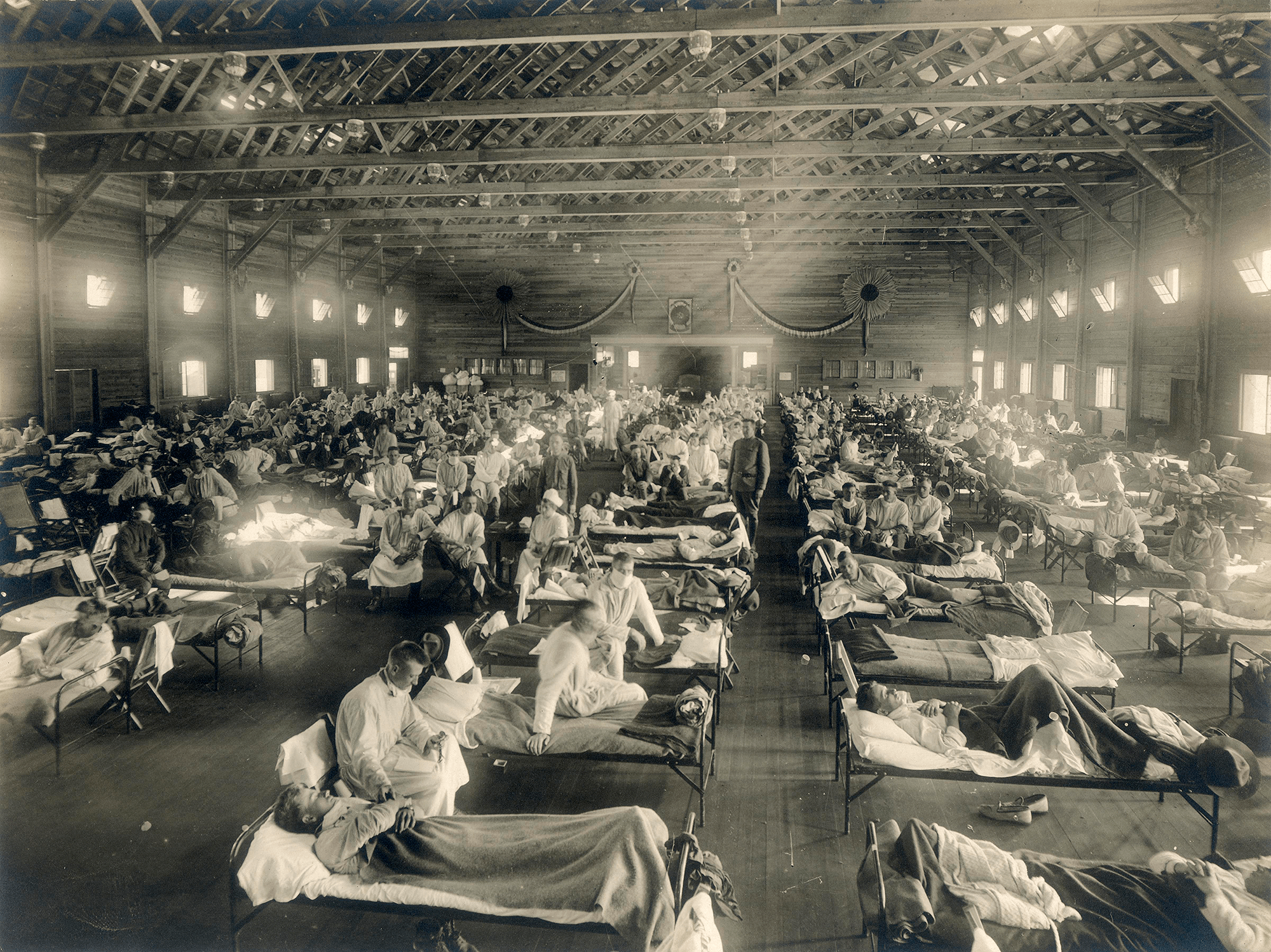
Самая страшная из пандемий («испанский грипп», или «испанка») прошла по миру в 1918–1920 годах (рис. 1). По разным оценкам, от нее погибли от 50 до 100 миллионов человек (3–6% населения Земли) [3]. В попытках изучить смертоносную природу «испанки» в 1997 году группе ученых удалось восстановить нуклеотидные последовательности небольших фрагментов вирусного генома, выделенных из образцов тканей жертв пандемии [4]. Эти и другие результаты показали, что люди ранее не сталкивались с этим штаммом вируса гриппа, который, вероятно, произошел от одного из вирусов гриппа птиц. В дальнейшем вирус, вызвавший испанский грипп, стал «матерью всех гриппозных пандемий» XX и XXI веков.
Врачи XX века испробовали множество способов лечения гриппа — от кровопускания до кислородной терапии и разработки вакцин и сывороток против гемофильной палочки (бактерии Haemophilus influenzae), которую до 1933 года ошибочно считали возбудителем гриппа. Всё это, как и народные средства, не дало результатов, и только переливание крови от переболевших пациентов имело хоть какой-то успех [5]. Вскоре после того, как Уилсон Смит и его коллеги однозначно показали вирусную природу заболевания и выделили патоген, начались попытки создания вакцины против гриппа (рис. 2).

Рисунок 2. История изучения вируса гриппа и разработки вакцин. 1933 г. Уилсон Смит, Кристофер Эндрюс и Патрик Лейдлоу выделили вирус гриппа А. 1936 г. Советский ученый Анатолий Смородинцев создал первую аттенуированную вакцину против гриппа. 1937 г. Вирус гриппа научились выращивать в куриных эмбрионах. 1940 г. Открыт вирус гриппа В, который так же хорошо, как и вирус гриппа А, размножался в куриных эмбрионах, но имел другие антигенные свойства. 1942 г. Разработка и тестирование бивалентной инактивированной противогриппозной вакцины, содержащей вирусы гриппа А и В. 1945 г. Одобрена первая инактивированная вакцина против гриппа для гражданского населения США. 1947 г. Обнаружена способность к изменению антигенных свойств вируса (антигенный дрейф), которая снижает эффективность вакцины. 1973 г. ВОЗ начинает делать прогнозы и выпускать рекомендации по составу противогриппозных вакцин на основании данных эпидемиологических лабораторий по всему миру. 1978 г. Производство трехвалентной вакцины (одновременно циркулируют два штамма вируса гриппа А и один штамм вируса гриппа В). 2013 г. ВОЗ начала давать рекомендации для состава четырехвалентной вакцины, включив туда второй штамм вируса гриппа В [6].
иллюстрация Ирины Ефремовой

Рисунок 3. Советский агитационный плакат. Художник Н.А. Игнатьев, 1959 год.
Первую аттенуированную (ослабленную) вакцину разработал наш соотечественник Анатолий Александрович Смородинцев в 1936 году. Более 50 лет ее широко использовали на территории СССР (рис. 3) [6]. В это же время другие группы исследователей работали над созданием инактивированных вакцин. В 1937 году австралийский ученый Фрэнк Бёрнет предложил относительно простой способ культивирования вируса в куриных эмбрионах, который позволил получать достаточное количество вирионов для создания убитой вакцины [6]. Затем в 1940 году выделили другой вирус гриппа, который также широко распространен в человеческой популяции, но значительно отличается по антигенным свойствам от ранее изученных вариантов. Новый вирус назвали вирусом гриппа В, а ранее открытому — присвоили название «вирус гриппа А». Второй вариант практически сразу дополнил состав инактивированной вакцины, которая имела эффективность около 69% и начала широко использоваться в армии США с 1944 года, а затем и среди городского населения [6].
Для ослабления вируса его выращивают в других клеточных культурах или живых организмах. После того, как вирус адаптируется к новым условиям, он уже значительно хуже размножается в организме человека и не вызывает серьезного заболевания, тем не менее активируя иммунную систему, — на этом основано действие живых аттенуированных вакцин. Подробнее о видах вакцин читайте в статье «Разработка вакцин: чем и как имитировать болезнь?» [7]. — Ред.
Что мы знаем о вирусе гриппа
В природе циркулирует четыре вида вируса гриппа из семейства ортомиксовирусов (Orthomyxoviridae). Мы поговорим только о двух из них — A и B, — так как они представляют для нас наибольшую опасность. Вирус гриппа C тоже заражает человека, но не вызывает тяжелого заболевания [8]. Свидетельств же того, что недавно открытый вирус гриппа D заражает кого-то, кроме свиней и крупного рогатого скота, пока не найдено [9].
Строение и жизненный цикл
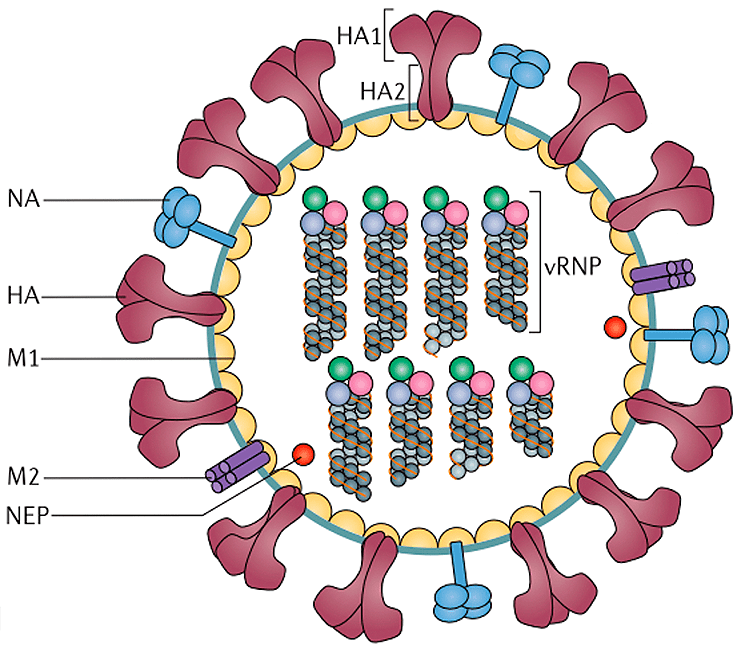
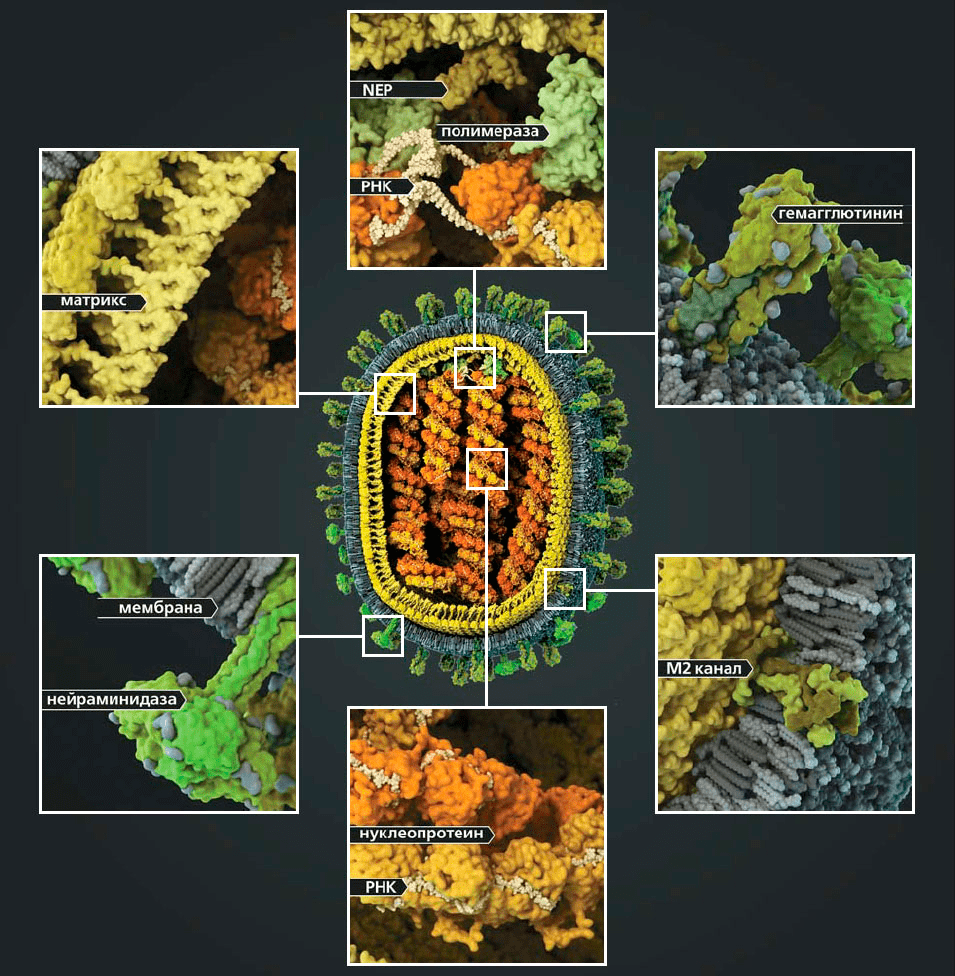
Под электронным микроскопом частицы вируса гриппа A и B практически не отличимы друг от друга: обе имеют сферическую или нитевидную форму с диаметром 100 нм и длиной (в случае нитевидной формы) около 300 нм [10]. Их структура также почти идентична. Условно ее можно разделить на три части: внешняя мембрана, белковая оболочка (или матрикс) и генетический материал (рис. 4).
На поверхности вирусной частицы находятся главные мишени иммунной системы и компоненты многих противогриппозных вакцин — белки гемагглютинин (HA) и нейраминидаза (NA). Первый необходим для проникновения в клетку хозяина, а второй — для успешного высвобождения вирусной частицы. Также считается, что нейраминидаза облегчает прохождение вируса через слизистую оболочку дыхательных путей [8], [10]. Вместе с этими белками во внешнюю липидную оболочку встроен ионный канал, состоящий из белков М2 (или NB и BM2 в случае вируса гриппа В). Изнутри вирион выстлан матриксным белком М1, который кроме механической защиты необходим для успешной распаковки вирусной частицы и сборки новых потомков. В самом центре частицы хранится вирусный геном в виде восьми молекул РНК (сегментов), покрытых нуклеопротеином (NP) и связанных с вирусной полимеразой.
Для того чтобы вирус попал внутрь клетки, гемагглютинин связывается с остатком сиаловой кислоты на поверхности наших клеток по принципу «ключ—замок». Клетка захватывает связавшийся вирус, окружая его внешней мембраной, так же как она «съедает» многие питательные вещества, которые затем «переваривает», разбирая на части. Но вирусу гриппа удается перехитрить систему и вырваться из этой цепочки. Для переваривания клетка закисляет среду внутри мембранного пузырька с вирусом, что вызывает структурные изменения в гемагглютинине и последующее слияние мембран вируса и клеточного пузырька. Кроме этого, через ионный канал в вирион закачиваются протоны (H+), что приводит к изменениям в структуре матриксного белка M1 и высвобождению комплекса из РНК и белков во внутриклеточную среду (рис. 5, видео 1) [8], [10].
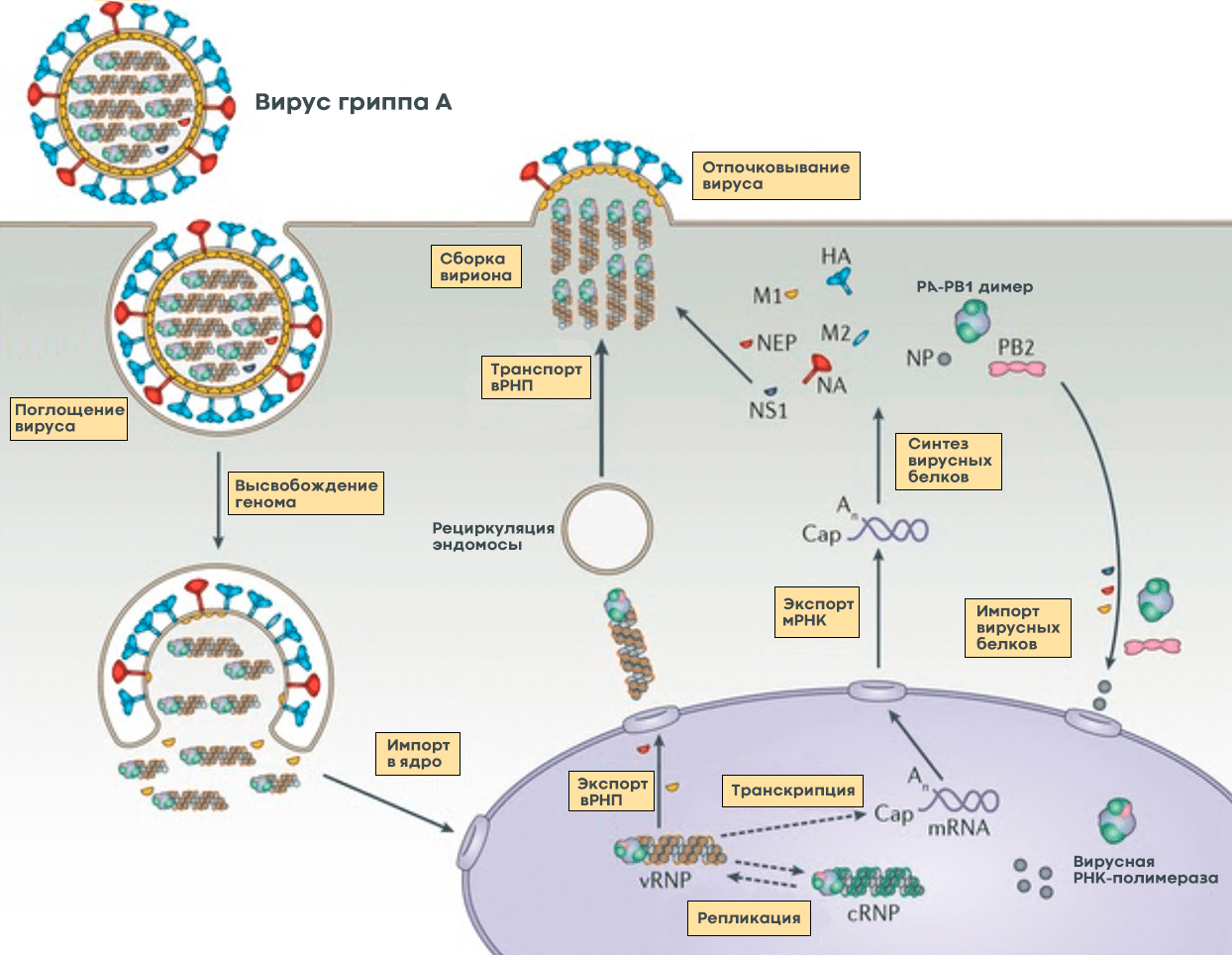
Рисунок 5. Жизненный цикл вируса гриппа А. После того, как клетка «поглотила» вирус гриппа, происходит слияние вирусной мембраны с мембраной клеточного пузырька, в результате чего высвобождается вирусный геном в виде комплекса из РНК и белков (вРНП), который транспортируется в ядро. В ядре клетки вирусная РНК-полимераза синтезирует копии генома с использованием промежуточного комплекса из комплементарной РНК и белков (кРНП) — этот процесс называют репликацией. Также вирусная РНК-полимераза выполняет транскрипцию — синтезирует вирусную матричную РНК (мРНК), которая затем транспортируется в цитоплазму клетки и используется для синтеза вирусных белков. Часть белков возвращается обратно в ядро для запуска новых циклов репликации (образования новых геномных вРНП), а другая участвует в сборке вириона в цитоплазме. Новые вРНП также транспортируются к месту сборки. Вирусные белки, которые должны быть встроены в мембрану, попадают к месту сборки за счет рециркуляции клеточных пузырьков. После сборки вирион отделяется от клетки почкованием. Условные обозначения: HA — гемагглютинин; NA — нейраминидаза; M1 и М2 — матриксные белки 1 и 2, соответственно; NP — нуклеопротеин; PA, PB1 и PB2 — субъединицы РНК-полимеразы; NEP и NS1 — неструктурные белки; vRNP — вРНП; cRNP — кРНП; mRNA — мРНК.
Видео 1. Взаимодействие вируса гриппа с клетками
Вирусная РНК попадает в ядро клетки, где начинается синтез РНК для производства новых вирусных белков (матричной РНК, или мРНК) и новой геномной РНК. Новые копии вирусного генома тут же «одеваются» в нуклеопротеин, связываются с полимеразой и покидают ядро (для чего необходим белок NEP). Сборка новых вирусных частиц происходит на внутренней стороне клеточной мембраны, в которую к этому времени уже встроены вирусные мембранные белки. Готовый вирус отделяется (отпочковывается) от клетки, но не освобождается полностью, так как гемагглютинин тут же связывается с остатками сиаловой кислоты на поверхности той же клетки. На этом этапе ключевую роль играет нейраминидаза, которая удаляет остатки сиаловой кислоты с клеточной поверхности и гемагглютинина, после чего вирус отправляется в свободное плавание, чтобы заражать новые клетки. В завершении всего этого цикла каждую клетку покидает до 15 тысяч новых вирусных частиц [11].
Почему погоня за гриппом никогда не закончится
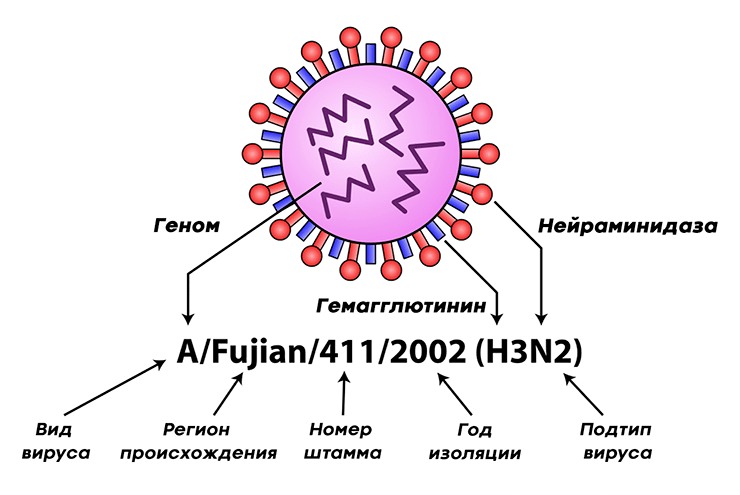
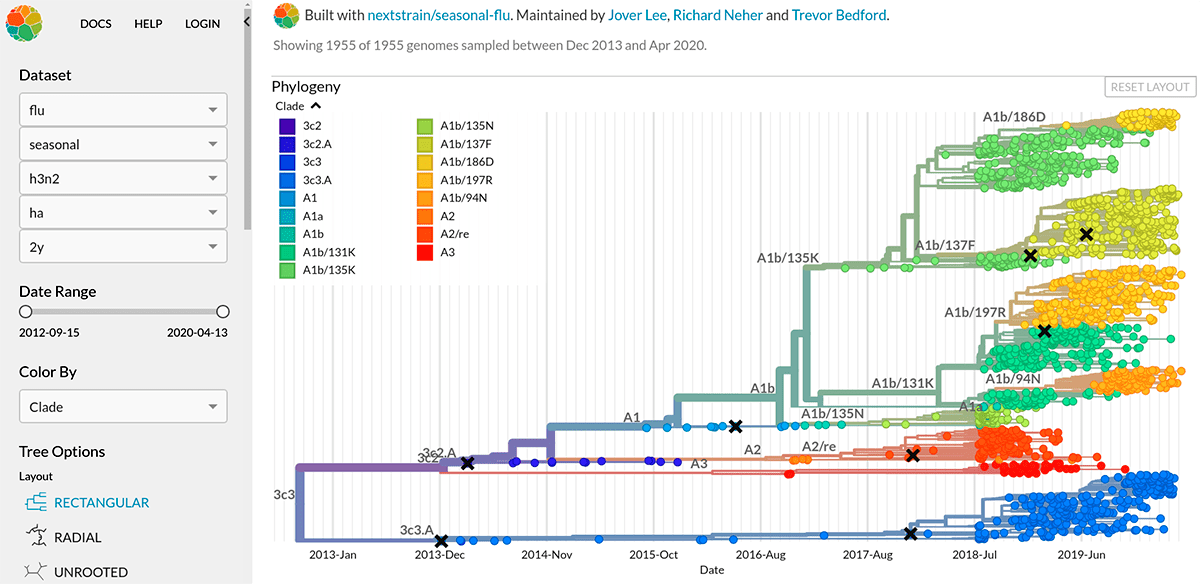
Вирус гриппа отличается чрезвычайной изменчивостью генома. Каждый сезон появляются новые генетические варианты вируса (штаммы), отличающиеся по своим антигенным характеристикам от предшественников, и сформированная у нас ранее иммунологическая память снова и снова оказывается бесполезна против них. Для того чтобы различать отдельные штаммы, была создана специальная номенклатура, которая, помимо видовой принадлежности и антигенных характеристик вируса, включает информацию о месте и времени изоляции данного образца (рис. 7а). А на портале Nextstrain можно проследить, с какой интенсивностью происходит образование новых штаммов, их расположение на ветвях древа эволюции (принадлежность к генетическим линиям) и распространение по миру (рис. 7б).
Механизмы, которые использует вирус гриппа для достижения такого разнообразия, — антигенный дрейф и антигенный шифт.
Антигенный дрейф — это постепенное накопление мутаций за счет ошибок, которые делает вирусная полимераза во время копирования генома. При этом полимеразы, которые синтезируют РНК, не славятся особой точностью из-за отсутствия механизмов исправления ошибок, поэтому скорость накопления мутаций у вирусов с РНК-геномом выше, чем у ДНК-вирусов [13]. Из-за постепенных точечных изменений в гемагглютинине и нейраминидазе возникают штаммы вируса, которые настолько отличаются от предыдущих вариантов, что наша иммунная система распознает их как совершенно новые. Именно поэтому к каждому последующему сезону падает эффективность противогриппозной вакцины, и приходится обновлять ее состав и заново всех прививать.
Второй механизм, антигенный шифт, куда более радикальный. Это обмен вариантами гемагглютинина и нейраминидазы между разными вирусами в процессе сборки вирусной частицы. Сейчас в природе для вируса гриппа А найдено 18 подтипов гемагглютинина и 11 подтипов нейраминидазы, которые теоретически могут сочетаться в любых комбинациях, многие из которых найдены среди животных [14]. В нашей популяции обнаружены штаммы с комбинациями H1N1 (гемагглютинин подтипа 1 и нейраминидаза подтипа 1), H2N2 и H3N2. Но если одну и ту же клетку заразят два вируса с разными комбинациями, то может произойти реассортация — перетасовка вариантов, в результате которой образуется вирус с новой комбинацией подтипов гемагглютинина и нейраминидазы. Именно антигенный шифт привел к возникновению наиболее смертоносных пандемий XX века — «азиатского» (1–2 млн смертей) и «гонконгского» (0,5–2 млн смертей) гриппов [2], [15]. Не так давно, в 2009 году, мы столкнулись с новой пандемией, вызванной вирусом «свиного» гриппа со сложной историей реассортаций, на счету которой — до 575 тыс. смертей [15]. Новый штамм A(H1N1)pdm09 возник в результате комбинации двух свиных вирусов гриппа А, один из которых был результатом тройной реассортации (рис. 8) [16].
pdm09.png)
Рисунок 8. Образование нового штамма вируса гриппа A(H1N1)pdm09 («свиного»), вызвавшего пандемию в 2009 году
иллюстрация Ирины Ефремовой по [16]
Куда скромнее обстоят дела у вируса гриппа В. Несмотря на то, что для него возможны все те же самые механизмы изменчивости, что и для вируса гриппа А, он не вызывает серьезных эпидемий. Это связано с тем, что мы практически единственные его носители (кроме людей, вирус гриппа В найден только у тюленей [14]), и поэтому не происходят межвидовые реассортации, которые могли бы привести к появлению принципиально новых штаммов . Сейчас в нашей популяции преимущественно циркулируют штаммы двух линий вируса гриппа В: B/Victoria и B/Yamagata [8].
О поиске новых реассортаций и их последствиях можно подробнее почитать в статье «Стремительная эволюция гриппа: как одни изменения влекут за собой другие» [17]. — Ред.
Грипп или другая ОРВИ?
Симптомы гриппа знакомы практически всем: внезапно повышается температура, появляются кашель (обычно сухой), головная боль, боль в мышцах и суставах, слабость, боль в горле и насморк. При этом кашель может быть сильным и длиться две и более недели (как правило, из-за повреждения эпителия дыхательных путей [19]). Но всё это начинается не сразу, а только спустя 1–4 (в среднем 2) дня после заражения вирусом. Скрытая опасность гриппа в том, что инфицированные люди становятся разносчиками инфекции еще до проявления первых симптомов, то есть во время инкубационного периода. В первые же 3–4 дня после появления симптомов больной наиболее заразен, поэтому важно оставаться дома при первых же признаках недомогания [20]! Описанные выше симптомы практически не отличаются от других острых респираторных вирусных инфекций, вызываемых еще двумя сотнями вирусов, а определить, имеем мы дело именно с гриппом или нет, можно только по результатам лабораторной диагностики [21].
Уже через 5–7 дней после начала болезни большинство людей выздоравливает самостоятельно и больше не представляет опасности для окружающих, но у людей из групп риска на фоне гриппа могут развиться серьезные осложнения, угрожающие жизни. Наиболее уязвимы пожилые люди старше 65 лет, дети младше 5 лет, беременные женщины и люди любого возраста с хроническими заболеваниями практически всех систем органов или с подавленным иммунитетом. Осложнения могут быть как умеренными (синусит, отит), так и очень тяжелыми (пневмония, как вирусная, так и бактериальная). Кроме того, на фоне гриппа может произойти воспаление тканей сердца, головного мозга или мышц, а также полиорганная недостаточность. В ответ на вирусную инфекцию может развиться неадекватно сильная воспалительная реакция во всем организме (сепсис). Также грипп может усугубить течение уже имеющихся хронических заболеваний [22].
К сожалению, из-за того, что вирус гриппа довольно быстро мутирует, у нас до сих пор нет эффективных противогриппозных препаратов. К когда-то найденным блокаторам М2-канала на основе адамантана (амантадин и римантадин), которые затыкают канал подобно пробке, уже устойчивы почти 100% штаммов вируса гриппа А H3N2 и более 95% штаммов вируса гриппа А H1N1 [23]. Позже разработанные ингибиторы нейраминидазы (осельтамивир, занамивир, перамивир, ланинамивир), мешающие вирусу гриппа завершить выход из клетки, нередко приносят организму больше вреда, чем пользы, поэтому применять их следует чрезвычайно осторожно [24]. Другие препараты находятся на различных стадиях клинических испытаний. Препарат балоксавира марбоксил, нацеленный на вирусную полимеразу, получил одобрение для применения в Японии и США лишь в 2018 году, но уже успел привести к появлению устойчивых к нему штаммов [25]. Также клинические испытания проходят методы лечения при помощи донорской плазмы или моноклональных антител, специфичных к мало меняющемуся (консервативному) участку HA [26].
К слову, и для ингибиторов нейраминидазы вскоре нашлись устойчивые мутанты, о которых можно подробнее почитать в статье «Костыль для нейраминидазы» [27]. — Ред.
За последнее время мы успели выучить назубок, какие существуют нефармацевтические способы защиты от распространения респираторных заболеваний, к которым относится как грипп, так и наш «новый знакомый» COVID-19. Чтобы избежать заражения контактным путем, необходимо регулярно мыть руки с мылом и не трогать грязными руками слизистые оболочки (рот, нос, глаза). Еще можно уменьшить вероятность заражения, если избегать близких контактов с больными людьми, а те, в свою очередь, должны прикрывать рот и нос при кашле и чихании и оставаться дома в случае плохого самочувствия.
Зимой и летом разным цветом
Может возникнуть впечатление, что каждый год вирус гриппа куда-то исчезает на несколько теплых месяцев. Однако оно обманчиво: вирус циркулирует в нашей популяции круглый год, а сезонные эпидемии возникают для жителей обоих полушарий Земли, живущих за пределами экваториальной зоны, в холодное время года или сезон дождей. Пока что мы не можем однозначно сказать, с чем это связано. Наиболее распространенное объяснение такое: в этот период года мы больше времени проводим в замкнутых помещениях и в обществе друг друга, кашляем, чихаем, разговариваем и просто дышим одним воздухом [28]. Особенно ярко это проявляется в школах и детских садах, так как дети наиболее активно болеют гриппом и распространяют инфекцию. Кроме того, вирус гриппа эффективнее распространяется и лучше выживает при более низких температурах и более низкой абсолютной влажности, характерных для зимы [29], [30]. Наконец, есть гипотеза, связывающая подверженность респираторным заболеваниям в зимнее время года с ослабленным иммунитетом в результате дефицита витамина D, который возникает из-за недостатка солнечных лучей [31]. Однако витамин D содержится в некоторых продуктах питания и является жирорастворимым, поэтому хорошо всасывается в кишечнике и может быть запасен в жировых и других тканях нашего организма на несколько месяцев вперед [32].
Спасительный укол?
Зачем нам вакцинация от гриппа
Эпидемии создают серьезную нагрузку на систему здравоохранения и могут привести к нехватке мест в больницах, что критично для людей, страдающих от тяжелых осложнений на фоне гриппа. Но в тоже время показано, что вакцинация способна сгладить эту проблему и предотвратить тысячи смертей и десятки тысяч госпитализаций [33]. В большом метаанализе ученые изучили опубликованные в период с 1967 по 2011 годы 17 рандомизированных контролируемых исследований и 14 наблюдательных исследований и определили среднюю эффективность противогриппозных вакцин. От сезона к сезону эффективность вакцинации была разной, но в среднем составила 59% для трехвалентной инактивированной вакцины у взрослых в возрасте 18–65 лет и 83% — для живой аттенуированной вакцины у детей в возрасте от 6 месяцев до 7 лет [34].
Кроме того, хоть и косвенно, но повсеместная вакцинация позволяет защитить от гриппа людей, которые по состоянию здоровья не могут прививаться и остаются уязвимы. Этих людей будет защищать коллективный иммунитет, который сформируется, если бóльшая часть популяции вакцинируется, что в дальнейшем будет мешать распространению вируса от человека к человеку . Но так как эффективность противогриппозной вакцины колеблется от сезона к сезону, то очень сложно посчитать, какая же доля людей должна быть вакцинирована для того, чтобы был сформирован необходимый уровень коллективного иммунитета (видео 2). По оценкам некоторых исследователей, каждый сезон в среднем необходимо вакцинировать около 80% здорового населения и 90% людей из группы риска — показатели, очень далекие от нынешнего уровня охвата вакцинацией населения РФ (~50%) [35], [36].
О том, что такое коллективный иммунитет, читайте в статье «Вакцинация перед школой: гайд для родителей» [37] — Ред.
Видео 2. Важность количества вакцинированных людей для формирования коллективного иммунитета. В зависимости от доли вакцинированного населения (указаны в процентах, отмечены желтыми точками) инфекция с разной скоростью распространяется (красные линии) по популяции, заражая людей без иммунной защиты (синие точки). Чем выше доля вакцинированных, тем медленнее происходит распространение патогена, однако только при высоких значениях возможно полное блокирование эпидемии и обеспечение защиты людей из групп риска.
К слову, отсутствие симптомов вовсе не означает отсутствие инфекции, которая даже в этом случае может нанести вред организму. Оказывается, что большинство людей переносит грипп бессимптомно. К такому выводу пришли британские ученые, которые тестировали добровольцев и наблюдали за состоянием их здоровья в течение нескольких сезонов [38].
Другой немаловажный аспект вакцинации — экономический. Ученые подсчитали, что затраты государства на повсеместную вакцинацию намного меньше, чем те убытки, которые приносит ежегодная эпидемия из-за сокращения рабочих часов, посещения врачей, покупки лекарств и оплаты больничных [39], [40]. Поэтому ежегодно многие страны стремятся увеличить охват вакцинации своего населения, и наша страна не стала исключением (рис. 11) [41].
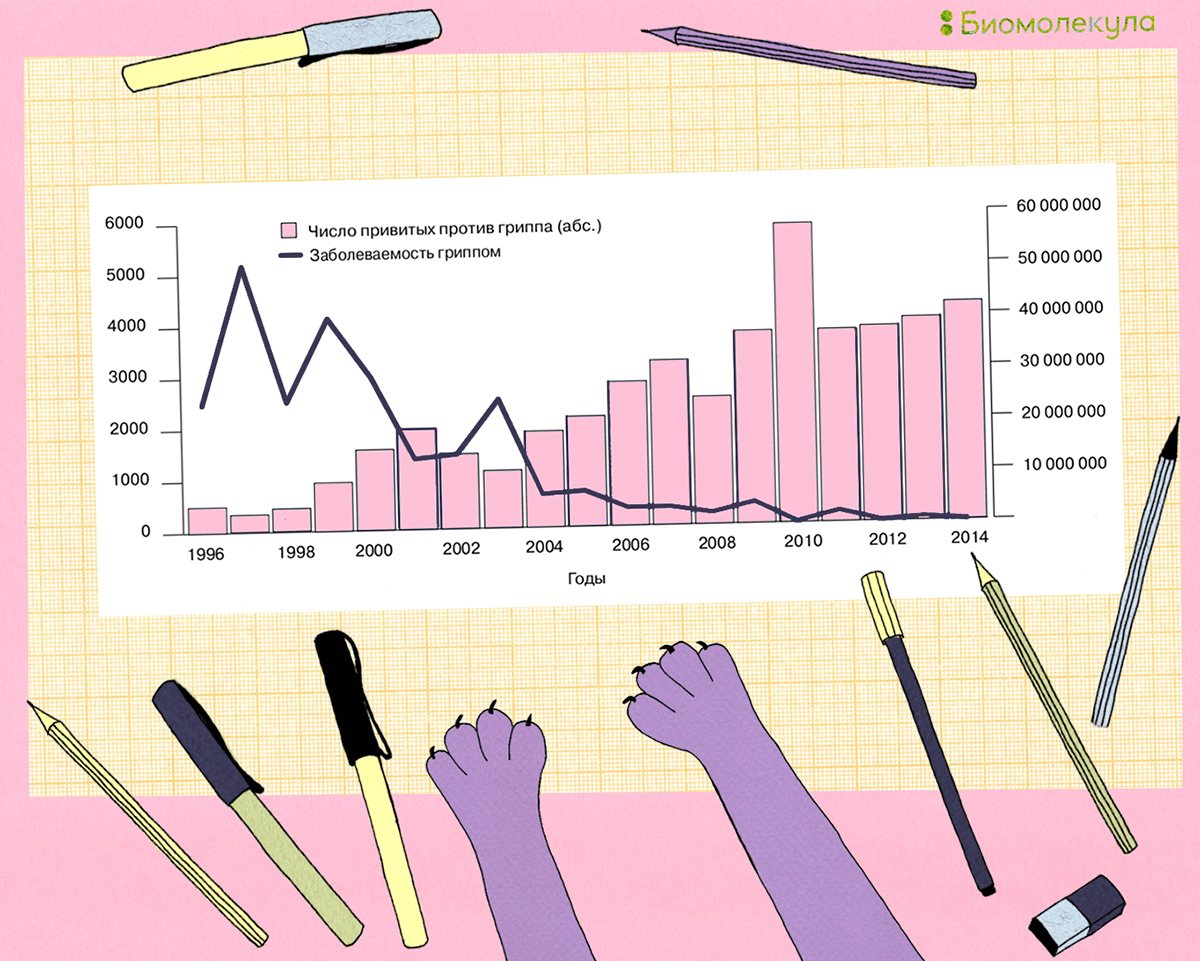
Рисунок 11. Заболеваемость гриппом (правая ось ординат) и охват профилактическими прививками против гриппа (левая ось ординат) совокупного населения Российской Федерации в 1996–2014 годах. На графике видно, насколько хорошо увеличение количества вакцинированных людей коррелирует со снижением количества случаев заболеваемости гриппом.
иллюстрация Ирины Ефремовой по [41]
Какие бывают вакцины?
Пожалуй, среди всех одобренных вакцин, рынок противогриппозных наиболее разнообразен. Многие из них уже были описаны в статье «Много — не значит хорошо: “Ультрикс”, “Гриппол”, “Совигрипп” — что выбрать?» [42]. Тем не менее давайте кратко рассмотрим, какие типы вакцин существуют, как их производят и в чем их различия.
Наличие широкого ассортимента противогриппозных вакцин прежде всего связано с тем, что по всему миру в одно и то же время циркулируют разные штаммы вирусов гриппа А и В, да еще и сразу несколько в одной географической области. Поэтому вакцины против гриппа многосоставные: трех- или четырехвалентные, то есть содержащие три или четыре штамма (два штамма вируса гриппа А и один или два штамма вируса гриппа В). Производители разных стран включают в состав своих вакцин разные штаммы в соответствии с ежегодными рекомендациями, которые ВОЗ выпускает с 1973 года [6].
Эффективность вакцины против гриппа во многом зависит от степени совпадения между вакцинными и циркулирующими штаммами, но даже если предсказание было неудачным, прививка обеспечивает перекрестный иммунитет, который хоть и менее эффективно, но дает защиту от вируса гриппа [43]. Следующий важный фактор, влияющий на эффективность вакцинации, — ее иммуногенность (способность вызывать иммунный ответ). Для того чтобы добиться наилучшего результата, используют разнообразные технологии создания вакцин, а также различные адъюванты .
Адъювант — вещество, которое вводят вместе с антигеном для того, чтобы усилить иммунный ответ на вакцину. Подробнее о том, как создают вакцины, можно почитать в статье «Разработка вакцин: чем и как имитировать болезнь?» [7]. — Ред.
По типу противогриппозные вакцины делят на живые ослабленные и инактивированные (рис. 13), представленные убитым вирусом (цельновирионные вакцины) или его частями (сплит-вакцины, они же расщепленные, а также субъединичные и виросомальные). Первая разработанная вакцина против гриппа была живой, однако сейчас большинство противогриппозных вакцин — инактивированные. Каждый год список доступных вакцин может быть разным, его можно уточнить у врача.
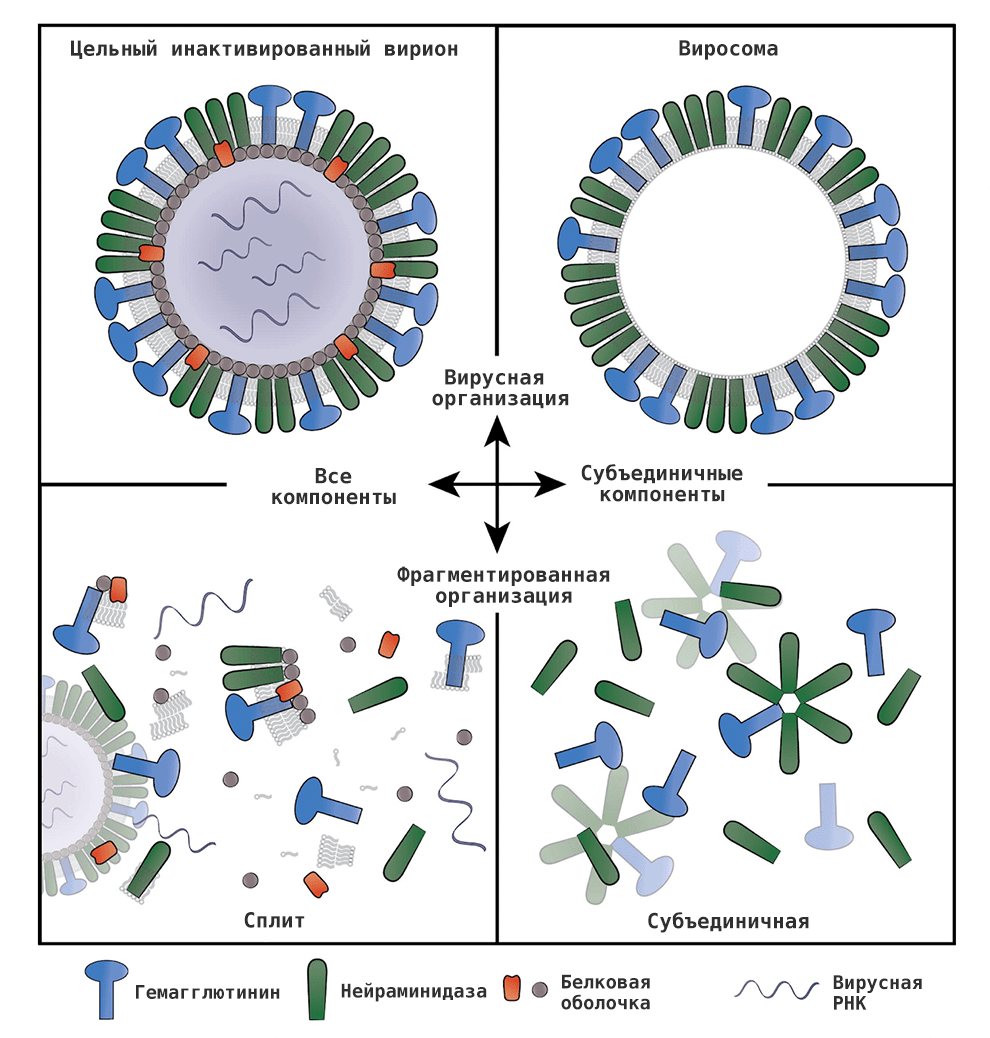
Рисунок 13. Варианты инактивированной вакцины против гриппа
У разных типов вакцин разные способы введения. Живые аттенуированные вакцины вводят при помощи назального спрея, и таким образом вакцинный вирус гриппа попадает сразу на слизистую верхних дыхательных путей и имитирует естественную инфекцию, стимулируя как системный, так и локальный иммунитеты. На удивление, живые аттенуированные вакцины не смогли составить конкуренцию инактивированным в эффективности, хотя теоретически должны были вызывать более сильный и обширный иммунный ответ [44]. Возможно, проблема в том, что многие из нас неоднократно сталкивались с вирусом гриппа, и иммунитет наших слизистых уже достаточно хорошо обучен и слишком быстро убивает вакцинный вирус, из-за чего системный иммунитет не успевает в полной мере с ним ознакомиться. Это предположение хорошо согласуется с тем фактом, что у детей живые аттенуированные вакцины имеют более высокую эффективность, чем инактивированные [34], [45], поэтому, несмотря на все сложности производства, в некоторых странах рекомендуют выбирать для детей этот тип вакцин. В то же время для взрослых не обнаружили значимой разницы между живой аттенуированной и инактивированной вакцинами, поэтому можно выбирать любую (если вы не из группы риска) [46].
Одно из обстоятельств, связанное с ограниченным применением живых вакцин, заключается в бесконтрольном накоплении мутаций в геноме вакцинного вируса и его возможном возврате к патогенному варианту (это описано, например, для вакцины против вируса полиомиелита [47]). Однако для гриппа такие события не были зарегистрированы на практике и имеют малую вероятность. Второе беспокойство вызвано тем, что использование живой аттенуированной вакцины против гриппа иногда приводит к проблемам с дыханием у детей в возрасте до двух лет, поэтому ее применение ограничено возрастом от 2 до 49 лет [48].
В случае с инактивированными вакцинами для стимуляции иммунного ответа и формирования надежной защиты необходимо намного больше антигена, так как вирус не будет размножаться в организме вакцинированного человека. Поэтому такие вакцины стали разрабатывать только после 1944 года, когда Уэнделл Стэнли подробно описал процедуру приготовления противогриппозной вакцины, выращенной в куриных эмбрионах, а затем инактивированной с использованием различных методов и сконцентрированной и очищенной при помощи дифференциального центрифугирования [6].
Инактивированные вакцины вводят внутримышечно или подкожно. Первая широко применяемая инактивированная вакцина против гриппа была цельновирионной и вызывала большое количество побочных эффектов, что, вероятно, было связано с недостаточной степенью очистки вакцины от фрагментов куриных яиц. Современные методы производства позволяют решить эту проблему. Позднее в практику ввели вакцины, содержащие только очищенные фрагменты вируса. Такие препараты вызывают меньше побочных реакций, но при этом содержат более ограниченное разнообразие антигенов вируса гриппа. Тем не менее метаанализы показывают, что все исследованные зарегистрированные инактивированные вакцины обладают схожей иммуногенностью и безопасностью [48]. В ответ на них формируется хороший титр нейтрализующих антител в сыворотке крови, однако они слабо стимулируют антительный ответ в слизистых оболочках и клеточный иммунитет [49].
Как производят вакцины против гриппа
Из-за того, что вирус гриппа непрерывно мутирует, процесс производства вакцины оказывается результатом сбалансированного решения сложной дилеммы: чем ближе к сезону, тем выше вероятность совпадения вакцинных и сезонных штаммов, но вместе с этим и более поздний срок выхода вакцины на рынок и, соответственно, увеличение риска не успеть к началу сезона. Производство каждой сезонной вакцины включает в себя выбор необходимых штаммов, создание вакцинного вируса, его наработку, очистку, проверку на эффективность и безопасность и получение лицензии — только после прохождения всех этих этапов ее можно продавать. Но еще надо успеть наработать вакцину в достаточном для продажи количестве! Кроме сезонных вакцин, изготавливаемых каждый год, разработано несколько вакцин против пандемических штаммов «свиного» и «птичьего» вирусов гриппа. Некоторые из них уже использовались во время предыдущих эпидемий, другие припасены на случай будущих [48].
Кому и когда прививаться от гриппа в России
Ежегодная вакцинация начинается с момента поступления препарата на рынок. Обычно это происходит уже в сентябре, и вакцина доступна на протяжении всего сезона. Согласно Национальному календарю прививок, вакцинироваться можно в любом возрасте, начиная с шести месяцев. Если ребенок проходит вакцинацию первый раз, то необходимо привиться дважды с интервалом в четыре недели. Это связано с тем, что маленькие дети, вероятнее всего, еще не сталкивались с гриппом, и одной иммунизации будет недостаточно для формирования необходимого уровня защитных антител. Далее можно вакцинироваться один раз в сезон.
По оценкам исследователей, дети до 5 лет и пожилые люди старше 65 лет особенно уязвимы для гриппа, поэтому вакцинация крайне важна как для них, так и для людей, с ними проживающих и о них заботящихся. Также в группу риска входят беременные женщины, люди с хроническими заболеваниями (в том числе с заболеваниями легких, сердечно-сосудистыми заболеваниями, метаболическими нарушениями и ожирением) и взрослые отдельных профессий и имеющие повышенный риск инфицирования (работники медицинских и образовательных организаций, транспортной и коммунальной сфер).
Как и со многими другими прививками из национального календаря, противогриппозную вакцину можно вводить в один день с другими вакцинами (кроме вакцины против туберкулеза), но в разные участки тела и разными шприцами. В ином случае интервал между прививками должен составлять не менее одного месяца. Также есть ограничения для проведения диагностики на туберкулез (пробы Манту): так как прививки могут влиять на чувствительность к вводимому туберкулину, то вакцинацию проводят только после оценки результатов пробы Манту, либо за месяц до туберкулинодиагностики. Для вакцинации детей и беременных женщин разрешено использовать только не содержащие консерванты вакцины.
Противопоказания к вакцинации
Современные вакцины могут производить с использованием как куриных эмбрионов, так и клеточных культур, поэтому сейчас от гриппа могут вакцинироваться даже люди с аллергией на белок куриного яйца. Тем не менее надо соблюдать осторожность, так как сильная аллергическая реакция может развиться в ответ и на другие компоненты вакцины. Кроме того, не являются причиной для отвода от противогриппозной вакцинации частые ОРВИ и хронические заболевания. Прививку делают через 5–10 дней после выздоровления от очередного ОРВИ или в период ремиссии в случае хронической болезни, но этот вопрос всегда необходимо сначала обсудить со своим лечащим врачом. Более подробные сведения о проведении вакцинации детей и взрослых с различными нарушениями здоровья можно найти в методических указаниях МУ 3.3.1.1123-02 «Мониторинг поствакцинальных осложнений и их профилактика».
Для некоторых противогриппозных вакцин (особенно живых аттенуированных) беременность и период лактации могут являться противопоказаниями. Поэтому перед вакцинацией обязательно проконсультируйтесь с лечащим врачом или ознакомьтесь с инструкцией к вакцине. Многие инактивированные вакцины безопасны для беременных женщин и плода, а также кормящих матерей и их детей.
Побочные реакции на вакцинацию
В большинстве случаев в ответ на противогриппозную вакцинацию не возникает серьезных осложнений. Если была введена инактивированная вакцина, то возможны побочные реакции в месте инъекции в виде покраснения, припухлости и болезненности. После введения живой аттенуированной вакцины могут появиться слабый насморк и небольшой кашель. Также возможны повышение температуры, недомогание, дрожь, потливость, болезненность в мышцах и суставах. И в любом случае в течение 30 минут после вакцинации необходимо оставаться под наблюдением врача, так как всегда есть вероятность аллергической реакции или развития других (более редких) осложнений.
Можно ли победить грипп?
К сожалению, нельзя сказать, что грипп находится под полным контролем. Вирус непрерывно мутирует, и в случае несовпадения вакцинных и циркулирующих штаммов эффективность вакцинации падает. И главное, мы никогда не избавимся от патогена, потому что у него есть обширнейший природный резервуар, а у нас не хватит сил и ресурсов для того, чтобы вакцинировать каждое животное в мире. Однако это не значит, что ситуация не может стать лучше.
Опираясь на 70-летний опыт, ВОЗ разработала Глобальную стратегию для борьбы с гриппом на 2019–2030 годы, которая предполагает разработку общемировых и национальных программ для снижения последствий от сезонного гриппа, минимизации риска перехода зоонозного гриппа в человеческую популяцию и смягчения последствий пандемического гриппа. По утверждениям ВОЗ, для реализации намеченных целей нам необходимы более совершенные методы профилактики, выявления, контроля и лечения гриппа, в том числе более эффективные вакцины и противовирусные препараты. Разработка собственных программ и инвестиции в борьбу с гриппом помогут развитию различных сфер здравоохранения и сделают страну в целом более подготовленной к новой пандемии, которая может не только унести сотни тысяч жизней, но и стать причиной социально-экономического кризиса. А как мы уже знаем, ее приход — лишь вопрос времени.
Например, совсем недавно на свинофермах обнаружили новый штамм G4 вируса гриппа А H1N1, который способен инфицировать людей, но значительно отличается от «человеческих» штаммов, а значит, обладает пандемическим потенциалом. Но к счастью, вирус был найден во время широкомасштабного скринингового исследования, а не в разгар очередной эпидемии, и у нас еще есть время для того, чтобы подготовить вакцинные варианты с этим штаммом «на всякий случай».
Для борьбы с гриппом на вооружение взяли и высокие технологии. Вычислительные мощности современных компьютеров активно используют как в разработке новых вакцин [59], так и для предсказания новых штаммов, которые будут циркулировать в следующем сезоне (видео 3) [17].
Видео 3. Георгий Базыкин: «Как предсказать будущую эволюционную успешность вируса?»
Универсальная вакцина
Еще один недостаток современных противогриппозных вакцин, о котором не было сказано выше, — возможность антигенного импринтинга. Когда наш иммунитет сталкивается с новым вариантом вируса гриппа (в результате инфицирования или вакцинирования), предпочтительнее активируется иммунологическая память, которая была сформирована в результате более ранних контактов с этим же патогеном и узнает неизменившиеся фрагменты вируса, таким образом подавляя формирование антител к изменившимся (новым для иммунитета) участкам [60]. Однако проверить, действительно ли предыдущие вакцинации и заражения оказывают влияние на эффективность последующих, очень сложно, так как в целом эффективность зависит от большого количества различных факторов [61]. Поэтому существуют данные, показывающие как наличие негативных последствий [61], так и их отсутствие [62].
Эту и многие из описанных выше проблем можно было бы решить, разработав одну универсальную вакцину, которой мы прививались бы один или несколько раз в жизни, как это происходит с вакцинами от других инфекций. Теоретически такая вакцина возможна, так как, несмотря на активное накопление мутаций, у вируса гриппа всегда остаются консервативные регионы, изменение в которых фатально для него. «Натаскивание» иммунитета на узнавание этих участков с последующим развитием достаточного для защиты иммунного ответа сделает организм устойчивым к любому из постоянно обновляемых штаммов.
Попытки создания универсальной вакцины предпринимаются уже более десяти лет. Ученые пробуют различные целевые антигены, технологические платформы для их наработки и способы иммунизации. Самые успешные уже проходят первую или вторую фазы клинических испытаний [63], [64]. В целом, их можно разделить на две группы в зависимости от того, на какую ветвь иммунитета нацелена вакцина: гуморальную (антитела, которые блокируют вирус) или Т-клеточную (рис. 14). В первом случае наибольшей популярностью пользуются «стебелек» гемагглютинина (фрагмент белка, который ближе к вирусной мембране) и кусочек белка ионного канала М2, состоящий из 23 аминокислот (M2e). Для Т-клеток (убивающих зараженные клетки, чтобы остановить распространение вируса по организму) в качестве антигена были выбраны нуклеопротеин и матриксный белок 1, которые активно синтезируются в инфицированной клетке и критически важны на многих этапах жизненного цикла вируса. Также есть вакцины, взявшие за основу полимеразу вируса гриппа [65].
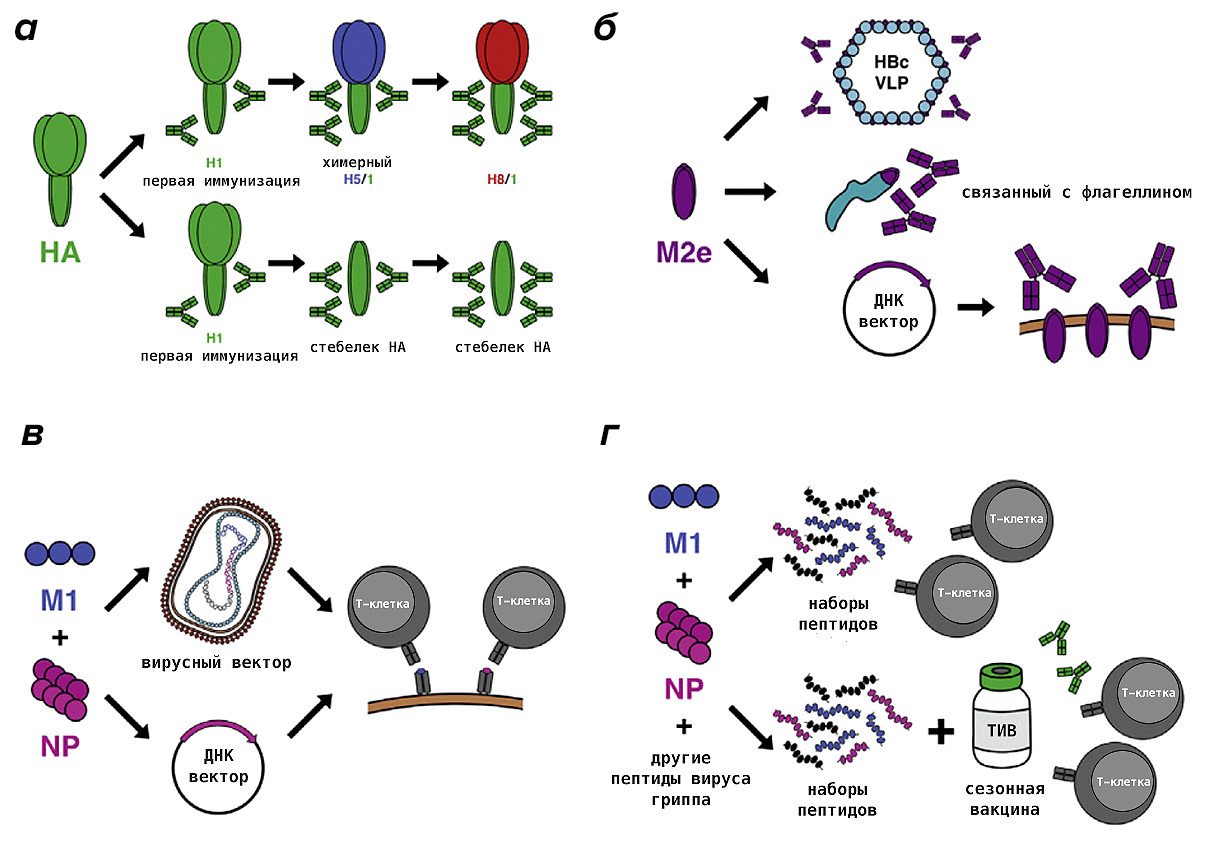
Рисунок 14. Разрабатываемые варианты универсальной противогриппозной вакцины. а — Использование химерных гемагглютининов (несколько последовательных вакцинаций гемагглютининами (HA) с разными «головками», но одинаковым «стебельком» будут способствовать формированию пула антител против «повторяющегося» антигена, то есть идентичного «стебелька»), либо вакцинация исключительно «стебельковой» частью гемагглютинина. б — Иммунизация консервативным фрагментом белка М2 (M2e), который связан с вирусоподобными частицами, состоящими из белка вируса гепатита В и липидов (HBc VLP), или с бактериальным белком флагеллином; либо при помощи ДНК-вектора. в — Матриксный белок 1 и нуклеопротеин могут быть доставлены в клетки нашего организма при помощи вирусного вектора (например осповакцины) или ДНК-вектора (ДНК-вакцины). г — Пептидные вакцины, состоящие из фрагментов матриксного белка 1, нуклеопротеина и других белков вируса гриппа, которые можно вводить отдельно или в комбинации с обычными сезонными вакцинами против гриппа (ТИВ — трехвалентная инактивированная вакцина), чтобы вызвать более обширный иммунный ответ.
Мы ежегодно слышим о том, как важно прививаться против гриппа, и получаем всё больше для этого возможностей. И стоит ли в очередной раз пренебрегать этим советом, если вакцина против гриппа безопасна и имеет доказанную эффективность? Надеемся, что в этой статье мы смогли доступно объяснить, с чем связано такое внимание к противогриппозной вакцинации во всем мире и почему она может спасти жизнь вам и вашим близким.
Литература
- Семенов А.В. Этимологический словарь русского языка. М.: Издательство «ЮНВЕС», 2003;
- J.K. TAUBENBERGER, D.M. MORENS. (2009). Pandemic influenza - including a risk assessment of H5N1. Rev. Sci. Tech. OIE. 28, 187-202;
- Niall P. A. S. Johnson, Juergen Mueller. (2002). Updating the Accounts: Global Mortality of the 1918-1920 "Spanish" Influenza Pandemic. Bulletin of the History of Medicine. 76, 105-115;
- J. K. Taubenberger. (1997). Initial Genetic Characterization of the 1918 "Spanish" Influenza Virus. Science. 275, 1793-1796;
- The Threat of Pandemic Influenza — National Academies Press, 2005;
- Claude Hannoun. (2013). The evolving history of influenza viruses and influenza vaccines. Expert Review of Vaccines. 12, 1085-1094;
- Разработка вакцин: чем и как имитировать болезнь?;
- Velislava N. Petrova, Colin A. Russell. (2018). The evolution of seasonal influenza viruses. Nat Rev Microbiol. 16, 47-60;
- Shuo Su, Xinliang Fu, Gairu Li, Fiona Kerlin, Michael Veit. (2017). Novel Influenza D virus: Epidemiology, pathology, evolution and biological characteristics. Virulence. 8, 1580-1591;
- Nicole M. Bouvier, Peter Palese. (2008). The biology of influenza viruses. Vaccine. 26, D49-D53;
- Timo Frensing, Sascha Y. Kupke, Mandy Bachmann, Susanne Fritzsche, Lili E. Gallo-Ramirez, Udo Reichl. (2016). Influenza virus intracellular replication dynamics, release kinetics, and particle morphology during propagation in MDCK cells. Appl Microbiol Biotechnol. 100, 7181-7192;
- Alexander Pflug, Maria Lukarska, Patricia Resa-Infante, Stefan Reich, Stephen Cusack. (2017). Structural insights into RNA synthesis by the influenza virus transcription-replication machine. Virus Research. 234, 103-117;
- Kyung H. Choi. (2012). Viral Polymerases. Viral Molecular Machines. 267-304;
- Jason S. Long, Bhakti Mistry, Stuart M. Haslam, Wendy S. Barclay. (2019). Host and viral determinants of influenza A virus species specificity. Nat Rev Microbiol. 17, 67-81;
- Patrick Saunders-Hastings, Daniel Krewski. (2016). Reviewing the History of Pandemic Influenza: Understanding Patterns of Emergence and Transmission. Pathogens. 5, 66;
- Donna M. Tscherne, Adolfo García-Sastre. (2011). Virulence determinants of pandemic influenza viruses. J. Clin. Invest.. 121, 6-13;
- Элементы: «Стремительная эволюция гриппа: как одни изменения влекут за собой другие»;
- Объяснена различная вирулентность вирусов гриппа — возбудителей «испанки»;
- Овчинников А.Ю., Эдже М.А., Коростелев С.А., Митюк А.М. (2015). Постинфекционный кашель: основные заблуждения и возможности современной терапии. «Лечебное дело». 1, 76–83;
- Linda J. Keilman. (2019). Seasonal Influenza (Flu). Nursing Clinics of North America. 54, 227-243;
- Vittorio Demicheli, Tom Jefferson, Eliana Ferroni, Alessandro Rivetti, Carlo Di Pietrantonj. (2018). Vaccines for preventing influenza in healthy adults. Cochrane Database of Systematic Reviews;
- Linda J. Keilman. (2019). Seasonal Influenza (Flu). Nursing Clinics of North America. 54, 227-243;
- Han Ju, Jian Zhang, Boshi Huang, Dongwei Kang, Bing Huang, et. al.. (2017). Inhibitors of Influenza Virus Polymerase Acidic (PA) Endonuclease: Contemporary Developments and Perspectives. J. Med. Chem.. 60, 3533-3551;
- Tom Jefferson, Mark A Jones, Peter Doshi, Chris B Del Mar, Rokuro Hama, et. al.. (2014) Neuraminidase inhibitors for preventing and treating influenza in adults and children;
- Лосева П. (2019). Противовирусное лекарство сделало вирус гриппа устойчивее. N+1;
- Florian Krammer, Gavin J. D. Smith, Ron A. M. Fouchier, Malik Peiris, Katherine Kedzierska, et. al.. (2018). Influenza. Nat Rev Dis Primers. 4;
- «Костыль» для нейраминидазы;
- Русакова Е. (2018). Дыхания больных оказалось достаточно для распространения гриппа. N+1;
- Anice C Lowen, Samira Mubareka, John Steel, Peter Palese. (2007). Influenza Virus Transmission Is Dependent on Relative Humidity and Temperature. PLoS Pathog. 3, e151;
- J. Shaman, M. Kohn. (2009). Absolute humidity modulates influenza survival, transmission, and seasonality. Proceedings of the National Academy of Sciences. 106, 3243-3248;
- J. J. CANNELL, R. VIETH, J. C. UMHAU, M. F. HOLICK, W. B. GRANT, et. al.. (2006). Epidemic influenza and vitamin D. Epidemiol. Infect.. 134, 1129-1140;
- Ieva Martinaityte, Elena Kamycheva, Allan Didriksen, Jette Jakobsen, Rolf Jorde. (2017). Vitamin D Stored in Fat Tissue During a 5-Year Intervention Affects Serum 25-Hydroxyvitamin D Levels the Following Year. The Journal of Clinical Endocrinology & Metabolism. 102, 3731-3738;
- Melissa A. Rolfes, Ivo M. Foppa, Shikha Garg, Brendan Flannery, Lynnette Brammer, et. al.. (2018). Annual estimates of the burden of seasonal influenza in the United States: A tool for strengthening influenza surveillance and preparedness. Influenza Other Respi Viruses. 12, 132-137;
- Michael T Osterholm, Nicholas S Kelley, Alfred Sommer, Edward A Belongia. (2012). Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. The Lancet Infectious Diseases. 12, 36-44;
- Pedro Plans-Rubió. (2012). The vaccination coverage required to establish herd immunity against influenza viruses. Preventive Medicine. 55, 72-77;
- Роспотребнадзор достиг максимального уровня охвата населения прививками против гриппа. (2020). ТАСС;
- Вакцинация перед школой: гайд для родителей;
- Andrew C Hayward, Ellen B Fragaszy, Alison Bermingham, Lili Wang, Andrew Copas, et. al.. (2014). Comparative community burden and severity of seasonal and pandemic influenza: results of the Flu Watch cohort study. The Lancet Respiratory Medicine. 2, 445-454;
- Carolyn Buxton Bridges, William W. Thompson, Martin I. Meltzer, Gordon R. Reeve, Walter J. Talamonti, et. al.. (2000). Effectiveness and Cost-Benefit of Influenza Vaccination of Healthy Working Adults. JAMA. 284, 1655;
- Global influenza strategy 2019–2030. Geneva: World Health Organization, 2019;
- Попова А.Ю., Ежлова Е.Б., Мельникова А.А., Фролова Н.В., Михеев В.Н., Рыжиков А.Б. и др. (2016). Влияние ежегодной иммунизации населения против гриппа на заболеваемость этой инфекцией в Российской Федерации. «Эпидемиология и вакцинопрофилактика». 15, 48–55;
- Много — не значит хорошо: «Ультрикс», «Гриппол», «Совигрипп» — что выбрать?;
- Andrea C Tricco, Ayman Chit, Charlene Soobiah, David Hallett, Genevieve Meier, et. al.. (2013). Comparing influenza vaccine efficacy against mismatched and matched strains: a systematic review and meta-analysis. BMC Med. 11;
- Michael Schotsaert, Adolfo García-Sastre. (2017). Inactivated influenza virus vaccines: the future of TIV and QIV. Current Opinion in Virology. 23, 102-106;
- Janelle Rhorer, Christopher S. Ambrose, Stephanie Dickinson, Holli Hamilton, Napoleon A. Oleka, et. al.. (2009). Efficacy of live attenuated influenza vaccine in children: A meta-analysis of nine randomized clinical trials. Vaccine. 27, 1101-1110;
- W.E.P Beyer, A.M Palache, J.C de Jong, A.D.M.E Osterhaus. (2002). Cold-adapted live influenza vaccine versus inactivated vaccine: systemic vaccine reactions, local and systemic antibody response, and vaccine efficacy. Vaccine. 20, 1340-1353;
- Полиомиелит: убийца из XX века;
- Peter C. Soema, Ronald Kompier, Jean-Pierre Amorij, Gideon F.A. Kersten. (2015). Current and next generation influenza vaccines: Formulation and production strategies. European Journal of Pharmaceutics and Biopharmaceutics. 94, 251-263;
- R. J. Cox, K. A. Brokstad, P. Ogra. (2004). Influenza Virus: Immunity and Vaccination Strategies. Comparison of the Immune Response to Inactivated and Live, Attenuated Influenza Vaccines. Scand J Immunol. 59, 1-15;
- Saad B. Omer, Robert Bednarczyk, Shabir A. Madhi, Keith P. Klugman. (2012). Benefits to mother and child of influenza vaccination during pregnancy. Human Vaccines & Immunotherapeutics. 8, 130-137;
- Gil Mor, Ingrid Cardenas. (2010). The Immune System in Pregnancy: A Unique Complexity. American Journal of Reproductive Immunology. 63, 425-433;
- Paul Loubet, Solen Kerneis, Olivia Anselem, Vassilis Tsatsaris, Francois Goffinet, Odile Launay. (2014). Should expectant mothers be vaccinated against flu? A safety review. Expert Opinion on Drug Safety. 13, 1709-1720;
- Lisa A. Jackson, Shital M. Patel, Geeta K. Swamy, Sharon E. Frey, C. Buddy Creech, et. al.. (2011). Immunogenicity of an Inactivated Monovalent 2009 H1N1 Influenza Vaccine in Pregnant Women. The Journal of Infectious Diseases. 204, 854-863;
- K. Zaman, Eliza Roy, Shams E. Arifeen, Mahbubur Rahman, Rubhana Raqib, et. al.. (2008). Effectiveness of Maternal Influenza Immunization in Mothers and Infants. N Engl J Med. 359, 1555-1564;
- Elizabeth P. Schlaudecker, Mark C. Steinhoff, Saad B. Omer, Monica M. McNeal, Eliza Roy, et. al.. (2013). IgA and Neutralizing Antibodies to Influenza A Virus in Human Milk: A Randomized Trial of Antenatal Influenza Immunization. PLoS ONE. 8, e70867;
- Kenneth A. McLean, Shoshanna Goldin, Claudia Nannei, Erin Sparrow, Guido Torelli. (2016). The 2015 global production capacity of seasonal and pandemic influenza vaccine. Vaccine. 34, 5410-5413;
- Evanson Z. Sambala, Ntombenhle Ngcobo, Shingai Machingaidze, Alison B. Wiyeh, Phetole W. Mahasha, et. al.. (2019). A global review of seasonal influenza vaccine introduction: analysis of the WHO/UNICEF Joint Reporting Form. Expert Review of Vaccines. 18, 859-865;
- Катлинский А. (2020). Россия не может стоять в очереди за вакцинами. «Специалисты о прививках»;
- Masige S. (2019). Australian researchers just released the world's first AI-developed vaccine and it could prevent another horror flu season. Business Insider Australia;
- Carole Henry, Anna-Karin E. Palm, Florian Krammer, Patrick C. Wilson. (2018). From Original Antigenic Sin to the Universal Influenza Virus Vaccine. Trends in Immunology. 39, 70-79;
- Edward A. Belongia, Danuta M. Skowronski, Huong Q. McLean, Catharine Chambers, Maria E. Sundaram, Gaston De Serres. (2017). Repeated annual influenza vaccination and vaccine effectiveness: review of evidence. Expert Review of Vaccines. 16, 723-736;
- Huong Q. McLean, Herve Caspard, Marie R. Griffin, Manjusha Gaglani, Timothy R. Peters, et. al.. (2018). Association of Prior Vaccination With Influenza Vaccine Effectiveness in Children Receiving Live Attenuated or Inactivated Vaccine. JAMA Netw Open. 1, e183742;
- Giuseppe A. Sautto, Greg A. Kirchenbaum, Ted M. Ross. (2018). Towards a universal influenza vaccine: different approaches for one goal. Virol J. 15;
- R. Nachbagauer, F. Krammer. (2017). Universal influenza virus vaccines and therapeutic antibodies. Clinical Microbiology and Infection. 23, 222-228;
- Wenling Wang, Renqing Li, Yao Deng, Ning Lu, Hong Chen, et. al.. (2015). Protective Efficacy of the Conserved NP, PB1, and M1 Proteins as Immunogens in DNA- and Vaccinia Virus-Based Universal Influenza A Virus Vaccines in Mice. Clin. Vaccine Immunol.. 22, 618-630;
- Declan Butler. (2018). The ghost of influenza past and the hunt for a universal vaccine. Nature. 560, 158-160;
- Aartjan J. W. te Velthuis, Ervin Fodor. (2016). Influenza virus RNA polymerase: insights into the mechanisms of viral RNA synthesis. Nat Rev Microbiol. 14, 479-493.