Огромный и загадочный мир бактериофагов
25 марта 2022
Огромный и загадочный мир бактериофагов
- 5087
- 0
- 14
Они живут везде, где только есть их хозяева — бактерии (читайте: повсюду!). Их присутствие незаметно, но оно влияет без преувеличения на каждого обитателя планеты. С начала прошлого столетия ученые не только с большим интересом исследуют мир фагов, но и находят способы применять их на благо человечества. Иллюстрация в полном размере.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редактор
-
Рецензент
-
Иллюстратор
Бактериофаги, или фаги, — самые распространенные и вместе с тем самые загадочные обитатели нашей планеты. Их открыли в начале прошлого века, и в их лице многие ученые увидели спасительное средство от бактериальных инфекций, которого все так долго ждали. Но вскоре началась эра антибиотиков, и о фагах на время забыли. Очередная волна интереса к бактериофагам поднялась на пике развития молекулярной биологии — они стали модельными организмами, которые помогли заглянуть в самую суть жизни. Новое рождение биология фагов переживает прямо на наших глазах. С одной стороны, возросший интерес к ним обусловлен остро вставшей проблемой антибиотикорезистентности. В то же время, стало понятно, что вирусы бактерий — не просто паразиты, но и симбионты, регуляторы, которые образуют глобальную сеть передачи генетической информации в масштабах биосферы. Бактериофаги играют важную роль в биологии вездесущих прокариот, а те, в свою очередь, формируют условия, в которых обитают все эукариотические организмы, включая человека. Этой статьей «Биомолекула» начинает cпецпроект об увлекательном мире бактериофагов.
Бактериофаги

Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Первые знакомства и начало науки о фагах
С миром микроорганизмов заочно были знакомы еще самые первые люди. Наши далекие предки наблюдали результаты жизнедеятельности этих невидимых для невооруженного глаза «соседей» повсюду: бактерии участвуют в формировании почвы и тем самым помогают выращивать урожай; делают несвежими продукты или, наоборот, помогают некоторые из них производить; вызывают болезни. Конечно же, поначалу никто не знал, что за это ответственны микроскопические существа. Коллективные усилия бактерий представали перед первобытными людьми то как благодать богов, то как проделки демонов.
Первым человечество познакомил с миром микроорганизмов нидерландский оптик-самоучка и исследователь-микроскопист Антони ван Левенгук в конце XVII века. Крохотные клетки, которые он увидел под микроскопом, произвели настоящий фурор [1]. На них интересно было смотреть, но пока еще никто не понимал, насколько важную роль они играют для человека и всей окружающей среды (рис. 1).

Рисунок 1. На пути к открытию бактериофагов: основные вехи. Конец XVII века. Антони ван Левенгук впервые увидел живые клетки под микроскопом [1]. 1892 г. Димитрий Иосифович Ивановский открыл первый вирус — вирус табачной мозаики. 1898 г. Британский химик и микробиолог Эрнст Ханбери Ганкин сообщил о литическом действии воды из рек Ганг и Джум, пропущенной через бактериальные фильтры, на возбудителей холеры. Считал, что это связано с летучим бактерицидным веществом. 1898 г. Российский и советский врач, микробиолог и эпидемиолог Николай Федорович Гамалея сообщил о «литическом ферменте», выделенном из лизата культур Baclillus anthracis. Вероятно, на самом деле это были бактериофаги. 1915 г. Фредерик Уильям Туорт впервые наблюдал лизис бактерий фагами. 1917 г. Повторное открытие вирусов бактерий и введение термина «бактериофаг» Феликсом д’Эреллем. 1940-е гг. Получены первые изображения бактериофагов под электронным микроскопом. Ученые убедились — фаги существуют!
иллюстрация Анастасии Самоукиной
Прошло еще почти два столетия, и стала зарождаться настоящая микробиология. Толчок дали работы двух великих ученых — Луи Пастера и Роберта Коха. К началу XX века многие микроорганизмы уже были изучены, открыты возбудители инфекций, против некоторых из них разработаны вакцины, лечебные токсиннейтрализующие сыворотки. Появилась полноценная бактериологическая диагностика.
В конце XIX века открыли и вирусы эукариот. Первым стал вирус табачной мозаики — его в 1892 году обнаружил русский физиолог и микробиолог Димитрий Иосифович Ивановский [2–4].
Казалось бы, мир паразитов изучен до самой последней границы, до самых простейших существ. Но ученых еще ожидал сюрприз, впоследствии положивший начало новому большому разделу биологии. Этим сюрпризом стали суперпаразиты — фаги, вирусы, способные поражать бактерий. Это оказалось настолько неожиданным, что в существование таких «молекулярных роботов» до того, как их удалось разглядеть в электронный микроскоп, отказывались верить некоторые маститые ученые и даже один Нобелевский лауреат.
Кстати, о паразитах на нашем сайте есть целая серия материалов. Читайте статьи «Его величество паразит» [5], «Манипулирование. I. Паразитное манипулирование» [6] и «Паразит паразиту враг» [7].
Как и многие научные открытия, первое знакомство ученых с бактериофагами произошло благодаря случайности. Британский исследователь Фредерик Уильям Туорт (рис. 1, 2а) загорелся идеей вырастить на бесклеточной питательной среде вирус осповакцины (в то время не знали, что с вирусами так не получится). В 1913 году он решил культивировать вирус на бесклеточных средах, для чего использовал осповакцину, по случайности контаминированную стафилококками. Вирусы осповакцины в чашках Петри так и не появились, но Туорт заметил другой загадочный эффект: некоторые колонии стафилококков получились полупрозрачными. В них не было бактерий, но присутствовали какие-то мелкие частицы — видимо, остатки клеток. Когда Туорт переносил стекловидные колонии на свежие, те также превращались в «призраков». Британский ученый так и не понял, что же случилось, он лишь выдвинул три гипотезы. Возможно, стафилококков разрушил некий вирус; либо фермент, выделившийся из погибших клеток; либо какой-то другой «живой» фермент, способный воспроизводить сам себя. Как мы теперь знаем, одна из этих догадок попала точно в цель. Туорт первым предположил, что это вирусы, но, как и его современники, не понимал, что они собой представляют и как «работают» [8].
Второе открытие фагов совершил канадско-французский ученый Феликс д’Эрелль (рис. 2). В 1916 году в Париже он изучал вспышку дизентерии в драгунском эскадроне, стоявшем в Мезон Лавите. И снова, как у Туорта, первым шагом стало ошибочное предположение. Д’Эрелль считал, что диарею вызывает бактерия в сочетании с вирусом, и что они усиливают друг друга. Чтобы проверить эту догадку, ученый получил фильтраты фекалий больных и добавлял их в растущие культуры возбудителя. В результате фильтраты фекалий выздоравливающих пациентов разрушали (лизировали) культуры. А когда этот лизат высевали на агар вместе с новыми культурами, на бактериальных газонах появлялись прозрачные кружки, которые д’Эрелль назвал taches vierges — «чистые пятна» (сейчас их называют бляшками). В отличие от своего предшественника, д’Эрелль сразу понял, в чем дело, и объявил, что открыл вирусы бактерий. Он и назвал их бактериофагами (выбрать «имя» д’Эреллю помогла супруга) [2], [8], [9].
Позже д’Эрелль пошел дальше и объявил фаги естественной защитной системой организма от бактериальных инфекций (в чем, к слову, отчасти оказался прав). В своих работах он критиковал ведущих иммунологов, чем очень уязвил бельгийского ученого Жюля Борде, получившего в 1919 году Нобелевскую премию за открытие системы комплемента. В ответ оскорбленный Борде заявил, что феномен, открытый самонадеянным французом, — всего лишь проявление аутолиза (когда бактериальные клетки разрушают сами себя своими же ферментами), и принялся доказывать свои идеи в экспериментах. Соперничество пошло только на пользу: оно помогло открыть некоторые важные свойства фагов. Все точки над i были расставлены в 1940 году, когда бактериофаги предстали перед учеными воочию, благодаря электронному микроскопу (рис. 1) [10].
Но это не конец истории, а только ее начало — благодаря фагам было сделано множество открытий в биологии и получена не одна Нобелевская премия. Подробнее об этом можно почитать в наших статьях «Пожиратели бактерий: убийцы в роли спасителей» [11] и «Модельные организмы: фаг лямбда» [12].
Знакомьтесь: фаги
Функционал бактериофага, как и любого вируса, незамысловат: найти подходящую клетку, проникнуть в нее, наплодить новые вирусные частицы, освободить их и отправить на поиски новой жертвы. В остальное время нужно лишь обеспечить надежную защиту для генетического материала. В этом плане все бактериофаги практически не различаются, поэтому и их структура организована по одному принципу, включая одни и те же основные компоненты:
- Генетический материал в виде нуклеиновой кислоты — ДНК или РНК.
- Капсула из белков, которая защищает нуклеиновую кислоту, как обшивка космического корабля обеспечивает защиту для экипажа. У бактериофагов это капсид, иногда — мембрана.
- Аппарат, обеспечивающий проникновение генетического материала в бактериальную клетку. Именно в этом компоненте встречаются наиболее заметные различия между разными видами фагов [9].
«Визитная карточка» большинства фагов — хвост. Такие фаги относятся к типу Uroviricota [3]. Это самые узнаваемые вирусы бактерий, внешне напоминающие инопланетный космический корабль. Например, так устроен фаг лямбда — модельный организм, который используют ученые по всему миру (рис. 3). В зависимости от типа хвоста, различают три морфологических варианта, (до недавнего времени они соответствовали таксономическим семействам) :
- Сифовирусы — с длинным несократимым хвостом. Это самая многочисленная группа, на нее приходится около 60% всех бактериофагов.
- Миовирусы — с длинным хвостом, который умеет сокращаться. На них приходится 25%.
- Подовирусы — с коротким несократимым хвостом, они составляют 15% [9], [13], [14].
На самом деле таксономия фагов намного сложнее и продолжает пересматриваться — последние значительные изменения (на момент написания этой статьи) произошли в 2020 году. Классификация в зависимости от внешнего вида имеет исторический смысл и в настоящее время применяется для удобства. А полную актуальную классификацию всех вирусов, включая фагов, можно найти на сайте Международного комитета по таксономии вирусов (ICTV).
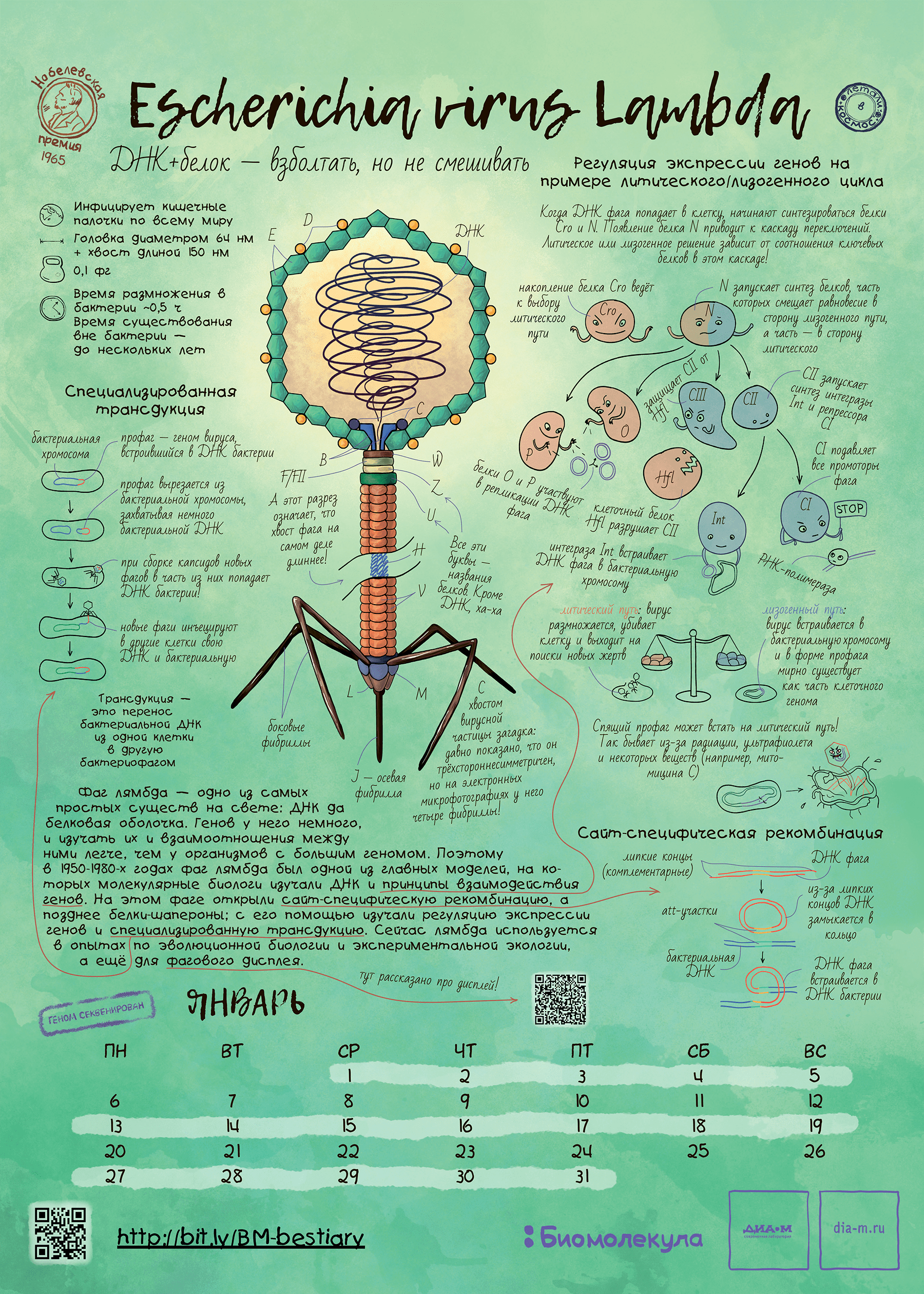
Рисунок 3. Тут изображен не НЛО, а пример структуры хвостатого фага. А именно — фага лямбда, модельного организма, о котором мы рассказывали в статье «Модельные организмы: фаг лямбда» [12].
Вообще, классификация фагов довольно сложна, и в ней учитываются разные характеристики, такие как морфология, физико-химические свойства вириона, структура нуклеиновых кислот, геномные данные.
Откуда взялись фаги?
Свято место, как известно, пусто не бывает. Бактерии, хотя и являются простейшими организмами, устроены всё же достаточно сложно, чтобы в них можно было паразитировать кому-то еще более мелкому и примитивному. Фаги заняли эту нишу очень давно, вероятно, сразу после возникновения первых прокариот. Точную дату никто не назовет, ведь вирусы — не динозавры и костей не оставляют. До сих пор нет ответа и на другой вопрос, волнующий ученых: откуда взялись бактериофаги? На этот счет существует несколько гипотез [15]:
- Гипотеза коэволюции говорит о том, что предки нынешних вирусов возникли еще до прокариот, в составе так называемого РНК-мира. Ведь существуют же до сих пор вироиды (или вирусоподобные инфекционные агенты): они состоят из РНК и лишены белковой оболочки. Тем не менее такая РНК может и сама действовать как фермент: расщеплять и лигировать другие молекулы РНК, образовывать пептидные связи и даже собственные копии. Возможно, первой формой жизни на нашей планете была именно РНК, а с появлением прокариот она приспособилась к паразитическому образу жизни [16]. Мы рассказывали об этой гипотезе в статье «РНК у истоков жизни?» [17], а еще на нашем сайте есть научный комикс «РНК: начало (мир РНК)» [18].
- Гипотеза клеточного происхождения (прогрессивная гипотеза) гласит, что нуклеиновые кислоты вирусов и бактериофагов — это генетический материал, который «убежал» из клетки и начал жить своей «пиратской» жизнью. Структуры, чем-то напоминающие вирусы, есть и у эукариот — эгоистические генетические элементы (плазмиды, транспозоны и некоторые другие) [19], [20].
- Регрессивная гипотеза утверждает, что вирусы — это клетки, которым было лень самостоятельно обеспечивать свою жизнедеятельность и размножение. Они избавились от всего «лишнего» и стали паразитировать на своих собратьях. Такое упрощение структуры и функционала — распространенное явление в мире паразитов, в том числе в микромире. Например, известны такие «лайтовые бактерии», как риккетсии и хламидии, которые могут размножаться только внутри других клеток. О бактериях-карликах, способных проходить через фильтры, ранее считавшиеся непроницаемыми для клеток, можно почитать в нашей статье «Маленький, да удаленький: самые маленькие клетки» [21]. Может быть, это и есть то самое переходное звено между бактериями и фагами?
- Гипотеза о вирусах-прародителях. Все гипотезы, перечисленные выше, утверждают, что начало жизни на Земле дали клетки, и именно они были первыми. Вирусы либо появились позже, либо существовали изначально, но никак не связаны с первыми прокариотами, а лишь превратились в паразитов. Но некоторые ученые считают, что нашими первыми предками могли быть именно вирусы. Постепенно они усложнились, приобрели механизмы для синтеза мембран, клеточных стенок. Эта гипотеза считается наиболее сомнительной, ведь на данный момент не известно вирусов, которые могли бы размножаться без хозяев, и нет подтверждений, что такие вообще могли существовать. Тем не менее в 2012 году было продемонстрировано, что вирусы могут формировать структуры, напоминающие ядра, в клетках хозяев [22]. В 2020 году российские ученые провели эксперименты с заражением бактерий фагом phiKZ. Внутри клеток этот бактериофаг формирует псевдоядро, напоминающее настоящее , [23]. Подобные структуры не родственны ядрам эукариот, поэтому такие эксперименты вовсе не доказывают, что вирусы могли дать начало клеточным формам жизни. Тем не менее эта способность вирусов весьма интересна и дает почву для дальнейших исследований. Большой интерес для ученых представляют гигантские мимивирусы — есть мнение, что они могут оказаться переходным звеном между доклеточными и клеточными формами жизни [3], [15].
О том, как джамбо-фаги могут образовывать псевдоядра в клетках бактерий, можно почитать в нашей статье «Я в домике!”: бактериофаги, у которых есть ядра» [24].
Если вам интересно узнать больше о мимивирусах и об их врагах в вирусном мире — читайте наши статьи «Гиганты вирусного мира» [25] и «Паразит паразиту враг» [7].
Филогенез бактериофагов до сих пор таит множество загадок. Между разными представителями обнаруживаются определенные сходства и различия, которые помогают выстраивать эволюционные линии. Однако неизвестно, составляют ли все вирусы, или хотя бы все фаги, единую монофилетическую группу. Иными словами, есть ли у них у всех один предок, или же отдельные разновидности возникли параллельно независимо друг от друга [26].
Из нашей статьи «Вирусные геномы в системе эволюции» можно подробнее узнать о происхождении вирусов и их месте в общей модели эволюции [27].
Поиски родственных связей затрудняет одна особенность фагов: мозаицизм их генома. Он напоминает лоскутное одеяло: сшит из многочисленных модулей, каждый из которых обладает собственной эволюционной историей. Эти модули могут включать [28], [29]:
- набор генов, полностью ответственный за сборку определенной «части тела» фага, например, головки или хвоста;
- набор генов, кодирующих белки, необходимые для определенного процесса, например, удвоения ДНК;
- модули субгенного уровня, которые кодируют белковые домены или группу доменов, необходимые для выполнения определенной функции;
- мороны — независимые транскрипционные единицы, обычно состоящие из одного гена, кодирующего белок с «опциональной», дополнительной функцией в фаговом геноме [3].
Геном фагов «пестрый», потому что эволюционируют они не совсем так, как многоклеточные организмы. С одной стороны, у них, как и описано в учебниках школьной биологии, периодически возникают мутации: полезные закрепляются, вредные отбраковываются. Это так называемый вертикальный путь. Но у фагов есть еще и путь горизонтальный, и он очень активно работает. Это так называемый модульный механизм, связанный с латеральным переносом генов за счет различных видов рекомбинации. У бактерий этот механизм тоже работает, но не в такой степени [29–31].
Исследователи фагов традиционно делились на два лагеря. Одни утверждали, что эволюция бактериофагов в первую очередь происходит за счет модульного механизма. Противники были уверены, что, хотя модульный механизм и вносит существенный вклад, главным двигателем нужно признать мутации. Сегодня для всех очевидно, что оба механизма работают, вопрос только в том, насколько существенный вклад вносит каждый из них. Из-за этого и возникают сложности с изучением филогенеза фагов: ведь он пронизан густо переплетенными нитями.
Впрочем, со временем картина становится более четкой. Известно, что у бактериофагов-родственников (условно представителей одного рода и семейства) есть одинаковые гены, объединенные в консервативные кластеры. Тут изменения происходят в основном за счет точечных мутаций, а перестановки модулей наблюдаются редко. Эти участки называются кор-геномом. Они содержат консервативные гены, которые кодируют структурные белки вириона, ферменты, гены транскрипции и репликации. Существенные изменения тут чреваты: чтобы фаг остался жизнеспособным, их нужно компенсировать точечными мутациями. Время на возникновение этих мутаций есть только у умеренных фагов, пока профаг находится в безопасности внутри бактериальной клетки. Зато горизонтальный перенос часто происходит в периферическом геноме, где находятся вариабельные гены, преимущественно мороны [3], [32].
Изучение эволюции фагов важно не только само по себе. Ведь в большинстве случаев она протекает не изолированно, а в форме коэволюции с бактериями-хозяевами. Знание этих процессов важно для более эффективного применения фагов в медицине и других сферах, в изучении их влияния на экосистемы.
Бактерии и фаги: миллиарды лет вместе
Когда у ученых не было эффективных инструментов, чтобы подсчитывать число фагов в окружающей среде, считалось, что эти «инопланетяне» если и влияют на экосистемы, то весьма незначительно. Всё изменилось в 1980–1990-е годы, когда стали широко использовать методы прямого подсчета вирусных частиц в природных образцах, такие как электронная и эпифлуоресцентная микроскопии. Оказалось, что фаги буквально повсюду, и их примерно в 10 раз больше, чем бактерий. Фактически, это самые многочисленные обитатели нашей планеты.
Говоря о бактериофагах как о санитарах микромира, по аналогии с волками — санитарами леса, нужно отметить одно существенное отличие. Если вспомнить пищевые цепочки из школьного курса биологии, то в воображении сразу предстанет пирамида, где внизу травоядные, а у верхушки хищники. Последних меньше, и за счет этого они контролируют размеры популяции более многочисленных жертв, при этом и сами не оставаясь голодными. У фагов же с бактериями всё наоборот: «хищников» больше на порядок. Тем не менее система поддерживается в равновесии: прокариоты не подверглись тотальному геноциду, но и не стали поголовно устойчивыми к фагам.
Чтобы понять, как фаги и чувствительные к ним бактерии стабильно сосуществуют, в первую очередь нужно поговорить о двух основных (но не единственных) жизненных циклах фагов (рис. 4):
- Литический цикл напоминает классические отношения «хищник—жертва». Фаг прикрепляется к бактериальной клетке с помощью специальных рецепторов и вводит внутрь свой генетический материал. Такая «зомбированная» бактерия превращается в фабрику по производству новых вирусных частиц. В конечном счете клетка разрушается, и новые фаги выходят во внешнюю среду, чтобы встретить новую жертву. Такие бактериофаги называются вирулентными.
- Лизогенный цикл больше похож на хроническую инфекцию (но этот термин тут не подойдет, для фагов он обозначает другое). Вирусная ДНК или РНК не спешит создавать свои копии и новые вирусные частицы. Такие фаги (они называются умеренными) могут длительно существовать в виде профага. Их ДНК встраивается в бактериальную хромосому или существует в виде плазмиды [14]. Бактерия «остается в живых», и профаг даже может наделять ее новыми полезными свойствами. Это может продолжаться очень долго, но однажды условия меняются, и запускается литический цикл [33–35].
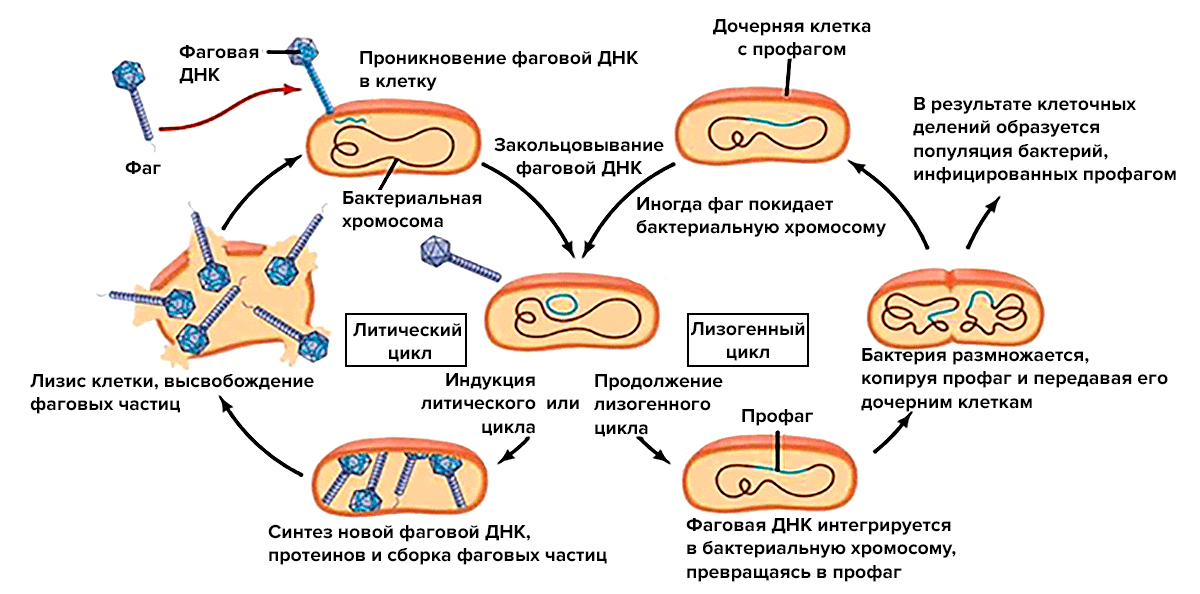
Рисунок 4. Схематическое изображение литического и лизогенного циклов. В то время как одни клетки, инфицированные фагами, погибают, другие остаются живыми и даже получают некоторые новые полезные свойства. Но позже все-таки могут также погибнуть.
Если проанализировать виро́м (совокупность всех вирусов) разных сред, то окажется, что большая часть его населения представлена вирулентными фагами (по крайней мере, они обычно преобладают в воде). Теоретически эта орда должна массово атаковать бактерии и уничтожить их на корню. Но этого не происходит. Бактерии никогда не погибают полностью даже при большой концентрации фаговых частиц и процветают повсеместно. Дело в том, что они защищены с помощью целого ряда механизмов.
В течение миллиардов лет сосуществования бактерий и фагов происходило что-то вроде гонки вооружений. Прокариоты выработали целый арсенал методов защиты — своего рода иммунитет. Причем у бактерий в этой гонке есть преимущество: у них мутации, позволяющие защищаться от фагов, происходят чаще и проще. Бактериофаги в некоторой мере компенсируют это своей численностью [14].
На приобретение защитных мутаций бактериям требуется время, а для начала нужно как-то остаться в живых. Тут дела обстоят как с пандемией COVID-19: иммунитет человека может справиться с вирусом, но пока он «разгонится», вирус может справиться с организмом самого человека. Поэтому врачи рекомендуют меры профилактики: носить маски, избегать общественных мест, часто мыть руки, не подходить к больным людям и, конечно же, вакцинироваться. Бактерии успешно используют некоторые «убежища» (refuges), чтобы «прятаться» от фагов:
- Численное укрытие. В отличие от хищников животного мира, бактериофаги не умеют гоняться за жертвами. Они полностью во власти стихии: им остается только ждать, когда законы физики помогут им коснуться подходящей бактериальной клетки. Понятно, что, в целом, вероятность не очень высока, особенно в таких средах, как почва, или если концентрации бактерий и соответствующих им фагов в целом малы. Под лежачий камень вода, как известно, не течет.
- Пространственное укрытие. Некоторые исследователи называют его одним из самых важных механизмов защиты бактерий от встречи с фагами. Он предполагает изоляцию по крайней мере части чувствительных микроорганизмов. Например, бактерии часто строят «крепости» — биопленки. В качестве кирпичиков микроорганизмы используют собственные тела, а «цементом» служит слизь.
- Физико-химическое укрытие. Некоторые бактерии селятся в таких местах, где есть химические соединения или физические факторы, сильно снижающие способность фагов инфицировать клетки (а то и вовсе сводят ее на нет). Один из примеров такой среды — рубец жвачных животных.
- Физиологическое укрытие. Сами бактерии могут находиться в таком состоянии, которое совсем не способствует размножению и распространению фагов. Например, если микроорганизмам не хватает питательных веществ, и у них нет ресурсов, чтобы превратиться в «вирусную фабрику», фаги всё еще могут проникать в бактериальные клетки, но находятся в них в неактивном состоянии [34].
- «Укрытие за трупами». Единственные «органы чувств» фагов — белки, способные связываться с рецепторами на поверхности бактериальных клеток. Но вместо живой клетки им может попасться бактериальный дебрис (остатки разрушенных бактерий). Фаг необратимо с ним связывается и инактивируется [3], [36].
Санитары микромира
Если смешать вирулентные фаги с чувствительными к ним бактериями, последних тут же станет меньше. В самом деле, фаги — основные убийцы бактерий: на них приходится до 70% бактериальных смертей (в среднем — 15–30%). Кроме того, при хронической инфекции скорость размножения бактерий уменьшается, и это тоже влияет на их численность. Лучше всего все эти процессы изучены в морской воде.
Быстрее всего фаги размножаются в наиболее многочисленных и быстрорастущих популяциях бактерий. Это проявление принципа «убивай побеждающего» — kill the winner. Бактериофаги непрерывно работают как неутомимая и неподкупная антимонопольная служба. Как только популяция какого-нибудь микроорганизма начинает преобладать в экосистеме — среди ее членов немедленно разгорается эпидемия, приводящая к коллапсу. За счет этого никто не может окончательно победить в конкуренции, и поддерживается широкое биоразнообразие [37–39].
Уничтожая бактерий, фаги парадоксальным образом способствуют их размножению. Тут задействованы сложные механизмы, связанные с пищевыми цепочками. Например, в море, если фагов нет, и микроорганизмы идут на пищу зоопланктона, вся биомасса полностью переходит на следующий уровень пищевой цепочки. Бактериофаги же возвращают 99% клеточного содержимого в окружающую среду в растворенном виде. В итоге энергия и вещество остаются в распоряжении микроорганизмов. По некоторым данным, в результате лизиса клеток вирусами в мировой океан ежегодно поступает около трех гигатонн углерода. Вирусы сильно влияют на поток углерода, азота и других питательных веществ в окружающей среде [14], [40]. Также фаги влияют на фиксацию углекислого газа в морской воде и осадочных породах, способствуют высвобождению из микроорганизмов диметилсульфида — газа, который участвует в формировании облаков и влияет на интенсивность поглощения солнечной радиации в атмосфере , [14].
Влияние микроорганизмов на климат — далеко не новость для ученых. Мы рассказывали об этом в статье «О, этот благодатный дождь из бактерий!» [41].
Экологическое значение фагов пока изучено недостаточно, и имеющиеся сейчас данные в основном касаются морских экосистем. Ученым еще предстоит многое узнать о роли этих удивительных существ в жизни бактерий и всех остальных обитателей Земли.
Бактерии защищаются
Бактериальные клетки вовсе не беззащитны перед фагами. В ходе эволюции они сформировали многочисленные механизмы устойчивости и сопротивляются на каждом этапе развития инфекции.
Предотвращение адсорбции фагов
Чтобы запустить свой генетический материал внутрь клетки, для начала фаг должен прикрепиться к ней с помощью особых рецептор-связывающих белков, которые иногда также называют фаговыми адгезинами. В качестве рецепторов приходится использовать различные структуры на поверхности бактериальной клетки. Чтобы сопротивляться адсорбции, бактерии выработали по крайней мере три механизма: блокирование фаговых рецепторов, образование внеклеточного матрикса и продукция конкурентных ингибиторов.
Чтобы блокировать фаговые рецепторы, микроорганизмы могут изменить их химическую структуру или трехмерную конфигурацию. Например, интересный механизм наблюдается у золотистого стафилококка. Эти бактерии производят IgG-связывающий белок — фактор вирулентности А, заякоренный в клеточной стенке. Когда этого белка много, адсорбция фагов ухудшается. Это говорит о том, что белок А вместе со связанными им иммуноглобулинами маскирует фаговый рецептор.
Образование межклеточного матрикса — полимеров, в которые бактерии погружены, как в желе, — защищает микроорганизмы от негативных воздействий внешней среды, а также создает физический барьер между бактериофагами и их рецепторами. Пример с биопленками мы рассматривали выше. Но некоторые фаги научились распознавать полимеры межклеточного матрикса, и даже разрушать их.
Конкурентные ингибиторы — вещества, способные связываться с фаговыми рецепторами и конкурирующие за них с бактериофагами. Например, FhuA — соединение на поверхности кишечных палочек — одновременно отвечает за транспорт железа и служит рецептором для адсорбции фагов. Этот рецептор может быть заблокирован антимикробным пептидом микроцином J25. Бактерии начинают его производить в условиях нехватки ресурсов, чтобы подавить рост представителей родственных видов. Одновременно оно обеспечивает противофаговую защиту.
Предотвращение проникновения ДНК фага в клетку
Этот механизм обеспечивается системами исключения суперинфекции (Sie). Они включают набор белков, которые, собственно, предотвращают проникновение в бактерию фаговых ДНК. Эти белки встроены в клеточную мембрану или связаны с ней. Интересно, что белки системы Sie зачастую «неродные» для бактерий: они кодируются не их собственными генами, а профагами. И это дает повод предположить, что Sie изначально предназначены не столько для защиты микроорганизмов, сколько, чтобы помогать фагам не пускать внутрь «кормушки» конкурентов.
Так, у фага T4 есть две системы Sie, предотвращающие проникновение в клетку других T-чётных фагов после инфицирования: эти системы представлены белками imm и sp. Они действуют отдельно друг от друга и работают по-разному (рис. 5):
- imm изменяет конформацию (пространственную конфигурацию) белков в месте введения вирусной ДНК. Этот защитный белок связан с мембраной и, как полагают ученые, должен связаться с другим белком, чтобы эффективно выполнять свои функции.
- Sp — мембранный белок, подавляющий активность фермента, который находится на конце хвоста фага и проделывает отверстия в стенке клетки-хозяина [42].
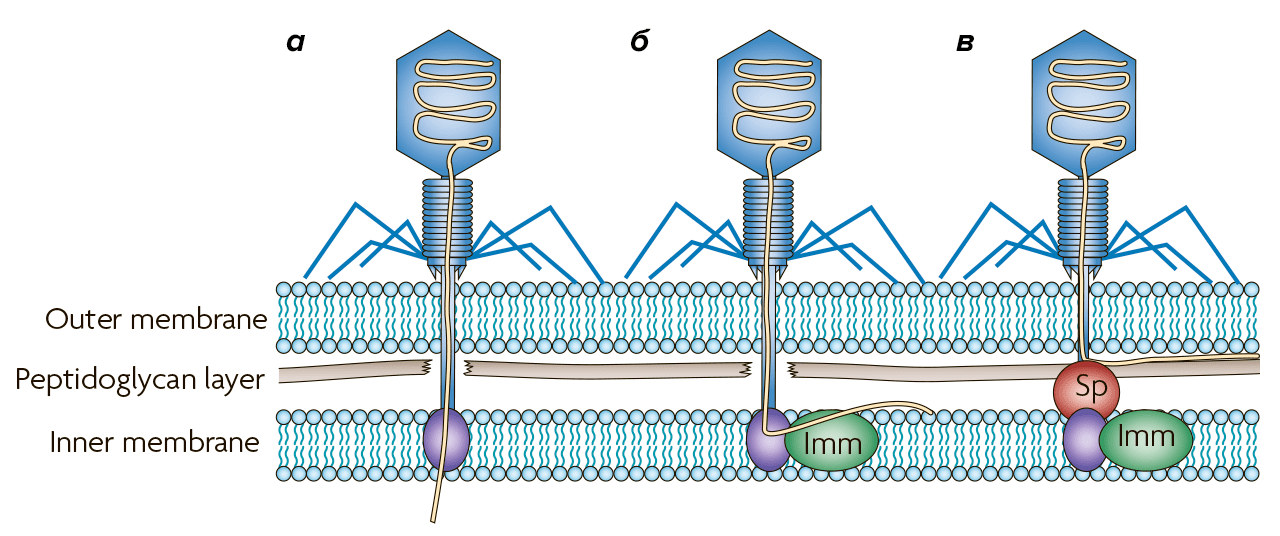
Рисунок 5. Блокирование проникновения ДНК в бактериальную клетку. а — Обычное инфицирование E. coli фагом T4. Пептидогликановый слой разрушается, и белок внутренней мембраны участвует в проникновении ДНК в цитоплазму. б — Белок фага T4 imm блокирует проникновение ДНК в цитоплазму, тем самым предотвращая инфицирование другими T-четными фагами. в — Белок Sp, также кодируемый фагом Т4, предотвращает деградацию пептидогликана, останавливая фаговую ДНК между слоем пептидогликана и внешней мембраной.
Разрушение нуклеиновых кислот фага
Даже после того, как фаг сумел проникнуть внутрь бактериальной клетки, праздновать победу ему еще рано. Враждебная нуклеиновая кислота может быть разрушена еще до того, как успеет натворить бед. Для этого в клетках прокариот есть, на удивление, аналог иммунной системы животных и человека.
Например, бактерии многих, если не всех, родов обладают системами рестрикции-модификации. ДНК прокариот отличается от вирусной тем, что часто метилирована. Когда внутрь клетки попадает неметилированная ДНК фага, то она либо «разрезается» ферментами-рестриктазами (рестрикция), либо модифицируется — тоже метилируется (ферментами-метилазами — бактериальными или фаговыми), что запускает литический цикл (рис. 6). Судьба фагового генетического материала, а следовательно, и бактериальной клетки зависит от соотношения активности этих ферментов. Обычно «выигрывают» рестриктазы, в то время как метилирование обеспечивает защиту собственного генетического материала микроорганизма [42–44].
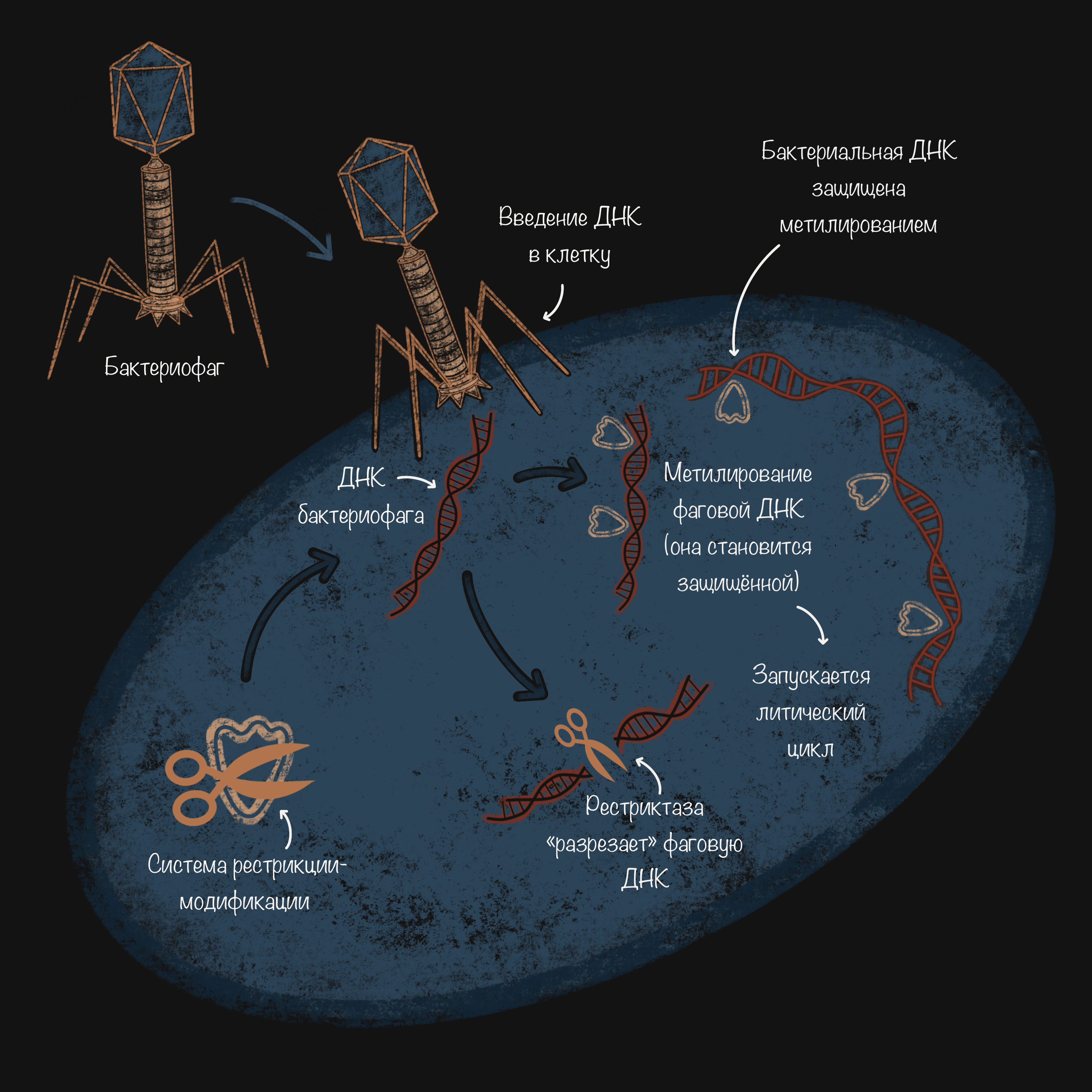
Рисунок 6. Схема работы системы рестрикции-модификации бактерий. Бактериальные рестриктазы «разрезают» ДНК фага, в то время как собственный генетический материал микроорганизма защищен метилированием.
иллюстрация Анастасии Самоукиной
Другая система защиты бактерий от чужеродного генетического материала носит название CRISPR/Cas. Это уже полноценный «иммунитет», способный специфически распознавать ДНК патогенов и «запоминать» новые фаги. В геноме бактерий есть особые участки — короткие палиндромные повторы, регулярно расположенные группами (Clustered Regularly Interspaced Short Palindromic Repeats, CRISPR) . Между этими повторами вставлены фрагменты ДНК фагов — как ориентировки в отделении полиции. Внутри клетки патрулируют «полицейские» — ферменты (Cas-белки), связанные с CRISPR-РНК. Если на их пути встречается фрагмент нуклеиновой кислоты, соответствующий CRISPR-РНК, Cas-белок его «разрезает» (рис. 7) [42], [45], [46].
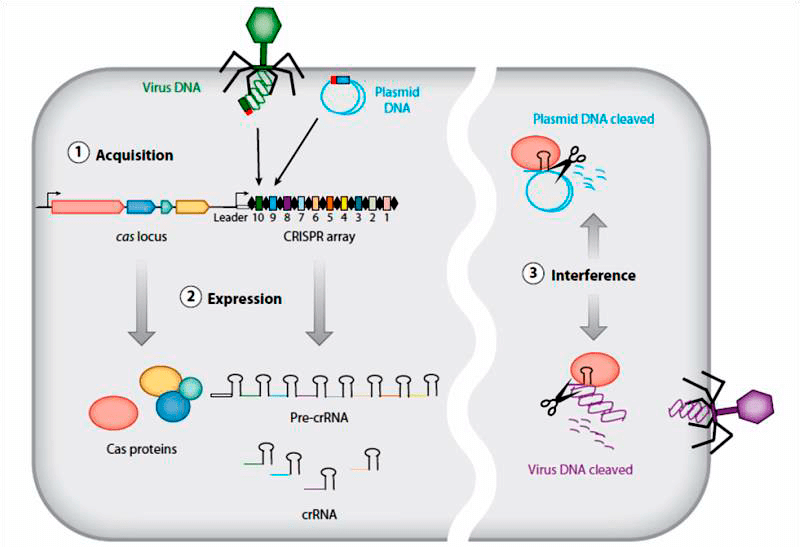
Рисунок 7. Схема работы системы CRISPR/Cas. В хромосоме бактерии встроены участки, в которых содержатся фрагменты ДНК фагов. Они служат матрицами для синтеза CRISPR-РНК, которые затем связываются с ферментами Cas. Когда РНК распознает вирусную ДНК, фермент ее «разрезает».
На нашем сайте есть подробная статья о работе системы CRISPR/Cas — «Просто о сложном: CRISPR/Cas» [47]. Когда ученые узнали о замечательных свойствах этой системы, ее стали использовать в генной инженерии. На данный момент это один из самых быстрых и эффективных инструментов редактирования генома.
Системы абортивной инфекции
Эти системы предотвращают дальнейшее распространение фагов, уже заразивших клетку. Это единственный вид защиты, который предусматривает гибель инфицированной клетки, и он обеспечивается работой большого количества различных белков. Как правило, эти белки действуют на этапе репликации, транскрипции или трансляции фаговой ДНК. Используя подобные механизмы «самоубийства», бактериальное сообщество действует наподобие многоклеточных организмов, которые тоже обладают массой средств для уничтожения клеток, пораженных вирусами.
Арсенал противофаговых средств бактерий не изучен окончательно. Ученые постоянно открывают новые механизмы. Например, в 2018 году израильские исследователи обнаружили целых 10, ранее неизвестных. Мы рассказывали об этом в статье «Противофаговая линия Мажино в клетках прокариот: новые открытия» [48].
Кроме того, фаги и сами могут защищать своих жертв, и даже общаться между собой, посылая собратьям сообщение: «Эту клетку убивать не надо!». Об этом можно почитать в статье «Бактериофаг-1 Бактериофагу-2, приём!» [49].
На все ухищрения бактерий фагам есть что ответить, и они тоже постоянно совершенствуют свои механизмы преодоления бактериальной резистентности. Бактериофаги приобретают мутации, которые позволяют им прикрепляться к новым или изменившимся старым рецепторам, эффективнее получать к ним доступ, избегать разрушения ДНК, оказавшись внутри клетки. И ученые продолжают открывать новые механизмы. Об одном из таких открытий можно почитать в нашей статье «Белок Ocr — швейцарский нож бактериофага T7» [50].
То, что не убивает, — делает сильнее
Раньше ученые смотрели на бактериофаги исключительно как на хищников, безжалостно расправляющихся с бактериями. Современные взгляды сильно изменились. Хищник превратился в некое подобие программного кода. Он может оказаться не только вредителем, но и вполне полезным софтом.
Фаги могут способствовать адаптации бактерий четырьмя основными путями:
- Некоторые выступают в качестве «опорных точек» для перестройки генома.
- Умеренные фаги защищают бактериальные клетки от вирулентных.
- Вирулентные, в свою очередь, могут уничтожить конкурирующие микроорганизмы.
- Многие фаги могут вводить в геном бактерий новые полезные гены, которые повышают устойчивость к внешним факторам (в том числе антибиотикам), помогают эффективнее вызывать инфекции, вырабатывать токсины, адаптироваться к среде (некоторые подробности можно найти в нашей статье «Фаги-оруженосцы на службе у бактерий» [51]). Это происходит в рамках лизогенной конверсии и трансдукции [52].
При лизогенной конверсии умеренный фаг вставляет в ДНК бактерии гены, которые кодируют те или иные полезные (для самой бактерии) белки (рис. 8). Этот признак наследуется вместе с профагом, но только до тех пор, пока захватчик не решит прекратить мирное сосуществование и не запустит литический цикл. Обычно гены, ответственные за лизогенную конверсию, находятся в моронах и не имеют большого значения для самого фага [53], [54].
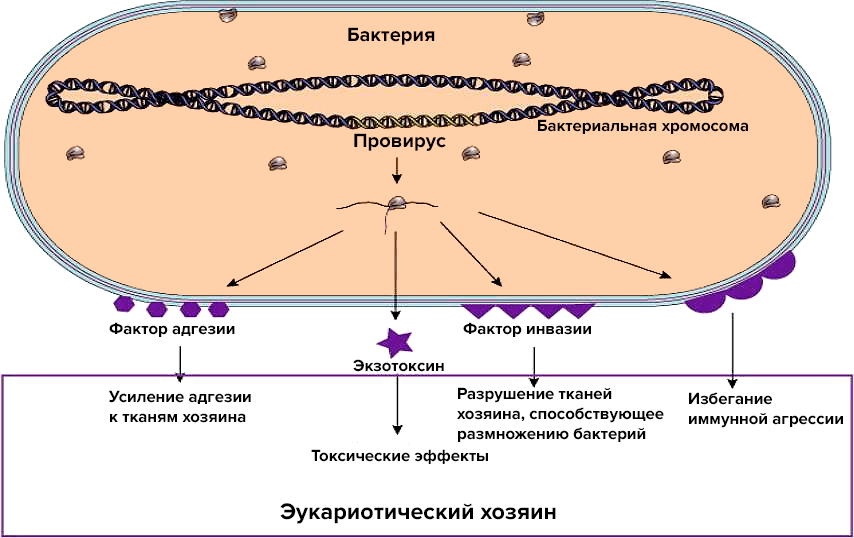
Рисунок 8. Схема лизогенной конверсии. Профаг может нести гены, которые кодируют белки, усиливающие адгезию к тканям хозяина, обладающие эффектами токсинов, разрушающие ткани хозяина, помогающие уклоняться от агрессии иммунной системы.
Самый яркий и известный пример лизогенной конверсии — выработка токсина дифтерийными палочками. На самом деле ген, кодирующий этот токсин, принадлежит не бактериям, а инфицирующему их умеренному β-фагу [55]. Некоторые другие полезные свойства, которыми фаги могут поделиться с бактериями, представлены в таблице.
| Название вещества | Фаг | Бактерия-хозяин |
|---|---|---|
| Экзотоксины — вещества, которые бактерии вырабатывают и выделяют во внешнюю среду | ||
| Дифтерийный токсин | β-фаг | C. diphtheriae (возбудитель дифтерии) |
| Нейротоксин (ботулотоксин) | С1 | C. botulinum (возбудитель ботулизма) |
| Шига-токсин | H-19B | E. coli (кишечные палочки, вызывающие диарею) |
| Энтеротоксины | φN315, φ13, φMu50A | S. aureus (золотистые стафилококки) |
| Холерный токсин (холероген) | CTXφ | V. cholerae (холерный вибрион — возбудитель холеры) |
| Белки, изменяющие антигенные свойства | ||
| Мембранные белки | Pnm1 | N. meningitidis (возбудитель менингита) |
| Гликозилирующие белки | ɛ34, P22 | S. enterica (возбудитель сальмонеллеза) |
| Глюкозилтрансфераза | SfII, SfV, SfX | S. flexneri (вызывает диарею) |
| Эффекторные белки, участвующие в инвазии (вторжении микроорганизмов в ткани) | ||
| Эффектор III типа | SopEΦ, GIFSY-2, GIFSY-3 | S. enterica |
| Ферменты | ||
| Супероксиддисмутаза | GIFSY-2, Fels-1 | S. enterica |
| Супероксиддисмутаза | Sp4, 10 | Кишечные палочки |
| Нейраминидаза | Fels-1 | S. enterica |
| Гиалуронидаза | H4489A | S. pyogenes |
| Лейкоцидин | φPVL | S. aureus |
| Стафилокиназа | φ13 | S. aureus |
| Фосфолипаза | 315.4 | S. pyogenes |
| ДНКаза/стрептодорназа | 315.6, 8232.5 | S. pyogenes |
| Сывороточная резистентность | ||
| OMPb, OMP | λ-фаг | E. coli |
| Белки адгезии для прикрепления бактерий к тканям хозяина | ||
| Vir | MAV1 | M. arthritidis |
| Белки оболочки фага | СМ1 | S. mitis |
| Другие соединения | ||
| Митогенный фактор | 370.1, 370.3, 315.3 | S. pyogenes |
| Митогенный фактор | Нет названия | P. multocida |
| Митогенный фактор | phisc 1 | S. canis |
| Вирулентность | GIFSY-2 | S. enterica |
| Антивирулентность | GIFSY-2, Fels-1 | S. enterica |
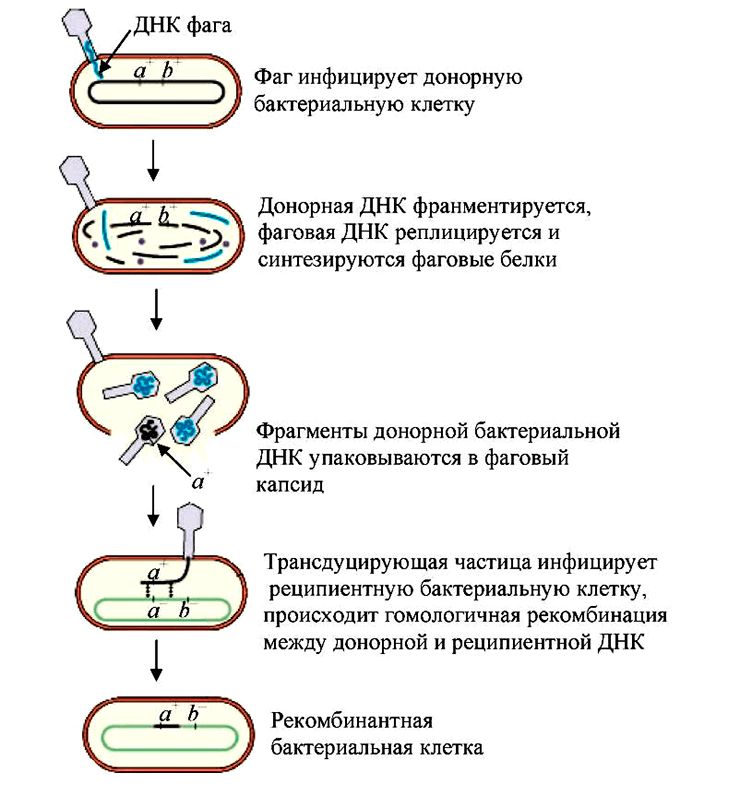
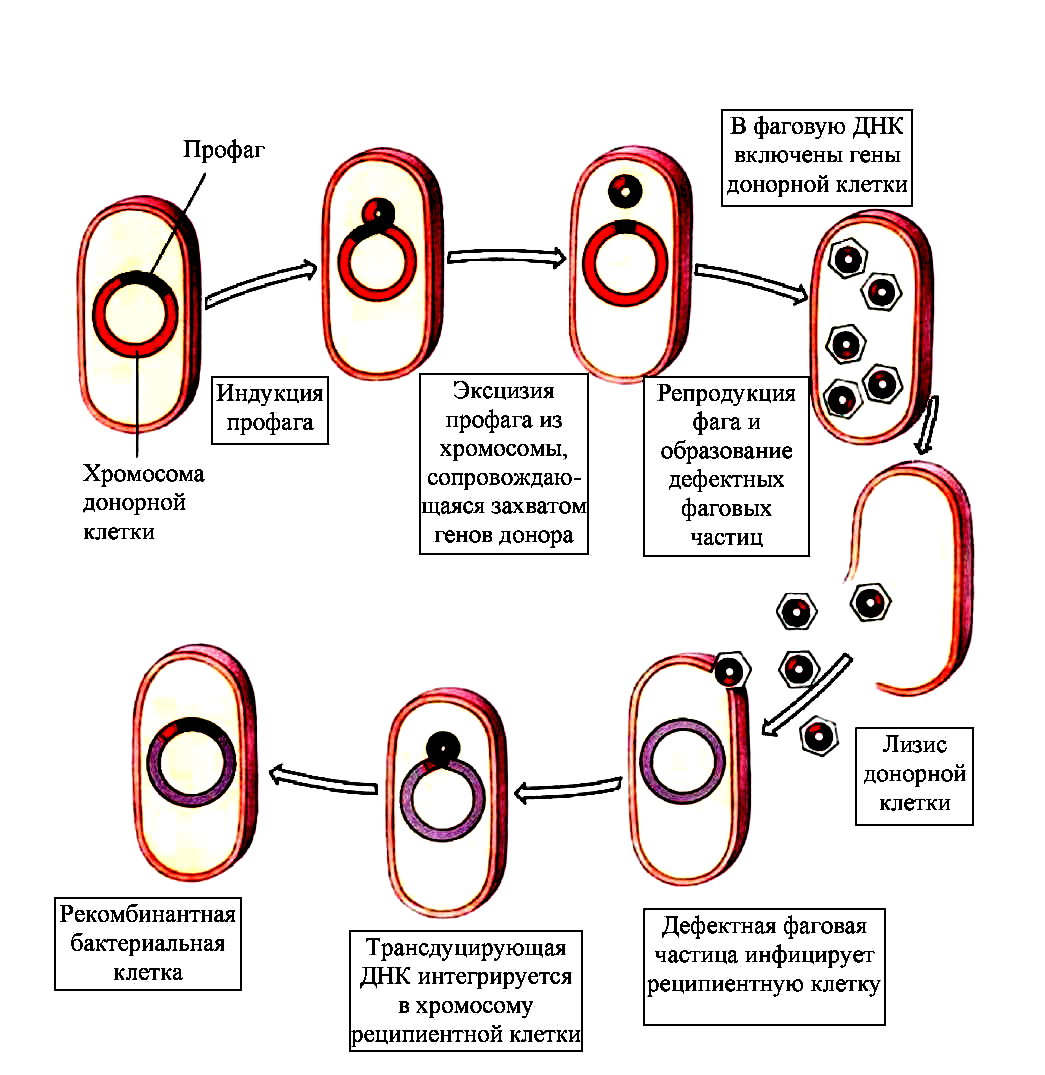
Иной механизм, с помощью которого фаги могут наделять бактерии полезными свойствами — трансдукция. В данном случае новый ген, позаимствованный у другого микроорганизма, не связан жестко с вирусной ДНК, а как бы приносится в дар бактерии и становится частью ее генома. Трансдукция бывает двух видов (рис. 9) [56], [57]:
- Общая — когда при сборке новых вирусных частиц в них случайно упаковываются кусочки бактериальной ДНК.
- Специфическая — когда профаг, индуцировавший литический цикл, неправильно вырезается из ДНК бактерии и захватывает ее фрагменты [3].
В частности, в ходе трансдукции микроорганизмы могут обмениваться генами, отвечающими за устойчивость к антибиотикам. Но значение этого явления выходит далеко за рамки индивидуальной пользы для отдельно взятой бактерии. Фаговая трансдукция помогает в целом обеспечивать разнообразие микробного мира, важна для его выживания.
Вирусный «микробиом» человека — виром
Организм человека населен микроорганизмами, составляющими его естественную микрофлору — об этом известно любому обывателю с тех пор, как реклама буквально из каждого утюга стала рассказывать о дисбактериозе и методах борьбы с ним. Но мало кому известно, что наше тело также является обиталищем огромного сообщества вирусов — вирома. Он включает примерно 1013 вирусных частиц (примерно как бактерий), и среди них есть:
- бактериофаги;
- вирусы, инфицирующие собственные клетки человека;
- фаги архей;
- вирусы эукариот, обитающих в составе микрофлоры;
- «временные пассажиры».
Считается, что большую часть от этого множества составляют хвостатые фаги.
По ряду причин изучать человеческий виром (еще иногда употребляют термин «фагом») сложнее, чем бактериальную микрофлору, но с появлением технологии секвенирования нового поколения дело пошло намного лучше [59], [60]. Один из наиболее известных современных проектов — «Микробиом человека». Когда ученые оценивают виром человека и животных, обычно они употребляют термин «вирусоподобные частицы». Это словосочетание означает, что генетический материал из тканей, биологических жидкостей и фекалий не всегда принадлежит жизнеспособным вирусам, способным заражать клетки [61–63].
Состав вирома различается в разных частях организма, а также зависит от возраста человека, питания, среды обитания, генетики, заболеваний, приема тех или иных лекарств и других факторов (рис. 10).
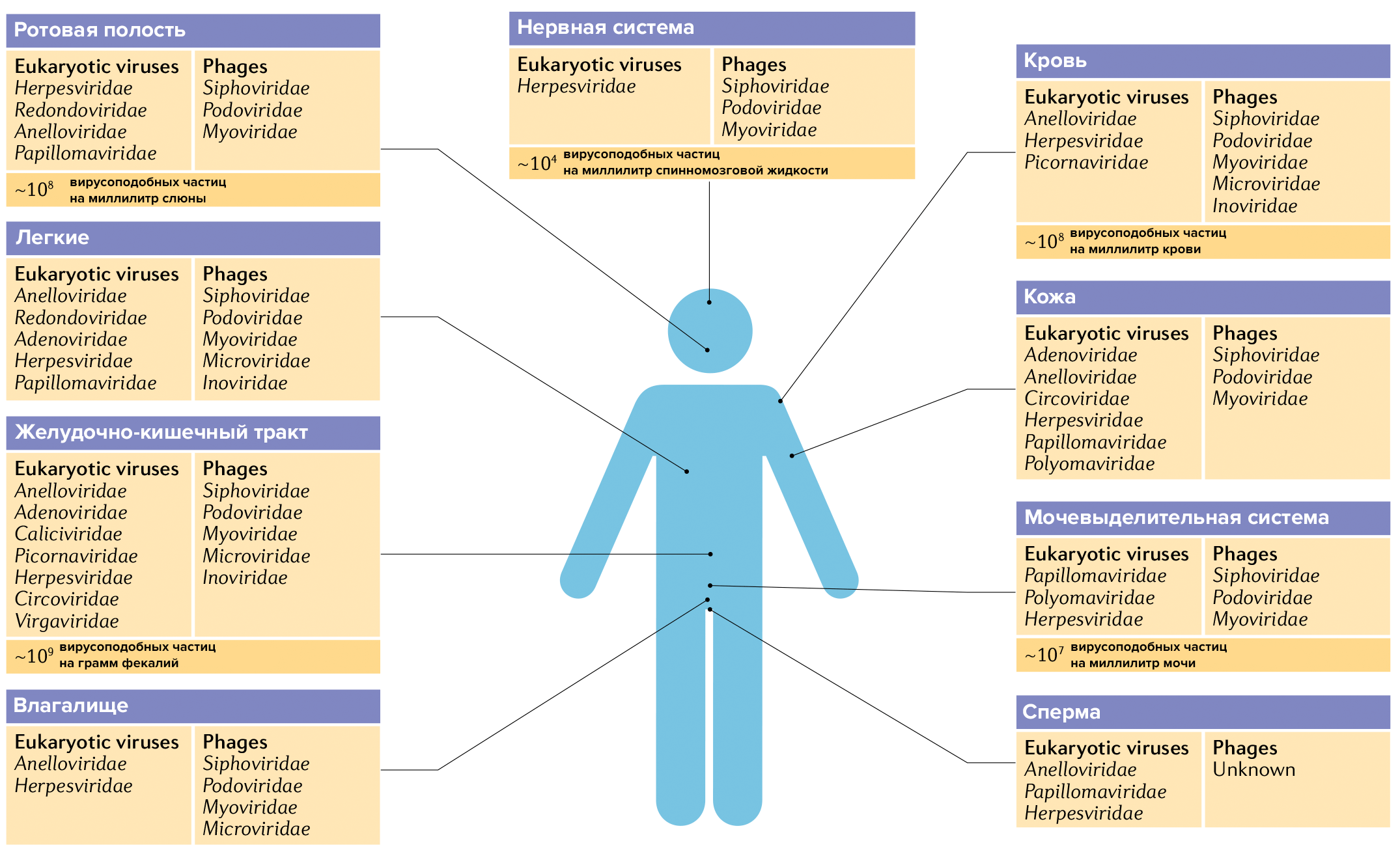
Рисунок 10. Вирусные сообщества в разных частях организма человека. Эта инфографика составлена на основе нескольких десятков научных обзоров. Будущие исследования наверняка приведут к тому, что списки этих виромов будут расширены.
Организм человека — не менее сложная «экосистема» для вирусов, чем, скажем, океан или почва. Тут на популяции микробов и вирусов влияют pH, иммунные механизмы, вещества, вырабатываемые в процессе жизнедеятельности человека (например, гидролипидная мантия на коже, желчь в кишечнике), доступность воды, питательных веществ и кислорода. В целом макроорганизм, бактерии и вирусы составляют сложную систему и постоянно взаимодействуют друг с другом [61], [63].
Пищеварительный тракт
Пищеварительный тракт — самая густонаселенная вирусами (в основном фагами) система человеческого организма, и ее виром изучен лучше всего. Тут обнаруживают в среднем 109 вирусоподобных частиц на каждый грамм кишечного содержимого. Наиболее распространены хвостатые фаги порядка Caudovirales.
Виром кишечника начинает формироваться с самого рождения. У детей на первом месяце жизни отмечается низкое разнообразие бактерий, но высокое — фагов. К двум годам картина меняется на противоположную: разновидностей бактерий становится много, а фагов — мало (вирусные сообщества в природе намного сложнее). Другое интересное свойство кишечной популяции фагов — ее большая вариабельность. Состав вирусоподобных частиц, которые получают от разных людей, зачастую сильно различается. Одно исследование показало, что ребенок «наследует» от матери 65% микрофлоры и только 15% вирома — остальная часть формируется в зависимости от условий окружающей среды и индивидуальных особенностей организма [61], [63], [64].
В норме в кишечнике преобладают умеренные фаги, а при многих заболеваниях увеличивается число вирулентных, чаще запускаются литические циклы. Триггерами могут стать не только патологические процессы, но и некоторые лекарства. Например, известно, что к индукции профагов приводят препараты из группы фторхинолонов — норфлоксацин и ципрофлоксацин. Лизис бактерий не проходит бесследно: он приводит к изменению состава микрофлоры. Вообще, при многих кишечных заболеваниях меняется структура не только микробиома, но и вирома [64].
| Заболевание | Исследованный материал | Изменения в вироме |
|---|---|---|
| Болезнь Крона и язвенный колит | кал* | Увеличение содержания Caudovirales |
| Ранняя стадия болезни Крона и язвенного колита | биоптант кишечника | Увеличение содержания Hepadnaviridae и Hepeviridae; уменьшение — Polydnaviridae, Tymoviridae и Virgaviridae |
| Колоректальный рак (злокачественные опухоли толстой и прямой кишки) | кал | Увеличение вирусного разнообразия |
| Сахарный диабет 1 типа | кал | Снижение вирусного разнообразия |
| Артериальная гипертония | кал | Обнаружены данные в пользу связи между увеличением числа фагов Erwinia ΦEaH2, Lactococcus 1706 и развитием артериальной гипертонии |
| Целиакия (непереносимость глютена) | кал | Увеличение содержания энтеровирусов |
| * — Важно понимать, что анализ кала не позволяет в полной мере оценить структуру микрофлоры и вирома пищеварительного тракта. В данном случае речь идет о микроорганизмах и вирусах, которые удается выделить в кале, — а в кишечнике они могут быть на самом деле представлены в меньшинстве. | ||
Кожа
Микрофлора кожи отличается относительно низкой численностью. К тому же кожа — орган, который постоянно контактирует с окружающей средой и подвергается всевозможным воздействиям. Из-за этого ее виром исследовать сложно, а генетический материал трудно отличить от случайных загрязнений. Тем не менее некоторые исследования были проведены. Во время одного из них 95% обнаруженных генетических последовательностей не удалось отнести ни к одному известному вирусу. Среди идентифицированного материала значительная часть принадлежала хвостатым фагам [61], [65].
Недавно провели исследование, авторы которого нашли новое неожиданное применение вирому кожи. Оказалось, что популяция вирусов у каждого человека настолько индивидуальна, что ее потенциально можно использовать для идентификации личности, если собственная ДНК по каким-то причинам недоступна для исследования. Возможно, в будущем удастся поставить вирусы на службу криминалистике , [66].
О криминалистических биотехнологиях во всех подробностях читайте в нашем спецпроекте «Криминалистика».
Ротовая полость
Как и в любой части организма, разнообразие бактериофагов в ротовой полости определяется разнообразием прокариот, а оно, в свою очередь, зависит от особенностей питания, вредных привычек, гигиены. Ротовая полость сама по себе неоднородна, и в ней есть разные «экологические ниши» (см. спецпроект «Биомолекулы» «Биология, медицина и косметология ротовой полости»). Если говорить о вироме, то тут, как и везде, преобладают хвостатые бактериофаги. В слюне содержится примерно 108 вирусоподобных частиц на мл, в зубном налете — 107 на мг.
Исследования показывают, что только небольшая часть вирусов в ротовой полости одинакова для разных людей. При этом у одного и того же человека со временем вирусное сообщество остается более-менее стабильным. Несомненно, фаги влияют на формирование микрофлоры рта, и их состав меняется при разных заболеваниях. В здоровой ротовой полости много умеренных бактериофагов, а при воспалительных процессах происходит сдвиг в сторону вирулентных. Изучение вирома ротовой полости играет важную роль в понимании развития различных патологий и может открыть новые подходы к лечению [61], [67], [68].
Дыхательные пути
Виром дыхательных путей, особенно нижних, исследован недостаточно хорошо. Этому вопросу посвящено мало научных работ, и в основном их проводили у детей с острыми респираторными заболеваниями. Раньше считалось, что микрофлора есть только в верхних дыхательных путях, а легкие стерильны. Более современные исследования показывают, что это не так. В легких здоровых некурящих людей есть небольшие бактериальные сообщества. Присутствуют в дыхательной системе и вирусы. Некоторые из них способны вызывать заболевания, некоторые безвредны. Есть тут и хвостатые фаги. Они попадают в легкие в основном из ротовой полости и верхних дыхательных путей [61], [69], [70].
Кровь
Даже святая святых организма человека — кровь, наша внутренняя среда, совсем не стерильна. В ней можно обнаружить как вирусы, так и фаги. В кровеносные и лимфатические сосуды бактериофаги проникают благодаря своей способности преодолевать слизистые оболочки из легких, печени, почек, головного мозга и главного резервуара — кишечника [61].
У фагов есть несколько возможностей проникнуть в кровоток. Самый простой способ — через повреждения на слизистой оболочке. Бактериофаги могут путешествовать внутри бактериальных клеток — в таком случае прокариоты играют роль «троянского коня». Но прячутся в таком «коне» вовсе не враги. Последствия проникновения фагов в кровь до конца не понятны, но считается, что они приносят пользу: помогают расправляться с опасными патогенами и стимулируют работу иммунной системы. Могут фаги путешествовать и путем эндоцитоза: когда клетка «прогибает» внутрь свою мембрану, и из нее получается пузырек с вирусной частицей внутри.
В 2017 году американские и австралийские ученые опубликовали результаты исследования, которое показало, что фаги путешествуют через плотно контактирующие клетки слизистых оболочек с помощью трансцитоза, и этот путь, видимо, имеет большое значение. Получается быстро и направленно: фаг перемещается по клетке в апикально-базальном направлении, то есть от верхушки к условно нижней части, прикрепленной к базальной мембране. При этом трансцитоз осуществляется через аппарат Гольджи. Исследователи наблюдали этот процесс на примере фага T4 в искусственно выращенных in vitro («в пробирке») клетках кишечника, легких, печени, почек и эндотелия головного мозга (рис. 11) [71].
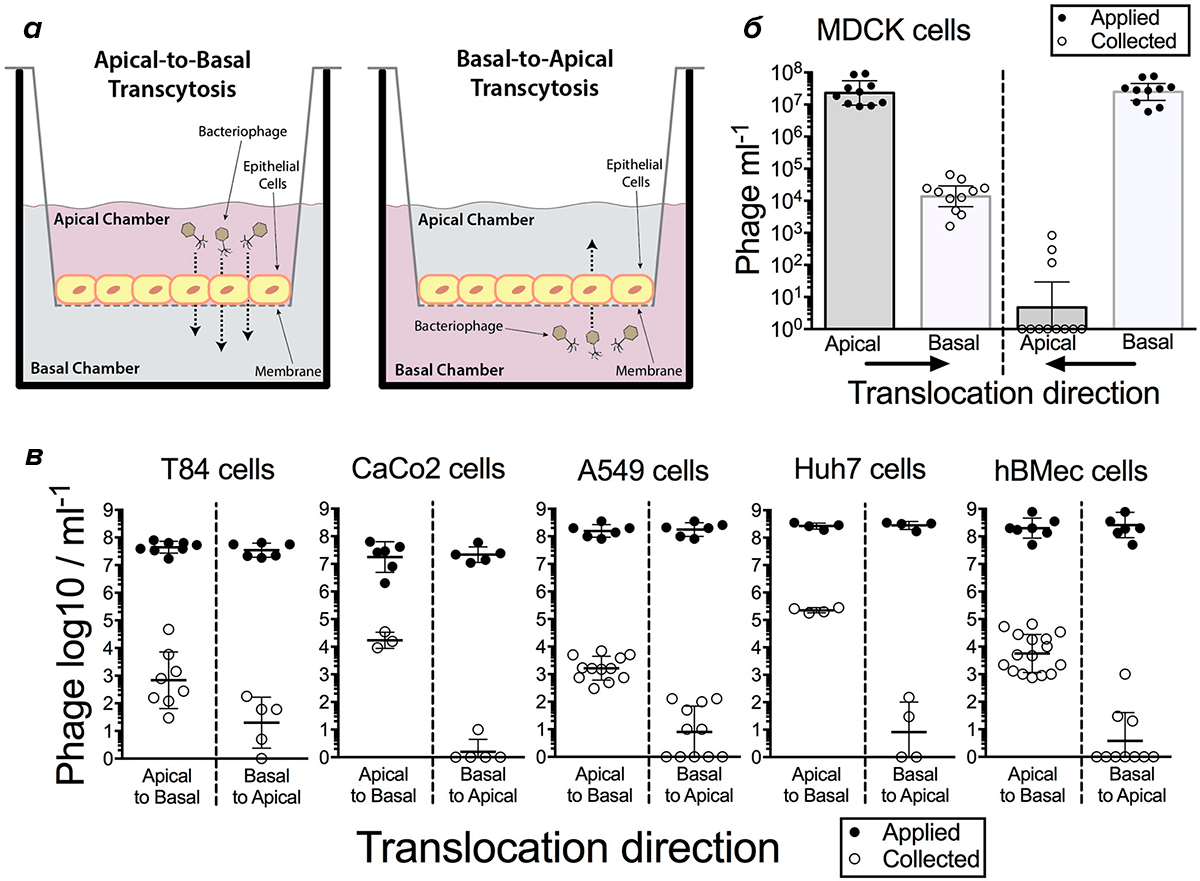
Рисунок 11. Трансцитоз бактериофага T4 через клеточные слои в лабораторных условиях. а — Клетки, над которыми находится апикальная камера, а внизу — базальная камера («снизу» — там, где клетка прикрепляется к базальной мембране). Фаги T4 вносили в каждую из этих камер, чтобы проследить направление транспорта. б — Трансцитоз бактериофагов в базально-апикальном и апикально-базальном направлении. в — Трансцитоз фагов через клетки T84 (эпителий толстой кишки), CaCo2 (эпителий толстой кишки), A549 (эпителий легких), Huh7 (клетки печень — гепатоциты) и hBNec (эндотелиальные клетки головного мозга). Черные кружки отражают число фагов, загруженных в одну из камер, белые кружки — число фагов, обнаруженных в противоположной камере, которым удалось пройти через клетку. Видно, что транспорт носит апикально-базальный характер.
По подсчетам авторов этого исследования, ежедневно через слизистую оболочку кишечника в кровоток человека должно проникать около 31 миллиарда фаговых частиц.
Современные исследования показывают, что фаги есть не только в крови, но и в других средах организма, которые классически считались стерильными. Это заставило ученых выдвинуть новую концепцию «внутреннего фагома», и она находит всё больше сторонников. Взаимодействия в треугольнике «фаги — бактерии — клетки человека» сложны и не до конца изучены. Причем, бактериофаги не всегда враги бактериям и друзья нам. Например, они могут становиться резервуаром генов устойчивости микроорганизмов к антибиотикам.
Кроме того, фаги — резервуар генетической «темной материи». Есть мнение, что эти неисследованные гены могут экспрессироваться не только в бактериальных, но и в эукариотических клетках. Для этого потенциального механизма есть множество ограничений: сильные различия между сайтами транскрипции млекопитающих и вирусов, системы рестрикции и фосфорилирования, особенности кодонов, распределение транспортной РНК. Но даже с учетом этих ограничений нельзя исключить определенного прямого влияния фаговой ДНК на клетки человека, обмен веществ, иммунитет, состояние здоровья и развитие заболеваний. Это интересная область для будущих исследований [72].
Мочеполовая система
В моче человека содержится 107 вирусоподобных частиц на миллилитр. В большинстве случаев это фаги, но есть и вирусы эукариот — исследования показывают, что более чем у 90% испытуемых обнаруживаются вирусы папилломы человека. В мазках из влагалища у здоровых женщин обнаруживается в основном фаговая ДНК, и только 4% приходится на генетический материал вирусов эукариот. Семенная жидкость у мужчин тоже не стерильна [61].
Нервная система
Нервная система надежно защищена от микроорганизмов — она отгородилась от сосудистого русла баррикадой в лице гематоэнцефалического барьера [73]. Он пропускает даже не все лекарственные препараты. Тем не менее в спинномозговой жидкости фаги тоже есть — 104 вирусоподобных частиц на миллилитр. Что они тут делают — еще предстоит изучить [61].
Подводя итог, можно только повторить то, о чем мы упоминали в начале этого обзора: фаги — очень значимый фактор, оказывающий влияние на всё живое на нашей планете. И ученые смогли обратить этот фактор в ценный ресурс, возможности которого до сих пор далеко не исчерпаны. Фаги нашли применение в науке, пищевой промышленности, медицине, ветеринарии. Об этом пойдет речь в следующих статьях нашего спецпроекта.
Литература
- 12 методов в картинках: микроскопия;
- А.В. Летаров. (2020). История ранних исследований бактериофагов и рождение основных концепций вирусологии. БМ. 85, 1189-1212;
- Летаров А.В. Современные концепции биологии бактериофагов. М.: ТД «ДеЛи», 2019;
- Ивановский Д. И. (1892) Мозаичная болезнь табака, Труды Варшавского университета, 6, 49-72;
- Его Величество паразит;
- Манипулирование. I. Паразитное манипулирование;
- Паразит паразиту враг;
- Martha R.J. Clokie, Andrew D. Millard, Andrey V. Letarov, Shaun Heaphy. (2011). Phages in nature. Bacteriophage. 1, 31-45;
- Markus G. Weinbauer. (2004). Ecology of prokaryotic viruses. FEMS Microbiol Rev. 28, 127-181;
- Hans-W. Ackermann, Hans-W. Ackermann. (2011). The first phage electron micrographs. Bacteriophage. 1, 225-227;
- Пожиратели бактерий: убийцы в роли спасителей;
- Модельные организмы: фаг лямбда;
- Edel Stone, Katrina Campbell, Irene Grant, Olivia McAuliffe. (2019). Understanding and Exploiting Phage–Host Interactions. Viruses. 11, 567;
- Катер Э. и Сулаквелидзе А. Бактериофаги. Биология и практическое применение. М.: «Научный мир», 2012;
- Wessner D.R. (2010). The origins of viruses. Nature Education. 3(9): 37;
- Karin Moelling, Felix Broecker. (2021). Viroids and the Origin of Life. IJMS. 22, 3476;
- РНК у истоков жизни?;
- РНК: начало (мир РНК);
- Reyad A. Elbarbary, Bronwyn A. Lucas, Lynne E. Maquat. (2016). Retrotransposons as regulators of gene expression. Science. 351;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Маленький, да удаленький: самые маленькие клетки;
- James A. Kraemer, Marcella L. Erb, Christopher A. Waddling, Elizabeth A. Montabana, Elena A. Zehr, et. al.. (2012). A Phage Tubulin Assembles Dynamic Filaments by an Atypical Mechanism to Center Viral DNA within the Host Cell. Cell. 149, 1488-1499;
- Yana A. Danilova, Viktoriia V. Belousova, Andrey V. Moiseenko, Innokentii E. Vishnyakov, Maria V. Yakunina, Olga S. Sokolova. (2020). Maturation of Pseudo-Nucleus Compartment in P. aeruginosa, Infected with Giant phiKZ Phage. Viruses. 12, 1197;
- «Я в домике!»: бактериофаги, у которых есть ядра;
- Гиганты вирусного мира;
- Allan Campbell. (2003). The future of bacteriophage biology. Nat Rev Genet. 4, 471-477;
- Вирусные геномы в системе эволюции;
- Graham F Hatfull, Roger W Hendrix. (2011). Bacteriophages and their genomes. Current Opinion in Virology. 1, 298-303;
- Graham F Hatfull. (2008). Bacteriophage genomics. Current Opinion in Microbiology. 11, 447-453;
- David Botstein. (1980). A THEORY OF MODULAR EVOLUTION FOR BACTERIOPHAGES. Ann NY Acad Sci. 354, 484-491;
- Bethany N. Kent, Lisa J. Funkhouser, Shefali Setia, Seth R. Bordenstein. (2011). Evolutionary Genomics of a Temperate Bacteriophage in an Obligate Intracellular Bacteria (Wolbachia). PLoS ONE. 6, e24984;
- Adrián Cazares, Guillermo Mendoza-Hernández, Gabriel Guarneros. (2014). Core and accessory genome architecture in a group of Pseudomonas aeruginosa Mu-like phages. BMC Genomics. 15;
- Bacteria-infecting viruses. The lytic and lysogenic cycles. Khan Academy;
- Tomasz Olszak, Agnieszka Latka, Bartosz Roszniowski, Miguel A. Valvano, Zuzanna Drulis-Kawa. (2017). Phage Life Cycles Behind Bacterial Biodiversity. CMC. 24;
- 10.23750/abm.v91i13-S.10819;
- Rasmus Skytte Eriksen, Namiko Mitarai, Kim Sneppen. (2020). Sustainability of spatially distributed bacteria-phage systems. Sci Rep. 10;
- Korytowski D.A. and Smith H.L. (2016). Permanence and Stability of a Kill the Winner Model in Marine Ecology. Cornell University;
- Schwink S. (2018). Virus-bacteria coevolution solves diversity paradox by 'Killing the Winner'. Illinois IGB;
- Sergei Maslov, Kim Sneppen. (2017). Population cycles and species diversity in dynamic Kill-the-Winner model of microbial ecosystems. Sci Rep. 7;
- Nana Yaw D Ankrah, Amanda L May, Jesse L Middleton, Daniel R Jones, Mary K Hadden, et. al.. (2014). Phage infection of an environmentally relevant marine bacterium alters host metabolism and lysate composition. ISME J. 8, 1089-1100;
- О, этот благодатный дождь из бактерий!;
- Simon J. Labrie, Julie E. Samson, Sylvain Moineau. (2010). Bacteriophage resistance mechanisms. Nat Rev Microbiol. 8, 317-327;
- Andjela Rodic, Bojana Blagojevic, Evgeny Zdobnov, Magdalena Djordjevic, Marko Djordjevic. (2017). Understanding key features of bacterial restriction-modification systems through quantitative modeling. BMC Syst Biol. 11, 1-15;
- Furuta Y. and Kobayashi I. Restriction-modification systems as mobile epigenetic elements. Austin (TX): Landes Bioscience, 2000-2013;
- Северинов К. (2016). Редактирование генома с CRISPR/Cas9. «Постнаука»;
- Frank Hille, Emmanuelle Charpentier. (2016). CRISPR-Cas: biology, mechanisms and relevance. Phil. Trans. R. Soc. B. 371, 20150496;
- Просто о сложном: CRISPR/Cas;
- Противофаговая линия Мажино в клетках прокариот: новые открытия;
- «Бактериофаг-1 Бактериофагу-2, приём!»;
- Белок Ocr — швейцарский нож бактериофага T7;
- Фаги-оруженосцы на службе у бактерий;
- Harald Brüssow, Carlos Canchaya, Wolf-Dietrich Hardt. (2004). Phages and the Evolution of Bacterial Pathogens: from Genomic Rearrangements to Lysogenic Conversion. Microbiol Mol Biol Rev. 68, 560-602;
- John W. Little. (2014). Lysogeny, Prophage Induction, and Lysogenic Conversion. Phages. 37-54;
- Malignant transformation. Britannica;
- Дифтерия: больная бактерия, способная убивать;
- Christine L. Schneider. (2017). Bacteriophage-Mediated Horizontal Gene Transfer: Transduction. Bacteriophages. 1-42;
- Yin Ning Chiang, José R. Penadés, John Chen. (2019). Genetic transduction by phages and chromosomal islands: The new and noncanonical. PLoS Pathog. 15, e1007878;
- Dana K Howe, Dee R Denver. (2008). Muller's Ratchet and compensatory mutation in Caenorhabditis briggsae mitochondrial genome evolution. BMC Evol Biol. 8, 62;
- Sam Behjati, Patrick S Tarpey. (2013). What is next generation sequencing?. Arch Dis Child Educ Pract Ed. 98, 236-238;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Guanxiang Liang, Frederic D. Bushman. (2021). The human virome: assembly, composition and host interactions. Nat Rev Microbiol. 19, 514-527;
- Ryuichi Kumata, Jumpei Ito, Kenta Takahashi, Tadaki Suzuki, Kei Sato. (2020). A tissue level atlas of the healthy human virome. BMC Biol. 18;
- Emma Guerin, Colin Hill. (2020). Shining Light on Human Gut Bacteriophages. Front. Cell. Infect. Microbiol.. 10;
- Marzanna Łusiak-Szelachowska, Beata Weber-Dąbrowska, Ewa Jończyk-Matysiak, Renata Wojciechowska, Andrzej Górski. (2017). Bacteriophages in the gastrointestinal tract and their implications. Gut Pathog. 9;
- Geoffrey D. Hannigan, Jacquelyn S. Meisel, Amanda S. Tyldsley, Qi Zheng, Brendan P. Hodkinson, et. al.. (2015). The Human Skin Double-Stranded DNA Virome: Topographical and Temporal Diversity, Genetic Enrichment, and Dynamic Associations with the Host Microbiome. mBio. 6;
- Ema H. Graham, Jennifer L. Clarke, Samodha C. Fernando, Joshua R. Herr, Michael S. Adamowicz. (2022). The application of the skin virome for human identification. Forensic Science International: Genetics. 57, 102662;
- April Martínez, Ryutaro Kuraji, Yvonne L. Kapila. (2021). The human oral virome: Shedding light on the dark matter. Periodontol 2000. 87, 282-298;
- Vicente Pérez-Brocal, Andrés Moya. (2018). The analysis of the oral DNA virome reveals which viruses are widespread and rare among healthy young adults in Valencia (Spain). PLoS ONE. 13, e0191867;
- Kristine M. Wylie. (2017). The Virome of the Human Respiratory Tract. Clinics in Chest Medicine. 38, 11-19;
- Raquel Nazareth, Maria-Jesus Chasqueira, Maria-Lúcia Rodrigues, Carolina Paulino, Catarina Conceição, et. al.. (2020). Respiratory viruses in mechanically ventilated patients: a pilot study. BMC Pulm Med. 20;
- Sophie Nguyen, Kristi Baker, Benjamin S. Padman, Ruzeen Patwa, Rhys A. Dunstan, et. al.. (2017). Bacteriophage Transcytosis Provides a Mechanism To Cross Epithelial Cell Layers. mBio. 8;
- Jeremy J. Barr. (2017). A bacteriophages journey through the human body. Immunol Rev. 279, 106-122;
- Blood-brain barrier. Связующее между двумя мирами — кровеносной и центральной нервной системами;
- N. Vander Elst, E. Meyer. (2018). Potential therapeutic application of bacteriophages and phage-derived endolysins as alternative treatment of bovine mastitis. VDT. 87, 181-187.