От медицинской онкологии к молекулярной биологии рака
22 февраля 2024
От медицинской онкологии к молекулярной биологии рака
- 710
- 0
- 7
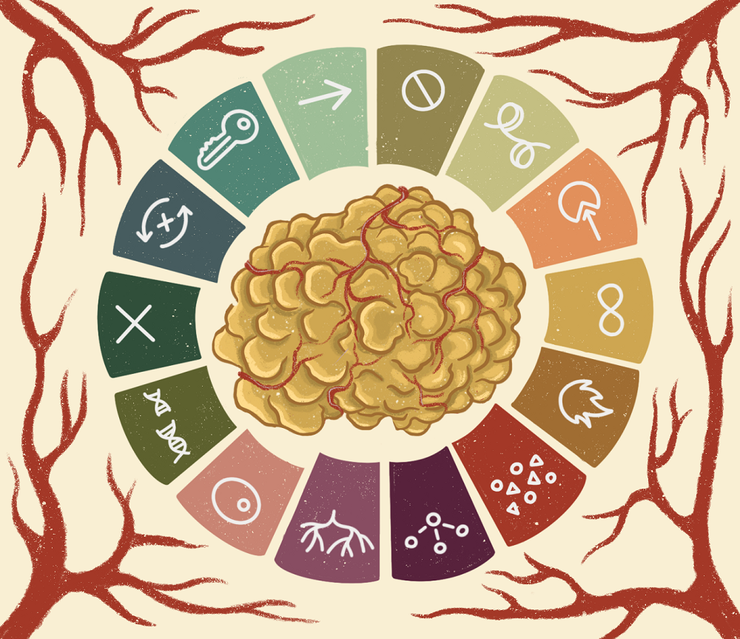
Концепция ключевых признаков рака hallmarks of cancer, отображенная на этом рисунке набором пиктограмм, — наш проводник в мире биологии рака.
Рисунок в оригинальном разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Иллюстратор
Хотя злокачественные опухоли известны человечеству, вероятно, с самого момента появления нашего вида, природа этой группы заболеваний стала понятна только во второй половине 20-го века, когда на стыке онкологии и молекулярной биологии возникла новая область знания — молекулярная онкология. В вводной статье нашего спецпроекта «Онкология» мы рассмотрим основные этапы развития этой науки и дадим краткое описание ключевых признаков рака (hallmarks of cancer), которые отличают злокачественные опухоли от здоровых тканей на молекулярном и клеточном уровне и объясняют основные симптомы рака: способность к безудержному росту, устойчивость к лечению и высокую вероятность рецидива удаленной опухоли, а также распространение по организму (метастазирование).
Онкология

Онкология — одно из самых динамично развивающихся направлений биомедицинских исследований. С одной стороны медицинское и практическое значение этой темы обеспечивает ей интерес общества и обширное финансирование; с другой — изучение раковой клетки и эволюции опухолей проливает свет на самые фундаментальные вопросы биологии, что делает данный спецпроект интересным для биологов самых разных специальностей.
Редактор спецпроекта — Мария Кондратова, к.б.н специалист в области молекулярной биологии рака и онкоиммунологии, автор научно-популярных книг «Кривое зеркало жизни» и «Невидимый страж», которые мы горячо рекомендуем всем интересующимся молекулярной онкологией и иммунологией.
Партнер спецпроекта — компания «ПраймБиоМед», занимающаяся разработкой и изготовлением антител и реагентов для иммуногистохимии. В портфеле компании — более 30 наименований антител для диагностики социально значимых заболеваний: рака молочной железы, легкого, простаты и микросателлитной нестабильности, а также системы детекции для иммуногистохимии, вспомогательные реагенты, буферные растворы для промывки и демаскировки собственного производства.
Злокачественное перерождение тканей, которое в разговорной речи мы называем обобщающим термином «рак», описывает группу заболеваний с таким набором симптомов: стремительное разрастание переродившейся ткани, высокая вероятность рецидива (возобновления патологического разрастания после удаления первичного очага), способность приобретать устойчивость к медикаментозному лечению и склонность к распространению по организму (метастазирование). Злокачественное перерождение может затрагивать плотные ткани — тогда мы говорим об опухолях. Однако случается, что такое перерождение затрагивает клетки костного мозга, отвечающие за формирование клеток крови и иммунной системы. Для этой группы заболеваний часто используют неточный, но прижившийся термин «рак крови» — здесь характерным признаком будет не столько местное разрастание тканей, сколько патологическое изменение состава крови, отраженное в старинном названии «белокровие», когда кровеносное русло заполняется незрелыми лейкоцитами.
Существует распространенное поверье, что рак — это сугубо современная «болезнь цивилизации». Оно ошибочно. Как мы увидим, злокачественные перерождения тканей в том или ином виде встречаются практически у всех многоклеточных организмов (возможно, это неизбежная плата за многоклеточность). Наш вид не является исключением из правила — раковые опухоли встречаются у самых разных млекопитающих.
В нашем новом спецпроекте «Онкология» мы планируем дать срез современных научных представлений о биологической природе и молекулярных механизмах рака, а также рассказать о современных методах диагностики и лечения онкологических заболеваний. «Биомолекула» опубликовала уже множество разрозненных статей о самых разных аспектах рака; настало время «собрать камни» и сделать обобщающий проект об этом важнейшем разделе современной биомедицинской науки, история которого, как зеркало, отражает развитие всей молекулярной биологии (рис. 1).
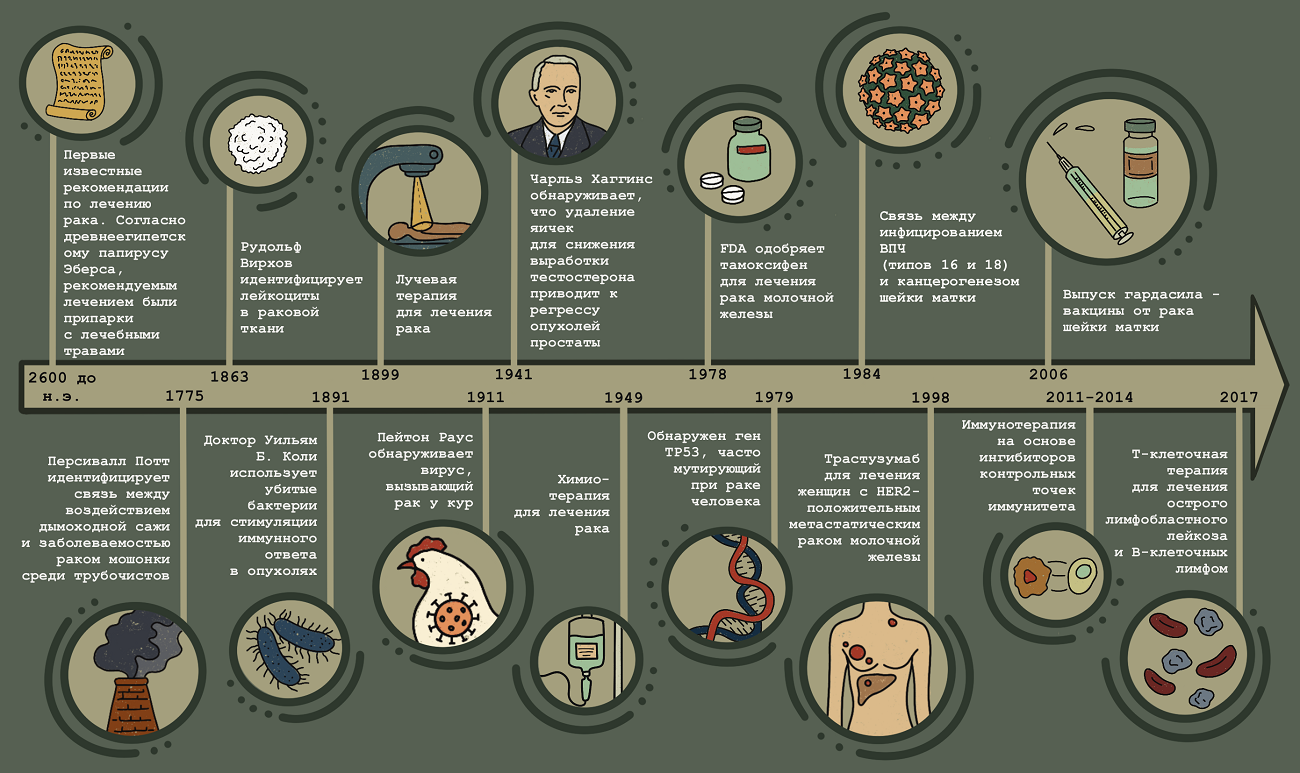
Рисунок 1. Основные вехи в исследовании и лечении рака.
2600 г. до н.э.: Первые известные рекомендации по лечению рака. Согласно древнеегипетскому папирусу Эберса, рекомендуемым лечением опухолей были припарки с лечебными травами, которые накладывались на кожу для облегчения болезненности и воспаления.
1775: Персивалл Потт идентифицирует связь между воздействием дымоходной сажи и заболеваемостью раком мошонки среди трубочистов. Это первое исследование, показавшее связь между воздействием окружающей среды и развитием рака.
1863: Рудольф Вирхов находит лейкоциты в раковой ткани, тем самым впервые установив связь между воспалением и раком.
1899: Первое использование лучевой терапии для лечения рака.
1891: Доктор Уильям Б. Коли использует убитые бактерии, называемые «токсинами Коли», для стимуляции иммунного ответа в опухолях.
1911: Пейтон Раус обнаруживает вирус, вызывающий рак у кур (вирус саркомы Рауса), устанавливая, что некоторые виды рака вызываются инфекционными агентами.
1941: Чарльз Хаггинс обнаруживает, что удаление яичек для снижения выработки тестостерона или введение эстрогенов приводит к регрессу опухолей простаты. Такие гормональные манипуляции, более известные как гормональная терапия, продолжают оставаться основой лечения рака простаты.
1949: В США одобрено использование первой химиотерапии (мехлорэтамина) для лечения рака.
1978: FDA одобряет тамоксифен — антиэстрогенный препарат, первоначально разработанный как противозачаточное средство, — для лечения рака молочной железы.
1979: Обнаружен ген TP53 (также называемый p53), наиболее часто мутирующий ген при раке человека.
1984: ДНК вируса папилломы человека (ВПЧ) типов 16 и 18 выявляется в большом проценте случаев рака шейки матки, что устанавливает связь между инфицированием этими типами ВПЧ и канцерогенезом шейки матки.
1998: Трастузумаб — моноклональное антитело, нацеленное на раковые клетки, сверхэкспрессирующие ген HER2, для лечения женщин с HER2-положительным метастатическим раком молочной железы [1].
2006: Гардасил — вакцина от ВПЧ, защищающая от заражения двумя типами вируса (ВПЧ 16 и 18), которые вызывают примерно 70% всех случаев рака шейки матки, и двумя дополнительными типами ВПЧ (ВПЧ 6 и 11), которые вызывают 90% остроконечных кондилом [2].
2011–2014: Иммунотерапия на основе ингибиторов контрольных точек иммунитета [3].
2017: Т-клеточная терапия с использованием химерных антигенных рецепторов (CAR) одобрена для лечения острого лимфобластного лейкоза и В-клеточных лимфом [4].
иллюстрация Анастасии Самоукиной
Краткая история рака как медицинской проблемы от древних папирусов до наших дней
Проблема злокачественного перерождения клеток уходит своими корнями в прошлое по меньшей мере на сотни миллионов, а возможно, и на два миллиарда лет. Именно таков возраст Франсвильской биоты — червеобразных организмов длиной до 12 см, которые были обнаружены в 2010 году в отложениях формации Francevillian в Габоне и на сегодняшний день считаются древнейшими многоклеточными. Мы не знаем, болели ли франсвильские «черви» раком, но теоретически — как только появляется многоклеточность, построенная на согласованном подчинении всех клеток организма единому плану и порядку, так сразу же возникает возможность «клеточного бунта» против этого плана и порядка — а это и есть «злокачественное перерождение».
Вопреки распространенному мнению, онкологические заболевания распространены не только у млекопитающих, и даже не только у позвоночных. Рак обнаруживается у всех более-менее долгоживущих многоклеточных: им болеют пресмыкающиеся (включая динозавров), рыбы, моллюски. Как показали исследования последних десятилетий, даже клетки такого примитивного многоклеточного животного, как гидра, способны к злокачественному перерождению (рис. 2) [5], [6].
Это открытие позволяет поставить знак равенства между понятиями «многоклеточное животное» и «подверженное раку»; впрочем, свои злокачественные опухоли есть и у растений — например, так называемые корончатые галлы (рис. 2В), возникающие под влиянием бактерий Agrobacterium tumefaciens. Просто в силу особенностей физиологии представителей «зеленого царства» эти перерождения для них не так опасны, как опасны злокачественные опухоли для животных.
Что касается человека, то нет сомнения, что злокачественные опухоли были с нашим видом с самого его возникновения. Характерные повреждения костей, наводящие на мысль о саркомах, встречаются в древнейших захоронениях (рис. 2Г), а медицинские трактаты древних цивилизаций содержат детальное описание разных опухолей и рекомендаций по их лечению — хирургическое удаление и прижигание.
Еще древние медики заметили основные характеристики злокачественных опухолей — быстрый рост, способность распространяться по организму (метастазирование) и высокую вероятность возобновления новой опухоли на месте удаленной. Следующие тысячи лет развития медицины вплоть до начала 20-го века почти ничего не добавили к этому знанию. Совершенствовались инструменты и методы проведения операций, но понимание природы болезни почти не прогрессировало. Появление анестезии и введение стандартов дезинфекции уменьшило смертность пациентов в результате хирургического вмешательства, однако статистика излечений оставалась неутешительной. Скажем, около половины пациенток, прооперированных по поводу рака молочной железы, умирало в следующие годы от рецидива болезни [7].
На фоне грандиозных успехов инфекционной медицины, которая в 19 веке смогла объяснить множество недугов и наметить пути к их преодолению, прогресс медицинской онкологии выглядел обескураживающе медленным.

Автор этой статьи и редактор всего спецпроекта — Мария Кондратова, к.б.н., специалист в области молекулярной биологии рака и онкоиммунологии, автор научно-популярных книг «Кривое зеркало жизни» [8] и «Невидимый страж» [9], которые мы горячо рекомендуем всем интересующимся молекулярной онкологией и иммунологией.
Впрочем, с 17-го по 19-й век все-таки было сделано несколько важных наблюдений. Во-первых, было показано, что по крайней мере некоторые опухоли образуются от соприкосновения с определенными веществами (канцерогенами), и начата борьба за то, чтобы сделать человеческую среду более безопасной (профилактическая онкология). Одним из примеров этой борьбы является истории борьбы английского врача Персивалла Потта с раком трубочистов.
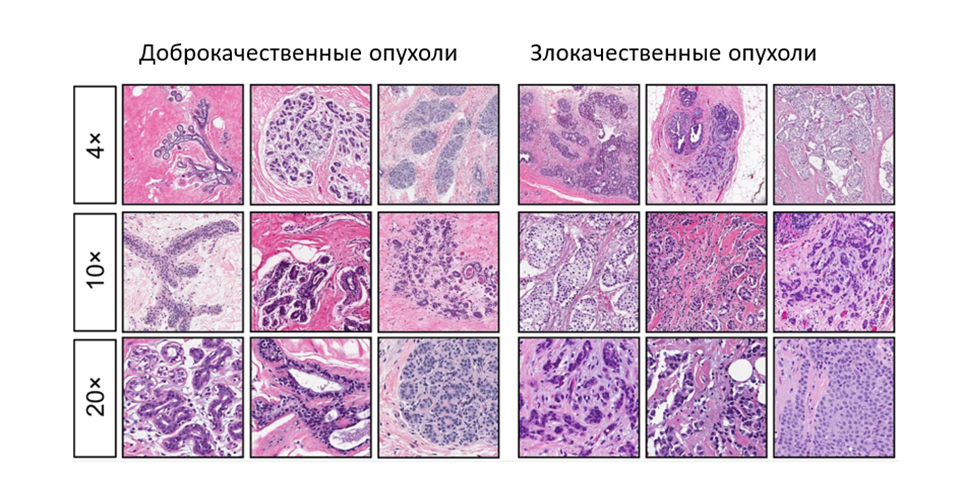
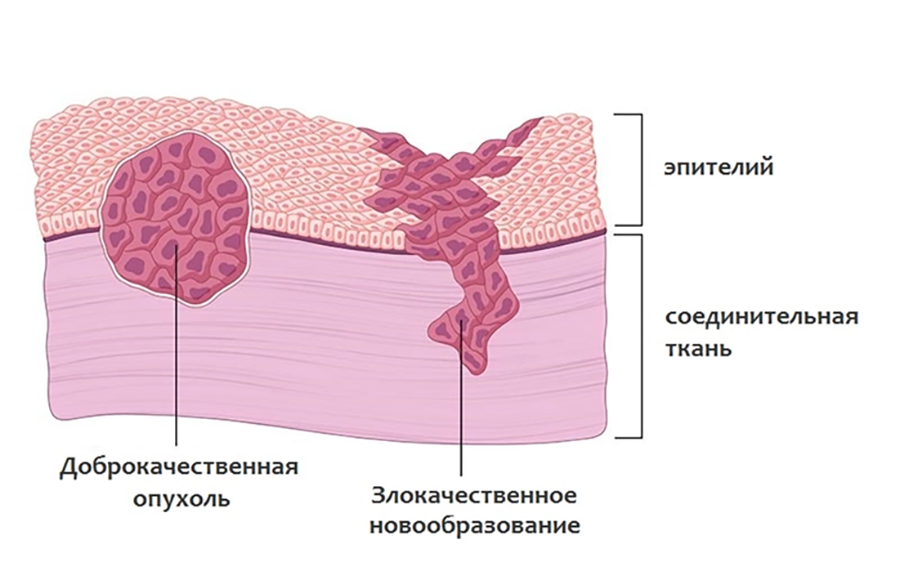
Во-вторых, медиками было отмечено, что инфицирование раны после удаления опухоли уменьшает риск ее рецидива (это наблюдение позже стало отправной точкой для развития методов иммунотерапии рака) [10]. Ну и, наконец, развитие инструментальных методов позволило описать разницу в строении доброкачественных (не склонных к метастазированию) и злокачественных опухолей. Цитологический анализ (рис. 3) стал основным методом диагностики злокачественных образований, который применяется и поныне, ну а ключевые отличия двух типов новообразований суммированы в таблице 1.
| Признак | Доброкачественная опухоль | Злокачественная опухоль |
|---|---|---|
| Скорость роста | Обычно низкая | Часто высокая (однако бывают и медленно растущие опухоли) |
| Взаимодействие с окружающими тканям | Опухоль растет в капсуле, раздвигая окружающие ткани | Новообразование прорастает в окружающие ткани |
| Поверхность | Как правило, ровная, гладкая | Бугристая |
| Границы | Четкие границы новообразования | У опухоли нет четких границ |
| Строение клеток | Клетки опухоли внешне и функционально схожи со здоровыми | Клетки значительно отличаются от нормальных, выглядят незрелыми (низкодифференцированными) |
| Метастазирование | Нет | Опухоли дают метастазы в регионарные лимфоузлы и отдаленные органы |
| Вероятность рецидива | Низкая | Высокая |
| Прогноз | Благоприятный прогноз, даже если опухоль достигла значительных размеров | Благоприятный прогноз на ранних стадиях болезни, но при поздней диагностике шансы на полное излечение заметно снижаются |
Другое дело, что в отсутствие иных методов лечения, кроме хирургического, прогресс диагностики первоначально мало что менял для пациентов. Настоящий прорыв в понимании механизмов ракового перерождения произошел только в 20 веке. Именно в это время на пересечении онкологии и молекулярной биологии родилась новая наука — молекулярная онкология, — благодаря достижениям которой во второй половине 20-го века был достигнут целый ряд прорывов в диагностике и лечении злокачественных опухолей. Однако для того, чтобы оценить достижения этой науки, давайте прежде зададимся вопросом: что же именно делает онкологические заболевания таким сложным явлением? В чем заключается «проблема рака»?
Темная тайна рака
Почему рак так тяжело сложно диагностировать на ранних стадиях? Почему онкологические заболевания сложно вылечить? Детальные ответы на эти вопросы мы будем искать в последующих статьях цикла, но общий контур проблемы желательно обозначить сразу [11].
И диагностика, и медикаментозное лечение фокусируются на различиях. Чтобы поставить диагноз, необходимо определить разницу между «здоровьем» и «болезнью». Легче всего диагностируются болезни, имеющие яркие однозначные симптомы — сопли при ОРВИ или острую боль при инфаркте миокарда сложно не заметить. Тяжелее всего диагностировать болезни, которые на ранних стадиях протекают скрыто, не давая видимых симптомов или давая столь слабые и «смазанные» симптомы, что их легко объяснить множеством разных причин. Именно к таким болезням относятся онкологические заболевания, но не только они: скажем, заражение вирусом иммунодефицита человека (ВИЧ) тоже невозможно установить без специальных тестов, пока болезнь не примет острый угрожающий жизни характер (СПИД) [12]. Именно факт, что между заражением и первыми клиническими признаками СПИДа, как правило, проходит несколько лет, определил стремительное распространение ВИЧ в человеческой популяции.
Так же, как и ВИЧ, большинство злокачественных опухолей обнаруживает себя «видимым образом» лишь на достаточно поздних стадиях. Создание же молекулярных тестов на опухоли, аналогичных тем, что помогают определить вирус иммунодефицита, сильно затрудняется тем, что рак — это болезнь, в некотором смысле «не имеющая собственного лица». Раковые клетки на молекулярном уровне очень похожи на обычные здоровые клетки нашего организма. Вирус или бактерия — это «Чужие» внутри нас: об их присутствии сообщают десятки и сотни молекул, отличающихся от человеческих, так что их легко засечь современными тестами. Однако различия между здоровой и раковой клетками совсем не так зримы — несколько мутаций (причем разных в разных формах рака), чуть повышенный уровень одних белков, чуть сниженный — других, сдвиг метаболизма... Методы ранней диагностики рака — это в буквальном смысле слова «поиск иголки в стоге сена», однако, несмотря на невероятную сложность задачи, определенный прогресс тут есть. В настоящее время акцент в клинической диагностике делается на использование комбинаций маркеров, что позволяет повысить надежность анализа. В частности, в РФ существует ряд сообществ, вроде Российского общества клинической онкологии (RUSSCO), которые занимаются разработкой протоколов диагностики. На каждую нозологию (разновидность рака) выделяют ряд маркеров и методов их оценки, по результатам которой и ставят диагноз.
В эту же ключевую проблему сходства между раковыми клетками и нормальными упирается сложность лечения онкологических заболеваний. Если думать об опухоли как о своеобразном паразите, легко понять, что проблема избавления от рака (как проблема лечения любого паразитического заболевания) упирается в поиск средств, которые убьют паразита, но не хозяина. Например, антибиотики атакуют белки, которые есть у бактерий, но не у человека; а антигельминтные препараты используют особенности физиологии червей. Однако черви и тем более бактерии в эволюционном плане отстоят от человека очень далеко (на эволюционном древе их разделяют миллионы и даже миллиарды лет), так что обнаружить различия между ними и нами и разработать препараты, которые уничтожат паразита, но будут относительно безвредны для человека, сравнительно легко.
И напротив: сходство опухолевых и здоровых клеток делает подобную задачу крайне сложной. В результате почти все антираковые препараты обладают огромным числом нежелательных побочных эффектов, которые мы едва ли потерпели бы в случае любой другой группы лекарств. Однако постепенно и здесь ситуация понемногу улучшается — по мере того, как мы начинаем лучше понимать молекулярные нюансы, определяющие поведение раковых клеток. Если первые поколения химиотерапии — это была «пальба из пушек по воробьям», повреждающая и злокачественные, и здоровые клетки; то современные «таргетные препараты» — это уже прицельная «снайперская стрельба» именно по раковым клеткам с куда меньшим числом нежелательных побочных эффектов, хотя, конечно, любое лечение злокачественных опухолей — это не сахар.
Следующий раздел будет посвящен анализу основных различий между нормальными и раковыми клетками на молекулярном уровне, на которых основываются современные методы диагностики и лечения злокачественных опухолей.
Ключевые признаки рака
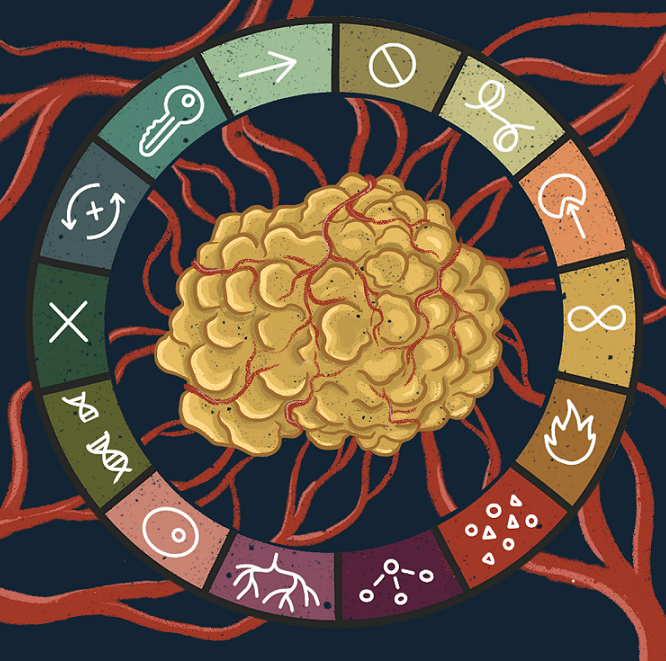
Молекулярная биология рака сегодня — это огромная территория научного знания, и чтобы не заблудиться в ней, нам понадобится карта. Опорная схема, которая позволяет собрать воедино самые разные аспекты жизнедеятельности раковых клеток и злокачественных опухолей. К счастью, нам не придется изобретать велосипед: эта схема уже существует. Это концепция «ключевых признаков рака». Впервые она была сформулирована выдающимися учеными Дугласом Ханааном и Робертом Вайнбергом еще в 2000 году, но с тех пор уже не раз обновлялась. Эволюция концепции «ключевых признаков» наглядно отражает прогресс молекулярной онкологии за последние 30 лет, так что мы рассмотрим ее именно в исторической перспективе, двигаясь от «старых» признаков к «новым» — а для начала все их просуммируем в табл. 2.
| Признак | Краткое описание |
|---|---|
| Независимость от внешних сигналов к росту и делению (самодостаточность) — self-sufficiency in growth signals | Здоровые клетки получают сигналы для роста и деления от окружающих тканей, раковые — сами производят всевозможные ростовые факторы и рецепторы к ним и делятся с огромной скоростью |
| Нечувствительность к сигналам, препятствующим росту и делению — insensitivity to anti-growth signals | В норме любой процесс в организме контролируется набором сигналов противоположного действия — по такому же принципу устроено, скажем, управление автомобилем, в котором кроме педали «газ» имеется еще и педаль «тормоз». Раковые клетки утрачивают чувствительность к сигналам, тормозящим деление. Этот механизм также вносит вклад в ускоренный рост злокачественных опухолей |
| Уклонение от апоптоза — evading apoptosis | Регулируемая клеточная гибель — апоптоз [14] — это естественный механизм «самоочищения» организма от старых и дефектных клеток, обеспечивающий «контроль качества» и препятствующий накоплению мутаций. У раковых клеток апоптоз поломан, и клетки с множеством мутаций не только выживают, но и продолжают делиться. Этот ключевой признак обеспечивает быструю эволюцию опухолей |
| Безграничная способность клеток к делению — limitless replicative potential | Зрелые клетки человеческого организма способны делиться лишь ограниченное число раз (предел Хейфлика), а раковые делятся безгранично. Этот ключевой признак связан с фенотипической пластичностью раковых клеток, которые по многим параметрам больше похожи на эмбриональные, незрелые ткани |
| Устойчивый ангиогенез — sustained angiogenesis | Стремительный рост опухоли поддерживается быстрым ростом сосудов, снабжающих ее кислородом и питательными веществами. Ангиогенез также вносит свой вклад в распространение клеток опухоли по организму |
| Способность к инвазии и метастазированию — tissue invasion and metastasis | В отличие от доброкачественных опухолей, раковые прорастают в окружающие ткани (инвазия) и распространяются по организму с током лимфы и крови (метастазирование). Это — самое опасное свойство злокачественных опухолей, так как метастазы в костях и головном мозге практически не поддаются лечению |
| Нарушения регуляции метаболизма — deregulated metabolism | Чтобы обеспечить стремительный рост и частое деление опухолевых клеток, им приходится перестраивать свой обмен веществ |
| Геномная нестабильность — genome instability | За счет нарушений механизмов репарации ДНК и апоптоза злокачественные клетки приобретают способность накапливать всё новые и новые мутации |
| Избегание иммунного ответа — evading the immune system | Раковые клетки синтезируют множество разнообразных молекул, подавляющих иммунный ответ. Предполагается, что эта способность приобретается опухолевыми клетками в результате их эволюции под действием естественного отбора |
| Воспаление — inflammation | Хроническое воспаление является одним из факторов риска возникновения злокачественной опухоли. В свою очередь, опухоль сама производит вещества, запускающие эту реакцию |
| Фенотипическая пластичность — unlocking phenotypic plasticity | Раковые клетки похожи на стволовые и эмбриональные клетки своей высокой пластичностью — способностью «на ходу» перестраиваться и менять свойства, которую большинство здоровых зрелых клеток утрачивают |
| Эпигенетическое перепрограммирование клеток — nonmutational epigenetic reprogramming | Эпигенетические механизмы регуляции генной активности вносят свой вклад в разнообразие раковых клеток |
| Полиморфная микробиота — polymorphic microbiomes | Микробиом — совокупность бактерий, вирусов и других микроорганизмов — оказывает большое влияние на появление и развитие злокачественных опухолей (особенно в пищеварительной системе) и влияет на эффективность химиотерапии |
| Сенесцентные клетки — senescent cells | Сенесцентные клетки, утратившие способность к делению, производят факторы роста и факторы воспаления, благоприятствующие росту опухолей |
Ключевые признаки рака в 2000 году
Молекулярная биология рака началась с попыток найти молекулярные механизмы злокачественного перерождения уже известных из клинических наблюдений и цитологического анализа злокачественных опухолей. Это отражает первая редакция ключевых признаков рака 2000 года [15], которые пытаются объяснить две отличительные черты злокачественных опухолей — способность к (почти) безграничному росту и метастазированию. Введение этой новой категории — «ключевые признаки» — было необходимо, так как к тому времени стало ясно, что один и тот же клинический симптом — например, патологическое разрастание ткани — может иметь разные молекулярные механизмы в разных опухолях. Таким образом, один «ключевой признак» может вносить свой вклад сразу в несколько симптомов, а один и тот же симптом может иметь несколько разных молекулярных причин.
Примером первого (один механизм — несколько симптомов) является усиленный рост сосудов (ангиогенез): он вносит свой вклад как в бесконтрольный рост опухоли, так и в ее распространение по организму.
Примером второго (несколько механизмов — один симптом) являются оставшиеся четыре ключевых признака — нечувствительность к сигналам, препятствующим росту и делению; независимость от внешних сигналов к росту [16]; уклонение от апоптоза [17] (запрограммированной клеточной гибели [14]); и безграничная способность к делению индивидуальных раковых клеток. При этом в одних опухолях (например, HER2+ рак молочной железы) преобладает первый механизм («нечувствительность к сигналам, препятствующих росту и делению»), а в других (опухоли с мутациями в р53) — нарушение апоптоза. Это разнообразие молекулярных механизмов, дающих сходный симптом (или точнее — фенотип), является одной из причин, по которым едва ли возможно существование «волшебной таблетки», излечивающей сразу все типы рака.
Основными практическими достижениями первого этапа развития молекулярной онкологии стала разработка таргетной терапии против HER2+ рака молочной железы и прояснение молекулярных механизмов гормональной чувствительности некоторых разновидностей рака [18]. Эти многообещающие успехи, в свою очередь, обеспечили дальнейшее финансирование области и приток новых научных кадров. К этому же времени относится открытие генов BRCA1 и BRCA2, мутации в которых являются причиной наследуемого рака молочной железы и яичников. Эпидемиологические данные показывают, что введение современных методов диагностики лечения сократило смертность от рака молочной железы по меньшей мере на треть за последние 30 лет [19].
Ключевые признаки рака в 2011 году
Статья 2011 года [20] включала в себя четыре дополнительных признака рака: нарушения регуляции метаболизма, геномная нестабильность, избегание иммунного ответа и воспаление. Эти признаки отражают две взаимодополняющие тенденции данной декады раковых исследований. С одной стороны — стремление ученых лучше понять особенности «внутренней жизни» раковых клеток для разработки новых методов диагностики и лечения; с другой — осознание факта, что развитие опухоли невозможно понять вне контекста [21]: взаимодействия опухолевых клеток со здоровыми клетками организма и особенно иммунной системы.
Вызывает даже некоторое удивление, что признак «нарушения метаболизма» был включен в перечень так поздно, ведь «эффект Варбурга» — о преобладании гликолиза в опухолевых тканях — был описан еще в 19 веке [22], [23]. Наглядный пример того, что знание некоторых фактов и осознание их важности могут быть достаточно далеко разнесены во времени.
Признак «геномная нестабильность» заслуживает отдельного комментария [24]. Речь тут идет даже не о том, что раковые клетки отличаются от нормальных целым рядом мутаций — этот факт был настолько очевиден для ученых, работающих в этой области, что его никогда и не включали в перечень «ключевых признаков». Дело в том, что раковый геном накапливает мутации гораздо быстрее, чем геном здоровой клетки, а раковая клетка, в свою очередь, способна выживать и даже делиться с такими «отклонениями от геномной нормы», с которыми обычная клетка гибнет. Геномная нестабильность раковых клеток самым непосредственным образом связана с одним из ключевых признаков, рассмотренных в предыдущем разделе, — нарушением апоптоза. В частности, белок р53 — ключевой регулятор апоптоза — в норме отвечает за то, чтобы клетки с большим количеством мутаций не допускались к делению. Закономерно, что мутация в этом белке ведет к тому, что такие клетки выживают. Нестабильность генома является важнейшим фактором, обеспечивающим стремительную эволюцию раковых опухолей и, следовательно, одним из факторов, затрудняющих их лечение.
Следующие два признака — «ускользание от иммунного ответа» и «воспаление» — описывают взаимодействие опухоли с организмом. Признаюсь, лично я не вполне согласна с таким обособлением и полагаю, что эти два признака вполне можно было бы объединить. Но авторам показалось важным особо подчеркнуть «воспаление» — патологический процесс, который вовлекает в себя далеко не только иммунные клетки. Именно в эту декаду в лексикон исследователей рака прочно входит словосочетание «микроокружение опухоли» [21] (рис. 4), и исследования взаимодействия раковых клеток со здоровыми (не мутированными) попадают в фокус внимания [25]. Выясняется, что раковая опухоль способна довольно активно менять поведение окружающих тканей и побуждать здоровые клетки работать на себя. Ангиогенез, о котором говорилось выше, — лишь одно из частных проявлений «перепрограммирования» здоровых клеток на обслуживание опухоли. Иммунные клетки и фибробласты также претерпевают изменения под действием веществ, которые выделяют раковые клетки, — с одной стороны. С другой — способность раковых клеток накапливать мутации способствует появлению внутри опухоли клеток, «невидимых» для иммунной системы, что обеспечивает «ускользание» опухоли из-под иммунного надзора.
Главными достижениями этого периода стало внедрение в клиническую практику PARP-ингибиторов для лечения рака молочной железы и яичников [26] с мутациями в белках BRCA1 и BRCA2. Этот метод лечения нацелен на такое свойство, как «геномная нестабильность». Опухоли с мутациями в генах BRCA, как правило, обладают множеством мутаций и геномных перестроек. PARP-ингибиторы еще сильнее увеличивают геномную нестабильность клеток, которая в результате становится буквально «несовместимой с жизнью», и опухоль погибает.
В это же время идет бурное развитие онкоиммунологии, результатом которого становится появление моноклональной терапии на основе ингибиторов контрольных точек иммунитета и клеточной терапии с использованием химерных антигенных рецепторов (CAR-Т) [27–29]. Открытие роли контрольных точек иммунитета в антиопухолевом иммунном ответе было награждено заслуженной Нобелевкой в 2018 году [3]. В начале 21 века широкое распространение получило использование метаболических особенностей злокачественных клеток в диагностике опухолей. Методы ПЭТ и ПЭТ-КТ стали доступны широкому кругу врачей и пациентов. Эти методы используют отличительное свойство опухолевых клеток жадно поглощать глюкозу для того, чтобы обнаружить первичную опухоль и метастазы.
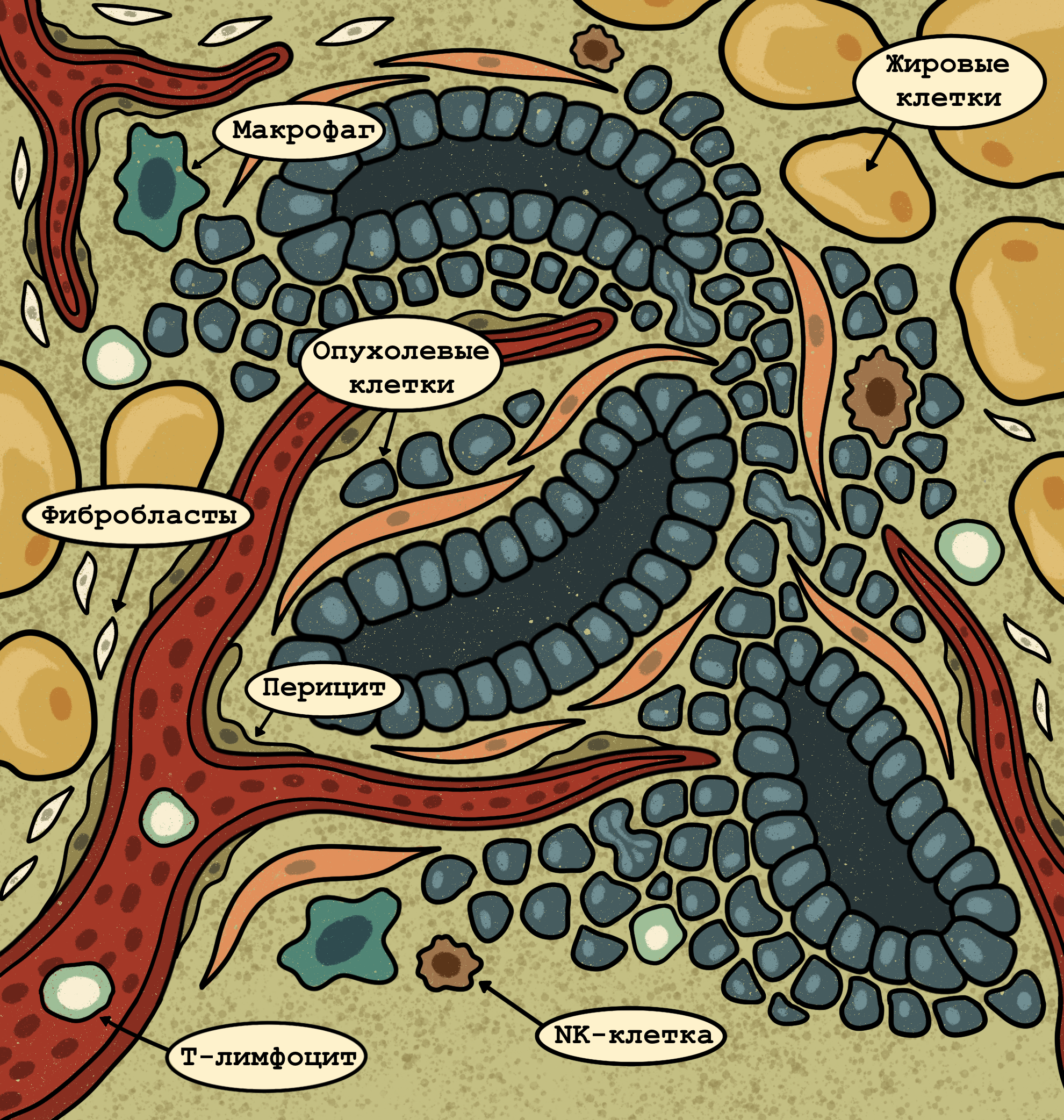
Рисунок 4. Микроокружение опухоли. Способность организма противостоять опухоли во многом зависит от микроокружения опухоли, которое включает в себя иммунные клетки (макрофаги, лимфоциты), клетки соединительной ткани (фибробласты), эндотелиальные клетки сосудов и многие другие.
иллюстрация Анастасии Самоукиной по статье 3 things to know about the tumor microenvironment
Ключевые признаки рака в 2022 году
Молекулярная биология рака существует не в вакууме — на нее неизбежно оказывает влияние развитие смежных биологических наук. Декада между 2011 и 2022 годами характеризуется широкой интеграцией в молекулярную онкологию достижений из других областей молекулярной биологии.
Главными «хитами» молекулярной биологии начала 21 века оказались следующие направления: эпигенетика и микробиомы, биология старения и изучение процессов дифференциации клеток на молекулярном уровне. Все они нашли свое отражение в последней (на данный момент) версии списка «ключевых признаков», опубликованной в начале 2022 года. Четыре новых признака включают в себя полиморфную микробиоту, эпигенетическое перепрограммирование клеток, фенотипическую пластичность и сенесцентные клетки [30].
Развитие методов секвенирования позволило глубже проникнуть в мир микроорганизмов — простейших, бактерий, вирусов и одноклеточных грибов, живущих в человеческом организме, — и оценить их роль в целом ряде нормальных и патологических процессов. Выяснилось, что именно микробиом кишечника [31] играет важнейшую роль в становлении иммунитета и регуляции обмена веществ. Более того, состав микробиома, судя по всему, оказывает влияние даже на психическое состояние человека. Неудивительно, что очень скоро эта тема привлекла внимание и исследователей-онкологов. Влияние микробиомов на развитие онкологических заболеваний пищеварительного тракта уже можно считать доказанным [32], [33], но куда более удивительным выглядит открытие, что именно от состава микробиомов может зависеть ответ на разные типы антираковой терапии. Возможно, уже в ближайшем будущем «коррекция микробиоты» станет важным методом профилактики развития рака, а также одним из сопутствующих методов лечения онкологических заболеваний [34].
Эпигенетика — еще одна стремительно развивающаяся область биологического знания. Она описывает молекулярные механизмы, регулирующие активность генов в разных клетках одного организма, — ведь именно эта регуляция, при генетической общности всех наших клеток, объясняет существование более 200 разных их типов в организме. Все они несут один и тот же геном, унаследованный нами от родителей, но при этом выглядят и действуют совершенно по-разному — сравните, например, клетку желудка, волоса и нейрон! Наряду с мутациями и геномной нестабильностью, изменение эпигенетической регуляции в раковых клетках служит еще одним важным источником их разнообразия [35]. Именно с эпигенетикой связано такое явление, как повышенная фенотипическая пластичность раковых клеток. В отличие от здоровых клеток, идущих путем «узкой специализации», раковые клетки способны сохранять черты незрелых эмбриональных клеток и изменяться как в сторону дифференциации, так и в противоположную — утраты клеточной специализации.
Эпигенетике на «Биомолекуле» посвящен целый спецпроект, начать знакомство с которым можно, например, со статьи «Молекулы и эпигеном» [36].
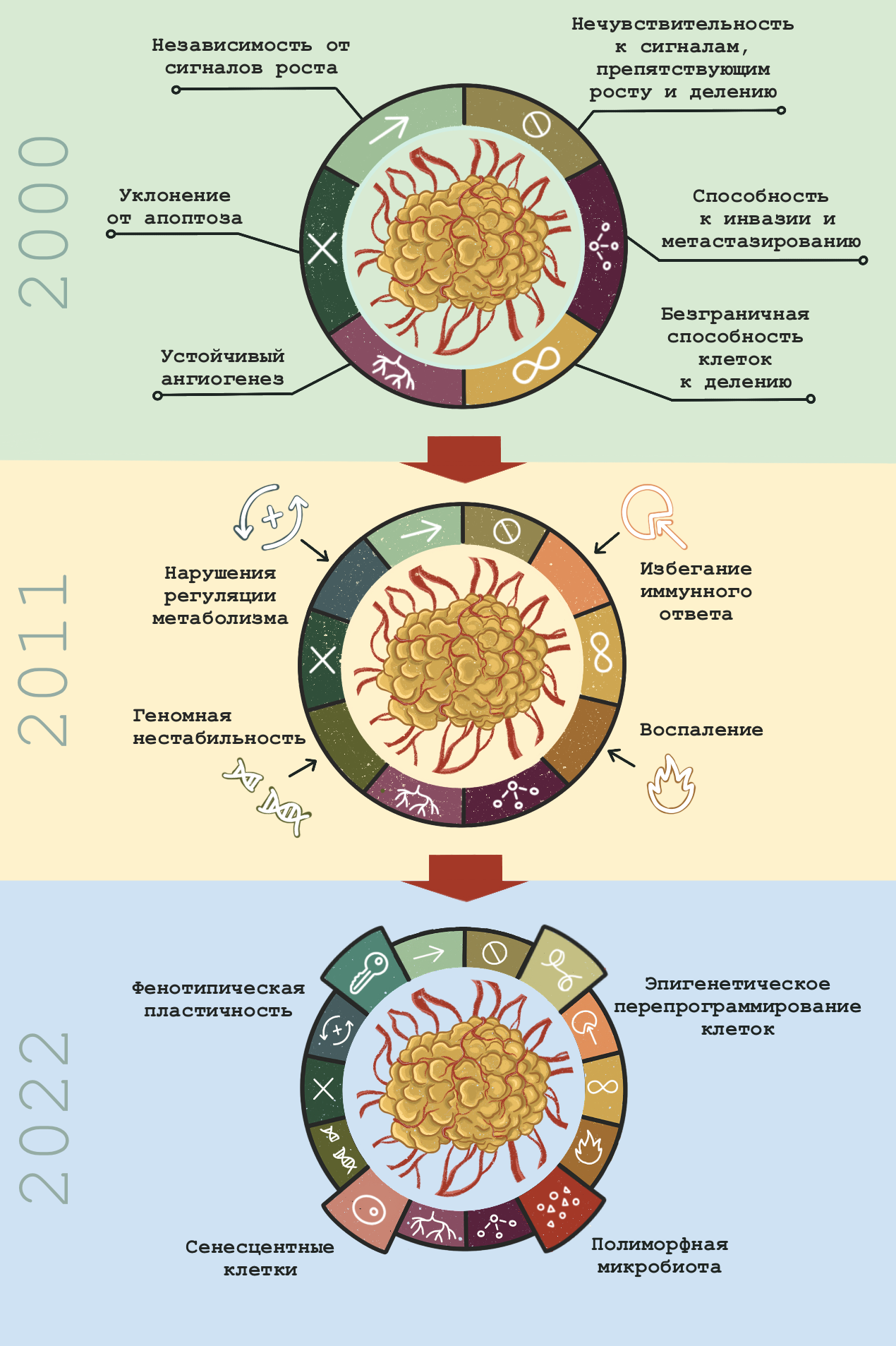
Рисунок 5. Эволюция концепции ключевых признаков рака от 2000 до 2022 года. Подробно все эти признаки разобраны выше и суммированы в табл. 2.
Сенесцентные клетки — еще один признак рака по этой классификации — это зрелые, а зачастую, пожалуй что и старые клетки, утратившие способность делиться. Остановка клеточного цикла — важный механизмом защиты от злокачественного перерождения, однако когда речь идет о раковых клетках и клетках опухолевого окружения, утративших способность к делению, — такие клетки, увы, продолжают работать на опухоль, синтезируя разнообразные факторы роста и молекулы, поддерживающие хроническое воспаление в опухоли и прилегающих к ней тканях, тем самым создавая «опухолевое микроокружение» [37]. Открытие и изучение сенесцентных раковых клеток стало важным шагом на пути к пониманию гетерогенности опухоли [38]. Конечно, злокачественная опухоль устроена несравненно «проще», чем здоровая ткань, в которой гармонично сосуществуют десятки разных типов клеток; однако было бы беспечным упрощением считать опухоль просто беспорядочной кучей одинаковых клеток — у нее тоже есть своя структура и даже некоторое подобие «специализации» и «симбиоза» делящихся и неделящихся клеток.
О практическом применении этих открытий, описанных в статье 2022 года [30], говорить пока еще рано, но эпигенетические маркеры уже используются для классификации опухолей непонятного происхождения, а данные микробиомов стараются учитывать при назначении лекарств.
Какое будущее ждет концепцию «ключевых к признаков» — сказать трудно. На мой взгляд, она уже стала чересчур громоздкой; возможно, в ближайшие времена нас ждет новая попытка «объять необъятное», но на данный момент — это, пожалуй, лучший способ хоть как-то структурировать онкологические знания (рис. 5).
Эволюционный взгляд на природу рака
В заключение хотелось бы сказать несколько слов о таком интересном разделе онкологии, как эволюционная биология рака [39]. С одной стороны, возможность злокачественного перерождения клеток — это наша «эволюционная плата» за сложность и многоклеточность организма [40], [41]. С другой — раковая опухоль сама по себе является сложным эволюционирующим обьектом. Изучение накопления мутаций в опухоли по мере ее роста, развития и метастазирования может служить неплохой моделью «видообразования» в более сложных биологических системах [42]. Взаимодействие опухоли с иммунной системой — клеточная модель конкуренции и коэволюции. Так что, изучая злокачественные перерождения, можно пролить свет и на самые фундаментальные биологические вопросы — развития и эволюции (рис. 6). Раковая опухоль — это в некотором роде «ошибка природы», но изучение подобных ошибок позволяет нам понять, как устроена жизнь. Раковые клетки в наши дни являются одним из излюбленных «модельных» организмов молекулярных биологов, которые изучают самые разные свойства живых клеток. Источник болезни становится источником знаний — такая вот диалектика [43].
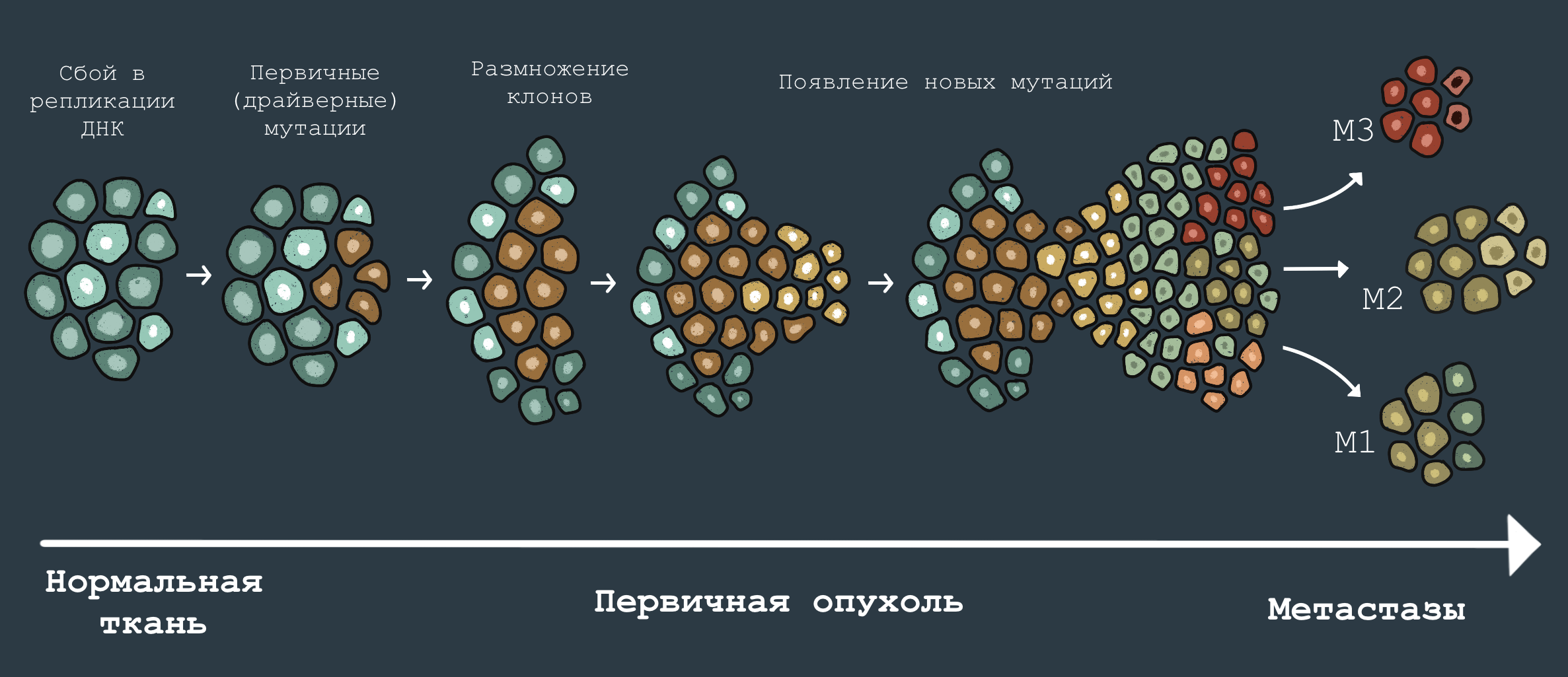
Рисунок 6. Эволюция раковой опухоли. В ходе развития раковой опухоли и ее распространения по организму в ней накапливаются всё новые мутации, меняющие ее свойства. Поздняя опухоль отличается от ранней, а вторичные новообразования, выросшие из метастазов, в свою очередь, могут отличаться набором мутаций от первичной опухоли. Именно эволюция опухоли объясняет такую неприятную черту злокачественных образований, как способность приобретать устойчивость к лекарственному лечению.
иллюстрация Анастасии Самоукиной
В более поздних статьях этого спецпроекта мы затронем самые разные аспекты медицинской и молекулярной онкологии и их неизбежных пересечений. А следующая статья будет посвящена современным методам диагностики злокачественных образований.
Литература
- Терапевтические моноклональные антитела;
- ВПЧ: вирус, вызывающий рак;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Клетки, которые лечат людей;
- Edward J. Odes, Patrick S. Randolph-Quinney, Maryna Steyn, Zach Throckmorton, Jacqueline S. Smilg, et. al.. (2016). Earliest hominin cancer: 1.7-million-year-old osteosarcoma from Swartkrans Cave, South Africa. S. Afr. J. Sci.. 112, 5;
- Игры в демиургов;
- Мукерджи С. Царь всех болезней. Биография рака. М.: «АСТ», 2013. — 800 с.;
- Мария Кондратова. «Кривое зеркало жизни». Рецензия;
- Мария Кондратова. «Невидимый страж. Как иммунитет защищает нас от внешних и внутренних угроз». Рецензия;
- Обыкновенное чудо, или Как рак исчезает сам собой;
- Соревнуясь с раком;
- Связанные одной лентой;
- Моноклональные антитела;
- Апоптоз, или Путь самурая;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Esther Witsch, Michael Sela, Yosef Yarden. (2010). Roles for Growth Factors in Cancer Progression. Physiology. 25, 85-101;
- Xuyi Wang, Evan R. Simpson, Kristy A. Brown. (2015). p53: Protection against Tumor Growth beyond Effects on Cell Cycle and Apoptosis. Cancer Research. 75, 5001-5007;
- Порочный цикл: от рака молочной железы до костных метастазов;
- Angela N. Giaquinto, Hyuna Sung, Kimberly D. Miller, Joan L. Kramer, Lisa A. Newman, et. al.. (2022). Breast Cancer Statistics, 2022. CA A Cancer J Clinicians. 72, 524-541;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Страшней клешней на свете нет...;
- Simona Negrini, Vassilis G. Gorgoulis, Thanos D. Halazonetis. (2010). Genomic instability — an evolving hallmark of cancer. Nat Rev Mol Cell Biol. 11, 220-228;
- Ming-Zhu Jin, Wei-Lin Jin. (2020). The updated landscape of tumor microenvironment and drug repurposing. Sig Transduct Target Ther. 5;
- Feiyue Zheng, Yi Zhang, Shuang Chen, Xiang Weng, Yuefeng Rao, Hongmei Fang. (2020). Mechanism and current progress of Poly ADP-ribose polymerase (PARP) inhibitors in the treatment of ovarian cancer. Biomedicine & Pharmacotherapy. 123, 109661;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Лечение Джимми Картера;
- Douglas Hanahan. (2022). Hallmarks of Cancer: New Dimensions. Cancer Discov. 12, 31-46;
- Зоопарк в моем животе;
- Wendy S. Garrett. (2015). Cancer and the microbiota. Science. 348, 80-86;
- Soumen Roy, Giorgio Trinchieri. (2017). Microbiota: a key orchestrator of cancer therapy. Nat Rev Cancer. 17, 271-285;
- Микробы из глубинки. Стоит ли нам трансплантировать себе фекалии дикарей, чтобы вернуть былое здоровье;
- Rajnee Kanwal, Karishma Gupta, Sanjay Gupta. (2015). Cancer Epigenetics: An Introduction. Methods in Molecular Biology. 3-25;
- Молекулы и эпигеном ;
- Clemens A. Schmitt, Boshi Wang, Marco Demaria. (2022). Senescence and cancer — role and therapeutic opportunities. Nat Rev Clin Oncol. 19, 619-636;
- Soon Sang Park, Yong Won Choi, Jang-Hee Kim, Hong Seok Kim, Tae Jun Park. (2021). Senescent tumor cells: an overlooked adversary in the battle against cancer. Exp Mol Med. 53, 1834-1841;
- Alexander Davis, Ruli Gao, Nicholas Navin. (2017). Tumor evolution: Linear, branching, neutral or punctuated?. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1867, 151-161;
- Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном;
- Старение — плата за подавление раковых опухолей?;
- Nicolai J. Birkbak, Nicholas McGranahan. (2020). Cancer Genome Evolutionary Trajectories in Metastasis. Cancer Cell. 37, 8-19;
- Модельные организмы: бонус — раковые клетки.