
Танец маленьких хромосом
16 августа 2021
Танец маленьких хромосом
- 481
- 0
- 0
Хищная бактерия Bdellovibrio bacteriovorus отличается не только необычным образом жизни, но и своеобразным небинарным делением
-
Автор
-
Редактор
Темы
Механизм симметричного деления бактериальных клеток и разделения по дочерним клеткам копий генома изучен довольно подробно и даже успел попасть на страницы учебников. Вместе с тем существует ряд бактерий с явной асимметрией клеток. Как же они делятся? Недавно на страницах журнала Current Biology вышла статья, описывающая деление и распределение хромосом по дочерним клеткам у Bdellovibrio bacteriovorus — хищных бактерий, обладающих явной клеточной асимметрией. Более того, результатом деления одной бактерии этого вида являются не две клетки, а больше. Как происходит деление этой во всех смыслах удивительной бактерии? Давайте разбираться.
Деление типичной бактерии на первый взгляд может показаться очень просто устроенным. Клетка удлиняется, потом посередине формируется перетяжка, копии удвоенного к этому моменту генома растаскиваются к противоположным полюсам клетки, затем перетяжка сокращается и — вуаля! — клетка разделилась надвое. Однако даже за таким простым процессом стоит сложный молекулярный каскад. Разделение дочерних хромосом в пространстве и времени координируется локусами ori и ter, в которых репликация начинается и заканчивается соответственно. Ориджины репликации дочерних хромосом растаскивает белковая система ParABS. Направление растаскивания задается белком ParB, который связывается со специфическими сайтами parS рядом с ориджинами (это некий аналог эукариотических центромер), а энергия обеспечивается АТФазой ParA (рис. 1).
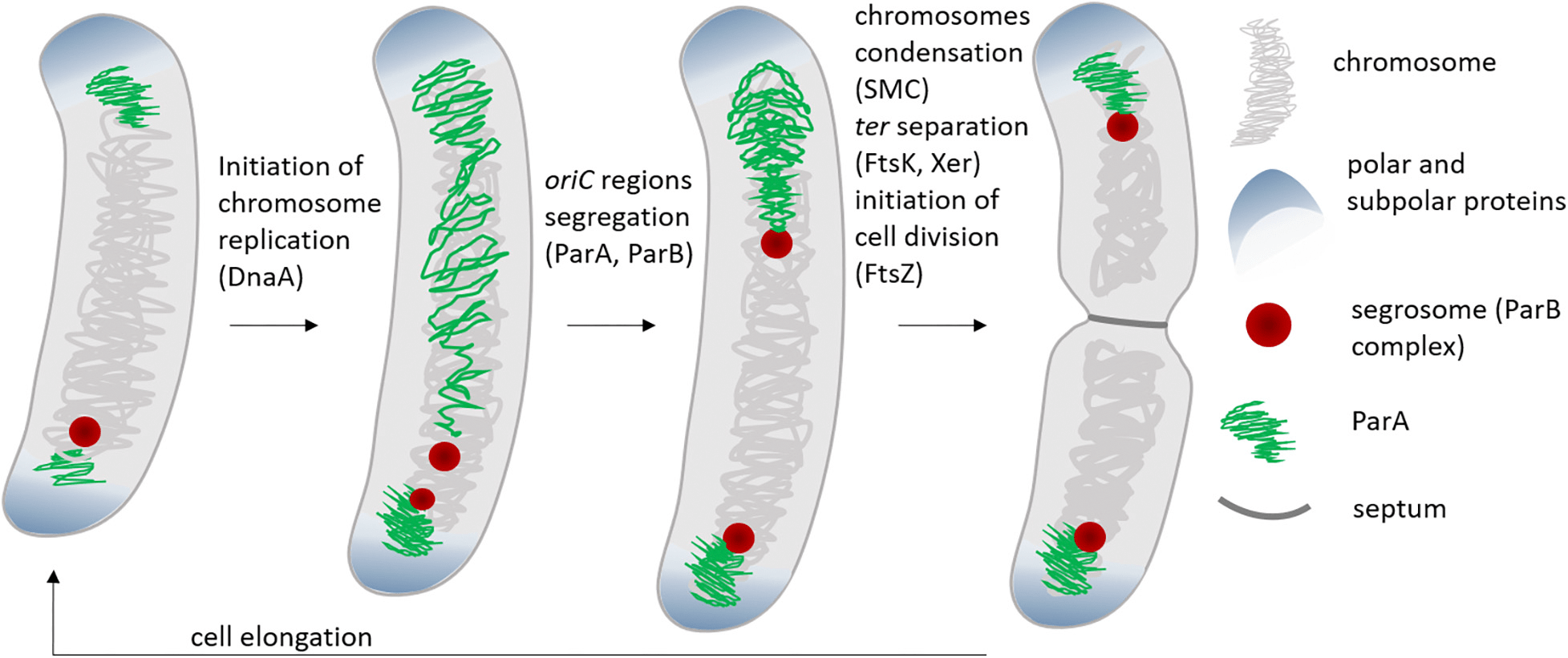
Рисунок 1. Разделение дочерних хромосом системой ParABS при делении бактериальной клетки
Но существует немало бактерий, клеточный цикл которых куда более сложен. Иногда, например, полиплоидная материнская клетка делится с образованием нескольких дочерних клеток, причем образование септ между дочерними клетками происходит последовательно, и в результате получается что-то вроде цепочки сосисок.
Одной из таких бактерий является Bdellovibrio bacteriovorus — хищная бактерия с весьма нетривиальным жизненным циклом. Клетки B. bacteriovorus строго полярны: на одном полюсе находится жгутик, а на другом, атакующем — нечто среднее между буром и присоской. Благодаря жгутику B. bacteriovorus способна быстро плавать в поисках добычи — клеток грамотрицательных бактерий. Прикрепившись к клетке-жертве за пили, B. bacteriovorus начинает «сверлить» тонкий слой пептидогликана грамотрицательной клетки и в конце концов оказывается в периплазматическом пространстве (рис. 2) [1].
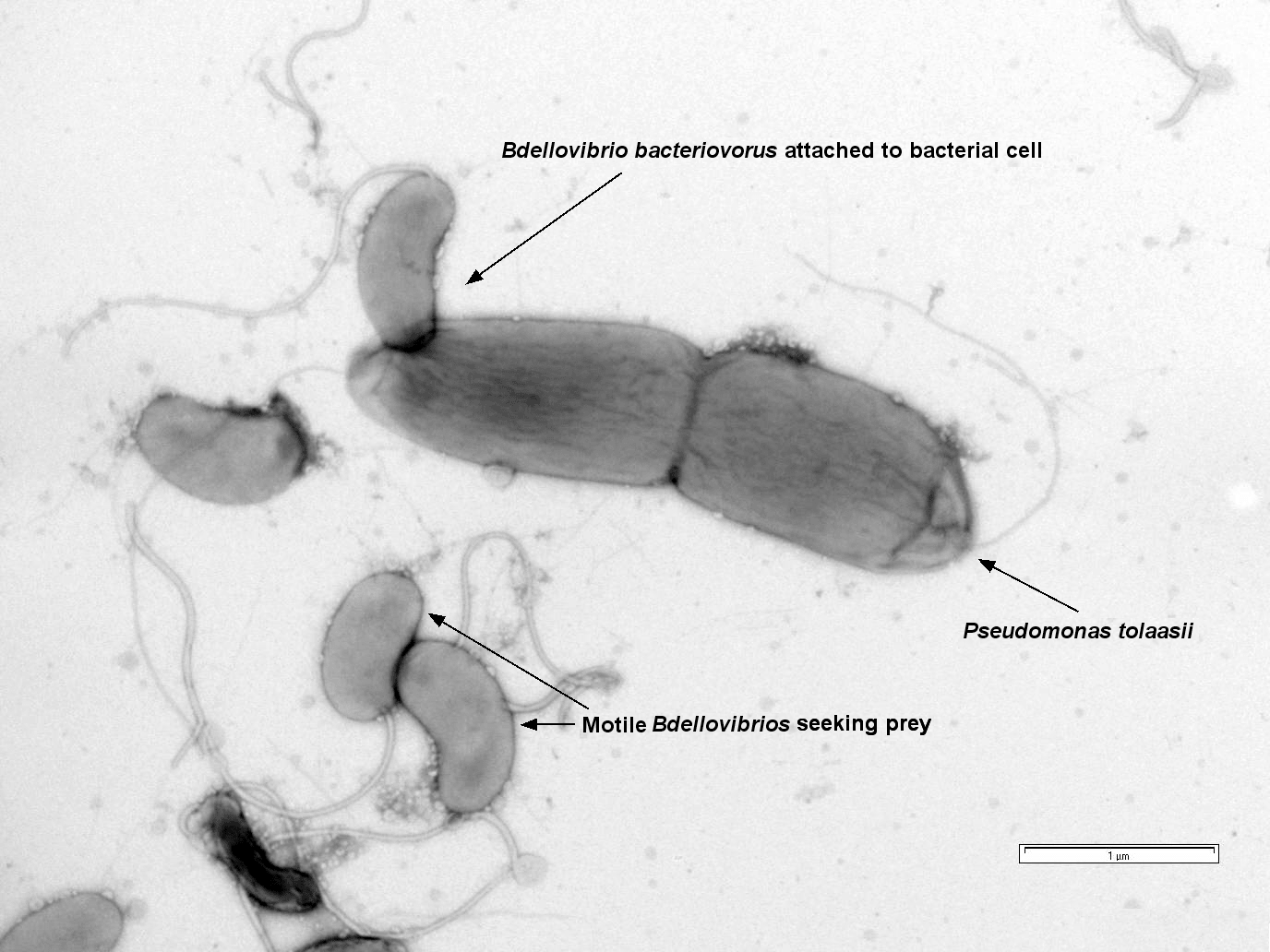
Рисунок 2. Клетки B. bacteriovorus атакуют клетки грамотрицательной бактерии Pseudomonas tolaasii
После попадания в периплазму морфология клетки B. bacteriovorus меняется: она округляется. Саму же инфицированную клетку на данной стадии называют бделлопластом. Сначала B. bacteriovorus не нарушает осмотическую целостность последнего рубежа обороны грамотрицательной бактерии — внутренней мембраны (напомним, у грамотрицательных бактерий мембраны две — внутренняя, или клеточная, и наружная, а между ними находится тонкий слой пептидогликана). Потом B. bacteriovorus начинает в прямом смысле высасывать все соки из клетки-жертвы, превращаясь при этом в длинный филамент. Потом филамент с помощью нескольких асинхронных делений распадается на обычные жгутиковые клетки B. bacteriovorus, которые покидают остатки клетки-жертвы (рис. 3) [1].
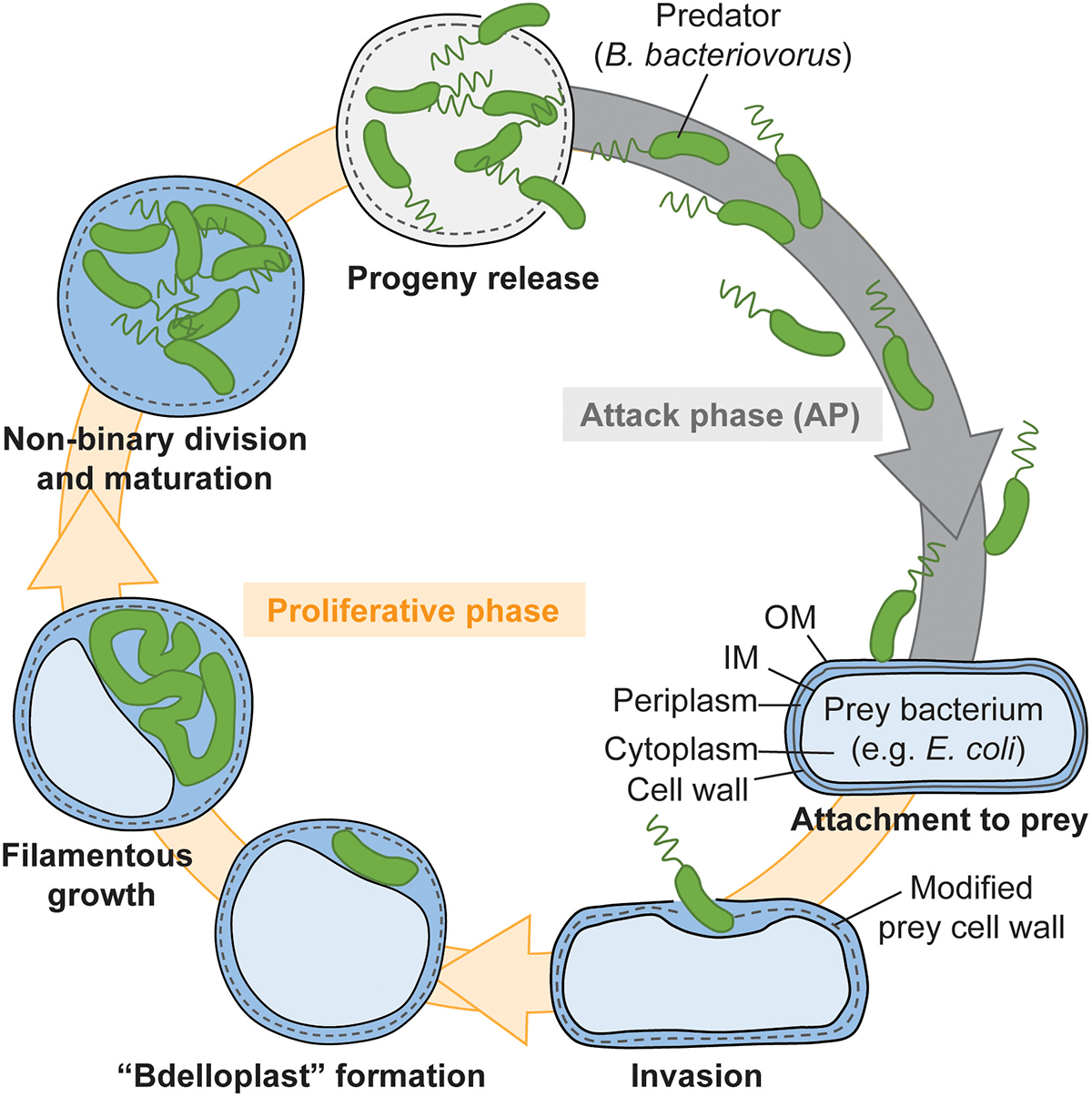
Рисунок 3. Жизненный цикл Bdellovibrio bacteriovorus
Как при таком странном делении происходит распределение копий генома по дочерним клеткам? Недавно бельгийские ученые опубликовали статью в журнале Current Biology, проливающую свет на сложную хореографию хромосом B. bacteriovorus во время деления. Чтобы наблюдать за поведением хромосом с помощью флуоресцентной микроскопии, ученые внедрили в геном B. bacteriovorus дикого типа дополнительные локусы parS вблизи предсказанных элементов ori и ter. Один из дополнительных локусов был взят от чумной палочки и распознавался ее белком ParB, сшитым с желтым флуоресцентным белком (YFP), а другой позаимствован у профага P1 и связывался его гомологом ParB, сшитым с циановым флуоресцентым белком (CFP). Теперь благодаря флуоресцентным меткам появилась возможность наблюдать за расположением ori и ter. Оказалось, что у свободноживущих B. bacteriovorus ориджин репликации всегда повернут к атакующему концу их клетки, а место терминации репликации — к противоположному. Удивительно, но у других асимметричных бактерий центромерный участок генома, то есть содержащий ori, обычно ориентирован в сторону того конца, который несет жгутик, то есть строго наоборот, чем у B. bacteriovorus.
Но на этом странности только начались! Окрашивание ДНК показало, что нуклеоид B. bacteriovorus не занимает всю цитоплазму целиком, как было принято считать, и по относительным размерам уступает нуклеоидам других бактерий, в том числе кишечной палочки, которая, к слову, имеет геном примерно такого же размера, что и B. bacteriovorus. Ученые предположили, что нуклеоид B. bacteriovorus более компактизирован, чем у других бактерий. Кроме того, флуоресцентные белки, свободно диффундирующие в цитоплазму бактерии, в область нуклеоида таинственным образом не попадали — это первое подобное наблюдение, когда случайные белки не попадают в бактериальный нуклеоид! Авторы статьи предположили, что геном B. bacteriovorus очень плотно, необычно плотно для бактерий компактизирован.
Чтобы наблюдать за тем, как реплицируется геном B. bacteriovorus, ученые заменили его собственный ген dnaN, кодирующий компонент реплисомы, на ген, с которого считывается DnaN, сшитый с зеленым флуоресцентным белком (GFP). Как и положено, до начала деления DnaN свободно болтался в цитоплазме. Первые оформленные скопления (фокусы) DnaN стали появляться на одном из полюсов клеток B. bacteriovorus примерно через полтора часа после добавления в культуру пищи — клеток Escherichia coli. Репликация ДНК начиналась спустя некоторое время после того, как B. bacteriovorus попадала в периплазматическое пространство жертвы, и начиналась она с инвазивного полюса, при этом ориентация генома относительно полюсов клетки оставалась неизменной.
Постепенно фокус DnaN перемещался с инвазивного полюса на середину клетки, что, вероятно, соответствует репликации материнской хромосомы. Чуть больше чем через два с половиной часа после смешивание клеток B. bacteriovorus с потенциальной добычей в клетках, как правило, на инвазивном конце, выявлялся второй фокус DnaN — стартовала новая репликация. Фокусы DnaN могут периодически сливаться или разъединяться, что может указывать на то, что в их состав входят две репликационные вилки. Третий фокус DnaN формировался на том конце, где прежде был жгутик; вслед за ним быстро формировался четвертый фокус. Важно отметить, что фокусы DnaN появлялись не одновременно, а последовательно, что указывает на асинхронную репликацию генетического материала B. bacteriovorus.
Таким образом, период активного роста хищной бактерии сопровождается множественной асинхронной репликацией ее генома. Более того, авторы показали, что нуклеоид B. bacteriovorus, очень компактизованный в неделящемся состоянии, при репликации претерпевает декомпактизацию.
Возникает логичный вопрос: как же разделить всю эту мешанину геномов, получившуюся в результате асинхронной репликации? Наблюдение за делящимися клетками в реальном времени показало, что, как только второй ориджин репликации обособляется (то есть начинается первый раунд репликации), он быстро перемещается на противоположный полюс клетки. В то же время терминатор репликации смещается с полюса клетки на ее середину. Сегрегация ter происходит также в середине клетки независимо от процесса клеточного деления. Более детальное наблюдение выявило, что перемещение ter в центр клетки происходит после того, как новореплицированный ориджин достигает противоположного полюса [1].
Чтобы наблюдать за сайтами parC, расположенными неподалеку от ориджина, авторы исследования заменили собственный белок ParB B. bacteriovorus на меченный флуоресцентным белком mCherry. Наблюдение за флуоресцентно меченым ParB помогло проследить, как происходит сегрегация хромосом при последующих раундах репликации. Оказалось, что при каждом новом раунде разделение ori происходит в самом начале репликации, а сегрегация ter так и остается рассинхронизованной с делением клетки.
В конце концов клетка B. bacteriovorus преобразуется в длинный филамент, содержащий несколько нуклеоидов, на полюсах каждого из которых находятся ориджин и терминатор репликации. Примерная схема удвоения и сегрегации ДНК в B. bacteriovorus приведена на рисунке 4.
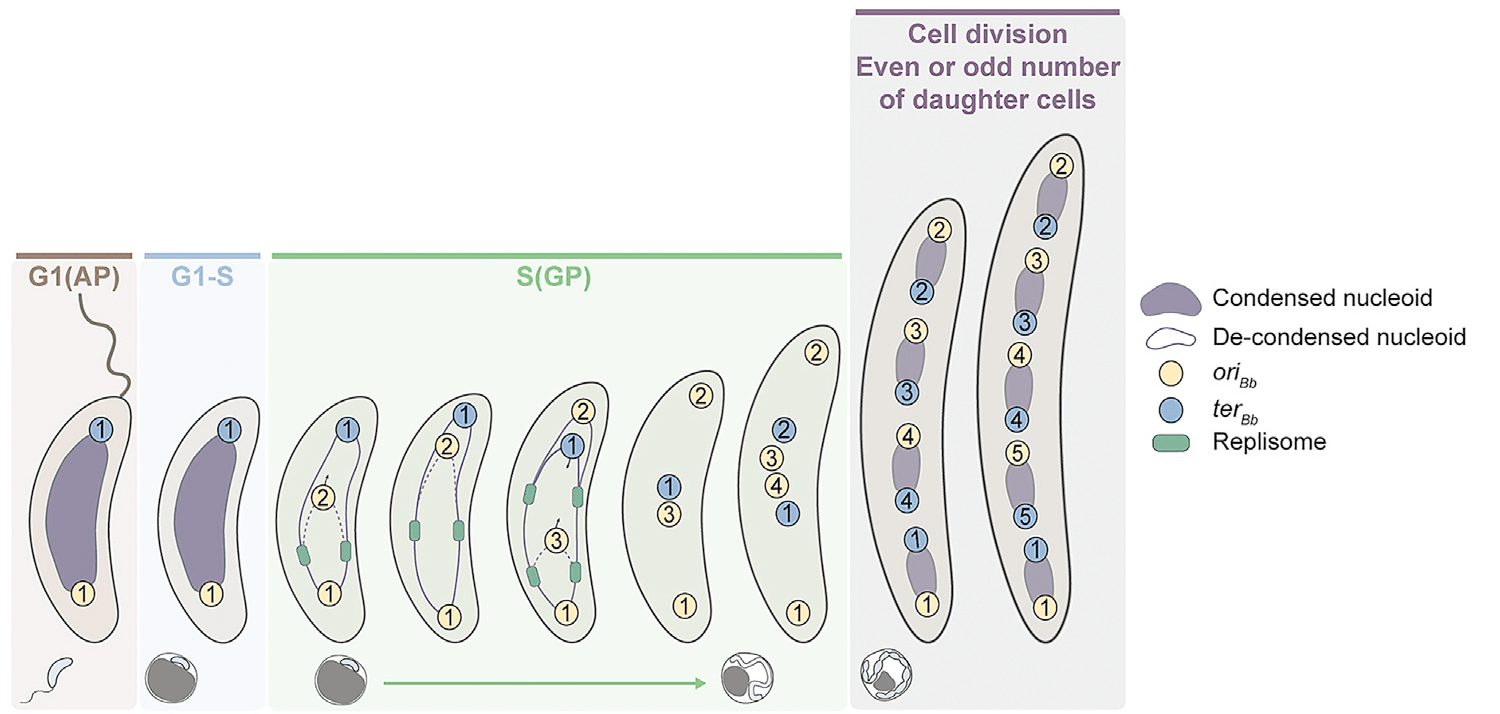
Рисунок 4. Схема удвоения и сегрегации хромосом при небинарном делении B. bacteriovorus. Номера на ориджинах и терминаторах указывают хронологический порядок их удвоения в ходе репликации генома. Стадия G1 соответствует свободноживущей жгутиковой стадии, G1-S — переход бактерии к хищническому существованию, S — размножение B. bacteriovorus внутри клетки-хозяина.
Ученые показали, что за сложные удвоения и перемещения хромосом у B. bacteriovorus отвечают белки системы ParABS. Внесение каких-либо нарушений в работу этой белковой системы сразу же сказывалось на делении бактерии. Стоит отметить, что ParB B. bacteriovorus не был локализован постоянно в центромерной области бактериальной хромосомы — это первый описанный пример подобного рода среди бактерий. Наблюдение за ParB, меченным mCherry, показало, что часто он солокализуется с DnaN, меченным GFP. Исследователи заключили, что новосинтезированные ориджины репликации могут служить платформами для дальнейших актов удвоения генома. Вариабельность в активности многочисленных ориджинов приводит к тому, что результатом деления одной клетки может быть как четное, так и нечетное число клеток.
Литература
- Jovana Kaljević, Terrens N.V. Saaki, Sander K. Govers, Ophélie Remy, Renske van Raaphorst, et. al.. (2021). Chromosome choreography during the non-binary cell cycle of a predatory bacterium. Current Biology;
- Carey Lambert, Laura Hobley, Chien-Yi Chang, Andrew Fenton, Michael Capeness, Liz Sockett. (2008). A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 313-361;
- Monika Pióro, Dagmara Jakimowicz. (2020). Chromosome Segregation Proteins as Coordinators of Cell Cycle in Response to Environmental Conditions. Front. Microbiol.. 11;
- Olanya O.M. and Lakshman D.K. (2015). Potential of predatory bacteria as biocontrol agents for foodborne and plant pathogens. Journal of Plant Pathology. 97, 405–417;
- Géraldine Laloux. (2020). Shedding Light on the Cell Biology of the Predatory Bacterium Bdellovibrio bacteriovorus. Front. Microbiol.. 10.






