
Вилладж ин зе диш
25 марта 2024
Вилладж ин зе диш
- 90
- 0
- 0
Символическое изображение подхода «деревенской культуры» — клетки многих людей объединяются в одной чашке Петри для дальнейшего экспериментального культивирования; каждая линия клеток является как бы представителем своего донора.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: «Клеточный мультикультурализм» — новый подход к использованию ИПСК в доклинических исследованиях, персонализированной медицине и функциональной геномике.
Возможность синергетически соединять различные методы современной биологии стимулирует ученых проектировать новые сложные подходы для решения как исследовательских, так и прикладных задач. В этой статье расскажем о попытках ученых разработать новый экономически оптимальный подход к работе с человеческими индуцированными плюрипотентными стволовыми клетками (ИПСК) для масштабных популяционных исследований. Использование отобранных у широких выборок людей ИПСК позволит глубже (на функционально-клеточном уровне) изучить генетически обусловленное человеческое разнообразие и ляжет в основу доклинических исследований с привлечением реальных пациентов. Успех подхода облегчит изучение связи картины патогенеза заболеваний и особенностей действия лекарственных препаратов с индивидуальными генетическими факторами, одновременно позволяя получать данные для персонализированного или специализированного для целевых групп лечения.
Ниже мы попробуем раскрыть вопрос, что в действительности могут значить ИПСК для доклиники, а затем взглянем на сложную методическую работу, которую ведут ученые для обоснования нового подхода, эффективно сочетающего крупные достижения в области методов клеточной и молекулярно-вычислительной биологии последних десятилетий.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
ИПСК — объект и одновременно инструмент, прочно уже закрепившийся в биомедицинских исследованиях, о потенциале которого сказано многократно и многое (например, в статьях на «Биомолекуле»: [1], [2]). Но если медицинское применение аутологичных или генетически отредактированных в целях достижения гистосовместимости клеток, полученных из ИПСК, сталкивается по ряду более или менее очевидных причин со сложностями (см., например, «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [3], раздел «Препараты на основе клеток»), то использование таких клеток в доклинике кажется во многих отношениях более легкой для внедрения инновацией, сулящей, тем не менее, значительные перспективы.
Можно ли преобразить финальные стадии доклинических исследований лекарственных препаратов [4] в нечто, что будет по существу скорее нулевой (или «минус первой») стадией клинического исследования? Преждевременное тестирование нового препарата на людях, конечно, не соответствует биоэтическим ограничениям в связи с непредсказуемыми рисками его воздействия на человеческий организм — поэтому и существует потребность в доклинике на экспериментальных животных. Но само использование нечеловеческих моделей в прямом смысле противоречит задаче таких исследований — установить границы предсказуемости действия и оценить потенциальную эффективность разрабатываемого агента в отношении человека. Так что, если бы у нас появилась возможность, не рискуя здоровьем добровольцев, каким-то образом сразу переходить к испытаниям на них?
Ex vivo — выражение, чуть менее известное, должно быть, широкому кругу, чем in vitro, узко может трактоваться как проведение измерений и тестов на извлеченных из организма биоматериалах вслед за тем, как весь организм был подвергнут какому-либо воздействию, либо в целях изучения автономной работы таких изъятых тканей или органов, изолированных от влияния интегративных регуляторных систем (нервной, эндокринной, отчасти иммунной). Такая концепция нам не поможет. Но обычно ex vivo понимается все же шире, с включением в эту категорию исследований, проводимых in vitro — с воздействием на клетки и ткани, извлеченные из организма и представляющие собой в определенном смысле «прокси» различных уровней его организации (клеточного, тканевого, органного). По сути, этот подход — опосредованное исследование высокоуровневой живой системы через манипуляции с ее частью, что хоть и не может полностью заместить опыты на целом, но своим конечным объектом, с учетом всех ограничений, имеет именно его (а не исследуемую часть, хотя последняя часто и закономерно превращается в самостоятельный объект исследований).
Проблема, жестко ограничивавшая подход ex vivo — его инвазивность. Достаточно легко получить кровь или маленький кусочек кожи, луковицы волос [5], а также материалы, получаемые в ходе операций, проводимых по медицинским показаниям, например, ткани опухолей. Но для всех задач доклиники этого недостаточно. Сетчатка глаза, дофаминергические нейроны черной субстанции, ткани сердечной мышцы... Потребоваться может любая ткань, становящаяся мишенью определенного патогенетического процесса. При этом наибольший интерес для ex vivo доклиники представляют полигенные (многофакторные) болезни, то есть патологические состояния, имеющие значимый, но не однозначно определяемый наследственный компонент. Таких немало среди затрагивающих центральную нервную систему, которая редко становится объектом прямых хирургических вмешательств, а кроме того, нужны исследования и здоровых доноров.
Здесь, раз уж мы говорили о «прокси», можно вспомнить о клеточных культурах, полученных из человеческого материала и выведенных в бессмертные линии с потенциалом к почти неограниченному росту. Эти модельные объекты хорошо поддаются стандартизации, к тому же они могут обладать свойствами некоторых органоспецифических клеток и, ограниченно, тканей. Но такие линии — это весьма особый биологический объект, как и злокачественные опухоли, из которых многие из них были получены. Они могут отличаться от соматических клеток по многим параметрам, вплоть до структуры и числа хромосом, на основании чего некогда даже обсуждался вопрос о выделении клеточной линии HeLa в отдельный биологический вид!
И, разумеется, каждая охарактеризованная линия была получена от одного человека, так что о представленности в ней генетического разнообразия нашего вида или определенной группы людей, например, носителей специфической мутации, не приходится думать. Отдельные мутации можно вносить инструментами генетического редактирования [6], но все дело в том, что даже моногенные заболевания могут проявляться по-разному из-за влияния индивидуального генетического контекста — действие мутантного аллеля может быть модифицировано, скомпенсировано или усугублено группами связно действующих генов и регуляторных элементов генома.
И здесь на передний план выступают ИПСК. Технология ИПСК и ее закономерное продолжение — технология трансдифференцировки — позволяет воспользоваться клетками, получаемыми самыми низкоинвазивными методами. Становясь стволовыми, эти клетки в определенной мере обходят ограничения роста, свойственные первичным культурам. Имея генотип, идентичный генотипу донора, ИПСК потенциально могут быть дифференцированы практически в любые типы тканей или быть материалом для формирования органоидов [6].
Существенное ограничение — это экономические и временные затраты на создание и поддержание биобанков и проведение самих исследований с репрезентативными количествами индивидуальных культур, полученных из ИПСК клеток. Помимо этого, сама процедура индукции плюрипотентности не слишком проста, но последующее довершение трансдифференцировки в целевую ткань — еще сложнее и, как пишут ученые, работающие в этой области, неохотно поддается стандартизации. Культуры ИПСК в индивидуальных экспериментах дают разный выход целевых тканеспецифичных клеточных типов с разными долями примесей клеток на промежуточных стадиях дифференцировки и таких, чья дифференцировка и вовсе свернула не туда. В связи с этим относительно дешевые методы анализа происходящих в клетках процессов, такие как балк-секвенирование РНК или определение содержания целевых белков в клеточном лизате, будут давать значительный разброс результатов на уровне выборки культур, зашумляющий различия, обусловленные генетическим фактором. Это имеет значение также для фундаментальных исследований в области функциональной геномики [7].
Последний вопрос разрешают методы, позволяющие отделить целевые клетки, находящиеся на нужном этапе «самоопределения», от прочих, такие как многоцветная проточная цитометрия при условии наличия у клеток четких маркеров дифференцировки, или, еще универсальнее и гораздо мощнее, секвенирование РНК одиночных клеток (scRNA-seq). И именно здесь, по мнению многих исследователей, из синергии трех краеугольных элементов — подхода ex vivo, технологии клеточной трансдифференцировки и метода транскриптомики одиночных клеток, — рождается новый подход с применением ИПСК, который изменит многое в индустрии доклинических исследований.
Поскольку генотипы доноров клеток отличаются, и часть этих отличий попадает в РНК, соответствующие программные алгоритмы, работая с данными scRNA-seq, способны эффективно различать клетки, принадлежащие независимым линиям, и группировать их транскриптомы в отдельные выборки. Это значит, что нет очевидной необходимости культивировать ИПСК от разных доноров отдельно (возможно, кроме случаев, когда доноры — близкие родственники). А следовательно, и трансдифференцировку эти клетки могут проходить вместе, что дополнительно снизит число источников вариативности данных, но в первую очередь позволит экономить ресурсы. Подобный подход иногда обозначают термином «мультиплексирование», когда на определенном этапе образцы объединяются для совместного анализа, а затем происходит демультиплексирование выходящих данных, в данном случае реализуемое за счет мощности scRNA-seq и программных инструментов (биологам также известно «пулирование», но оно обычно требует следующего этапа с раздельным анализом попавших в пул образцов).
Такие совместные культуры клеток многих доноров сейчас начали вводить в практику, называя «деревня в (культуральной) чашке» — village in a dish, либо просто — village culture . Первые исследования, осуществленные на подобных культурах, уже опубликованы в рецензируемых журналах [8], другие существуют в виде препринта [6], [9]. Но для более широкого внедрения этого подхода требуется еще решить внутренние методические проблемы, и первоочередная — достаточно ли точно мы знаем, что генетически не идентичные клетки, находясь в смешанной культуре, никак не реагируют на это? Ведь при дифференцировке в организме, за исключением феноменов мозаицизма и химеризма, они бы находились в генетически идентичном окружении, и обратное неестественно?
Автор предложил бы перевод «коммунальная культура», но английское словосочетание communal culture кажется фонетически проигрышным, либо исследователей могла смутить омонимия с антропологическим термином. Термин «мультикультура» используют для моделей, включающих множество клеточных типов [10].
К счастью для разработчиков нового подхода, метод scRNA-seq отлично соответствует и этой задаче, наиболее полно из всех доступных методов характеризуя состояние, в котором находится клетка. Эта характеристика включает количественное оценивание с приемлемой точностью экспрессии огромного множества генов на момент анализа, что, в свою очередь должно позволять отслеживать влияние на клетки любых дополнительных факторов, если они затрагивают транскрипцию и созревание РНК хотя бы нескольких отдельных генов.
В ушедшем, 2023, году в журнале Nature Communications была опубликована статья [11], полностью посвященная данной теме. Команды исследователей из 7 австралийских научных центров (основная работа проводилась в лабораториях Квинслендского и Мельбурнского университетов и Института медицинских исследований Гарвана) объединили усилия, чтобы установить, действительно ли совместное культивирование индуцированных стволовых клеток многих доноров не вносит существенных изменений в состояние каждой отдельной линии по сравнению с независимым культивированием.
Как в любом стандартном исследовании, направленном на валидацию какой-либо методики или подхода, исследователи на первом этапе проверяли в том числе сходимость результатов, полученных в независимых лабораториях. В каждом из трех исследовательских центров одни и те же три клеточные линии ИПСК были разморожены, «приведены в чувство» в течение двух недель последующего культивирования, а затем смешаны в равной пропорции для четырехдневного совместного роста в культуре (рис. 1а). Протоколы культивирования были идентичны вплоть до использования реагентов из одних производственных партий. После клетки были доставлены в лабораторию Института Гарвана для анализа scRNA-seq всех экспериментальных культур — как смешанных, так и соответствующих одиночных. Помимо этого, в той же лаборатории протестировали влияние процедуры криоконсервации, для чего вилладж-культуры поддерживались в течение 7 дней, замораживались, а затем были разморожены и подвергнуты анализу (4 и 7 дней соответствуют обычным минимальным срокам прекультивирования ИПСК перед индукцией дифференцировки в соответствующих случаях — после пересева и после вывода из криоконсервации). При этом во всех экспериментах независимые культуры также объединялись между собой ненадолго перед процедурой сбора клеток, видимо, чтобы дополнительный сбор и пересев при объединении не становился дополнительным специфическим воздействием для вилладж-культур.
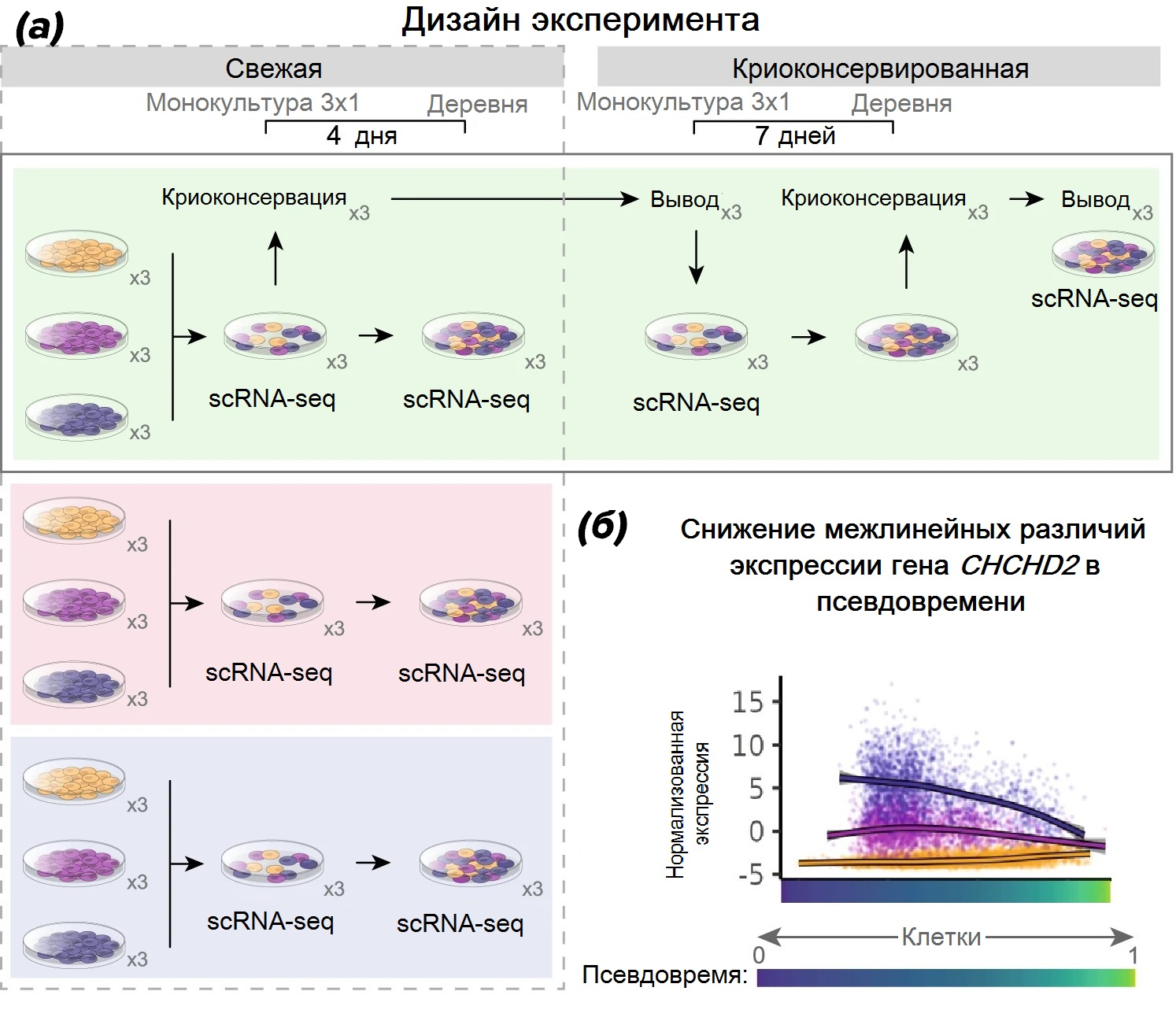
Рисунок 1. (а) — схема исследования. Три индивидуальные клеточные линии культивировались в трех лабораториях, затем смешивались в равных пропорциях. Часть клеток отбиралась для секвенирования РНК одиночных клеток, оставшиеся культивировались 4 дня в режиме «деревни». В одной из лабораторий проводился также эксперимент по влиянию на «деревенскую» культуру прохода через криоконсервацию. Все эксперименты проводились в трех повторностях.
(б) — динамические эффекты в экспрессии, наблюдаемые в псевдовремени, на примере гена CHCHD2, важного маркера нейроэпидермального пути дифференцировки ИПСК.
Применив статистический метод построения линейной смешанной модели, авторы установили, что дисперсия генной экспрессии, обусловленная всеми включенными переменными (принадлежность клеток к одной из индивидуальных линий, лабораторией, проводившей культивирование, номером эксперимента, прохождением клеток через криоконсервацию, одиночным или совместным культивированием, а также парными взаимодействиями всех перечисленных факторов между собой), не выходила за ожидаемые рамки. Важно, что статус «деревни» вносил в свежих образцах не больший вклад в наблюдаемую обобщенную дисперсию экспрессии, чем такие переменные, как лаборатория или клеточная линия. В образцах, подвергшихся криоконсервации, картина, надо сказать, оказалась несколько более смещенной в пользу вклада статуса «деревни» (фактора совместного культивирования) в сравнении с принадлежностью к линии. Тем не менее, авторы подчеркивали, что среди всех отдельных генов, чья дисперсия под действием хотя бы одного из учтенных факторов составляла больше 1%; гены, имеющие такой высокий вклад в дисперсию со стороны принадлежности к линии, составляют большую долю, чем гены, испытывающие сопоставимое влияние со стороны наложение (ковариаты) факторов «линия-статус культивирования» (2401 генов против 980). Иными словами, модель «деревни» должна позволить правильно обнаружить разницу в экспрессии между клетками из разных донорских линий по большинству отдельных генов, и лишь для значительно меньшей части эффекты от совместного культивирования помешают отслеживанию межлинейных различий (рис. 2).
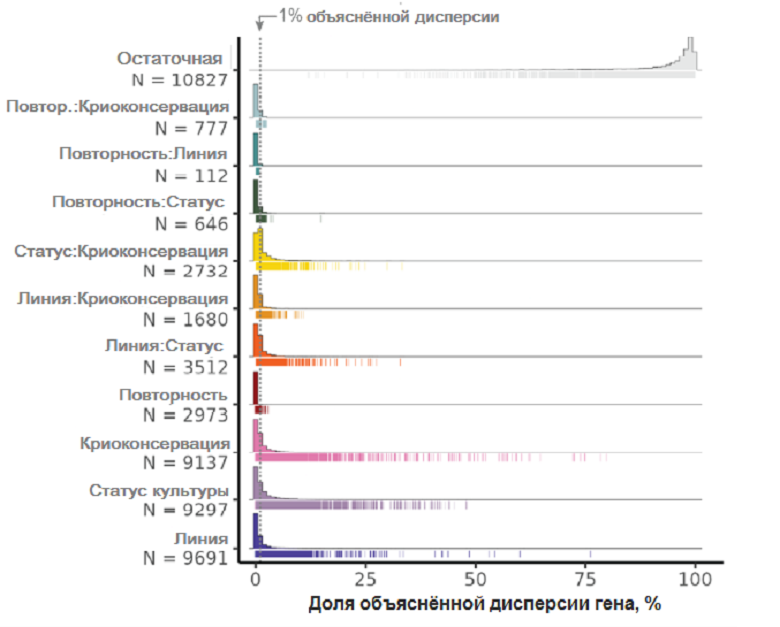
Рисунок 2. Доля дисперсии в экспрессии индивидуальных генов, объясняемая вкладом различных факторов. Процент дисперсии относится к дисперсии индивидуального гена (тонкие цветные штрихи под горизонтальной осью). Высота столбцов — количество генов. N — число проанализированных клеток.
Дополнительно авторы проверили, смогут ли они выявить локусы количественных признаков экспрессии (eQTL; вариации в генетической последовательности, влияющие на уровень экспрессии связанных генов), выявленные в предшествующей работе [12] и присущие используемым линиям. Им удалось выявить до 70,6% описанных эффектов таких локусов в свежих и до 66,8% в подвергнутых криоконсервации образцах, причем эффекты были согласованы между независимыми и вилладж-культурами. Наконец, выявленная межлинейная разница экспрессии была проанализирована на наличие динамических эффектов в псевдовремени, то есть изменений в различиях между клетками разных линий, происходящих на протяжении существования виртуального дифференцирующегося ряда клеточных поколений.
Поскольку первоначально определенные межлинейные вариации экспрессии относились к каждой линии в целом, а в культурах ИПСК в линиях, естественно, преобладали клетки в плюрипотентном состоянии, то выявленные межлинейные различия или их отсутствие характеризовали в целом это потенциально стартовое для последующих экспериментов по дифференцировке состояние, из которого клеткам предстоит выйти в ходе предполагаемых последующих этапов работы с культурой. Это значит, что существующие в этом стартовом состоянии малые различия потенциально могут обернуться гораздо более значительными на пути перехода клеток в целевой статус дифференцировки. Анализ в псевдовремени позволяет оценить степень и распространенность таких динамических перемен.
В культурах ИПСК часть клеток всегда начинают спонтанный процесс дифференцировки, поэтому авторы могли построить псевдовременной ряд, и это позволило выделить 1965 значимых динамических вариаций — межлинейных различий в экспрессии отдельных генов, которые последовательно уменьшались или увеличивались вдоль траектории псевдовремени (рис. 1б). При этом авторы уже не проверяли, отражается ли вилладж-статус на динамике изменения картин экспрессии генов в клетках разных линий, потому что не использовали в модели ковариату статуса культивирования и псевдовремени, что оставляет этот вопрос открытым, но обеспечили методологическую базу для подобного исследования.
В финале, культивировав вместе ИПСК уже почти двух десятков доноров и проведя процедуру дифференцировки их в зрелые кардиомиоциты за 15 дней, исследователи еще раз продемонстрировали возможности доступного программного обеспечения для работы с данными scRNA-seq различать индивидуальные донорские линии, хотя в случае с кардиомиоцитами им пришлось ограничиться РНК, добытой из клеточных ядер (строение этих клеток и межклеточные контакты затрудняют выделение отдельных кардиомиоцитов для scRNA-seq). Они также показали, что при объединении индивидуальных линий ИПСК в деревню важно учитывать скорость роста каждой и продолжительность эксперимента, иначе имеющие преимущество линии могут вытеснить другие до его завершения.
Важно подчеркнуть, что, как упоминалось выше, данная работа не закрывает полностью важный методический вопрос эквивалентности условий вилладж-систем и независимого культивирования. Проверка гипотезы на ИПСК не позволяет утверждать, что в случае других клеточных типов картина будет сохраняться. Частично разрешить этот вопрос позволит отслеживание динамических эффектов в данных scRNA-seq с использованием псевдовремени в дифференцирующихся до терминальных клеточных типов культурах, но сложность и стоимость таких тестов велика. Разные клеточные типы, вероятно, потребуют специфичных подходов — в некоторых тканях клетки справляются со своими функциями более автономно, в других — только поддерживая сложную и динамичную сеть взаимодействий (яркий пример — иммунные клетки в лимфоидных тканях); во втором случае можно предположить появление значительных вилладж-эффектов уже после завершения процесса трансдифференцировки.
Если же совместное культивирование донорских линий в различных востребованных практикой экспериментальных условиях не оказывает большего влияния на показатели экспрессии генов в клетках (по выражению одного из авторов метода псевдовремени, отсутствуют выраженные кросс-линейные эпистазы), чем проведение эксперимента персоналом разных лабораторий, то, как отметил первый автор исследования Дрю Нивин, этот подход может трансформировать нашу способность внедрять науку о стволовых клетках в высокоточные методы лечения. Полученные в исследованиях подобной системы результаты затем могут быть использованы в клинических испытаниях с целью предварительного отбора групп пациентов, которые, вероятно, получат от них пользу (а также, добавим, подход может удешевить персонализированную медицину, когда пациенты клиник при исследовательских медицинских центрах будут, возможно, получать лечение, подобранное на основе результатов тестов, проведенных на их клетках в объединенной культуре).
Литература
- Была клетка простая, стала стволовая;
- В поисках клеток для ИПСК — шаг за шагом к медицине будущего;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- В поисках клеток для ИПСК — шаг за шагом к медицине будущего;
- Noelia Antón Bolaños, Irene Faravelli, Tyler Faits, Sophia Andreadis, Sebastiano Trattaro, et. al. Multi-donor human cortical Chimeroids reveal individual susceptibility to neurotoxic triggers — Cold Spring Harbor Laboratory;
- Imogen R. Brooks, Cristina M. Garrone, Caoimhe Kerins, Cher Shen Kiar, Sofia Syntaka, et. al.. (2022). Functional genomics and the future of iPSCs in disease modeling. Stem Cell Reports. 17, 1033-1047;
- Michael F. Wells, James Nemesh, Sulagna Ghosh, Jana M. Mitchell, Max R. Salick, et. al.. (2023). Natural variation in gene expression and viral susceptibility revealed by neural progenitor cell villages. Cell Stem Cell. 30, 312-332.e13;
- Jana M. Mitchell, James Nemesh, Sulagna Ghosh, Robert E. Handsaker, Curtis J. Mello, et. al. Mapping genetic effects on cellular phenotypes with “cell villages” — Cold Spring Harbor Laboratory;
- Woochan Lee, Seyoon Lee, Jung-Ki Yoon, Dakyung Lee, Yuri Kim, et. al.. (2023). A single-cell atlas of in vitro multiculture systems uncovers the in vivo lineage trajectory and cell state in the human lung. Exp Mol Med. 55, 1831-1842;
- Drew R. Neavin, Angela M. Steinmann, Nona Farbehi, Han Sheng Chiu, Maciej S. Daniszewski, et. al.. (2023). A village in a dish model system for population-scale hiPSC studies. Nat Commun. 14;
- Christopher DeBoever, He Li, David Jakubosky, Paola Benaglio, Joaquin Reyna, et. al.. (2017). Large-Scale Profiling Reveals the Influence of Genetic Variation on Gene Expression in Human Induced Pluripotent Stem Cells. Cell Stem Cell. 20, 533-546.e7;
- Gioele La Manno, Ruslan Soldatov, Amit Zeisel, Emelie Braun, Hannah Hochgerner, et. al.. (2018). RNA velocity of single cells. Nature. 560, 494-498.








