Вирусная РНК-полимераза оказалась дальним родственником клеточных РНК-полимераз, участвующих в РНК-интерференции
19 марта 2020
Вирусная РНК-полимераза оказалась дальним родственником клеточных РНК-полимераз, участвующих в РНК-интерференции
- 610
- 0
- 2
Электронная микрофотография вирионов crAss-подобных фагов
-
Автор
-
Редактор
Тщательное изучение вирусных белков, даже самых многочисленных, подчас преподносит исследователям множество сюрпризов. Российские и американские ученые детально изучили РНК-полимеразу бактериофага φ14:2, входящего в семейство сrAss-подобных фагов — самой многочисленной группы вирусов в желудочно-кишечном тракте человека. Этот фермент упаковывается в вирионы вместе с вирусным геномом и участвует в транскрипции генов фага в начале инфекции. Исследователям удалось получить кристаллическую структуру РНК-полимеразы фага φ14:2, которая, как оказалось, очень похожа на эукариотические РНК-полимеразы, задействованные в РНК-интерференции. Авторы работы высказывают предположение, что эукариотические РНК-полимеразы, участвующие в РНК-интерференции, позаимствованы у фага, который, вероятно, инфицировал бактерию — предка митохондрий.
Чтобы совершить удивительное открытие в мире вирусов и микроорганизмов, вовсе не обязательно спускаться в океанские глубины, покорять горные вершины или забираться в другие труднодоступные места: зачастую необычные вещи спрятаны буквально у нас под носом. Так обстоят дела и с crAss-подобными бактериофагами , которые обитают в кишечнике каждого человека, но до сих пор оставались совершенно не изученными. Лишь в 2014 году, ученые, анализируя метагеном кишечного микробиома человека, обнаружили в нем последовательности ДНК, которые удалось собрать в геном длиной 100 тысяч пар оснований. Оказалось, что этот геном принадлежал ранее неизвестному бактериофагу, который получил название crAssphage (по названию метода, используемого для сборки генома — cross assembly) [1]. Выяснилось также, что crAssphage — это самый распространенный фаг в популяции человека. На его геном приходится до 90% всех ридов (прочтений), получаемых при секвенировании вирусной фракции микробиома кишечника человека [1]. Позже группа Евгения Кунина открыла, что в природе существует множество фагов, родственных crAss-фагу, но никто из них не был изучен в лабораторных условиях [2]. И это неудивительно, ведь большинство crAss-подобных фагов не культивировали в лаборатории, и мы знаем о них лишь из исследований метагеномов. Изучение crAss-подобных фагов представляет огромный интерес, поскольку они — самые многочисленные вирусы в кишечнике человека и, безусловно, оказывают влияние на наш микробиом . Кроме того, большинство генов crAss-подобных фагов мало на что похожи и кодируют новые, пока неизвестные белки.
О разнообразии и интересной жизни бактериофагов расскажет статья «Пожиратели бактерий: убийцы в роли спасителей» [3]. — Ред.
Микробиом кишечника настолько разнообразен по составу и функциям, что о нём можно написать десятки работ! Вот лишь несколько из опубликованных на «Биомолекуле»: «Микробиом кишечника: мир внутри нас», «Чего от нас хотят микробы?», «Микробные фармацевты внутри нас. Человеческий микробиом — спаситель и убийца» и «Кишечная микрофлора: третий нелишний в иммунотерапии рака» [4–7]. — Ред.
Российские и американские ученые, среди которых специалисты Сколковского института науки и технологий, нашли crAss-подобный вирус — φ14:2, удобно культивируемый в лаборатории, и, используя его как модель, разобрались, каким образом crAss-подобные фаги транскрибируют свои гены [8]. Фаг φ14:2 поражает бактерию Cellulophaga baltica. Один из его генов кодирует большой белок gp66 (2180 аминокислотных остатков, а. о.), аминокислотная последовательность которого содержит маленький участок (всего 50 а. о.), похожий на фрагмент одной из субъединиц клеточных РНК-полимераз. Этот участок включает мотив, содержащий три абсолютно консервативных остатка аспартата, которые в многосубъединичных РНК-полимеразах координируют ионы магния и образуют каталитический центр фермента. Чтобы изучить функции gp66 и его ортологов в других crAss-подобных фагах, ученые экспрессировали ген белка gp66 в клетках кишечной палочки E. coli, очистили белок и показали, что он действительно может синтезировать РНК по матрице ДНК в присутствии ионов магния. И это несмотря на то, что gp66 похож на обычные РНК-полимеразы лишь своим крошечным фрагментом (менее 3% от всей величины белка). Вот уж поистине иголку в стоге сена нашли и предсказали биоинформатики!
Какова роль gp66 в жизненном цикле вируса? Чтобы изучить функции gp66 in vivo, исследователи добавили к инфицированным клеткам бактерий C. baltica рифампицин — антибиотик, который блокирует работу бактериальных РНК-полимераз, но не действует на gp66. Под действием рифампицина с течением времени вирусных транскриптов в зараженных клетках становилось все больше, а бактериальных — все меньше. Стоит отметить, что гены вируса φ14:2, как и других вирусов, экспрессируются в зараженной клетке не одновременно. Первой начинается экспрессия так называемых ранних генов, к числу которых относятся гены, кодирующие компоненты репликативного аппарата (на них приходится около трети генома φ14:2). Далее «включаются» средние гены — гены экспрессионого модуля. Последними экспрессируются поздние гены, которые кодируют белки капсида. Анализ вирусных транскриптов показал, что рифампицин подавлял экспрессию поздних и средних генов, не влияя на экспрессию ранних. Исследователи сделали вывод, что за транскрипцию ранних генов отвечает именно белок gp66, который попадает в инфицированную клетку вместе с вирусным геномом. Кроме того, ранние гены φ14:2 не имеют особых мотивов, характерных для бактериальных промоторов (они известны как элементы –35 и –10 по месту своего нахождения относительно точки начала транскрипции). Зато эти мотивы есть в промоторах средних и поздних генов. Более того, эксперименты показали, что бактериальная РНК-полимераза успешно распознает такие промоторы in vitro. Таким образом, ранние гены φ14:2 транскрибирует его собственная РНК-полимераза — gp66, — а для экспрессии средних и поздних генов требуется РНК-полимераза клетки-хозяина.
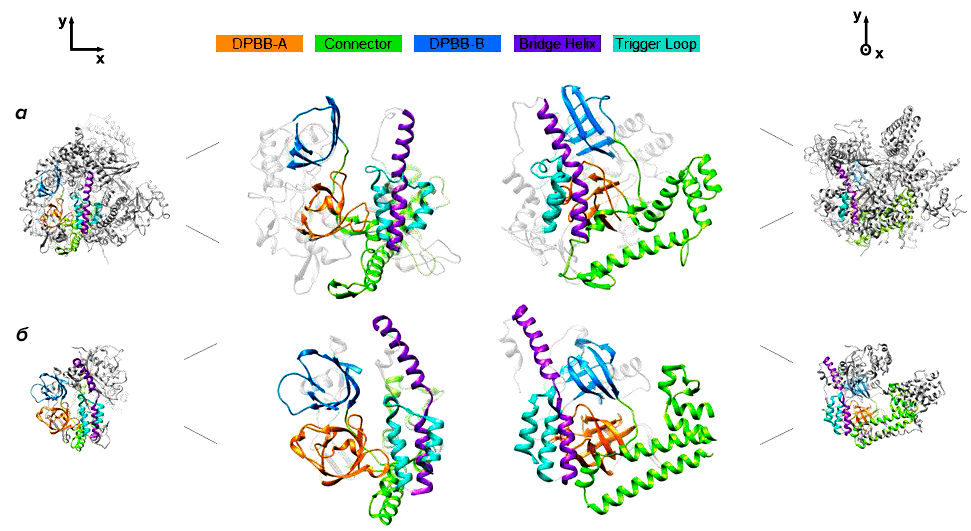
Самый достоверный и точный способ узнать, как именно функционирует белок, — разрешить его пространственную структуру. Но для этого необходимо получить кристаллы белка, что часто становится весьма нетривиальной задачей, особенно для таких больших белков, как gp66. Однако исследователи смогли кристаллизовать gp66 и получить его структуру с разрешением в 3,5 ангстрем с помощью рентгеноструктурного анализа.
По структуре gp66 оказался наиболее близок к РНК-полимеразе QDE-1 грибка Neurospora crassa, которая участвует в синтезе малых интерферирующих РНК (рис. 1) [9]. Стоит, однако, отметить, что высокая степень сходства между gp66 и эукариотическими РНК-полимеразами, синтезирующими малые интерферирующие РНК, наблюдается лишь в областях белков, критически важных для выполнения основных функций. РНК-полимераза gp66 значительно больше, чем QDE-1, и имеет много дополнительных доменов с пока неизвестными функциями.
РНК-полимераза N. crassa, наиболее близкая к gp66, и ее ортологи широко распространены у современных эукариот и, вероятно, имелись у последнего их общего предка [11]. Эти белки первоначально были описаны как РНК-зависимые РНК-полимеразы, хотя в дальнейшем оказалось, что in vitro они транскрибируют однонитевую ДНК намного эффективнее, чем РНК [12]. Авторы исследования предполагают, что РНК-полимеразы этой группы появились у эукариот благодаря вирусу, инфицирующему бактериального предка митохондрий. К слову, похожий сценарий заимствования РНК-полимераз у вирусов уже был описан. Так, транскрипционный аппарат митохондрий, по всей вероятности, произошел от РНК-полимеразы T7-подобных фагов, не родственной клеточным многосубъединичным РНК-полимеразам и полимеразам crAss-подобных фагов.
Что еще интересного можно сказать про РНК-полимеразы crAss-подобных фагов? Судя по всему, это необычайно гибкие белки, способные к денатурации и структурным перестройкам. Так, при инфицировании бактериальной клетки gp66, состоящий из 2180 а. о., ухитряется протиснуться через канал в хвосте фага диаметром всего около 4 нм. Скорее всего, для этого РНК-полимераза gp66 полностью разворачивается. Попав в цитоплазму клетки-хозяина, gp66 должен приобрести свою нативную структуру. Интересно, что структура, которую получили исследователи, имеет конформацию каталитического центра, ранее не описанную для других РНК-полимераз, и в такой форме не может поддерживать катализ. Вероятно, это способ регулировать активность РНК-полимераз crAss-фагов на поздних стадиях инфекции, и переход в активную форму происходит при упаковке РНК-полимеразы в капсид или во время ее выхода в цитоплазму клетки.
Профессор Центра наук о жизни Мария Соколова, руководившая исследованием, отмечает:
«Это первая работа, где изучили, как происходит развитие инфекции crAss-подобным фагом. До сих пор были опубликованы работы, где изучали распространенность crAss-подобных фагов, их связь с какими-либо заболеваниями и т.п. В одной работе crAss-подобного фага выделили из фекалий человека, но не продвинулись дальше масс-спектрометрического анализа его вирионов. Мы же разобрались в том, как транскрибируются гены фагов этой группы, используя ф14:2 как модельный организм. Кроме того, полученная нами структура — это первая структура РНК-полимеразы, которая имеет общее происхождение с многосубъединичными РНК-полимеразами клеточных организмов, но настолько сильно от них отличается, что совершенно неясно, как она функционирует! Существует какой-то необычный механизм регуляции активности этой РНК-полимеразы, над определением которого мы сейчас работаем. Это очень интересно с точки зрения эволюции РНК-полимераз и процесса транскрипции в целом. Ну и наконец, РНК-полимераза вируса ф14:2 — это первый белок crAss-подобных фагов, для которого была экспериментально установлена функция. Бионформатические подходы, конечно же, очень важны и без них бы мы ничего не знали, но без эксперимента они дают не более чем предсказание.
А еще, представьте, похожие РНК-полимеразы есть у каждого человека в кишечнике. Это не какой-то редкий белок, который мы выделили из редкого вируса, а представитель очень распространенной в природе группы РНК-полимераз, о которых до сих пор было совершенно ничего не известно».
Литература
- Bas E. Dutilh, Noriko Cassman, Katelyn McNair, Savannah E. Sanchez, Genivaldo G. Z. Silva, et. al.. (2014). A highly abundant bacteriophage discovered in the unknown sequences of human faecal metagenomes. Nat Commun. 5;
- Natalya Yutin, Kira S. Makarova, Ayal B. Gussow, Mart Krupovic, Anca Segall, et. al.. (2018). Discovery of an expansive bacteriophage family that includes the most abundant viruses from the human gut. Nat Microbiol. 3, 38-46;
- Пожиратели бактерий: убийцы в роли спасителей;
- Микробиом кишечника: мир внутри нас;
- Чего от нас хотят микробы?;
- Микробные фармацевты внутри нас. Человеческий микробиом — спаситель и убийца;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- Drobysheva A.V., Panafidina S.A., Kolesnik M.V., Klimuk E.I., Minakhin L., Yakunina M.V. et al. (2020). Structure and function of virion RNA polymerase of crAss-like phage. bioRxiv;
- Carlo Cogoni, Giuseppe Macino. (1999). Gene silencing in Neurospora crassa requires a protein homologous to RNA-dependent RNA polymerase. Nature. 399, 166-169;
- Paula S Salgado, Minni R. L Koivunen, Eugene V Makeyev, Dennis H Bamford, David I Stuart, Jonathan M Grimes. (2006). The Structure of an RNAi Polymerase Links RNA Silencing and Transcription. PLoS Biol. 4, e434;
- S SHABALINA, E KOONIN. (2008). Origins and evolution of eukaryotic RNA interference. Trends in Ecology & Evolution. 23, 578-587;
- Heng-Chi Lee, Antti P. Aalto, Qiuying Yang, Shwu-Shin Chang, Guocun Huang, et. al.. (2010). The DNA/RNA-Dependent RNA Polymerase QDE-1 Generates Aberrant RNA and dsRNA for RNAi in a Process Requiring Replication Protein A and a DNA Helicase. PLoS Biol. 8, e1000496.