За пределами порядка
20 марта 2011
За пределами порядка
- 3295
- 7
- 3
В 1890 году — задолго до выяснения пространственного строения ферментов — немецкий химик Эмиль Фишер для объяснения специфичности ферментативных реакций выдвинул гипотезу «ключ—замóк», предполагающую точное соответствие форм фермента и субстрата. С тех пор стало ясно, что пластичность — неотъемлемое свойство биологических молекул (модель «рука—перчатка»), а теперь оказывается, что во многих случаях «ключ» даже не обязан иметь какой-либо определенной формы, чтобы, тем не менее, открывать совершенно конкретный «замóк».
-
Авторы
-
Редакторы
Несмотря на то, что одна из догм молекулярной биологии утверждает необходимость существования уникальной упорядоченной структуры молекулы белка для воплощения его функции, многие из белков функционируют и прекрасно себя «чувствуют» в состоянии полного «беспорядка». Исследования последних лет показывают, что такие неструктурированные белки отнюдь не исключение, а вполне себе правило.
Развитие молекулярной биологии в последние полвека можно вполне считать диалектическим — «незыблемые» догмы и правила появляются, господствуют на протяжении десятилетий, а затем задорно опровергаются, уступая место новым постулатам. Например, сформулированная Ф. Криком в 1958 г. центральная «догма» молекулярной биологии была задумана как обобщение направления реализации генетической информации в природе (ДНК → РНК → белок), но эту схему столь быстро стало можно соединять стрелками в почти любом направлении, так что говорить о ней сейчас целесообразно только в исторической ретроспективе.
Аналогично мы наблюдаем, как меняются представления о фолдинге белковой молекулы. Изначально К. Анфинсен предложил формулировку, согласно которой каждый белок имеет фиксированную и уникальную пространственную структуру, которая определяет его биологическую функцию. («Биомолекула» уже не раз освещала эти вопросы [1], [2].) Однако на сегодняшний день известны примеры, которые можно считать исключениями из сформулированных Анфинсеном положений (уникальность, стабильность и высокая скорость спонтанного формирования структуры белка). Белки могут иметь практически идентичные аминокислотные последовательности, которые, тем не менее, кодируют различные структуры и функции [3], [4]. Или даже одна последовательность обеспечивает наличие двух различных нативных структур, играющих каждая свою биологическую роль [5].
Ещё одним таким «исключением» являются «функционально неупорядоченные белки» (от англ. Intrinsically unstructured proteins), особенностью которых является отсутствие фиксированной пространственной структуры [6], — для всей молекулы или ее части. При этом они отнюдь не являются «клеточным мусором», а выполняют важные функции, для которых такая повышенная пластичность, по-видимому, является обязательным условием.
Длительное время на такие белки обращали мало внимания как на какой-то нелепый курьез, но сейчас становится понятно, что их роль в клетке весьма существенна, а число — велико. (Другой пример «молекулярного курьеза» — белки, чья основная цепь «завязана» в узлы — protein knots.) Профессор Кейт Данкер (Keith Dunker) из университета Индианы (Индианаполис, США) увлекся неструктурированными белками в 1995 году, когда на одном семинаре его в самое сердце поразили слова докладчика-кристаллографа, что именно та часть молекулы белка, которая не «видна» в структуре из-за аномально высокой подвижности, выполняет самую важную работу. С коллегами он создал компьютерную программу, которая по аминокислотной последовательности предсказывает неструктурированные белки, — и оказалось, что до 40% всех белков имеют фрагменты без выраженной конформации, а около ¼ — не структурированы от начала до конца [7]. Впрочем, эта программа (и ей подобные) получила свою дозу критики за то, что «нормальные» белки иногда тоже распознаются ею как неструктурированные.
Биофизические эксперименты указывают на то, что высокая пластичность неструктурированных белков лежит в основе их функции и позволяет им связываться с бóльшим числом уникальных белков-партнеров, чем это дано «обычным» белкам. Таким образом, роль белков, не имеющих фиксированного пространственного строения, уже нельзя игнорировать, — как было заявлено прямо в названии обзора Питера Райта (Peter Wright), биофизика из НИИ Скриппса (Ла-Хойя, Калифорния, США), основательный пересмотр парадигмы «структура—функция» неизбежен [8]. Впрочем, некоторых разговоры об изменении парадигмы не особо волнуют: например, кристаллограф Томас Стейц (Thomas Steitz), лауреат Нобелевской премии по химии за 2009 год [9], говорит: «Моей мантрой всегда было: функция требует структуры. Конечно, какая-то подвижность необходима, — видимо, она играет существенную роль в процессе сборки, однако это не заслуживает особого интереса, раз белки все равно делают то, что им предписано» [10].
Наиболее острым вопросом в этой области как в 1999-м, когда вышел обзор Райта, так и сейчас, является — каким же образом белок выполняет работу, если молекула не имеет строго фиксированной формы? Поскольку сама идея высокой пластичности явно противоречит ранее господствовавшей в биохимии концепции «ключа и замка», может показаться, что заставить неструктурированный белок работать — это все равно, как открыть замок вместо ключа варёной макарониной.
Выход из этого парадокса был найден в лаборатории Райта в 2007 году: выражаясь образно, оказалось, что макаронина принимает форму ключа непосредственно при контакте с замком! В исследовании регулятора работы генов белка CREB обнаружили, что для «включения» гена этому регулятору необходимо связаться не только с ДНК, но и с ещё одним белком — CBP, — но ответственная за это взаимодействие часть CREB пребывает именно в неупорядоченном состоянии. Ученым удалось адаптировать методику ЯМР-спектроскопии для сверхбыстрой регистрации динамики белковой цепи CREB, и выяснилось, что при взаимодействии с белком CBP неупорядоченный участок одновременно сворачивается и сам, принимая форму того самого «ключа» [11]. Что самое интересное, этот процесс очень напоминает схему сворачивания «обычного» глобулярного белка с образованием нескольких ключевых дальних взаимодействий в полипептидой цепи с последующим почти мгновенным переходом в свернутую форму, — только тут эти взаимодействия образуются не внутри одной молекулы, а с участием того белка, который необходимо «распознать». Сам Райт считает, что отсутствие заранее заданной структуры в данном случае является преимуществом, которое позволяет сигнальным белкам очень гибко и вполне селективно взаимодействовать между собой.
Тотальный беспорядок
Мантра структура—функция испытала еще больший удар со стороны белков, которые вообще никогда не сворачиваются, даже связавшись со своими функциональными белками-партнерами. К их числу относится Sic1 — регулятор клеточного цикла, который «запирает» ДНК, делая её недоступной для репликации до тех пор, пока клетке не придёт пора делиться. В лаборатории специалиста по клеточному циклу дрожжей Майка Таерса (Mike Tyers) в Университете Торонто (Канада) открыли, что когда Sic1 фосфорилируется одновременно по шести остаткам в молекуле, он способен связаться с белком Cdc4, направляющем Sic1 в протеасому на «переработку». Это, в свою очередь, открывает возможность для беспрепятственной репликации ДНК [12]. Примечательно, что требуется фосфорилирование именно шести остатков (четыре или пять недостаточно), — и это при том, что Cdc4 имеет только один фосфат-распознающий сайт. Каким же образом ему удается «досчитать до шести», если на его «руке» только один палец?
Все попытки кристаллизовать Sic1 провалились, и позже с помощью ЯМР-спектроскопии удалось показать, что этот белок является неструктурированным не только в свободном состоянии, но и в связанной с Cdc4 форме [13]! Комплекс двух белков оказался «конформационной смесью» нескольких состояний, равновесно переходящих друг в друга, и в которых каждая фосфатная группа по очереди занимает сайт связывания на поверхности Cdc4 (см. «Порядок из хаоса»). Согласно компьютерной модели, каждая из шести фосфатных групп необходима для создания достаточно сильного электростатического поля, обеспечивающего формирование стабильного комплекса между Cdc4 и Sic1. В таком связанном виде Cdc4 обеспечивает взаимодействие Sic1 с лигазным комплексом E3. При этом конформационная лабильность Sic1, видимо, обеспечивает доступность различных частей молекулы для фермента, навешивающего убиквитиновые «черные метки» [14], [15] — сигнал к последующей деградации.
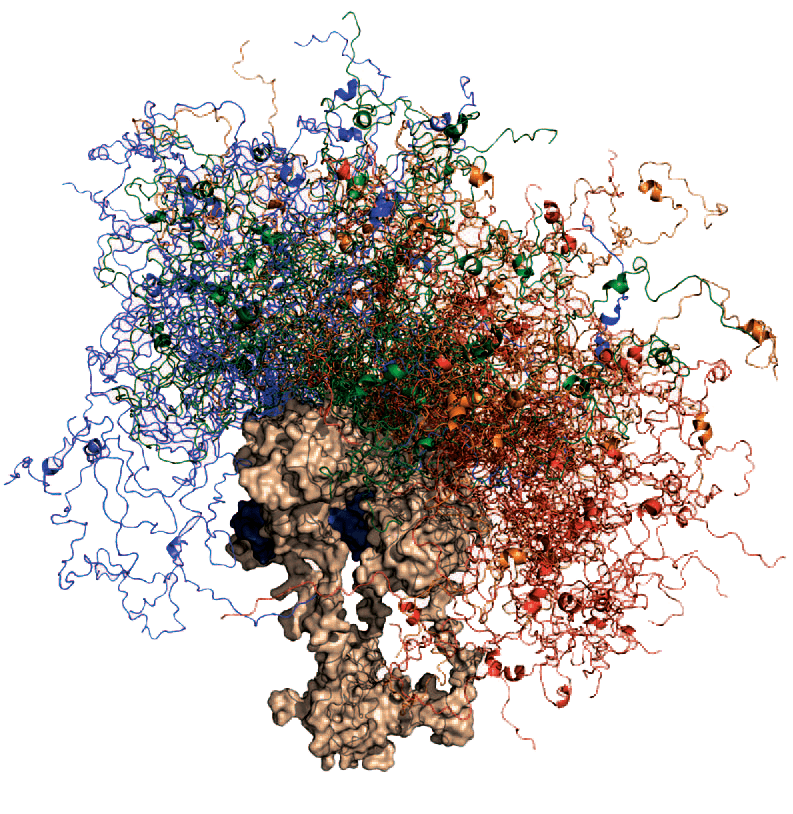
Как оказалось, среди неструктурированных белков наличие множественных сайтов взаимодействия с белками-партнерами — дело не редкое. Видимо, такая множественность позволяет реагировать на сигналы сразу от многих молекул, что особенно важно для белков-«концентраторов», находящихся в центре многочисленных сигнальных путей. Этим белкам необходимо очень быстро обрабатывать изменения, происходящие в их клеточном окружении. Характерным примером является супрессор опухолей p53 (рис. 1), вовлеченный в несчетное количество сигнальных путей и связанный с течением большинства форм рака. Его впечатляющая разноплановость связана с необычной структурой, сочетающей как упорядоченные, так и неструктурированные фрагменты. Глобулярное ядро молекулы отвечает за связывание с ДНК и лишь несколькими другими белками; два неструктурированных «крыла» обеспечивают взаимодействие с десятками, если не сотнями других белков, при этом одно из них содержит модуль, «переключающий» структуру в зависимости от белка-партнера [16].
Как предсказать беспорядок?
Недоверие большинства ученых к неструктурированным белкам вызвано еще и тем, что биохимики, выделяя белковые экстракты из живых тканей или суспензий бактерий, боролись больше всего как раз с разворачиванием и «слипанием» белков, а также с расщеплением их протеазами. С такой предысторией непросто поверить, что развернутые и неструктурированные белки могут быть чем-то, кроме мусора.
Однако исследователи таких белков уверяют, что эти опасения напрасны: в самой клетке неспецифические протеазы обычно «заперты» внутри лизосом. «Слипания» и агрегации неструктурированных белков не происходит, потому что в них чрезвычайно мало объемных гидрофобных аминокислотных остатков, образующих в глобулярных белках «ядро сворачивания» и заодно ответственных за агрегацию, если белок развернут или свернут неправильно.
Аминокислотный состав неструктурированных белков — главным образом, полярные и заряженные остатки, — скорее всего, был оптимизирован естественным отбором, так что сам по себе он не является признаком отсутствия структуры. Алгоритмы для предсказания неструктурированных белков «настроены» именно на характеристики конкретных типов последовательностей, — что и объясняет их неточность (как неверное предсказание для белков, которые на самом деле очень хорошо сворачиваются, так и неспособность предсказать неструктурированность многих гидрофобных последовательностей).
Вообще, программа Данкера и аналогичные алгоритмы обеспечивают точность предсказания порядка всего 80%, что, конечно, больше 50%, соответствующих случайному выбору. Кристаллографы используют эти предсказания, чтобы заранее установить белки, которые, скорее всего, бесполезно пытаться кристаллизовать. «Программы-предсказатели беспорядка достаточно примитивны, но они все же очень помогают нам», — говорит Адам Годзик (Adam Godzik), глава биоинформатического подразделения программ по структурной геномике [17] в США. В сети работает также база DisProt, содержащая не предсказания, а экспериментально подтвержденную информацию о неструктурированных белках; она также поддерживается лабораторией Данкера.
Мало-помалу, основная «догма» молекулярной биофизики изменяется: сегодня уже не приходится говорить о жесткой связи фиксированной трехмерной структуры белка с функцией. Открыт полный спектр типов пластичности белковой молекулы: от классической схемы «ключ—замок» до полностью неструктурированного генетического регулятора Sic1, со всеми промежуточными вариантами. Однако изучение этих объектов только начинается и не обещает быть простым и быстрым — работы по Sic1 потребовали 10 лет труда шести лабораторий и самых современных биохимических, биофизических и компьютерных методик.
Однако Данкер, Райт и другие «охранники беспорядка» настроены оптимистично. По их общему мнению, сейчас исследования неструктурированных белков во многом напоминают романтическое время получения первых белковых кристаллов в 1950–1960-х, когда каждая новая структура была настоящим событием. Однако прежде чем удастся до конца понять загадку неструктурированных белков, ученым еще долго придется выискивать правила в их на первый взгляд хаотической организации.
Написано по материалам Nature [10].
Литература
- Компьютерные игры в молекулярную биофизику биологических мембран;
- Торжество компьютерных методов: предсказание строения белков;
- Непохожие «гомологичные» белки;
- Из пункта А в пункт Б за один ход;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Недоупорядоченные белки;
- Vladimir N. Uversky, A. Keith Dunker. (2010). Understanding protein non-folding. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1804, 1231-1264;
- Peter E Wright, H.Jane Dyson. (1999). Intrinsically unstructured proteins: re-assessing the protein structure-function paradigm. Journal of Molecular Biology. 293, 321-331;
- Белоксинтезирующая Нобелевская премия по химии (2009);
- Tanguy Chouard. (2011). Structural biology: Breaking the protein rules. Nature. 471, 151-153;
- Kenji Sugase, H. Jane Dyson, Peter E. Wright. (2007). Mechanism of coupled folding and binding of an intrinsically disordered protein. Nature. 447, 1021-1025;
- Piers Nash, Xiaojing Tang, Stephen Orlicky, Qinghua Chen, Frank B. Gertler, et. al.. (2001). Multisite phosphorylation of a CDK inhibitor sets a threshold for the onset of DNA replication. Nature. 414, 514-521;
- T. Mittag, S. Orlicky, W.-Y. Choy, X. Tang, H. Lin, et. al.. (2008). Dynamic equilibrium engagement of a polyvalent ligand with a single-site receptor. Proceedings of the National Academy of Sciences. 105, 17772-17777;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Christopher J Oldfield, Jingwei Meng, Jack Y Yang, Mary Qu Yang, Vladimir N Uversky, A Keith Dunker. (2008). Flexible nets: disorder and induced fit in the associations of p53 and 14-3-3 with their partners. BMC Genomics. 9, S1;
- Ловля бабочек, или Чем структурная геномика поможет биологии.