
Зрительный родопсин — рецептор, реагирующий на свет
10 марта 2007
Зрительный родопсин — рецептор, реагирующий на свет
- 32020
- 11
- 14
Родопсин, фоторецептор клеток-«палочек» сетчатки, обесцвечивается при освещении в зависимости от дозы излучения.
-
Автор
-
Редактор
Зрение — одно из наиболее удивительных чувств, которым природа наградила человека. С помощью зрения мы получаем огромное количество информации об окружающем мире, можем наслаждаться красотами природы и великими произведениями искусства. За восприятие электромагнитного излучения «видимого диапазона», лежащее в основе зрения, отвечает рецептор белковой природы, содержащийся в фоторецепторной мембране «дисков» клеток сетчатки глаза, — родопсин.
Введение
Родопсин — светочувствительный пигмент (хромопротеин) фоторецепторных клеток сетчатки глаза позвоночных — является в настоящее время одним из наиболее изученных мембранных белков. Сетчатка глаза (рис. 1) преобразует свет в нервные сигналы, определяя чувствительность зрения в различных диапазонах освещенности — от звездной ночи до солнечного полдня. Сетчатка образована двумя главными типами зрительных клеток — палочками (около 120 млн. клеток на сетчатку человека) и колбочками (около 7 млн. клеток). Колбочки, сконцентрированные преимущественно в центральной области сетчатки (называемой центральной ямкой), функционируют только при ярком свете и отвечают за цветовое зрение и чувствительность к мелким деталям, а более многочисленные палочки ответственны за зрение в условиях слабой освещенности и отключаются при ярком освещении. (Это является причиной того, что ночью невозможно уверенно различить цвета предметов. Ночью, как известно, «все кошки серы».)

Рисунок 1. Структурные элементы зрительной системы человека. В увеличенном фрагменте сетчатки показано относительное расположение трёх её слоёв. Задний слой сетчатки состоит из длинных и узких клеток фоторецепторов — палочек и колбочек. Средний слой содержит нейроны трёх типов: биполярные, горизонтальные (соединяющие рецепторы и биполярные клетки сравнительно длинными связями, параллельными сетчаточным слоям) и амакриновые клетки. В переднем слое находятся ганглиозные клетки, аксоны которых проходят по поверхности сетчатки, собираясь в пучок, и покидают глаз, образуя зрительный нерв.
[1], рисунок адаптирован
Мембраны колбочек содержат три типа рецепторов-опсинов, отвечающих за восприятие света с различными длинами волн, — синего, зеленого и красного пигментов. Аминокислотная последовательность, структура и механизм работы этих белков очень близки к таковым для родопсина, однако тонкие различия в белковом окружении светочувствительного кофактора (ретиналя) приводят к тому, что их спектральные характеристики различаются (рис. 2). В этой статье речь пойдет главным образом о зрительном родопсине, содержащемся в светочувствительных мембранах клеток-палочек.
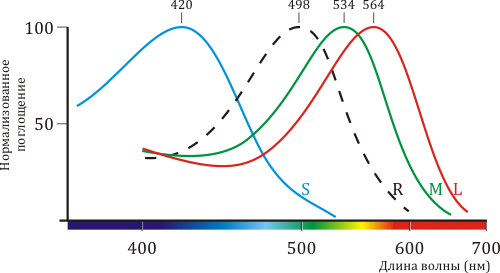
Рисунок 2. Спектральные характеристики родопсина и трёх других типов опсинов. Цветное зрение приматов трихроматично, то есть определяется тремя типами клеток-«колбочек», содержащих каждая свой тип светочувствительного пигмента, по аминокислотной последовательности и структуре очень схожего с родопсином. На рисунке приведены нормализованные спектры поглощения «синего» (β), «зелено-голубого» (γ) и «жёлто-зеленого» (ρ) пигментов из S-, M- и L-колбочек, соответственно. Также показан спектр родопсина из клеток-«палочек» (обозначен пунктиром).
[2], рисунок адаптирован
История изучения родопсина
Открытие родопсина
Пурпурная окраска клеток-палочек была открыта Генрихом Мюллером (Heinrich Müller) в 1851 году, который приписал её гемоглобину. В 1876 году Франц Болл (Franz Boll) заметил, что сетчатка лягушки чувствительна к свету и после освещения меняет свою окраску на жёлтую с последующим обесцвечиванием. Болл также продемонстрировал, что сетчатка приобретает изначальную окраску после некоторого времени, проведенного животным в темноте. Вилли Кюхне (Willy Kühne), продолживший работы Болла, определил, что пигмент, отвечающий за окраску сетчатки — это белок наружных сегментов палочек (НСП), названный им «зрительным пурпуром» (родопсином).
Кюхне выделил родопсин из клеток пигментного эпителия сетчатки, сравнил спектроскопические свойства этого белка и препарата сетчатки, постулировал, что жёлтый и бесцветный продукты, образующиеся под действием света, химически различны и заключил, что генерация сетчаткой электрических импульсов является следствием реакции на свет. Работы Кюхне легли в основу современного понимания молекулярных механизмов зрения.
Ретиналь — светочувствительный кофактор
Джордж Уолд (George Wald) и его коллеги по Гарвардскому университету впервые открыли, что родопсин состоит из двух компонентов — бесцветного белка, называемого опсином или жёлтым пигментом и 11-цис-ретиналя, ковалентно связанного хромофора каротиноидной природы, акцептирующего свет.
В 1933 году Уолд выделил из препарата сетчатки вещество, первоначально идентифицированное как витамин А, что объяснило феномен «куриной слепоты» у пациентов с авитаминозом по этому каротиноиду (к тому времени еще мало было известно о биохимической роли витаминов). Позже оказалось, что кофактором является ретиналь — соответствующий витамину А (ацетату ретинола) альдегид. Уолд и коллеги продемонстрировали, что ретиналь, добавленный в темноте к обесцвеченному родопсину, способен восстанавливать «свежий» пигмент, причём этим действием обладает только 11-цис-изомер. В 1967 году Уолд получил Нобелевскую премию по физиологии и медицине «за исследования в области физиологии и биохимии зрения», а также за открытие биохимической роли витамина А.
На пути к пространственной структуре родопсина
Полная аминокислотная последовательность родопсина была определена в 1982 году в Институте биоорганической химии АН СССР Ю. А. Овчинниковым и сотр. [3] и несколько позже подтверждена анализом структурного гена родопсина Д. Хоггнесом и Дж. Натансом в США. Было показано, что в последовательности родопсина длиной 348 аминокислотных остатков присутствует семь протяжённых участков, состоящих из неполярных аминокислотных остатков, образующих трансмембранные (ТМ) α-спирали, соединенные вне- и внутриклеточными участками-«петлями». При этом N-конец находится во внеклеточной области, а C-конец — в цитоплазматической. Такая топология рецептора была подтверждена ограниченным протеолизом белка в составе нативной мембраны, обработкой моноклональными антителами и химической модификацией проникающими и непроникающими агентами. Также было установлено место прикрепления кофактора: ретиналь связывается альдиминной связью с остатком ЛИЗ-296, находящимся в седьмой (последней) ТМ α-спирали.
Пространственная структура родопсина долго не поддавалась изучению «прямыми» методами (такими как рентгеноструктурный анализ (РСА) и спектроскопия ядерного магнитного резонанса (ЯМР)). В то время как атомная структура другого мембранного белка со схожей семиспиральной топологией — бактериородопсина — была определена Гендерсоном и сотр. еще в 1990-м году [4], структура зрительного родопсина высокого разрешения оставалась неизвестной до 2000 года. Подробнее об этой структуре написано в главе «Структура родопсина».
Родопсин принадлежит к обширному семейству G-белоксопряжённых рецепторов (GPCR-рецепторов), названному так за механизм трансмембранной передачи сигнала, основанный на взаимодействии с внутриклеточными примембранными G-белками. Появление его пространственной структуры, полученной с высоким экспериментальным разрешением, является очень важным событием для биологии и медицины, поскольку родопсин как «родоначальник» семейства А GPCR-рецепторов является своего рода «моделью» структуры и функций множества других рецепторов, чрезвычайно интересных с фундаментальной и практической (фармакологической) точек зрения.
Молекулярная основа зрения
Строение фоторецепторных клеток
Клетки-«палочки» сетчатки (также известные как фоторецепторные клетки) — это высокоспециализированные нейроны, способные реагировать на свет. Особая часть клетки, называемая наружным сегменом палочки (НСП, см. рис. 3а), содержит 1000–2000 мембранных органелл, называемых дисками. Диски уложены в «стопки» (подобно блинам) и располагаются внутри общей с остальными частями клетки плазматической мембраны (рис. 3б). Диски как бы «отпочковываются» от плазматической мембраны, при этом их внутренняя область гомологична внеклеточному пространству (рис. 3в). Наружные сегменты колбочек имеют принципиальное отличие от НСП, заключающееся в том, что диски колбочек представляют собой складки плазматической мембраны (а не самостоятельные органеллы), и их внутреннее пространство сообщается с внеклеточной средой.

Рисунок 3. Строение сетчатки и зрительной клетки-фоторецептора — «палочки». а — Сканирующая электронная микрофотография сетчатки мыши. Палочки составляют ~70% из всех (6,4×106) клеток сетчатки, на долю колбочек приходится ~2%. Наружные сегменты палочек (НСП) содержат «диски», мембрана которых обогащена родопсином, а внутренние сегменты (ВС) отвечают за обеспечение клетки энергией и питательными веществами. б — Электронная микрофотография НСП, выделенного из сетчатки мыши. Молярное соотношение между родопсином и фосфолипидами мембраны «дисков» — ~1:60; доля других белков в мембране невелика, и их роль в процессе зрения пока остаётся невыясненной. в — Схематичное изображение клетки-палочки. Под действием света проницаемость мембраны НСП для ионов падает, что приводит к гиперполяризации и возникновению нервного импульса. г, д — Квазитопографическое изображение поверхности родопсин-содержащей мембраны диска, полученное с помощью атомно-силовой микроскопии в разном масштабе. Пунктирным овалом обведен димер родопсина, «выбившийся» из рядов, образуемых другими димерами. Считается, что активной формой рецептора, способной к реакции на свет, является именно димер.
Основной белковый компонент (>90%) фоторецепторных мембран — родопсин, занимающий ~50% площади поверхности мембраны дисков (родопсин также присутствует в небольших количествах в плазматической мембране клетки). Мембрана дисков состоит из фосфолипидов (40% фосфатидилхолина, 38% фосфатидилэтаноламина, 13% фосфатидилсерина) и холестерина. Высокая доля ненасыщенных жирных кислот (~80%) делает фоторецепторную мембрану чрезвычайно жидкой, что имеет важное значения для функционирования родопсина.
В фоторецепторной мембране молекулы родопсина образуют димеры (см. главу «Взаимодействие родопсина с G–белком трансдуцином»), располагающиеся рядами (рис. 3г–д). Среднее число молекул родопсина на один диск — ~8×104, что в расчете на целую сетчатку даёт около 1014–1015 молекул фоторецептора.
Биохимический каскад зрения
В плазматической мембране НСП позвоночных, не сообщающейся с мембранами дисков, расположены специальные каналы, специфичные для катионов Na+ и Ca2+ и зависящие от циклического гуанозинмонофосфата (цГМФ). В темноте часть этих каналов открыта и названные катионы могут свободно диффундировать из внеклеточного пространства в цитозоль. Этот «темновой ток» ионов, открытый в 1970 году Вильямом Хейгинсом, вызывает деполяризацию плазматической мембраны НСП — «темновая» трансмембранная разность потенциалов НСП составляет ~50 мВ вместо обычных для нервной клетки 70 мВ. Как и «обычные» нейроны, палочки вырабатывают медиатор в ответ на деполяризацию, и таким образом получается, что в темноте фоторецепторы постоянно возбуждены и вырабатывают нервный импульс.
В результате поглощения кванта света молекулой родопсина инициируется цепь биохимических событий, следствием которой является закрытие катионных (Na+/Ca2+) каналов, уменьшение темнового тока и гиперполяризация плазматической мембраны (увеличение положительного заряда на внешней поверхности клетки). Свет, повышая разность потенциалов на мембране рецепторной клетки (гиперполяризуя её), уменьшает выделение медиатора, фактически «выключая» рецепторы. При этом эффективность биохимического каскада настолько высока (коэффициент усиления 105–106), что один-единственный (!) фотон может привести к гиперполяризации и быть зарегистрирован в зрительной коре мозга.
Поглощение родопсином кванта света приводит к ряду его фотохимических превращений, первым этапом которых является фотоизомеризация 11-цис-ретиналя в полностью транс-форму (подробнее об этом и других фотопревращениях родопсина см. в главе «Фотоцикл родопсина»). Изомеризация ретиналя, протекающая за очень короткое время в 200 фс, — единственный светозависимый процесс в зрительном цикле; остальные процессы сопряжены с конформационными перестройками в молекуле родопсина и являются следствием этого первичного акта поглощения света. Наибольшую важность для биохимических реакций, приводящих к возникновению фоторецепторного ответа, представляет один из интермедиатов фотолиза — метародопсин II (максимум на спектре поглощения λmax=380 нм), который содержит полностью транс-ретиналь и характеризуется значительными конформационными перестройками по сравнению с «темновой» формой родопсина.
Метародопсин II (R*, «световая» или «активированная» форма родопсина R) способен связывать особый G-белок, называемый трансдуцином, передающий возбуждение, сконцентрированное на молекуле трансмембранного рецептора, в жидкую фазу цитоплазмы. Трансдуцин (Т) относится к семейству гетеротримерных G-белков и состоит из трех субъединиц (Тα, Тβ и Тγ с массами 40, 37 и 8 кДа соответственно), в первой из которых (Тα) находится сайт связывания гуанидиновых нуклеотидов ГДФ и ГТФ. В темноте (рис. 4а) Тα-субъединица содержит связанную молекулу ГДФ и образует комплекс с субъединицами Тβ и Тγ (функционирующими как димер Тβγ). Комплекс (Тα–ГДФ)–Тβγ имеет высокое сродство к метародопсину II (R*), и после реакции с ним молекула связанного ГДФ обменивается на ГТФ (рис. 4б). Комплекс R*–(Тα–ГТФ)–Тβγ быстро диссоциирует на R*, активный компонент Тα–ГТФ и димер Тβγ. Освобождённая молекула R* способна катализировать распад еще сотен или даже тысяч трансдуциновых комплексов (рис. 4в), что является первым этапом усиления сигнала в процессе передачи зрительного сигнала (см. также видео).
Активный комплекс Тα–ГТФ, в свою очередь, активирует следующий белок зрительного каскада — гетеротетрамерную фосфодиэстеразу (ФДЭ) циклического ГМФ (цГМФ). Активация этого белка, локализованного на поверхности мембран дисков, приводит к расщеплению эффекторной молекулы — до трех тысяч молекул цГМФ на одну молекулу активного фермента (рис. 4г) — и инактивации цГМФ-зависимых катионных каналов, приводящей к гиперполяризации плазматической мембраны.
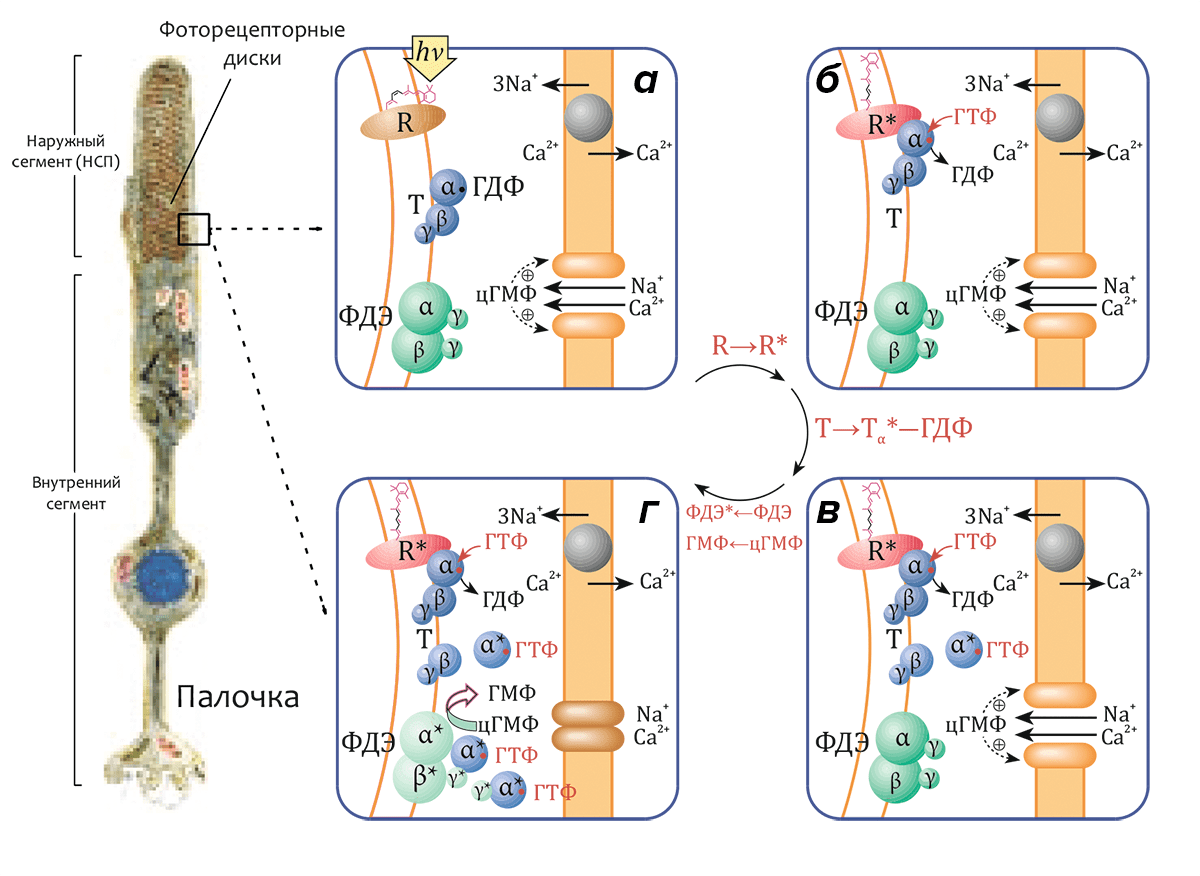
Рисунок 4. Схема активации зрительного каскада. а — В «темновом» состоянии родопсин неактивен (R). α-субъединица трансдуцина (Т) находится в комплексе с ГДФ (Тα–ГДФ) и связана с димером β- и γ-субъединиц (Тβγ). цГМФ-диэстераза (ФДЭ) — гетеротетрамер, состоящий из двух гомологичных каталитических α- и β-субъединиц (ФДЭαβ) и двух идентичных γ-субъединиц, являющихся внутримолекулярными ингибиторами фермента, также неактивна. Гуанилатциклаза поддерживает высокий уровень цГМФ в цитоплазме. цГМФ-зависимые катионные каналы в плазматической мембране открыты, и катионы Na+ и Ca2+ могут диффундировать из внеклеточного пространства в цитозоль. Внутриклеточная концентрация Ca2+ поддерживается на постоянном уровне находящимся в плазматической мембране Na+/Ca2+,K+-катионообменником. б — В результате поглощения кванта света родопсин переходит в активное состояние (R→R*). Активный R* связывается с трансдуцином и индуцирует обмен связанного с Тα ГДФ на ГТФ (см. видео). в — Комплекс R*–(Тα–ГТФ)–Тβγ диссоциирует на R*, Тβγ и активный комплекс Тα*–ГТФ, после чего R* способен активировать другую молекулу трансдуцина. г — Тα*–ГТФ активирует ФДЭ (ФДЭαβ*), которая гидролизует множество молекул цГМФ. Снижение внутриклеточной концентрации цГМФ приводит к закрытию цГМФ-зависимых каналов, что влечет за собой гиперполяризацию плазматической мембраны. Слева приведено схематическое изображение палочки сетчатки.
[1], рисунок адаптирован
Электрофизиологический эффект фоторецепторной клетки на световой стимул длится в течение сотен миллисекунд, а затем прекращается благодаря специальным механизмам, «выключающим» фосфодиэстеразный каскад и восстанавливающим «темновое» состояние. «Активированная» форма родопсина (R*) трижды фосфорилирована в C-конце (см. главу «Трансмембранная топология»), и имеет сродство к цитоплазматическому белку аррестину, который блокирует взаимодействие с трансдуцином и участвует в десенсибилизации и деградации рецептора. Подробнее об этом механизме см. в статье В.М. Липкина в «Соросовском образовательном журнале» [1].
Фотоцикл родопсина
При поглощении фотона молекула родопсина меняет цвет, что связано с фотоизомеризацией 11-цис-ретиналя в полностью транс-форму и смещением максимума спектра поглощения рецептора с 498 нм до 380 нм (рис. 5). В конце концов, Шиффово основание гидролизуется и полностью транс-ретиналь выделяется в цитоплазматическую среду. Изменение спектральных характеристик родопсина, следующее за поглощением кванта света, объясняется конформационными перестройками, вызванными изомеризацией ретиналя. В большом количестве спектроскопических экспериментов с охлаждением родопсина до очень низких температур был выделен ряд промежуточных его состояний (рис. 5), что позволило охарактеризовать последовательность фотопревращений родопсина следующим образом:
- Ещё до начала каких-либо структурных перестроек родопсина энергия света аккумулируется молекулой хромофора в сильно искажённой полностью транс-форме, расположенной в том же белковом сайте связывания, где находится 11-цис-ретиналь в темноте. «Напряжённая» конформация изомеризованного хромофора трансформирует свою энергию в дальнейшие конформационные изменения родопсина.
- Фотоизомеризация хромофора чрезвычайно быстра и занимает всего 200 фс.
- Состояние мета-I (рис. 5) является переходным и довольно быстро превращается в мета II, являющееся «главным действующим лицом» биохимического каскада зрения.
- Фотоинтермедиат мета-II — физиологически и биохимически наиболее важное промежуточное состояние родопсина, поскольку именно оно ответственно за взаимодействие с примембранными белками, среди которых можно назвать и трансдуцин.
- Опсин спонтанно рекомбинирует с 11-цис-ретиналем, возвращаясь в «темновую» форму родопсина. В отличие от опсина, родопсину не свойственна «базальная» активность (т.е., в «темновой» форме он не имеет сродства к G-белку (трансдуцину)). Это обстоятельство определяет очень низкий активационный порог для клеток-«палочек» (или, что то же, высокую чувствительность).
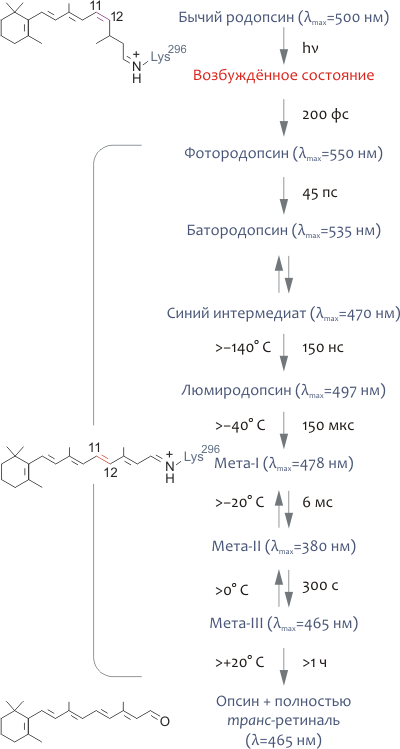
Рисунок 5. Фотоцикл родопсина. Поглощение кванта света с длиной волны, близкой к 500 нм, приводит к чрезвычайно быстрой (200 фс) изомеризации ковалентно связанного хромофора 11-цис-ретиналя в полностью транс-форму. Как следствие, родопсин претерпевает ряд быстрых конформационных перестроек, различимых спектроскопически, и в результате превращается в сравнительно долгоживущий метародопсин-II, или мета-II, существующий в равновесии с мета-I формой. В итоге фотопревращений родопсина, полностью транс-ретиналь выделяется в цитоплазму, восстанавливается до полностью транс-ретинола (при участии ряда ретинол дегидрогеназ) и конвертируется обратно в 11-цис-ретиналь в клетках пигментного эпителия под действием специальных ферментов (так называемый ретиноидный цикл). «Восстановленный» хромофор может спонтанно рекомбинировать с опсином, превращаясь в «темновую» форму родопсина. На рисунке справа от стрелок указаны характерные времена того или иного превращения, а слева — максимальные температуры, при которых фотоинтермедиат удавалось наблюдать in vitro. В скобках указаны максимумы соответствующих спектров поглощения.
[8], рисунок модифицирован
В бόльших подробностях с фотопревращениями родопсина можно ознакомиться в [7].
Структура родопсина
Трансмембранная топология
Родопсин — интегральный мембранный белок цилиндрической формы (размеры ~75×35×45 Å), трансмембранная (ТМ) часть которого образована «пучком» α-спиралей, уложенных по циклическому принципу в направлении против часовой стрелки (при виде с внеклеточной стороны) и примерно ортогональных плоскости мембраны, причем спираль ТМ3 расположена практически в центре «пучка» (рис. 6). Геометрия многих спиралей отклоняется от «идеальной» (т.е., содержит «изломы»); сильнее всего искажена спираль ТМ6 за счет влияния остатка ПРО-267 (одного из наиболее консервативных во всем семействе GPCR-рецепторов, «родоначальником» подсемейства А которых является родопсин).
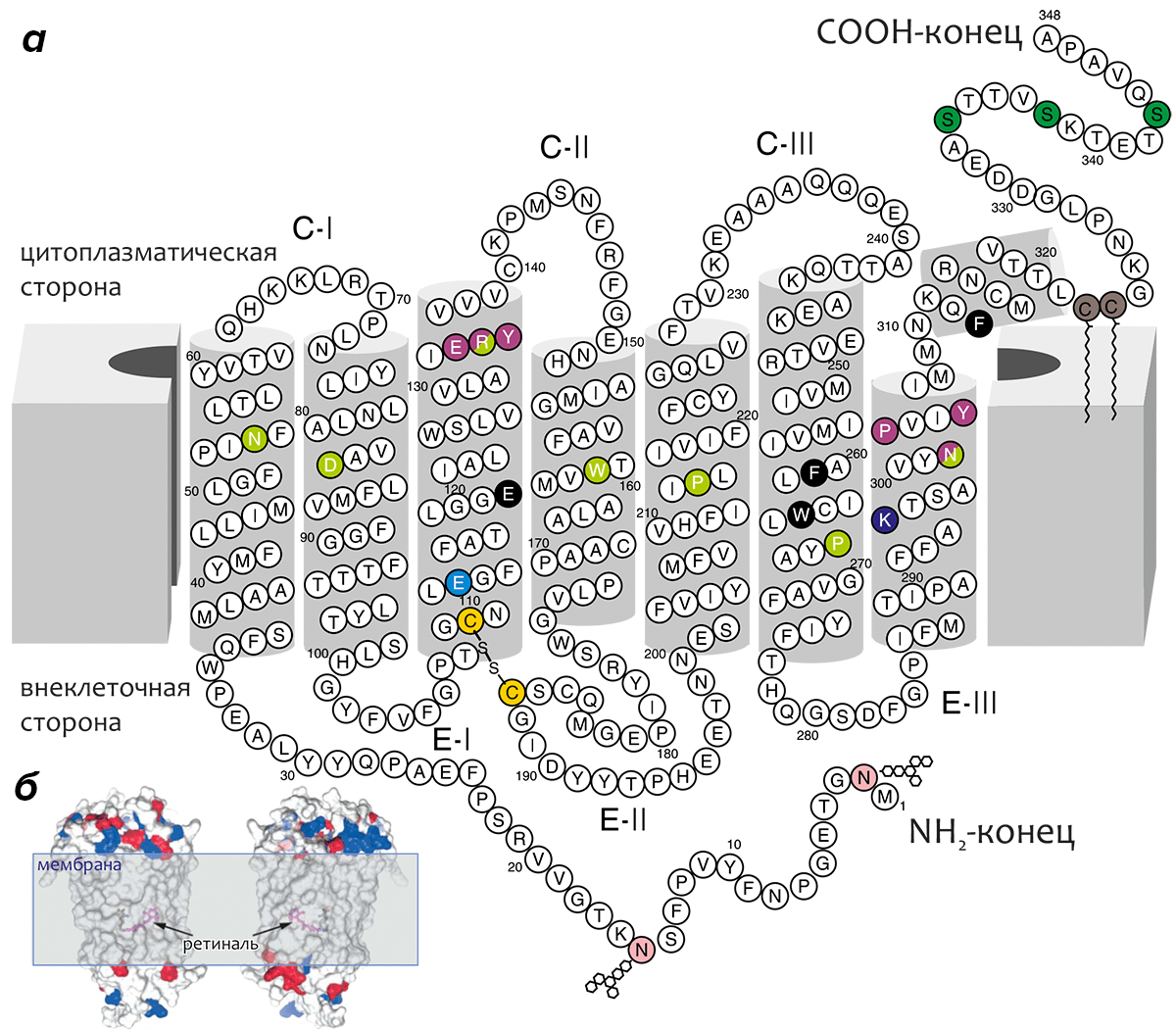
Рисунок 6. Трансмембранная топология родопсина. а — «Двумерная» модель родопсина, объясняющая способ его упаковки в мембране. C-I–CIII и E-I–EIII — цитоплазматические и внеклеточные петлевые участки, соответственно. Трансмембранный домен образован α-спиралями (серые цилиндры), геометрия многих из которых отклоняется от «идеальной». Стабильность ТМ-пучка усиливается консервативной во многих GPCR-рецепторах дисульфидной связью между остатками цистеина в ТМ3 и E-II (показаны золотым). Хромофор — 11-цис-ретиналь — не изображён на рисунке; он присоединяется к остатку ЛИЗ-296 в ТМ7 (показан фиолетовым) через протонированное Шиффово основание. Положительный заряд этой альдиминной связи нейтрализуется остатком глутаминовой кислоты ГЛЮ-113 (показан голубым). Остатки аспарагина АСН-2 и АСН-15 (показаны розовым) гликозилированы ГЛЮ-N-Ац-(β1,4)-ГЛЮ-N-Ац-(β1,4)-МАН (ГЛЮ — глюкоза, МАН — манноза); МЕТ-1 ацетилирован. Два остатка цистеина в примембранной спирали 8 (показаны коричневым) пальмитоилированы. Три остатка серина в C-конце рецептора, фосфорилирующиеся в процессе фотоактивации родопсина, показаны темно-зеленым. Эти остатки в фосфорилированной форме отвечают за взаимодействие с белком аррестином, отвечающим за инактивацию и десенсибилизацию родопсина. Два консервативных мотива, важных для активации рецептора и взаимодействия с трансдуцином, (D/E)RY в ТМ3 и NPxxY в ТМ7, показаны малиновым. Наиболее консервативные во всем семействе GPCR-рецепторов остатки для каждой ТМ-спирали показаны салатовым. Некоторые другие функционально важные остатки выведены на черном фоне. Схема ТМ топологии родопсина предложена Харгрэйвом [9] и Овчинниковым [3], [10]. б — Расположение родопсина в мембране (изображён в виде молекулярной поверхности, окрашенной в соответствии с зарядом остатка: отрицательный — красный, положительный — синий). (Положение вне- и внутриклеточного пространства то же, что и в а, масштаб другой.) Положение хромофора показано с помощью удаления некоторых спиралей из структуры. Молекула родопсина показана с двух противоположных сторон.
Длина аминокислотной последовательности родопсина — 348 остатков, масса белка — около 38 кДа, а длина ТМ спиралей варьирует от 20 до 33 остатков. ТМ домен белка составляет ~65% его общей массы, а размеры вне- и внутриклеточных областей примерно равны. Хромофор (ретиналь) связывается в ТМ области белка, ковалентно присоединяясь к остатку ЛИЗ-296.
Внеклеточный домен родопсина образован N-концевым участком, а также «петлями» E-I–E-III, и содержит два сайта гликозилирования по остаткам аспарагина. N-конец и внеклеточная петля II (E-II) содержат пары β-структурных «шпилек» β1–β2 и β3–β4, причём последние связаны консервативной дисульфидной связью со спиралью ТМ3, как бы «накрывая» сайт связывания ретиналя «крышкой». Цитоплазматический домен образован петлями C-I–C-III и C-концевым участком молекулы. В состав С-конца входит примембранная амфифильная спираль 8, «заякоренная» в мембране двумя остатками пальмитоиловой кислоты, присоединёнными к остаткам цистеина в этой спирали. В C-конце также находится три остатка серина, по которым предположительно происходит фосфорилирование рецептора, связанное с его активацией (рис. 6).
Многочисленные мутагенетические эксперименты позволили выяснить роль некоторых консервативных остатков, находящихся в ТМ области родопсина. Так, консервативный мотив (D/E)R(Y/W), находящийся в цитоплазматическом конце ТМ3, регулирует конформационные перестройки, сопровождающие активацию рецептора. Остаток глутаминовой или аспарагиновой кислоты (ГЛЮ-134 в родопсине) образует солевой мостик с консервативным остатком аргинина, способствуя «удержанию» рецептора в неактивной конформации (мутация кислотной функции этого остатка приводит к получению постоянно активных форм родопсина, не зависящих от влияния света). Протонирование ГЛЮ-134, происходящее при образовании первичного фотоинтермедиата родопсина, приводит к дальнейшим конформационным перестройкам и возникновению мета-II состояния (см. главу «Фотоцикл родопсина»). Другой консервативный мотив, находящийся в цитоплазматическом конце ТМ7 — NPxxY (NPVIY в родопсине, тут “x” обозначает любой остаток) — связывают с образованием комплекса с G-белком трансдуцином.
В целом, практически любой заряженный или полярный остаток, находящийся в ТМ домене, играет свою важную для функционирования и/или создания «архитектуры» рецептора роль. Многие полярные остатки образуют «сети» водородных связей, в которых иногда участвуют молекулы воды, связанные в ТМ домене. Эти системы довольно слабых связей также важны для функционирования такой точно настроенной молекулярной структуры, как рецептор. Причём, полярные остатки ТМ домена, как правило, заглублены в белковое окружение, а «боковую» поверхность рецептора, взаимодействующую с неполярной областью бислойной мембраны, образуют незаряженные и неполярные гидрофобные остатки (рис. 6б).
Пространственная структура
Пространственная структура родопсина была впервые определена в 2000 году с помощью метода рентгеновской кристаллографии [11], и в последствии несколько раз уточнялась. До сих пор она остаётся единственной трехмерной структурой GPCR-рецептора, экспериментально полученной с высоким разрешением. Структуры других белков этого семейства до сих пор неизвестны, поскольку эти рецепторы очень сложно выделить в необходимом для метода РСА количестве и подобрать условия, в которых белок будет образовывать кристалл, дающий чёткую дифракционную картину. Методу спектроскопии ЯМР такие большие и сложно устроенные мембранные белки пока что недоступны.
В десятилетие, прошедшее с момента получения структуры бактериородопсина (белка со схожим устройством) [4] до появления структуры фоторецептора с высоким разрешением, с помощью метода криоэлектронной микроскопии была получена структура родопсина низкого разрешения [12]. На основе этой структуры с учётом вариабельности аминокислотной последовательности родопсина в различных организмах был предложен «шаблон» расположения Cα-атомов этого рецептора и других рецепторов семейства GPCR [13]. Эти модели показали отличное (по сравнению с бактериородопсином) расположение ТМ спирали 3 (ТМ3) по отношению к другим спиралям, но другие особенности строения родопсина оставались до недавнего времени неизвестными.
Структура родопсина (рис. 7) демонстрирует немного отличающуюся от таковой в бактериородопсине упаковку спиралей: они расположены под бóльшими углами к нормали к мембране, во многих случаях сильнее искажены. Кроме того, ТМ3 почти полностью окружена остальными спиралями, в то время как в бактериородопсине спирали расположены почти точно по эллипсу, в направлении против часовой стрелки при виде с внеклеточной стороны (в родопсине это направление укладки сохраняется).
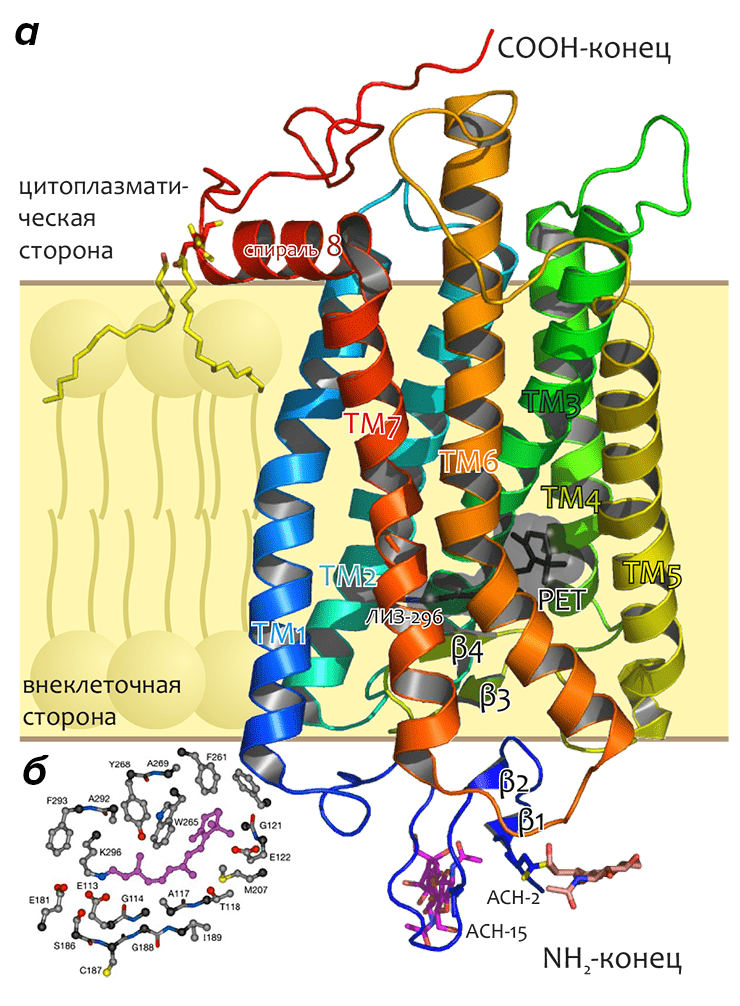
Рисунок 7. Пространственная структура зрительного родопсина. а — Молекула изображена в виде ленты, обозначающей расположение основной цепи белка. N- и C-концы, а также ТМ спирали подписаны. Показаны боковые цепи двух остатков аспарагина, модифицированные молекулами углеводов, двух остатков цистеина, модифицированных пальмитоиловой кислотой, «заякоривающей» примембранную амфифильную спираль 8 в мембране, а также остатка лизина-296, образующего ковалентную связь с хромофором (структура ретиналя (РЕТ) показана черным цветом внутри полупрозрачной ван-дер-ваальсовой поверхности). Положение мембраны схематично показано жёлтым слоем. Рисунок построен на основе структуры 1U19 из Брукхейвенского банка данных белковых структур (доступны также другие структуры родопсина: 1F88, 1GZM, 1HZX, 1L9H). б — Схематическое изображение остатков, формирующих сайт связывания ретиналя в родопсине (показаны боковые цепи остатков, расположенных не далее, чем на 5 Å от хромофора).
Структурные исследования родопсина помогли установить роль молекул воды, находящихся в ТМ домене рецептора и определить конформации вне- и внутриклеточных петель родопсина. Основываясь на этих исследованиях, были предложены возможные механизмы активации белка и участия функционально важных групп и микродоменов в ТМ передаче сигнала и конформационных перестройках, связанных с поглощением света. Подробнее об этом можно почитать в недавнем обзоре Кристофа Пальцевского (Krzysztof Palczewski) [14], одного из наиболее активных участников упомянутых исследований.
Димеризация родопсина в мембране
С помощью атомно-силовой микроскопии нативных дисковых мембран показано (и подтверждено биохимическими методами), что родопсин образует димеры и даже олигомеры более высокого порядка, выстраивающиеся в «ряды» димеров с вкраплениями олигомеров (см. главу «Строение фоторецепторных клеток», [5], [6]). В настоящее время появляются свидетельства того, что именно димеры родопсина (и других GPCR-рецепторов) являются функционально активными формами [15], но механизм их димеризации и роль этого процесса в работе рецептора пока еще недостаточно хорошо изучены.
Взаимодействие родопсина с G–белком трансдуцином
Взаимодействие активированной формы родопсина с G-белком трансдуцином является ключевым биохимическим аспектом в зрительном процессе (см. главу «Биохимический каскад зрения»). Точный механизм этого процесса неизвестен, поскольку отсутствует структурная информация высокого разрешения об активированной форме родопсина, однако показано, что во взаимодействии с G-белком существенную роль может играть димеризация рецепторов.
Предположительно, с G-белком взаимодействует димер рецептора, одна молекула в составе которого «активирована» и взаимодействует с трансдуцином, а другая может быть неактивной (или даже быть другим GPCR-рецептором) и G-белок не активирует. По данным атомно-силовой микроскопии [6], димер образуется с участием спиралей ТМ4 и ТМ5. Конформационные перестройки, сопровождающие активацию родопсина, приводят к тому, что цитоплазматическая часть рецептора, находящаяся вблизи консервативных мотивов, участвующих в активации родопсина ([D/E]RY в ТМ3 и NPxxY в ТМ7), меняет свое строение. Солевой мостик, связывающий остатки ГЛЮ-134 и АРГ-135, разрушается (что связано с протонированием ГЛЮ-134 и депротонированием Шиффова основания ретиналя в ЛИЗ-296), и петлевые цитоплазматические участки родопсина приобретают сродство к трансдуцину. Схематически предполагаемый процесс взаимодействия родопсина с трансдуцином показан ниже в видео, основанном на биохимических данных и кристаллографических структурах родопсина и субъединиц трансдуцина.
Видео. Возможный механизм взаимодействия родопсина («темновая» форма — синий, «активированная» — жёлтый) с трансдуцином (Tα — оранжевый, Tβ — красный, Tγ — зелёный). Молекула ГТФ показана фиолетовым, ГДФ — светло-фиолетовым. Анимация основана на данных атомно-силовой микроскопии [5] и молекулярного моделирования с использованием индивидуальных кристаллографических структур родопсина и трансдуцина [15].
Перспективы исследования родопсина
Структурные исследования родопсина продолжаются, и среди вопросов, ждущих своего разрешения, можно назвать следующие:
- Какие структурные превращения сопровождают активацию родопсина и придают ему способность взаимодействовать с белками-партнерами (такими как трансдуцин, белки-киназы и аррестин)?
- Каковы пространственные структуры комплексов активированного состояния родопсина и трансдуцина, а также мономера или димера фосфорилированного активированного родопсина и аррестина?
- Какую роль играет димеризация GPCR-рецепторов в трансмембранной передаче импульсов и десенсибилизации рецепторов?
- Каким образом «отработанная» молекула полностью транс-ретиналя высвобождается из сайта связывания в родопсине, и как 11-цис-ретиналь встраивается обратно?
- Каков механизм клеточного «созревания» и деградации родопсина?
Дальнейшее исследование родопсина имеет не только фундаментальное значение и может быть использовано не только для лечения или предотвращения биохимических нарушений зрения. Родопсин — самый разносторонне исследованный белок из семейства GPCR-рецепторов, и закономерности, полученные для него, могут быть использованы для изучения структуры и функциональных особенностей других рецепторов этого семейства. С дисфункцией этих белков связано огромное количество заболеваний [16], и изучение их структуры и, главное, механизма взаимодействия с лигандами, может открыть новые возможности для дизайна новых лекарственных веществ [17] — эффективных и безопасных.
Литература
- Липкин В.М. (2001). Зрительная система. Механизмы передачи и усиления зрительного сигнала в сетчатке глаза. Соросовский образовательный журнал. 9, 2–8;
- Википедия: Color vision (англ.);
- Овчинников Ю.А., Абдулаев Н.Г., Фейгина М.Ю., Артамонов И.Д., Богачук А.С. (1983). Зрительный родопсин: Полная аминокислотная последовательность и топология в мембране. Биоорганическая химия. 10, 1331–1340;
- R. Henderson, J.M. Baldwin, T.A. Ceska, F. Zemlin, E. Beckmann, K.H. Downing. (1990). Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy. Journal of Molecular Biology. 213, 899-929;
- Y. Liang, D. Fotiadis, T. Maeda, A. Maeda, A. Modzelewska, et. al.. (2004). Rhodopsin Signaling and Organization in Heterozygote Rhodopsin Knockout Mice. Journal of Biological Chemistry. 279, 48189-48196;
- Dimitrios Fotiadis, Yan Liang, Slawomir Filipek, David A. Saperstein, Andreas Engel, Krzysztof Palczewski. (2003). Atomic-force microscopy: Rhodopsin dimers in native disc membranes. Nature. 421, 127-128;
- Рубин А.Б. Фотопревращения бактериородопсина и родопсина // Биофизика, т.2. М.: Наука, 2004;
- Y. Shichida, H. Imai. (1998). Visual pigment: G-protein-coupled receptor for light signals. Cellular and Molecular Life Sciences (CMLS). 54, 1299-1315;
- Hargrave P.A., McDowell J.H., Curtis D.R., Wang J.K., Juszczak E., Fong S.L. et al. (1983). The structure of bovine rhodopsin. Biophys. Struct. Mech. 9, 235–244;
- Овчинников Ю.А. Зрительный родопсин // Биоорганическая химия. М.: Просвещение, 1987;
- Palczewski K., Kumasaka T., Hori T., Behnke C.A., Motoshima H., Fox B.A. et al. (2000). Crystal structure of rhodopsin: a G-protein-coupled receptor. Science. 289, 739–745;
- Schertler G.F. and Hargrave P.A. (1995). Projection structure of frog rhodopsin in two crystal forms. Proc. Natl. Acad. Sci. USA. 92, 11578–11582;
- Joyce M Baldwin, Gebhard F.X Schertler, Vinzenz M Unger. (1997). An alpha-carbon template for the transmembrane helices in the rhodopsin family of G-protein-coupled receptors. Journal of Molecular Biology. 272, 144-164;
- Krzysztof Palczewski. (2006). G Protein–Coupled Receptor Rhodopsin. Annu. Rev. Biochem.. 75, 743-767;
- Paul S.-H. Park, Slawomir Filipek, James W. Wells, Krzysztof Palczewski. (2004). Oligomerization of G Protein-Coupled Receptors: Past, Present, and Future†. Biochemistry. 43, 15643-15656;
- Torsten Schöneberg, Angela Schulz, Heike Biebermann, Thomas Hermsdorf, Holger Römpler, Katrin Sangkuhl. (2004). Mutant G-protein-coupled receptors as a cause of human diseases. Pharmacology & Therapeutics. 104, 173-206;
- Драг-дизайн: как в современном мире создаются новые лекарства.







