Калиевый канал in silico
01 мая 2012
Калиевый канал in silico
- 4213
- 9
- 11
Использование в белковой кристаллографии детергентов приводит к тому, что мембранные белки редко можно «увидеть» в их естественной среде — липидном бислое. Однако компьютерное моделирование позволяет исправить этот недостаток.
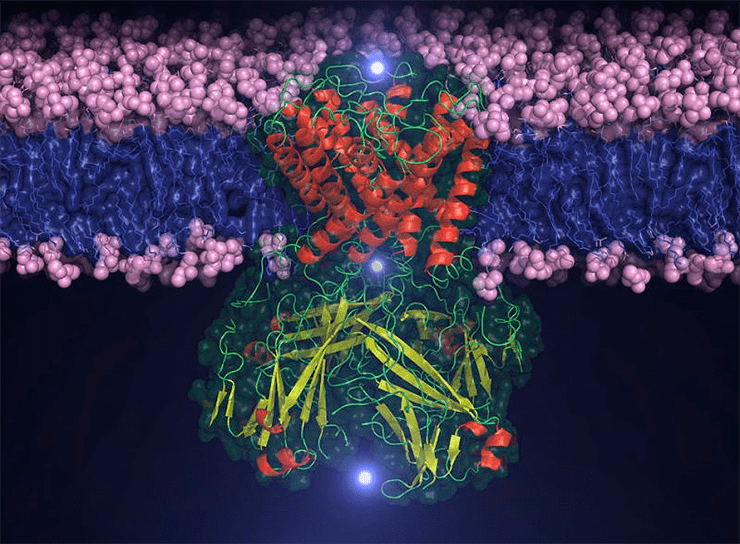
изображение одного из бактериальных K+-каналов: Tim Nugent
-
Автор
-
Редакторы
Несмотря на то, что за несколько десятилетий существования метода моделирования молекулярной динамики (МД) сущность подхода практически не поменялась, совершенствование алгоритмов и взрывное развитие компьютерных мощностей позволяет достигать все новых рубежей. Американские исследователи провели моделирование МД потенциал-чувствительного калиевого канала, в результате чего удалось в деталях проследить процесс активации / инактивации этого белка, «рассмотрев» подробности, ранее известные лишь гипотетически.
В основе работы возбудимых тканей — а это не только нервы, но и мышцы, и железы, — лежат ионные каналы, встроенные в плазматическую мембрану клетки и способные в ответ на определенные воздействия открываться и, наоборот, закрываться, пропуская определенные ионы или блокируя их проход. Живые клетки всегда имеют трансмембранный (ТМ) электростатический потенциал [1], лежащий в основе массы жизненно-важных процессов — от синтеза АТФ и рецепции до проведения нервного импульса. «За открытия, касающиеся ионных механизмов, участвующих в возбуждении и торможении <...> нервной клетки», британские физиологи Алан Ходжкин и Андре Хаксли получили в 1963 году Нобелевскую премию по физиологии и медицине. Однако молекулярные механизмы открытой ими потенциал-зависимой регуляции проницаемости мембраны для ионов оставались покрытыми мраком до 1980-х, когда появились современные подходы к изучению мембранных белков, а именно — ионных каналов.
Потенциал действия в возбудимой клетке начинается с открывания Na+-каналов, реагирующих на деполяризацию — уменьшение ТМ-потенциала, равного в покоящейся клетке примерно −70 мВ (цитоплазматическая сторона мембраны заряжена отрицательно по отношению к внеклеточной). Возникающий в связи с входящим в клетку «натриевым током» скачок потенциала открывает K+-каналы, и ионы калия устремляются изнутри клетки наружу. Позже нарушенный баланс K+ и Na+ будет восстановлен за счет действия Na+/K+-насоса, но главное уже произошло — потенциал действия «побежал» по мембране возбудимой клетки.
И Na+-, и K+-каналы здесь — потенциал-чувствительные, то есть они открываются и закрываются, реагируя на электрическое поле, причем в покое (когда потенциал ≈−70 мВ) они закрыты, а открываются они при деполяризации, когда ТМ-напряжение исчезает. Удивительная способность чувствовать такую «не биологическую» характеристику, как разность потенциалов, у всех потенциал-чувствительных каналов (и натриевых, и калиевых, и кальциевых) определяется наличием потенциал-чувствительного домена (ПЧД), четвертый ТМ-сегмент (S4) которого несет большой положительный заряд, а значит, может служить сенсором потенциала. Такие ионные каналы образуются из четырех субъединиц, в каждой из которой есть поровый домен (ПД) и ПЧД, «закрученные» вокруг общей оси, подобно лепесткам диафрагмы .
Подробнее строение потенциал-чувствительного канала мы уже разбирали в статье «О чем не знал Гальвани: пространственная структура натриевого канала» [2]
Структурная биология уже более 15 лет назад расшифровала строение K+-канала: сначала «обычного», потом и потенциал-чувствительного. (На самом деле, у человека более 40 типов разных K+-каналов, так что разнообразие не ограничивается двумя названными типами ;-) Однако особенность приготовления образцов для рентгеноструктурного анализа или спектроскопии ядерного магнитного резонанса (основных методов определения строения биомолекул) такова, что в эксперименте невозможно сохранить ТМ-потенциал, и все структуры каналов из-за этого получаются «открытыми» (то есть, активированными). До сих пор неизвестно строение неактивного (закрытого) канала, а значит и подробности цикла активации / инактивации неизвестны тоже.
Выход из сложившегося положения предлагает группа американских биофизиков во главе с Дэвидом Шоу (David Shaw), заслужившим себе репутацию на мировом финансовом рынке, а потом неожиданно «переквалифицировавшимся» в компьютерную молекулярную биологию и уже потрясшим мир преодолением «миллисекундного барьера» [3] в моделировании молекулярной динамики биомолекул [4].
На этот раз ученые не ставили задачи смоделировать процесс сворачивания белка (фолдинг); вместо этого они решили исследовать работу потенциал-чувствительного K+-канала в ответ на приложение внешней разности потенциалов: как он открывается, закрывается и проводит ионы [5]. Фактически, исследователи используют созданный ими специализированный суперкомпьютер для МД «Anton» в качестве микроскопа: без особенных хитростей запустив МД, наблюдают за тем, что произойдет. Подобную работу ни за что бы не опубликовали в одном из самых известных журналов — Science, — если бы не то обстоятельство, что длительность рассчитанных траекторий (сотни микросекунд) на порядки превосходит то, что можно посчитать на «обычных» суперкомпьютерах для довольно сложной системы, содержащей тетрамерный ионный канал, мембрану, воду и ионы. (Обычно для таких систем больше 1–10 мкс посчитать не удается.) Ну и конечно, рецензентов работы не мог не подкупить тот факт, что полученная в результате моделирования картина в целом согласуется с уже известным механизмом активации / инактивации канала, но показывает его в невиданных ранее подробностях.
В работе было проведено более двух десятков расчетов МД структуры K+-канала («химера Kv2,1/Kv1,2»), помещенной в липидный бислой в ячейке с водой с растворенным в ней KCl (0,5 М). Часть траекторий была получена в «деполяризованном» (V > 0 мВ), а часть — в «гиперполяризованном» (V < 0 мВ) состоянии. В условиях гиперполяризации мембраны канал из первоначально «открытого» состояния переходил в «закрытую» форму, не способную пропускать ионы K+ и воду (рис. 1а). Наиболее сильные изменения в структуре канала происходили, как и ожидалось, в области потенциал-чувствительного домена: вольт-сенсорная α-спираль S4, в открытом состоянии «выдвинутая» наружу (во внеклеточную область), при появлении напряжения «ввинчивалась» в ПЧД, что сопровождается переносом заряженных групп (остатков аргинина и лизина) «вниз», с образованием временных солевых мостиков с противоположно заряженными группировками сегментов S1 и S2 ПЧД (рис. 1б). Такой механизм активации / инактивации предполагали и ранее, на основании многочисленных биохимических и биофизических экспериментов. Однако в таких подробностях ранее проследить за процессом не было никакой возможности (видео 1).
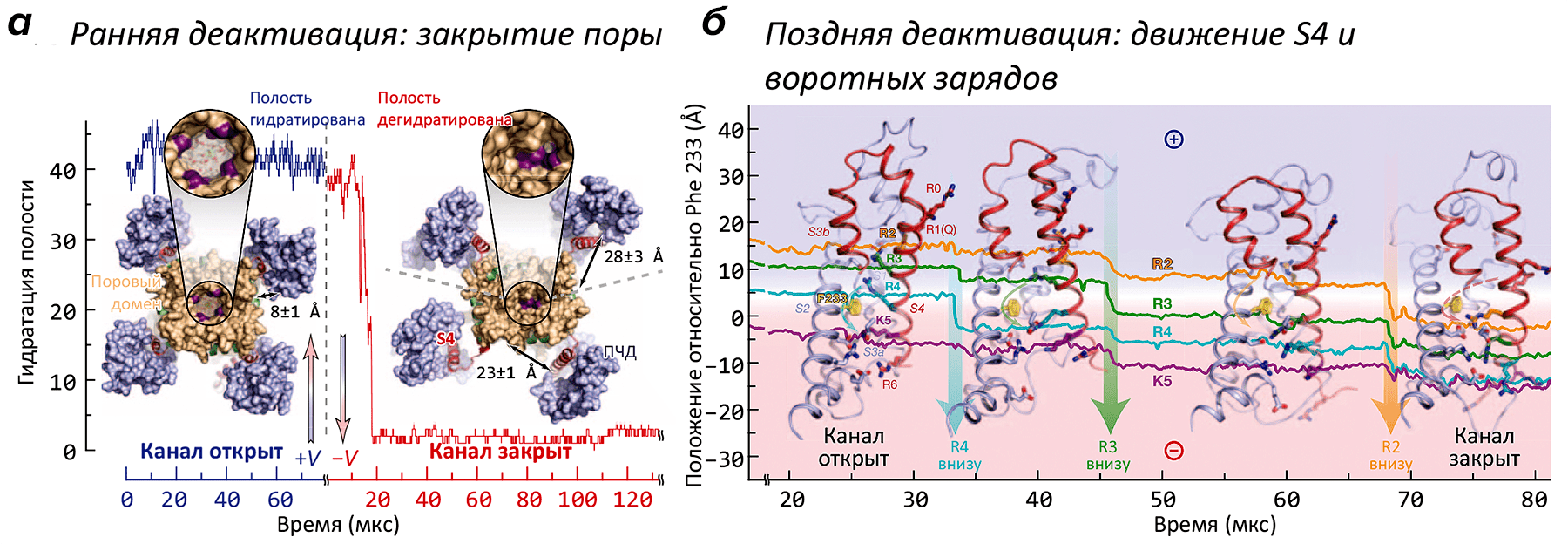
Рисунок 1. Движения потенциал-чувствительного домена (ПЧД) при активации K+-канала. а — Вид модели канала с внутриклеточной стороны в активированном (+V) и покоящемся (−V) состояниях. Канал представляет собой тетрамер: находящийся в центре поровый домен окружен четырьмя ПЧД. Геометрическое закрывание поры (показано на увеличенных врезках) подтверждается кривой гидратации, показывающей количество молекул воды, находящихся в «вестибюле» канала. При «включении» потенциала (через ≈20 мкс) растворитель и ионы K+ покидают канал, и пора «захлопывается» под действием гидрофобного коллапса. Интересно, что в открытом канале ПЧД «прижаты» к поре, в то время как в закрытом — расположены более свободно. б — Постепенное «вдвигание» вольт-сенсора S4 и находящихся в нем «воротных зарядов» в ПЧД при «включении» потенциала (т.е., в процессе закрывания канала). В частности, в процессе инактивации заряд R2 переносится на 15 Å «вниз», что в общих чертах описывает основную структурную перестройку, сопровождающую инактивацию канала. Попутно с «нырянием» в ПЧД, сегмент S4 совершает поворот на ≈120°.
Видео 1. Визуализация инактивации K+-канала при реполяризации мембраны. Канал показан «сбоку», мембрана и две субъединицы из четырех для ясности скрыты. В начале траектории можно видеть проникающие через пору ионы K+ и показанную синей поверхностью гидратированную полость канала; при закрывании канала эти события пропадают.
В моделировании был показан гипотетический до того переход из состояния канала, когда все вольт-сенсоры S4 уже выдвинуты деполяризацией (снятием напряжения) «вверх», но сама пора пока еще остается закрытой, в «полностью открытое» состояние. Показана и роль «линкера», соединяющего конец S4 с двумя ТМ-спиралями S5 и S6, образующими пору: этот линкер передает механическое движение переноса S4 вверх / вниз, что приводит к открыванию и закрыванию поры. На основе проделанного моделирования исследователи предложили схему функционирования потенциал-чувствительного K+-канала (рис. 2).
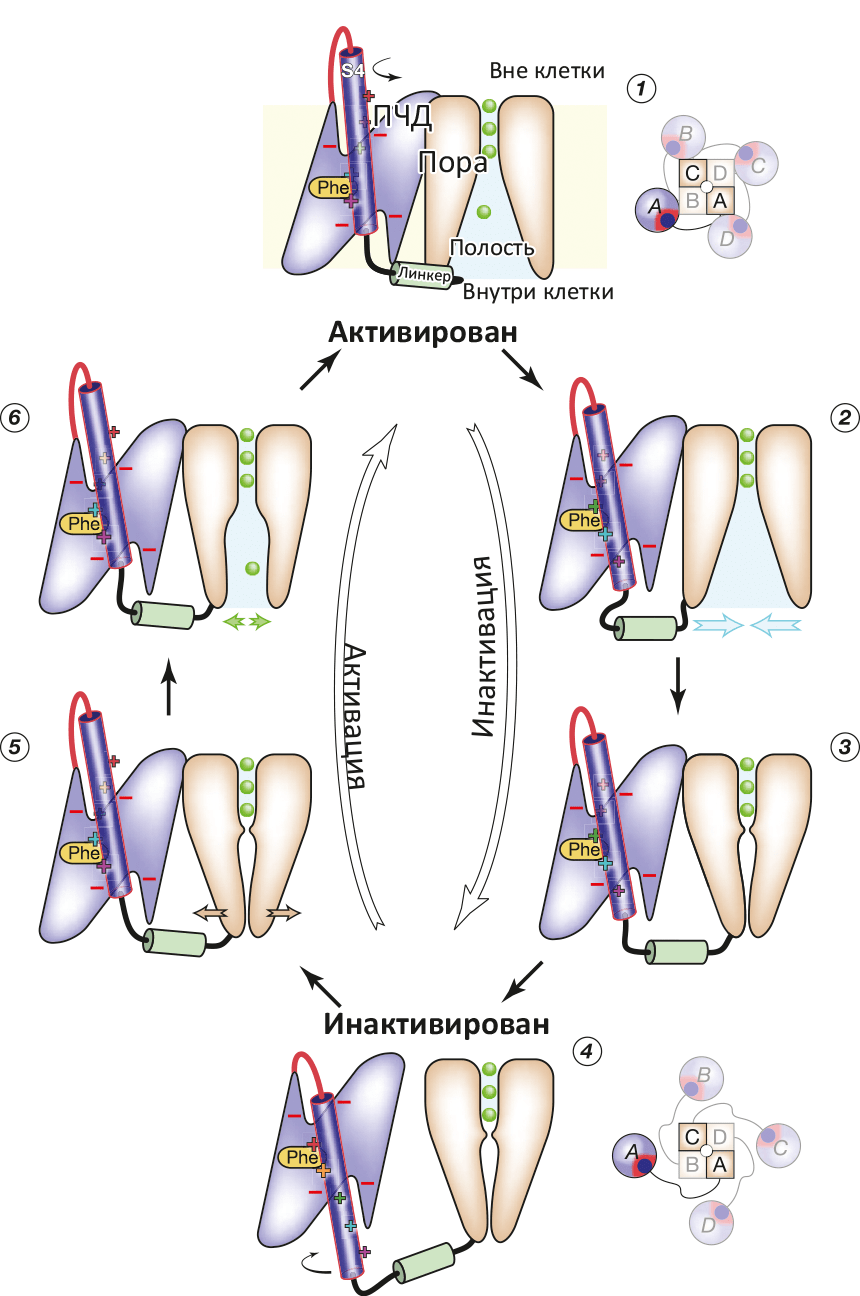
Рисунок 2. Схема работы потенциал-чувствительного K+-канала. (1) Реполяризация (восстановление ТМ-потенциала покоя −70 мВ) приводит к «вдвиганию» вольт-сенсора S4 в ПЧД, что приводит к (2) дегидратации полости канала и «гидрофобному коллапсу» (закрытию поры) (3). При окончании «вдвигания» S4 (4) линкер S4—S5 становится максимально длинным, что позволяет ПЧД «отсоединиться» от поры. При деполяризации (5) (например, при входящем Na+-токе) α-спираль S4 опять выдвигается, ПЧД плотно присоединяется к поре, которая вследствие этого открывается (6). Цикл замкнулся.
Отдельный акцент сделан на практическом применении таких «тяжелых» расчетов: кроме использования компьютера в качестве микроскопа, можно исследовать механизм возникновения так называемых каналопатий — таких заболеваний как аритмия, мигрени, параличи, болевые синдромы, которые связаны с нарушением работы ионных каналов. В частности, мутации в ПЧД (тех самых положительно заряженных остатков аргинина / лизина в S4) приводят к тому, что ПЧД начинает «подтекать» и пропускать через себя так называемые Ω-токи. В ряде дополнительных расчетов исследователи обнаружили и этот феномен, продемонстрировав механизм «протечки».
С одной стороны, Шоу и коллеги не открыли ничего особо нового — схема работы канала, предложенная на рис. 2, в общих чертах была известна и ранее. Однако, пожалуй, самое важное, что следует из их работы, — это то, что увеличение длительности расчетов МД позволяет узнать о биологических системах что-то новое, что само по себе отнюдь не очевидно (такие сложные конформационные явления могли и не произойти вовсе, несмотря на «игру» с потенциалом). Так что истинная причина, по которой чисто «расчетную» работу опубликовали в Science, заключается в том, что возможности методов молекулярного моделирования, часто подвергающиеся (вполне справедливой) критике, все же больше, чем полагали скептики.
Литература
- Формирование мембранного потенциала покоя;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Миллисекундный барьер взят!;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- M. O. Jensen, V. Jogini, D. W. Borhani, A. E. Leffler, R. O. Dror, D. E. Shaw. (2012). Mechanism of Voltage Gating in Potassium Channels. Science. 336, 229-233.