
За генный полиморфизм приходится платить
29 июля 2013
За генный полиморфизм приходится платить
- 8195
- 0
- 6
Генные полиморфизмы являются не только источником биоразнообразия и эволюционного материала, но также причиной многих заболеваний человека
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В меняющихся условиях окружающей среды генетическое разнообразие в популяции дает отдельным особям преимущество. Оно не только позволяет виду выживать и существовать в геологических масштабах времени, но и является основой генетической изменчивости и непрерывного процесса видообразования. Обычно белки, кодируемые разными аллелями одного гена, обладают одинаковыми функциональными свойствами, и само по себе наличие генных полиморфизмов не оказывает никакого влияния на жизнедеятельность организма, являясь выражением его биологической индивидуальности. Но эти генетические различия вносят важный вклад в индивидуальные особенности развития защитных реакций и предрасположенность к целому ряду заболеваний, среди которых — невынашивание беременности.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Генетическое разнообразие — добро или зло?
Бурное развитие геномики, происходящее в последнее время [1], предоставляет новые мощные инструменты описания и анализа генетического разнообразия. Как правило, гены представлены в популяции двумя или более вариантами — аллелями, — отличающимися между собой либо одиночными заменами нуклеотидов (SNP — single nucleotide polymorphism), то есть реальными изменениями «генетического кода», либо числом повторяющихся фрагментов ДНК. Именно SNP особенно важны для молекулярной диагностики болезней.
Что нового в понимании генетической вариабельности человека и в приложении к персонифицированной медицине дают персональные геномы? Во-первых, открываются новые генетические варианты — в каждом человеческом геноме обнаруживается порядка 3 млн. SNP на 3 млрд. нуклеотидов (это примерный размер генома целиком), что дает уровень различий один нуклеотид на 1000 п.н. Геномы двух разных людей пересекаются примерно по половине SNP. Иногда замена всего одного нуклеотида может стать причиной заболевания, но чаще всего сочетание нескольких генетических полиморфизмов может либо предрасполагать, либо препятствовать проявлению различных заболеваний, и тогда из называют мультифакториальными (МФЗ).
К мультифакториальным заболеваниям относится подавляющее большинство хронических болезней человека, включая сердечнососудистые, эндокринные, иммунные, нервно-психические, онкологические и др. Полиморфизмы «генов предрасположенности» в сочетании с неблагоприятными внешними факторами (нерациональное питание, вредные привычки, загрязнения окружающей среды, инфекции) повышают риск развития заболевания.
В ходе эволюции SNP появляются в результате мутации единого аллеля-предшественника. Такое огромное количество изменений в жизненно-важной генетической программе возникает потому, что в ДНК любой клетки человека ежедневно происходят тысячи случайных изменений (например, депуринизация — отрыв основания аденина или гуанина от нуклеотида), а в процессе репликации самым частым классом ошибок являются замены одиночных пар нуклеотидов. Замена нуклеотида в последовательности ДНК может произойти в регулирующей области гена и значительно изменить уровень его экспрессии (количество транскрибируемой РНК), либо в кодирующей области, отвечающей непосредственно за «считываемый» с гена белок-продукт. А может быть и такой случай, что ДНК мутирует, а продукт гена остается неизменным — в этом случае говорят о синонимичной замене.
Скорость мутации нуклеотидной пары равна примерно 10−8 на поколение. Зная число пар нуклеотидов в геноме (3 млрд) можно вычислить, что каждая гамета содержит примерно 30 однонуклеотидных замен, т.е. каждый ребенок в мире рождается с примерно 60 новыми SNP! Изменение одной «буквы» в гене может существенно повлиять на работу белка-продукта за счет изменения пространственной организации белковых доменов (рис. 1), либо за счет нарушения посттранскрипционных изменений РНК (сплайсинга и редактирования) или посттрансляционных модификаций белка (процессинга и присоединения различных химических групп к аминокислотным остаткам). А может и не повлиять. Такие несинонимичные замены (nSNVs — nonsynonymous single nucleotide variants) с точки зрения эволюции считаются нейтральными (ни вредными, ни полезными). Большая часть SNP, конечно же, относится именно к этому классу, иначе рождаемые дети просто-напросто не выживали бы.
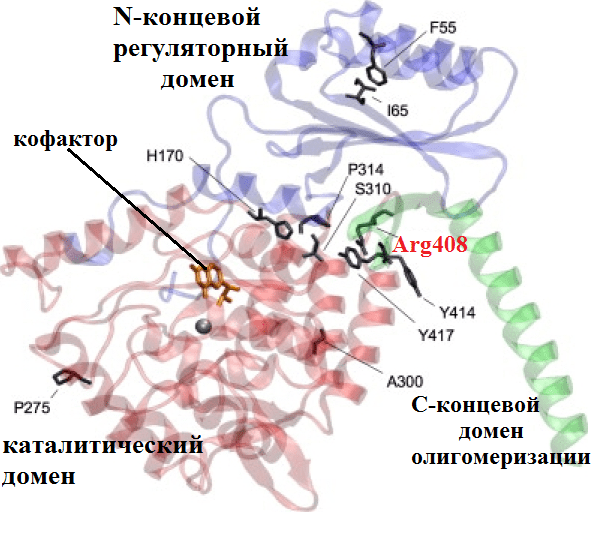
Рисунок 1. Вредные несинонимичные замены. Пример такой замены — полиморфизм PAH R408W, причина довольно известного заболевания фенилкетонурии (ФКУ). На этикетках газированных напитков и жевательных резинок можно встретить надпись «не рекомендовано больным фенилкетонурией». А все потому, что эти продукты содержит подсластитель аспартам, который состоит из двух аминокислот — аспарагиновой кислоты и фенилаланина. Организм здорового человека последнюю перерабатывает, однако у больных ФКУ — редким врожденным заболеванием (оно диагностируется у одного из 10 000 новорожденных) — фенилаланин и продукты его распада накапливаются в организме и могут привести к поражению мозга. Больных детей до совершеннолетия нужно кормить пищей, не содержащей фенилаланина. На молекулярном уровне это объясняется тем, что в гене фенилаланин-4-гидроксилазы в 12-м экзоне происходит замена цитозина на тимин. Вследствие этого возникает замена аргинина на триптофан в 408 положении аминокислотной последовательности печеночного фермента, который в норме катализирует превращение фенилаланина в тирозин. В результате замены нарушается сборка активного белка («портится» взаимодействие между двумя субъединицами тетрамера), и фермент не может больше выполнять свои функции. На рисунке изображена доменная структура олигомера гидроксилазы и обнаруженные SNP, нарушающие фолдинг белка [1].
Один ген может иметь много полиморфных вариантов. Большинство замен в них является безвредными (нейтральными). Наиболее часто встречаемый аллель называют нормальным, а редкие варианты — мутантными. Если при конкретном заболевании наблюдается более высокая частота определенного аллельного варианта (неважно — мутантного или нормального), то такой SNP называют ассоциированным с заболеванием, а полиморфный ген — геном-кандидатом предрасположенности к развитию МФЗ. Развитие МФЗ может быть запущено либо одной причиной, либо комбинацией нескольких, которые могут быть чисто генетическими (например, один или несколько аллельных вариантов комплекса генов), либо чисто средовыми (например, химические аллергены, действию которых подвергается работник лакокрасочного завода или парикмахер), либо поведенческими (например, пристрастие к определенной пище), либо социальными или психологическими. При этом индивидуальный вклад каждой причины в проявление болезни может быть незначительным, и только их сумма ведет к развитию заболевания.
Пример МФЗ, к развитию которого приводит только наличие определенных комбинаций аллельных вариантов в генах предрасположенности — невынашивание беременности (НБ) (рис. 2). Сочетание аллельных вариантов с действием факторов среды пока мало изучено, однако на данный момент в мире исследованы SNP более 90 генов, относящихся к генной сети патологии беременности. Большая часть работ посвящена исследованию генов системы детоксикации, фолатного обмена, факторов свертывания крови, HLA-системы, факторов роста, генов антиоксидантной защиты и генов, вовлеченных в воспалительные процессы.
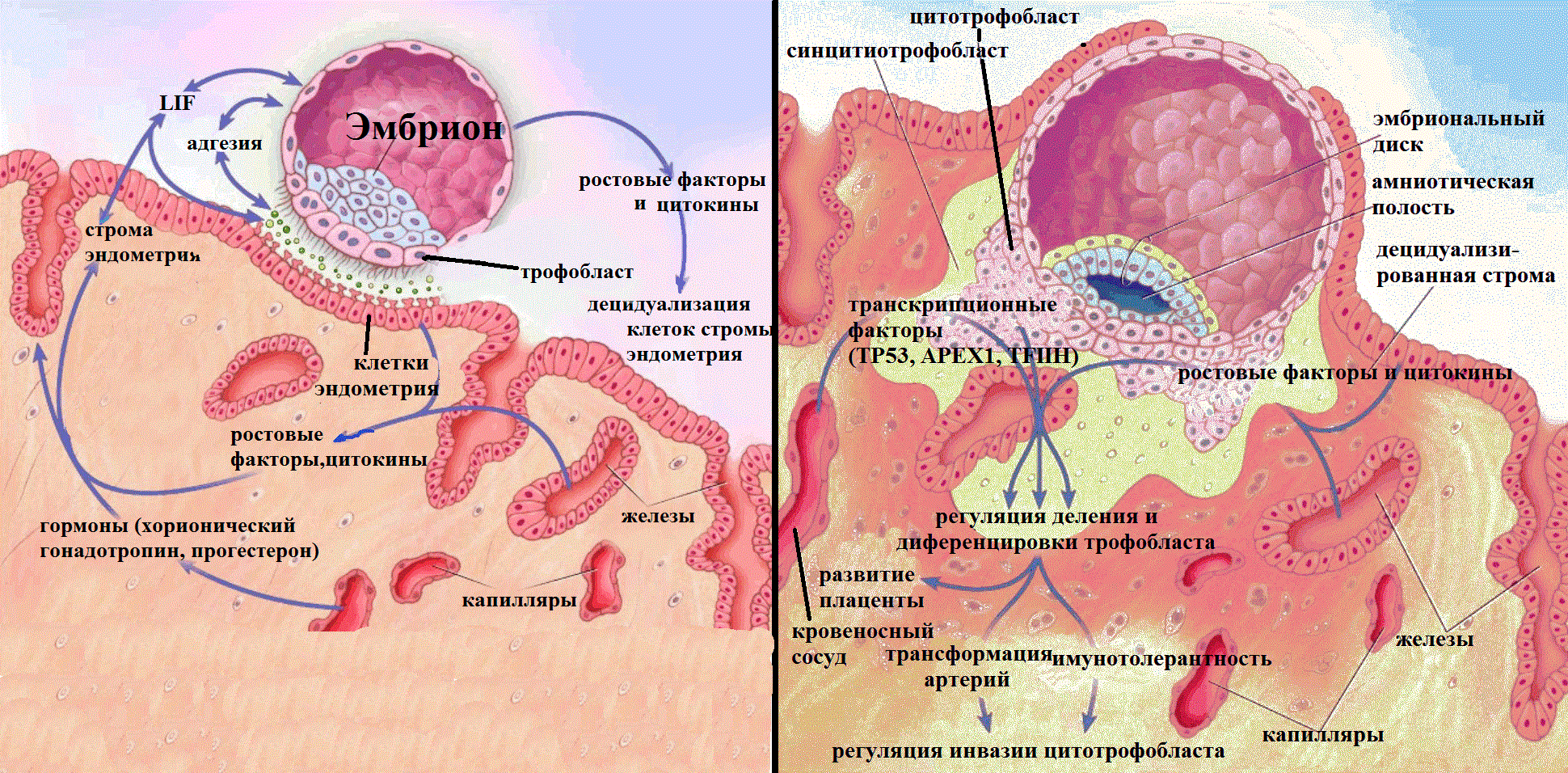
Рисунок 2. Имплантация эмбриона и причины невынашивания. Успех беременности зависит от полноценной имплантации эмбриона в организм матери. Успешная имплантация — результат сложных взаимодействий между гормонально подготовленным эндометрием матки и зрелой бластоцистой. Имплантация бластоцисты в эндометрий включает два этапа: 1) адгезия двух клеточных систем — эндометрия и трофобласта — и 2) децидуализация стромы эндометрия. Затем начинается фаза внедрения трофобласта в стенку эндометрия и активная дифференцировка трофобласта. Активно делящиеся клетки цитотрофобласта, сливаясь, образуют путем эндоредупликации синцитиотрофобласт, напрямую контактирующий с материнской кровеносной системой. В этом процессе активно задействованы все молекулы-участники регуляции и контроля клеточного цикла. Цитотрофобласт внедряется в децидуа и изменяет кровеносные сосуды матери для обеспечения тока крови к плоду: образуются хорион и плацента. Если при формировании плаценты инвазия трофобласта будет недостаточной, то произойдет выкидыш или задержка развития плода [7].
На базе кафедры генетики и НИИ Биологии ЮФУ мы изучали ассоциацию SNP генов, отвечающих за контроль повреждений ДНК, c невынашиванием беременности [5]. Эти гены называются DDR — DNA damage response, — куда относятся гены системы репарации и контроля клеточного цикла, о которых более подробно будет сказано позже.
Большие перемены — результат накопления небольших изменений
Почему именно эти гены были выбраны для исследования? Все объясняется тем, что в начале развития эмбрион должен внедриться в стенку матки. Это ключевой момент для успешного протекания беременности. При этом клетки трофобласта и стромы эндометрия делятся не традиционным образом, а путем эндоредупликации (удвоения хромосом без деления), невозможной без участия белков, контролирующих клеточный цикл и репарацию (рис. 3).
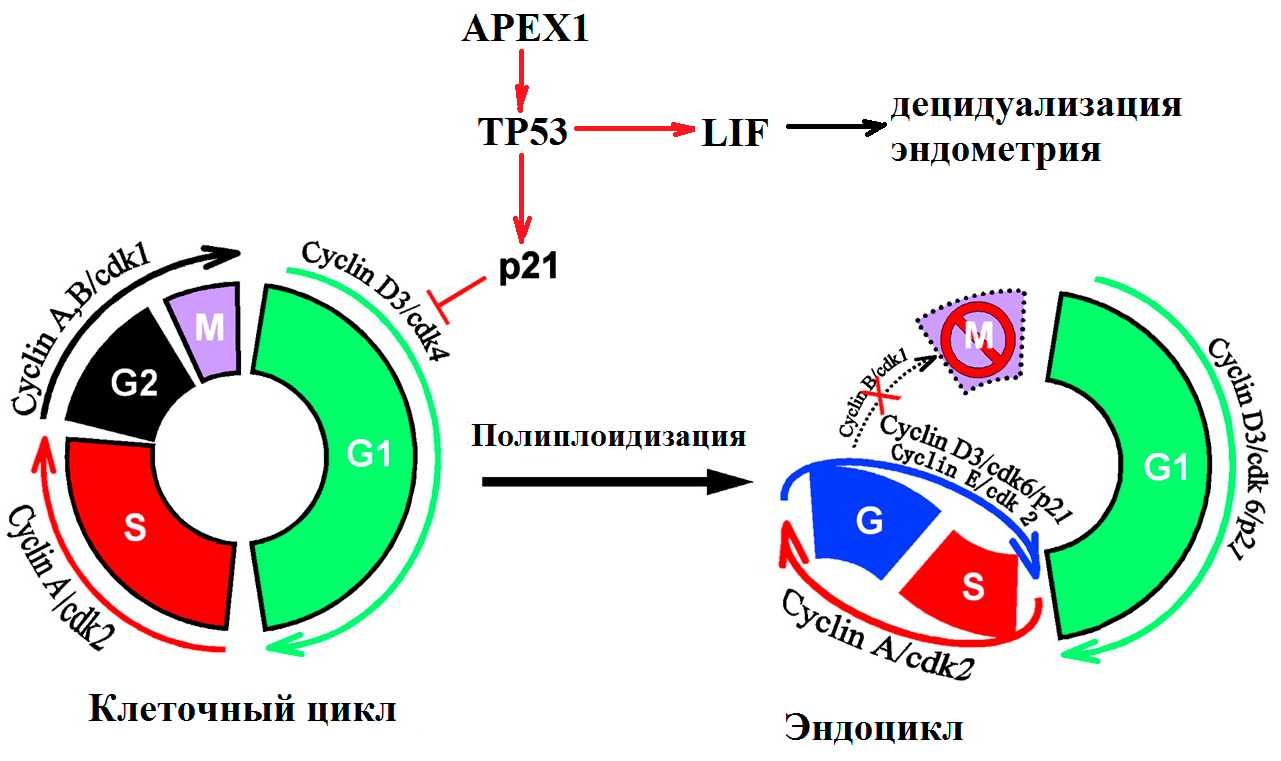
Рисунок 3. Участие генов системы репарации и контроля клеточного цикла в подготовке к имплантации эмбриона. Процесс образования специализированных клеток децидуа — ключевой для развития беременности. В начале децидуализации стромальные клетки, непосредственно окружающие имплантируемую бластоцисту, активно делятся. Клеточный цикл осуществляется за счет работы циклин-зависимых киназ. Во время деления клеток эндометрия белок p21 подавляет работу комплекса циклина D и киназы cdk4, что приводит к образованию эндоцикла (удвоению хромосом без деления). В результате эндоредупликации получаются гигантские полиплоидные клетки децидуа (до 64n). На рисунке показана роль регуляторов клеточного цикла в «обычном» митозе и в эндоцикле клеток стромы эндометрия и трофобласта [8–10].
Несмотря на то, что под воздействием неблагоприятных факторов внешней среды, а также во время процесса эндоредупликации происходит огромное количество ошибок, за год в каждой клетке накапливается очень небольшое число стабильных изменений нуклеотидной последовательности. Среди множества случайных замен оснований в ДНК лишь одна на тысячу приводит к возникновению мутации. Все остальные повреждения очень эффективно ликвидируются в процессе репарации ДНК (рис. 4).
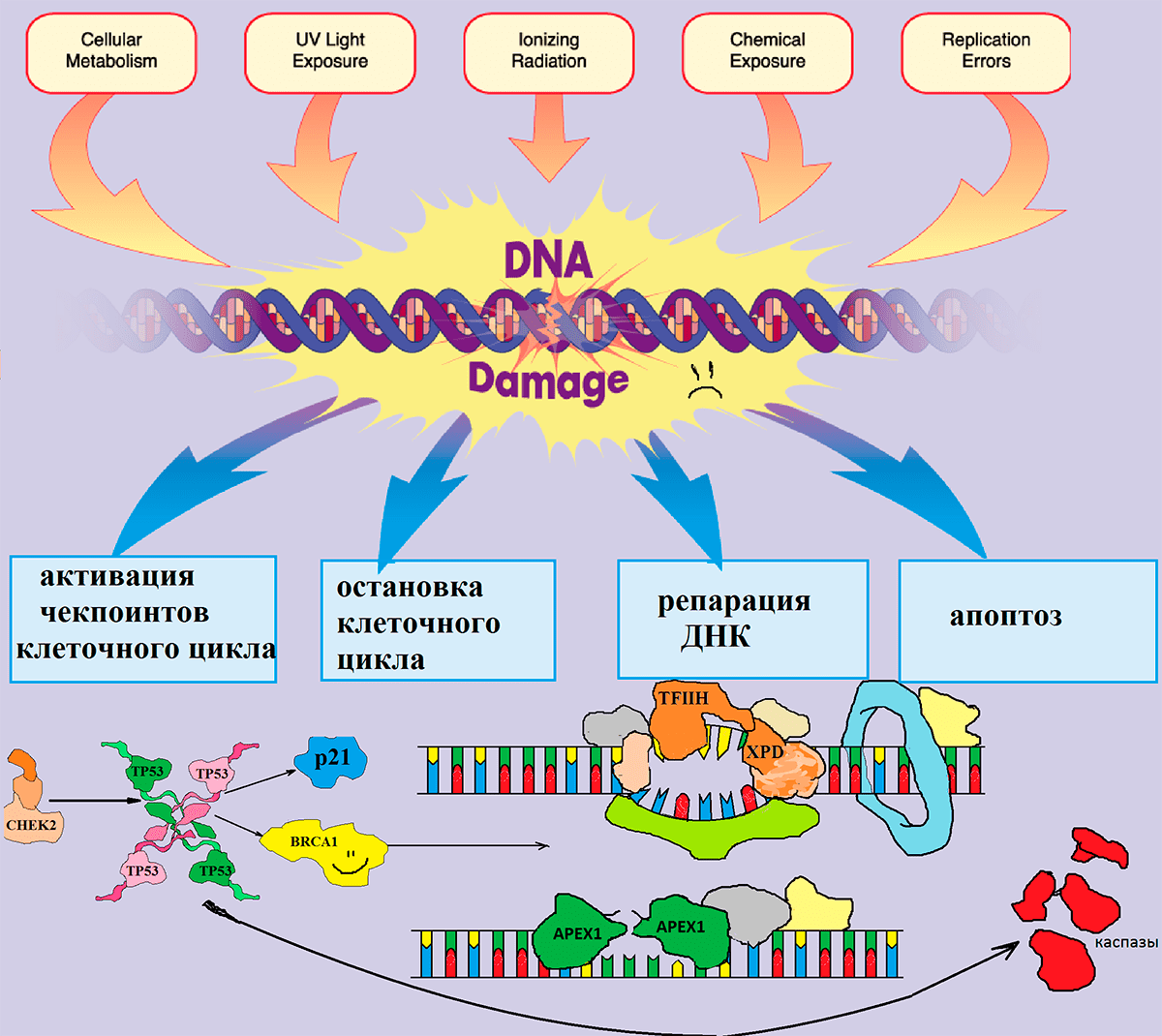
Рисунок 4. Механизм работы системы контроля повреждений ДНК. В раннем эмбриональном периоде происходит активное деление как клеток плода, так и материнских клеток. Этот процесс осуществляется ансамблем слаженно действующей системы репарации. Излучения (радиация, УФ), побочные продукты метаболизма, которые образуются внутри клеток, токсины, попадающие в организм с воздухом, пищей или питьем, а также ошибки репликации вызывают изменения в нуклеотидной последовательности ДНК, которые в норме узнаются белками-участниками контроля клеточного цикла.
Среди последних — белковые продукты генов CHEK2 и TP53, которые останавливают деление клеток и являются объектом нашего исследования. После того, как они срабатывают, ошибка исправляется белками репарации, в числе которых — белковые продукты генов APEX1 и XPD, также ставшие объектами нашей работы. Если же ошибку исправить не удастся, то включается механизм «самоубийства» клетки (апоптоза). Всё это вместе составляет сложную сеть взаимодействующих сигнальных каскадов в клетке, изменение работы одного из которых может привести к нарушению работы и гибели клетки.
Показано, что при различных осложнениях беременности наблюдается повышенный уровень апоптоза в трофобласте [4]. В результате происходит недостаточная подготовка стенок матки к имплантации эмбриона и изменения в маточно-плацентарных артериях, что приводит к снижению кровотока в них. Следствием этого является гипоксия, запускающая механизм окислительного стресса. Гипоксия усиливает апоптоз в трофобласте путем повышения экспрессии ТР53.
Именно поэтому для своих исследований мы выбрали гены системы репарации и контроля клеточного цикла. Исследование генов, контролирующих процесс репарации, — одна из важных задач в раскрытии патогенетических звеньев имплантации эмбриона и децидуализации эндометрия. Знание их роли в патогенезе невынашивания беременности позволяет, с одной стороны, прогнозировать риск развития патологии или тяжесть ее течения, с другой — индивидуально подобрать специфическую терапию для конкретного пациента.
История одного исследования
Участницы нашего исследования были разделены на две группы: женщины с нормально протекавшей беременностью, решившие прервать данную беременность на сроке 6–12 недель, и женщины с НБ. Из тканей матери (периферическая кровь и эндометрий) и плода (хорион, эмбрион) выделяли ДНК и изучали геном испытуемых на наличие аллельных вариантов Asp148Glu, Lys751Gln, 1100delC и Pro72Arg генов APEX1, XPD, CHEK2 и TP53, соответственно. Всё это — гены системы контроля клеточного цикла и репарации ДНК.
Анализ экспрессии этих генов позволил выявить возможные причины и механизмы нарушения процессов эмбриогенеза, приводящих к развитию патологии беременности. В ходе исследования мы обнаружили, что при одновременном наличии полиморфных аллелей изучаемых генов (как в генотипе плода, так и в генотипе матери) достоверно повышается вероятность развития патологии беременности. Большая часть полученных нами отличий в частоте полиморфных аллелей между исследуемыми группами выявлена именно при анализе фетальной ткани (хорион), что говорит о значительном вкладе отцовского генотипа в нормальное развитие беременности.
Это объясняется тем, что процесс имплантации эмбриона контролируется сложной молекулярной машиной, руководимой белками-участниками систем репарации и контроля клеточного цикла (рис. 5). Во время активного деления клеток неизбежно возникновение ошибок. Эти ошибки контролируются в специальных «сверочных точках» (чекпоинтах) клеточного цикла. Белки-сенсоры обнаруживают повреждения ДНК и активируют белки-датчики, которые, в свою очередь, активируют белки-эффекторы. Одним из таких белков является CHEK2 (чекпоинт-киназа2). Киназа активирует опухолевый супрессор TP53, известный также как «страж генома». Этот белок подавляет развитие многих типов новообразований, стимулирует остановку клеточного цикла и репарацию или апоптоз (в зависимости от физиологических условий и типа клеток). Действуя в качестве транскрипционного фактора, TP53 связывается со специфическими последовательностями ДНК и активирует большое число генов-мишеней. Известно, например, что TP53 избирательно индуцирует экспрессию гена хорионического гонадотропина человека (ХГЧ). ХГЧ — один из самых ранних формируемых эмбрионом сигналов, который обеспечивает поддержание продукции прогестерона и иммунную толерантность материнских тканей к ткани плода (являющейся наполовину чужеродной для организма матери из-за наличия отцовского генома).
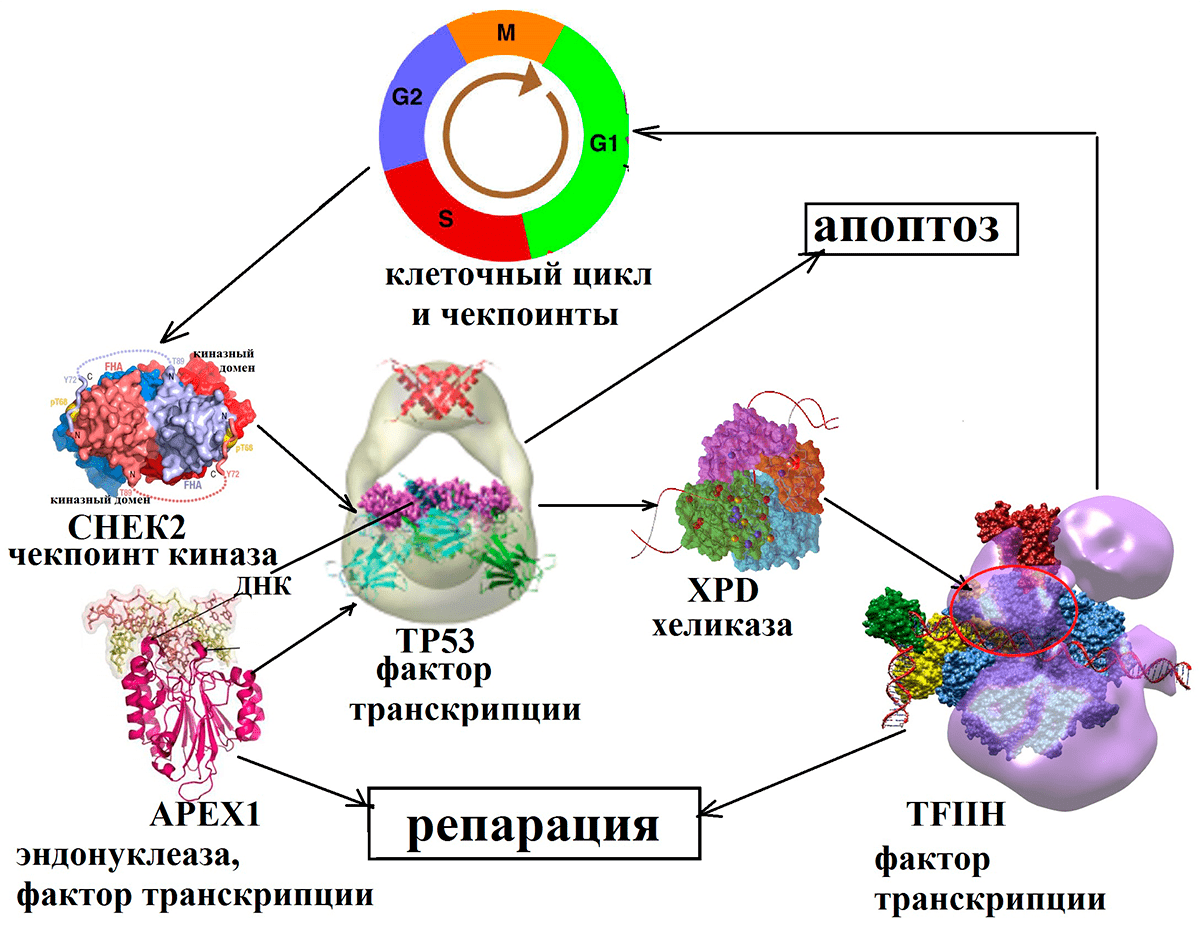
Рисунок 5. Взаимодействие белков репарации и контроля клеточного цикла. В ответ на повреждение ДНК чекпоинт-киназа активирует опухолевый супрессор, который вызывает остановку клеточного цикла и активирует хеликазу и эндонуклеазу, осуществляющие репарацию.
В результате SNP гена в молекуле его белкового продукта одна аминокислота может быть заменена на другую, что приводит к изменению конформации, размера, заряда и других свойств белка. Часто эти изменения приводят к изменению активности (как в случае с TP53, рис. 6) или потере функции (как в случае с CHEK2, рис. 7).
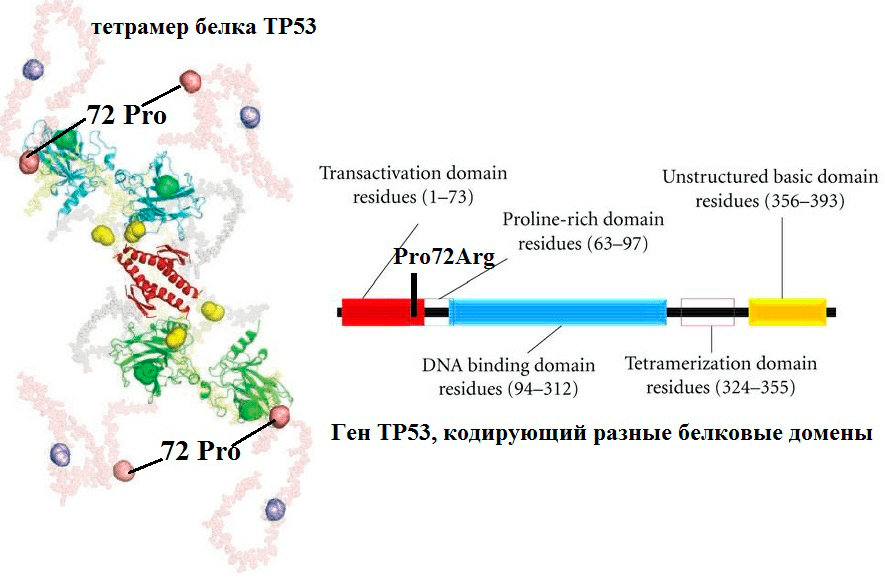
Рисунок 6. Повышение активности белка опухолевого супрессора TP53 в результате SNP кодирующего его гена. Полиморфизм Pro72Arg белка TP53 расположен в участке, богатом пролином и отвечающем за взаимодействие ингибитором TP53. Ингибитор связывается с Pro-формой гораздо сильнее, чем с Arg-формой, поэтому TP53/Arg72 эффективнее активирует апоптоз, чем исходная форма.
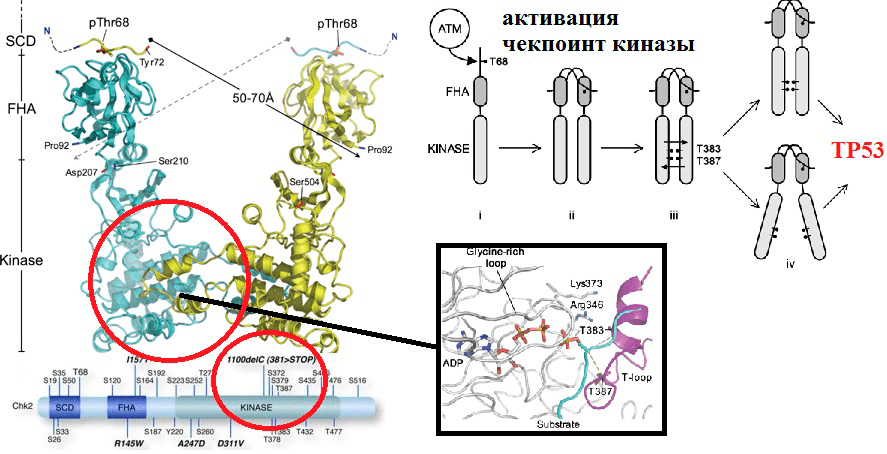
Рисунок 7. Потеря белком киназной функции в результате SNP в кодирующем его гене. Полиморфизм 1100delC гена CHEK2 приводит к экспрессии укороченного киназного домена. Это приводит к тому, что активация белка в ответ на повреждения ДНК становится невозможной (для нее необходимы 387 и 383 остатки треонина, а длина мутантного белка лишь 381 остаток из-за делеции).
При случайном одновременном наличии нескольких аллельных вариантов, продукты генов которых задействованы в выполнении схожих функций, может произойти нарушение работы всего метаболического пути и клетки в целом. Так, полиморфизм Lys751Gln гена XPD нарушает связывание с транскрипционным фактором (ТФ) IIH, действующим на ядерные рецепторы и обеспечивающим контроль активации генов гормонального ответа, необходимый для нормального развития плаценты. Вследствие этого в сыворотке крови матери повышается уровень ХГЧ (хорионического гонадотропина человека) и нарушается функция плаценты. SNP попадает в домен, богатый пролином, необходимый белку для полной индукции апоптоза. В случае неэффективной имплантации эмбриона и возникновения гипоксии будут нарушены механизмы апоптоза. Кроме того, ТР53 не сможет эффективно активировать необходимый для имплантации регулятор LIF и белок р21, запускающий процесс эндоредупликации в эндометрии, а также ХГЧ, участвующий в плацентации посредством стимуляции роста сосудов.
Полиморфные варианты генов системы репарации и контроля клеточного цикла производят менее активные белки репарации и специфические протеинкиназы, что вносит немалый вклад в развитие патологии беременности вследствие несрабатывания механизма корректировки повреждений ДНК, появления геномной нестабильности и запуска апоптоза в материнских и фетальных клетках (клетках плода), что подтвердилось в ходе нашего исследования.
По ту сторону добра и зла
Особенности спектров генетических полиморфизмов в зависимости от географических условий, диеты и этнической принадлежности говорят о невидимой руке естественного отбора. Имеются исследования, в которых было установлено, что частота аллеля Pro гена ТР53 тесно связана с географической широтой и температурой: она гораздо выше в экваториальных популяциях (рис. 8) [6].
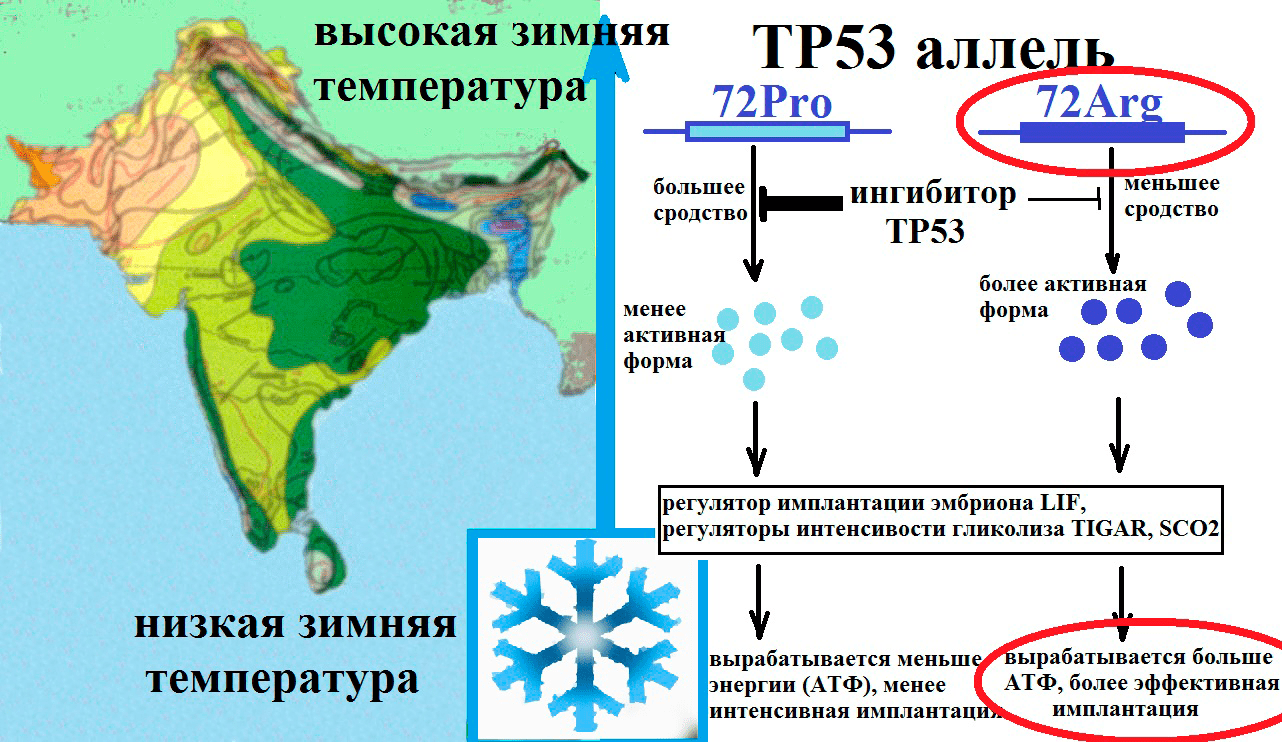
Рисунок 8. Предполагаемый механизм отбора полиморфизма гена TP53. Под влиянием более низких температур в популяции отбирается TP53 Arg72 аллель, так как он дает более активную форму TP53, повышающего активность белков SCO2 (участвует в синтезе АТФ) и TIGAR (участвует в регуляции гликолиза и защите от окислительного стресса). TP53 Arg72 аллель участвует в регуляции метаболизма и имплантации эмбриона и повышении уровня приспособленности.
Эти факты особенно интересны в свете нейтральной теории молекулярной эволюции (НТМЭ), которая объясняет происхождение и распределение nSNV, ассоциированных с болезнями. Авторы одного из недавних исследований предполагают, что большинство аллельных вариантов, ассоциированных с заболеваниями, в современных человеческих популяциях изначально были нейтральными, а некоторые из них могли иметь адаптивное значение (например, замена глутамина на валин в одной из цепей гемоглобина — причина серповидно-клеточной анемии). В рамках этой теории nSNV, ассоциированные с МФЗ, имеют равную скорость эволюции с нейтральными nSNV. Это объясняется тем, что на них, в отличие от nSNV, приводящих к развитию моногенных болезней (например, фенилкетонурии), не действует очищающий отбор, элиминирующий заболевших индивидов [3]. Этот подход хорошо объясняет то, что исследуемый нами полиморфизм Asp148Glu гена АРЕХ1 является исключительно нейтральным для функционирования белка — он не теряет своей эндонуклеазной активности [11], — однако нами выявлена достоверная связь между наличием этого SNP в генотипе матери или плода и невынашиванием беременности.
Таким образом, НТМЭ обеспечивает клиническую генетику информативной базой для объективной оценки адаптивных событий человеческой истории как одной из основных причин заболеваний человека.
Заключение
Индивидуальный вклад каждой причины в проявление болезни может быть незначительным, и только их суммы может оказаться достаточно для развития заболевания. Именно поэтому очень сложно определить, какой именно фактор послужил сигналом для запуска патогенеза. С точки зрения индивидуального прогноза здоровья и оценки риска МФЗ каждый персональный геном дает исчерпывающую информацию о носительстве аллелей, связанных с клиническими фенотипами. Ярким примером МФЗ является невынашивание беременности (НБ). Частота невынашивания в первые три месяца беременности может достигать 80%, и, по меньшей мере, половина этих случаев происходит по непонятным причинам.
Интеграция геномики и феномики в рамках системной биологии, появившиеся в последнее время новые мощные инструменты описания и анализа генетического разнообразия — секвенирование индивидуальных геномов [12] и полногеномный анализ SNP на биочипах, проекты HapMap и «1000 геномов» [1] — дают надежду на быстрый прогресс в каталогизации генетического разнообразия, связанного с риском развития распространенных болезней. Эта информация повысит эффективность лекарственной терапии и перебросит мостик от фундаментальных научных исследований к доказательным рекомендациям в персонифицированной медицине.
Молекулярно-генетическая диагностика позволит врачу заглянуть в индивидуальную программу жизни человека, увидеть особенности его организма, предрасположенность к одним заболеваниям и устойчивость к другим. Таким образом, диагностика заболеваний на досимптомном этапе развития [13] позволит своевременно провести адекватную профилактику заболевания (например, невынашивания беременности или сахарного диабета) и назначить индивидуальную, подходящую именно для этого пациента схему лечения.
Существование генных полиморфизмов является результатом действия факторов микроэволюции и вносит вклад в генетическое разнообразие популяции, тем самым обеспечивая их удивительной способностью изменяться в соответствии с бесконечной изменчивостью окружающего мира. Исследование и выявление генных полиморфизмов, вносящих вклад в развитие того или иного заболевания, имеет прямую прогностическую ценность. Именно такой подход к терапии позволит свести к минимуму неблагоприятные эффекты лекарственных препаратов, сохранить пациенту здоровье и даже жизнь.
Литература
- Перевалило за тысячу: третья фаза геномики человека;
- Søren W. Gersting, Kristina F. Kemter, Michael Staudigl, Dunja D. Messing, Marta K. Danecka, et. al.. (2008). Loss of Function in Phenylketonuria Is Caused by Impaired Molecular Motions and Conformational Instability. The American Journal of Human Genetics. 83, 5-17;
- J. T. Dudley, Y. Kim, L. Liu, G. J. Markov, K. Gerold, et. al.. (2012). Human genomic disease variants: A neutral evolutionary explanation. Genome Research. 22, 1383-1394;
- Щербаков В.И. (2011). Апоптоз в трофобласте и его роль при патологии беременности. «Успехи современной биологии». 2, 145–158;
- Куцын К.А., Коваленко К.А., Машкина Е.В., Шкурат Т.П. (2013). Молекулярно-генетический анализ полиморфизмов генов системы репарации и контроля клеточного цикла у женщин с невынашиванием беременности. «Современные проблемы науки и образования». 1;
- Hong Shi, Si-jie Tan, Hua Zhong, Wenwei Hu, Arnold Levine, et. al.. (2009). Winter Temperature and UV Are Tightly Linked to Genetic Changes in the p53 Tumor Suppressor Pathway in Eastern Asia. The American Journal of Human Genetics. 84, 534-541;
- Errol R. Norwitz, Danny J. Schust, Susan J. Fisher. (2001). Implantation and the Survival of Early Pregnancy. N Engl J Med. 345, 1400-1408;
- S. K. Dey, H. Lim, Sanjoy K. Das, Jeff Reese, B. C. Paria, et. al.. (2004). Molecular Cues to Implantation. Endocrine Reviews. 25, 341-373;
- Gianluca Tell, Franco Quadrifoglio, Claudio Tiribelli, Mark R. Kelley. (2009). The Many Functions of APE1/Ref-1: Not Only a DNA Repair Enzyme. Antioxidants & Redox Signaling. 11, 601-619;
- W. Hu, T. Zheng, J. Wang. (2011). Regulation of Fertility by the p53 Family Members. Genes & Cancer. 2, 420-430;
- David M. Wilson, Daemyung Kim, Brian R. Berquist, Alice J. Sigurdson. (2011). Variation in base excision repair capacity. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 711, 100-112;
Скверный анекдот: негр, китаец и Крейг Вентер...;- Упреки в нарциссомике.






