РНК у истоков жизни?
16 августа 2013
РНК у истоков жизни?
- 13005
- 6
- 10
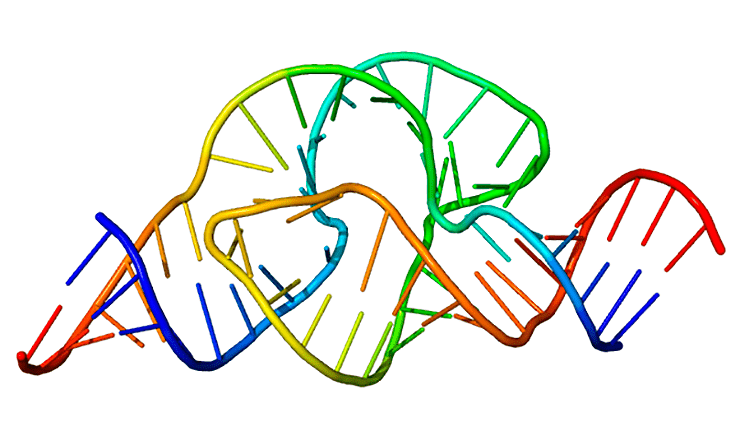
Сторонники теории мира РНК утверждают, что жизнь на нашей планете началась с рибозимов — молекул РНК, способных к катализу без участия белковых ферментов. На рисунке — один из таких рибозимов, обладающих рибонуклеазной активностью.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Идея того, что жизнь могла возникнуть на основе самореплицирующихся молекул РНК, уже не нова. В самом деле, РНК совмещает в себе как функцию хранения наследственной информации, так и способность к биохимическому катализу. Сейчас гипотеза РНК-мира из чисто умозрительной теории превратилась в теоретическую модель, имеющую хорошую доказательную и экспериментальную базу. Безусловно, эта теория вызывает много вопросов, но, тем не менее, она по полному праву может быть названа одной из наиболее обоснованных гипотез возникновения жизни на Земле.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Противоречия гипотезы мира РНК
Идея мира РНК была высказана в 1968 году Карлом Вёзе [1], а окончательно сформулирована в 1986 году нобелевским лауреатом Уолтером Гильбертом. То, что РНК способна как хранить наследственную информацию, так и выполнять работу (например, при биосинтезе белка), было известно и ранее. Но окончательно гипотеза мира РНК смогла сформироваться лишь после открытия в 1981 году рибосомальной РНК из ресничного простейшего Tetrahymena, которая способна к автосплайсингу. Осуществляется это следующим образом: к интронной последовательности РНК прикрепляется нуклеотид G, далее цепь разрезается в месте присоединения нуклеотида. После этого происходит окончательное вырезание интрона и сшивание экзонов. Более того, эта интронная последовательность обладает рибонуклеазной активностью, т.е. она способна связываться с субстратной РНК и специфично разрезать её. Такие свойства рибонуклеиновому интрону придаёт его способность к образованию сложных трёхмерных структур.
Однако платой за высокую лабильность РНК служит её склонность к быстрой деградации. Здесь мы и сталкиваемся с первой трудностью концепции РНК-мира. Как молекула может служить надёжным хранилищем генетической информации, если время её жизни мало?
Это противоречие способны разрешить некоторые предположения. Считается, что первые РНК могли размножаться в микрополостях во льду. В подтверждение этому, по данным ряда экспериментов, максимальная рибозимная активность РНК наблюдается при температуре около −8 °С. Возможно, это связано с тем, что при подобных температурах увеличивается концентрация РНК и понижается активность воды. Однако вероятная сложность здесь заключается в том, что РНК при низких температурах обретают повышенную склонность к образованию водородных связей между комплементарным нуклеотидами, что ведёт к образованию межмолекулярных комплексов и снижению каталитической активности [2].
Следующей большой трудностью является склонность РНК к гидролизу при pH>6. Фосфодиэфирные связи между нуклеотидами наиболее стабильны при рН, лежащих в пределах 4–5.
Также двоякую роль играют и ионы Mg2+: с одной стороны, они стабилизируют вторичную и третичную структуры РНК (что критично для способности к катализу), с другой же, их высокая концентрация способствует деградации молекул. Выше упоминалось, что молекулы РНК наиболее стабильны в кислой среде. В этих условиях цитозин и аденозин протонируются, тем самым обретая дополнительный положительный заряд, что снижает потребность в катионах. К примеру, при рН=4 некоторые рибозимы сохраняют свою активность даже в отсутствие ионов [2].
РНК является весьма сложной молекулой, и вероятность её внезапного возникновения из отдельных атомов или фрагментов крайне низка. Действительно, сложно себе представить, как могли соединиться вместе азотистое основание, рибоза и фосфат, образовав нуклеотид. Однако Санчез, Оргел, Паунер и Сазердэнд показали возможность синтеза пиримидинов из молекул, вероятно, имевшихся в пребиотических условиях Земли [3].
Также важно понять, каким образом осуществлялась полимеризация первых нуклеотидов в полимерные цепочки. Относительна недавно была обнаружена важная роль различных минералов и ионов металлов в катализе при образовании биополимеров [4]. К примеру, монтмориллонит катализирует полимеризацию нуклеотидов, 5′-фосфат которых ранее был активирован имидазолом. Более того, монтмориллонит способен образовывать везикулы из простых жирных кислот [4]. Таким образом, этот минерал, с одной стороны, способствует полимеризации нуклеотидов, а с другой — образованию мембранных структур.
Гипотетически, существует множество вариантов соединения рибонуклеотидов друг с другом через различные атомы рибозы. Однако в живых организмах нуклеотиды соединены друг с другом через 3′,5′-фосфодиэфирную связь (за некоторыми исключения: например, кэп в мРНК эукариот присоединяется через 5′,5′-связь). Недавние исследования Шостака показали, что рибозимы, имеющие в своём составе нуклеотиды, соединённые как через 3′,5′-связь, так и через 2’,5′-связь, частично сохраняли каталитические свойства [5]. Вероятно, в первых рибонуклеиновых полимерах могли реализовываться различные варианты фосфодиэфирной связи, однако эволюцией была отобрана именно 3′,5′-связь.
Зачастую каталитической активностью обладают лишь длинные цепочки РНК. Это один из основных объектов критики теории РНК-мира, ибо случайное возникновение длинных последовательностей, способных выполнять биохимическую работу, весьма маловероятно. Одна из лучших рибозимных репликаз, созданных на сегодня, способна реплицировать до 95 нуклеотидов [6], однако сама она при этом имеет длину в 190 нуклеотидов (см. врезку). Длина этой последовательности слишком велика для спонтанного возникновения в пребиотических условиях. Исследования in vitro показывают, что для выделения молекул, способных к катализу, требуется около 1013—1014 молекул РНК [2] — довольно много для того, чтобы столь длинный рибозим мог появиться в готовом виде. Однако открытие коротких рибозимов ставит под сомнение идею того, что для появления РНК-катлизаторов требуются астрономические количества молекул. В самом деле, получены полирибонуклеотиды c активными дуплексами, способными к самовырезанию, имеющие длину лишь 7 остатков [2]. Более того, были получены данные, что даже рибозим, урезанный всего лишь до пяти нуклеотидов, сохранял свои ферментативные способности [2]. Но каталитическая активность у минирибозимов значительно ниже, чем у их более длинных «собратьев». Из этого следует, что короткие рибозимы могли быть эволюционными предшественниками длинных. Со временем они приобрели бóльшую длину, которая способствовала обретению более правильной структуры и, как следствие, улучшению каталитических свойств.
Интроны, способные вырезаться самостоятельно, были обнаружены в тирозиновой тРНК таких сложных организмов, как человек и цветковое двудольное растение Arabidopsis thaliana. Эти 12-ти и 20-ти нуклеотидные участки в клетке вырезаются путём сплайсинга с участием белков, однако этот интрон показал способность вырезать самого себя и без участия ферментов.
РНК-переключатели
Ограниченная каталитическая способность рибозимов часто становится ещё одним хлипким краеугольным камнем теории мира РНК. Критики теории считают, что тот минимум химических реакций, который необходим для осуществления метаболизма в мире РНК, не может быть обеспечен одними лишь рибозимами. Подавляющее большинство РНК-катализаторов катализируют лишь разрыв и создание фософодиэфирных связей между нуклеотидами. Кажется, что молекулы РНК со своими четырьмя весьма схожими мономерами безнадёжно проигрывают в химическом разнообразии белкам, которые имеют в своём составе 20 аминокислот, весьма различных по свойствам. Однако не стоит забывать, что многие белковые ферменты для выполнения активной работы должны присоединить лиганды — кофакторы, — без которых ферментативная активность попросту исчезает.
И здесь стоит вспомнить об РНК-перключателях или рибопереключателях (англ. riboswitches). Что же это такое? Как известно, информация об аминокислотной последовательности белка передаётся в рибосому через мРНК. Матричная РНК транскрибируется с ДНК посредством фермента ДНК-полимераза II. В данном случае, помимо самого гена, транскрибируется участок впереди него, на котором и расположен рибоперключатель [8]. РНК-переключатель представляет собой участок мРНК, способный связывать молекулу строго определённого вещества. После связывания переключатель меняет свою пространственную конфигурацию, что делает невозможной дальнейшую транскрипцию [8].
Важно понимать принцип работы РНК-переключателей, поэтому скажем пару слов об их устройстве. Состоит он из двух частей: из аптамера и «экспрессионной платформы». Аптамер, по сути, является рецептором, который с очень высокой селективностью связывается с определённой молекулой. Эффекторной молекулой для аптамера является молекула, производимая белком, ген которого и регулируется переключателем. «Экспрессионная платформа» и есть сам РНК-переключатель, который после связывания рецептора с лигандом меняют конфигурацию и препятствует дальнейшей транскрипции.
Однако существуют и РНК-переключатели, действующие по более сложному механизму. Например, рибопереключатель, контролирующий транскрипцию гена metE бактерии Bacillus clausii, является двойным, т.е. имеет два рецепторных участка, связывающих две разных молекулы [9]. Разберём данный механизм подробнее.
Ген metE кодирует фермент, превращающий гомоцистеин в аминокислоту метионин. Затем метионин используется (уже другим ферментом) для синтеза S-аденозилметионина (или проще — SAM). Помимо гена metE, существует и другой ген — metН. Белок гена metН катализирует ту же реакцию, но с большей эффективностью, чем metE. Однако metН для своей работы требует кофермент — метилкобаламин (или MeCbl), синтезируемый из аденозилкобаламина (или AdoCbl). Так вот, транскрипт metE имеет РНК-переключатель, который содержит два связывающих участка: один для SAM, другой — для AdoCbl. Данный переключатель способен действовать как логический элемент NOR (и/или) [9]. То есть, для выключения metE достаточно связывания с рецепторами рибопереключателя либо одной из эффекторных молекул, либо сразу обеих. Сам механизм прерывания трансляции основан на образовании шпильки путём удаления шести нуклеотидов из рибопереключателя (рис. 1А). Логику действий такого элемента NOR можно описать так: «Я подавляю транскрипцию, если в среде присутствует либо вещество А, либо вещество В, либо оба вещества сразу». Остаётся только удивляться, сколь красивы и элегантны решения Природы!
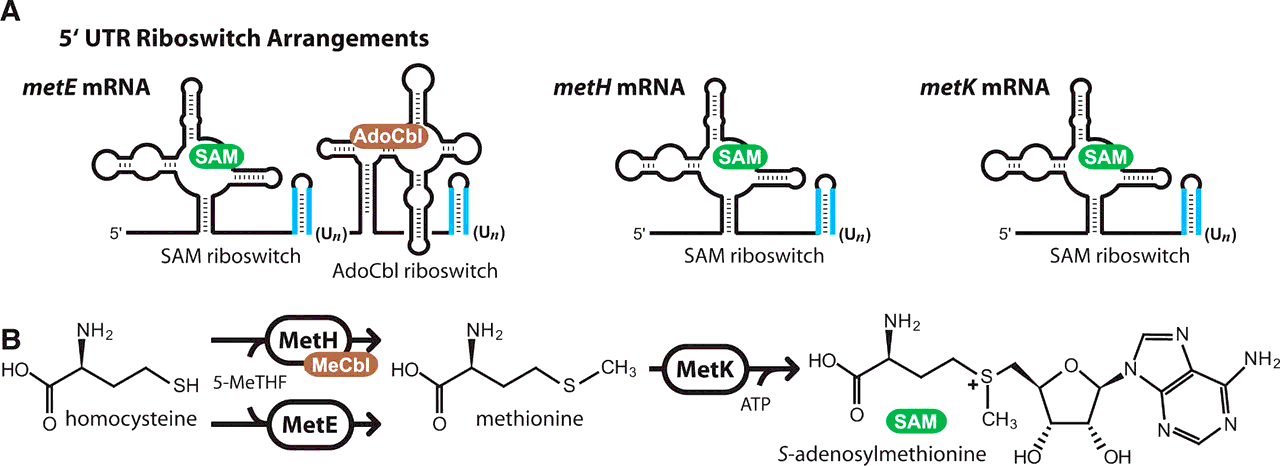
Рисунок 1. Работа рибопереключателей. А — Рибопереключатели на транскриптах генов metE, metH и metK. Голубым обозначены шпилечные структуры, образуемые в результате вырезания шести или более уридиновых нуклеотидов. Видно, что у metE имеется два акцепторных и два шпилечных участка. В — Путь биосинтеза S-аденозилметионина. На первом этапе гомоцистеин преобразуется в амикислоту метионин. Это превращение может быть катализировано одним из двух ферментов: metE или metH. metH проводит эту реакцию с большей эффективностью, однако требует для своей работы дополнительного вещества (кофактора). На втором этапе фермент metK превращает метионин в S-аденозилметионин.
Между тем, РНК-переключатели способны связывать значительное число белковых кофакторов, таких как флавинмононуклеотид, тиаминпирофосфат, тетрагидрофолат, S-аденозилметионин, аденозилкобаламин [8]. Изначально считалось, что РНК-переключатели способны лишь подавлять экспрессию генов [8], но позже были получены данные, свидетельствующие о том, что некоторые переключатели, напротив, ее усиливают. Сами по себе РНК-переключатели представляют весьма интересное явление, так как они демонстрируют возможность регуляции работы генов без прямого участия белков — иными словами, демонстрирует самодостаточность и универсальность РНК. Судя по всему, РНК-переключатели являются очень древним механизмом: так, они обнаружены во всех доменах живой природы: у бактерий, архей и эукариот [8]. Похоже, что, по меньшей мере, некоторые из современных кофакторов белков были прямиком заимствованы из мира РНК. Можно нарисовать примерно такую картину: рибозимы изначально использовали многие из современных кофаторов для своих целей, однако с появлением более эффективных белковых ферментов эти кофакторы были заимствованы последними.
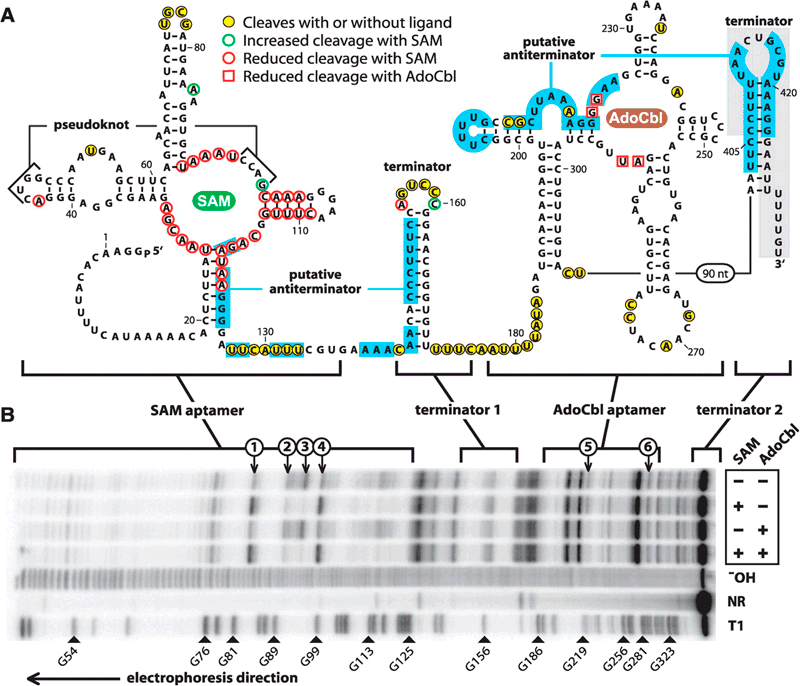
Рисунок 2. Вторичная структура РНК-переключателя гена metE. Выделены акцепторы — сайты связывания с молекулами SAM и AdoCbl, а также шпилечные терминирующие структуры.
Геномные тэги и тРНК
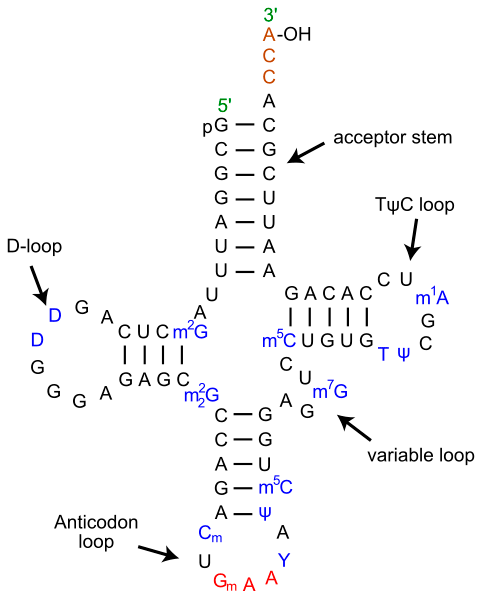
Рисунок 3. Вторичная структура тРНК. На рисунке отчётливо видна характерная для тРНК вторичная структура в виде «клеверного листа». В верхней половине молекулы на 3′-конце расположена CCA-область и акцепторная петля, связывающая аминокислоту. В нижней части молекулы находится антикодоновая петля, ответственная за комплементарное связывание с кодоном мРНК. Согласно гипотезе геномного тэга, верхняя и нижняя половины тРНК эволюционировали по отдельности, причём верхняя половина древнее нижней.
Всем хорошо известна важная роль тРНК в биосинтезе белка. Однако у тРНК и подобных ей молекул есть другая, менее известная, но не менее важная функция: в различных репликативных процессах они исполняют роль праймеров и шаблонов. Это могут быть процессы репликации одноцепочечной вирусной РНК, репликация митохондриальной ДНК у грибов, репликации теломер [10].
Обратимся к вирусной РНК. 3′-конец многих бактериальных вирусов и вирусов растений структурно очень похож на «верхнюю половину» современной тРНК (та часть молекулы, которая связывается с аминокислотой; рис. 3). Подобные участки, расположенные на 3′-концах, названы «геномными тэгами» [10]. Тэг играет роль шаблона при инициации репликации вирусной РНК. Более того, эти участки бывают настолько похожи на «настоящие» тРНК [10], что могут быть аминоацилированы (т.е. к ним может быть присоединена аминокислота) при помощи фермента аминоацил-тРНК-синтетазы.
Также репликация многих РНК у ретровирусов начинается с того, что к сайту связывания праймера на вирусной РНК присоединяется тРНК хозяйского организма [9]. Тем самым видно, что тРНК современных организмов способны также служить и праймерами. Затем, используя тРНК как праймер, обратная транскриптаза копирует вирусный РНК-геном в ДНК.
Возможно ли, что тРНК сегодняшних организмов произошли от древних геномных тэгов? Алан Вейнер и Нэнси Мэйцелс [10] отвечают на этот вопрос утвердительно. Согласно их теории, верхняя и нижняя половинки тРНК эволюционировали по-отдельности, причём верхняя часть тРНК появилась раньше нижней и является потомком геномных тэгов [10].
Происхождение рибосом
При построении гипотезы мира РНК много внимания уделяется и происхождению рибосом, потому что их образование фактически можно приравнять к переходу от РНК-катализа к белковому процессу. Как известно, рибосома состоит из двух субъединиц: малой и большой. Ключевую роль в синтезе белковой цепи играет большая субъединица рибосомы, в то время как маленькая считывает мРНК. Модель происхождения одной из молекул большой субъединицы была предложена канадскими биохимиками Константином Боковым и Сергеем Штейнбергом [11].
Они сосредоточили внимание на 23s-рРНК (состоящей из шести доменов, I–VI), так как именно в этой молекуле находится функциональный центр, ответственный за реакцию транспептидации (присоединение новой аминокислоты к растущей полипептидной цепи). Данная молекула содержит около трёх тысяч нуклеотидов и способна образовывать сложные трёхмерные структуры. Важную роль в поддержании трёхмерной структуры молекулы играют так называемые А-минорные связи [11]. Они представляют собой связи между «стопками» нуклеотидов (как правило, аденозинов [11]) с участками, образующими двойные спирали. Связи формируются между спиралями и стопками, расположенными в разных областях молекулы.
23s-рРНК слишком сложна, чтобы она могла появиться сразу в готовом виде [12]. Соответственно, в молекуле должна присутствовать некая более простая структура, с которой и началась её эволюция. Особое внимание исследователей привлёк домен V [11]. Интересным в нём было то, что он содержит большое количество двойных спиралей при фактически полном отсутствии аденозиновых стопок. Вот что пишут по этому поводу авторы исследования: «Чтобы объяснить аномалию, имеющую место в домене V, мы предположили, что это отражает порядок, в котором различные части присоединялись к 23s-рРНК по мере её эволюции. В А-минорных мотивах конформационная стабильность аденозиновых стопок зависит от присутствия двойных спиралей, в то время как двойные спирали способны сохранять стабильную структуру сами по себе» [11]. Из этого следует, что домен V является наиболее древней частью молекулы: его спиральные участки, что придают стабильность всей молекуле, должны были появиться раньше других частей, содержащих аденозиновые стопки. Более того, именно в пятом домене находится функциональный центр, ответственный за формирование пептидной связи в процессе биосинтеза белка.
Выходит, что пятый домен является и функциональным центром молекулы, и её структурным остовом. Это говорит о том, что эволюция 23s-рРНК началась именно с него. Далее авторы попытались реконструировать эволюцию 23s-рРНК. Для этого они разбили молекулу на 60 относительно небольших участков и попытались «разобрать» её так, чтобы, убирая части поэтапно, не повредить структуру оставшейся молекулы. Опустив детали, укажем, что вывод был именно такой: эволюция этой молекулы началась именно с пептидил-трансферазного центра пятого домена, так как при разборке он оставался последним неповреждённым участком (см. рис. 4). Исследователи считают, что именно эта структура и является древней «проторибосомой». Способна ли эта маленькая часть огромной молекулы выполнять свою работу самостоятельно? Исследования дают положительный ответ. В ходе экспериментов были получены искусственно выведенные рибозимы, способные осуществлять реакцию транспептидации [12].
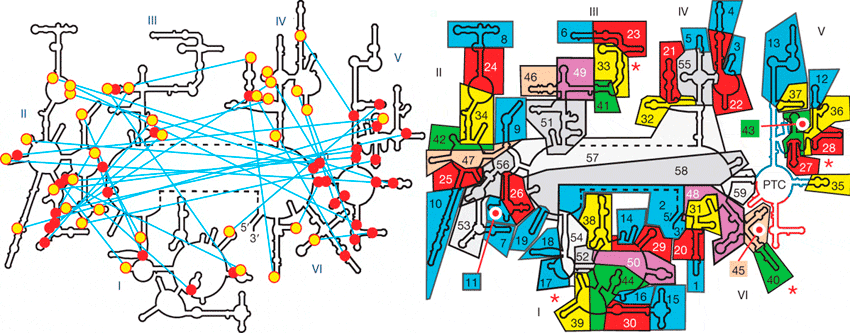
Рисунок 4. Эволюция «проторибосомы». Слева — Вторичная структура 23s-рРНК. Красные кружочки изображают спиральные участки, жёлтые — аденозиновые «стопки». Голубые линии показывают А-минорные связи. Римские цифры обозначают домены молекулы. Отчётливо видно, что наибольшее количество спиральных участков находится в домене V. Справа — Для того чтобы выяснить процесс эволюции 23s-рРНК, авторы разбили молекулу на 60 структурных блоков. Далее они попытались «разобрать» молекулу так, чтобы при последовательном удалении этих блоков молекула продолжала работать [12]. Сначала они отделили 19 блоков, не повредив при этом оставшиеся. После удалось отделить ещё 11 блоков, а затем ещё последовательно 9, 5, 3, 3, 2, 2, 2. Затем ещё три блока оказалось возможным отделить по одному [12].
По всей видимости, именно пятый домен послужил «стартовой точкой» в эволюции 23s-рРНК. Позже к нему начали добавляться различные блоки, улучшающие работы молекулы. Изначально к проторибосоме присоединилось восемь блоков, образовавших «основание», что повлекло за собой увеличение стабильности всей молекулы. Затем добавились следующие 12 блоков, которые образовали структуры, позволяющие соединяться большой и малой субъединицам друг с другом. Последними добавились блоки, образующие т.н. «протуберанцы» — выросты на поверхности большой субъединицы [12]. Функция этих выростов в том, чтобы помочь рибосоме выбрать нужную аминоацил-тРНК, а также «выпустить на волю» ту тРНК, которая уже отдала свою аминокислоту растущей белковой молекуле.
Следы мира РНК
Наследие мира РНК можно обнаружить в любом живом организме. Вспомним рибосомы, которые, по всей видимости, являются реликтами очень давней эпохи, ведь структурно и функционально рибосомы крайне схожи и у человека, и у дождевого червя, и у кишечной палочки. Главный переносчик энергии в клетке — молекула аденозинтрифосфата — представляет собой не что иное, как аденозин с двумя дополнительными фосфатами. Такие важнейшие молекулы, как переносчики электронов ФАД и НАД также являются модифицированными нуклеотидами. Конечно, гипотеза мира РНК ещё не доказана, да и нет гарантий, что когда-нибудь это случится. Но факт того, что важнейшие процессы в клетке протекают при активном участии РНК и рибонуклеотидов, может служить веским доводом в пользу истинности этой теории.
Литература
- Карл Вёзе (1928–2012);
- Harold S Bernhardt. (2012). The RNA world hypothesis: the worst theory of the early evolution of life (except for all the others)a. Biology Direct. 7, 23;
- C. Briones, M. Stich, S. C. Manrubia. (2009). The dawn of the RNA World: Toward functional complexity through ligation of random RNA oligomers. RNA. 15, 743-749;
- Matthew W. Powner, Béatrice Gerland, John D. Sutherland. (2009). Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions. Nature. 459, 239-242;
- Jack W Szostak. (2012). The eightfold path to non-enzymatic RNA replication. J Syst Chem. 3;
- A. Wochner, J. Attwater, A. Coulson, P. Holliger. (2011). Ribozyme-Catalyzed Transcription of an Active Ribozyme. Science. 332, 209-212;
- Элементы: «Рибозимы могут размножать друг друга»;
- Элементы: «Сложные РНК-переключатели — новый механизм регуляции генов»;
- N. Sudarsan, M. C. Hammond, K. F. Block, R. Welz, J. E. Barrick, et. al.. (2006). Tandem Riboswitch Architectures Exhibit Complex Gene Control Functions. Science. 314, 300-304;
- Weiner A.M., Maizels N. (1999) The genomic tag hypothesis: modern viruses as molecular fossils of ancient strategies for genomic replication, and clues regarding the origin of protein synthesis. Biol. Bull. 196, 327–328;
- Konstantin Bokov, Sergey V. Steinberg. (2009). A hierarchical model for evolution of 23S ribosomal RNA. Nature. 457, 977-980;
- Элементы: «Тайна рибосом разгадана?».