«Нарисуем» живую клетку
10 сентября 2013
«Нарисуем» живую клетку
- 1206
- 0
- 2
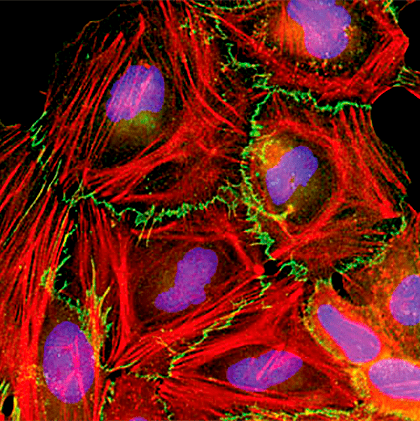
Клетки карциномы шейки матки человека HeLa, подвергнутые трехцветному прижизненному окрашиванию. Фотография получена с помощью конфокальной флуоресцентной микроскопии.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Со времен изобретения светового микроскопа прошло немало времени, и теперь ученые, говоря о получении изображения клетки (англ. imaging), имеют в виду отображение биохимических процессов в ней на надмолекулярном и даже молекулярном уровнях. Для этого разработано множество методов и технологических ухищрений, при которых соблюдается одно главное условие: клетка на момент изучения должна быть живой.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Инновационные методологические разработки в области биологии все больше сосредотачиваются на познании живых систем в их физиологическом, и даже динамическом состоянии, по сравнению с классическими, но устаревающими статическими, описательными подходами. Необходимость такого условия становится все более ощутимой по мере расширения наших фундаментальных знаний о клетке. Системы передачи сигнала, прохождения жизненного цикла и обеспечения метаболических процессов клетки настолько тонко настроены, что не только ее гибель, но и слишком грубое воздействие в процессе изучения могут свести на нет достоверность выявляемых особенностей.
Что же может «увидеть» современный исследователь, изучающий живую клетку? Не будет преувеличением сказать, что практически всё. Подробнейшую топографию ее поверхности со сложной микродоменной структурой плазматической мембраны [1], гликанами и сигнальными белковыми островками; трехмерную топографию отдельных органелл или же очаги биосинтеза и градиенты плотности растворимых сигнальных молекул; проницаемость и уровень поляризации мембран митохондрий; функционирование цитоскелета в режиме реального времени; преобразования структуры хроматина при делении клетки; физическое взаимодействие молекул белков и множество других сложных клеточных процессов и состояний.
Технологии красоты изображений
Лидирующие позиции по количеству методов и биохимическому охвату исследуемых микроскопических объектов следует признать за подходом, в основе которого лежит использование флуоресцентных красителей и биологических люминофоров. Классическая световая и конфокальная микроскопии в сочетании с прижизненным окрашиванием клеток в последние два десятилетия обеспечили прогресс в качественной идентификации и количественном описании молекулярных систем и способствовали развитию клеточной биологии. Открытие зеленого флуоресцирующего белка (GFP) [2] и его производных, так же как и люцифераз, дало начало важнейшим приложениям молекулярной биологии в визуализации клеток. На основе GFP создано множество зондов и маркеров для изучения как внутренних структур, так и поверхности клеток. Биолюминесценция, являющаяся важной альтернативой флуоресценции, характеризуется меньшим токсическим воздействием и низким фоновым свечением по сравнению с флуоресценцией. С ее помощью отслеживают движение клеток in vivo, измеряют количество ионов кальция и других сигнальных молекул, определяют протеолитическую активность, устанавливают наличие белок-белковых взаимодействий.
Вообще, проблему поиска непосредственного физического взаимодействия между молекулами ученые научились решать несколькими способами. Это и упомянутые люминесцентные репортерные белки, и Ферстеровский перенос энергии флуоресценции (FRET) [3], [4] и биолюминесценции (BRET) от одного флуорофора к другому, и масс-спектрометрическое выделение белковых комплексов.
Флуорохромы остаются незаменимыми молекулами для визуализации на самых различных уровнях рассмотрения клетки, в том числе и в огромном многообразии подходов современной микроскопии. Они используются в многофотонной микроскопии при описании динамических (например, иммунных) процессов. Переход от рассмотрения микроскопических структур к описанию наноструктур, сопровождающийся неизбежным переходом через пресловутый дифракционный предел (200 нм, который соответствует примерно половине длине волны видимого света, открыт Эрнстом Аббе в 1873 г.), позволил не только обновить технологическую базу для визуализации, но и приступить к непосредственному изучению принципиально нового уровня организации биологической материи — одиночных молекул. Сверхразрешающие типы микроскопии (подробнее о некоторых из них см. в статье «Лучше один раз увидеть, или микроскопия сверхвысокого разрешения» [5]), такие как микроскопия локализованной фотоактивации (PALM-микроскопия) и поверхностно-усиленная Рамановская спектроскопия (SERS), также зависят от флуоресцентного сигнала, только в случае PALM считывается непосредственно флуоресцентный сигнал, а в случае SERS измеряется рассеивание свечения на молекулах биологического образца.
В качестве флуоресцирующего агента может выступать не только органический краситель или флуоресцирующий белок, но и наноразмерный кристалл, квантовые свойства которого позволяют электронам легко возбуждаться и так же легко релаксировать с испусканием определенной длины волны. Такие нанокристаллы получили название квантовых точек (англ. quantum dots) и уже заслужили себе статус проверенных оптических репортеров в клеточной биологии [6]. Их свечение более яркое, они легко попадают в клетку, имеют стабильные характеристики флуоресценции и высокую удельную поверхность, и при этом справляются с визуализацией очень маленьких объектов. Будучи связанными с определенными молекулами, квантовые точки могут служить наносенсорами и определять не только особенности поверхности биологических структур, но и рН их локального окружения с нанометровым разрешением [7].
Следует отметить, что при тотальном господстве идеологии использования флуоресценции существует несколько типов приборов, работающих по принципу неинвазивного исследования, то есть без введения в клетку каких-либо чужеродных веществ, в том числе флуорофоров. К ним относится сканирующая ион-проводящая микроскопия (SICM), которая в сочетании с конфокальной микроскопией и методом локальной фиксации потенциала (patch-clamp) позволяет с высоким разрешением описывать топографию клеточной поверхности [8]: с ионными каналами и специфическими наноструктурами на ней (рис. 1). Еще один мощный неинвазивный метод — это когерентная антистоксова микроскопия комбинационного рассеивания (CARS), при которой путем рассеяния многофотонного сигнала на внутримолекулярных химических связях создается трехмерное изображение внутриклеточных структур с субмикронным разрешением [9]. Ученые из Токийского университета пошли другим путем — они измерили с помощью миниатюрных термометров и детекторов распределение температуры в различных участках живой клетки и пришли к выводу, что функцией локальной температуры внутри клетки является не только активность биологических молекул, но и работа клетки в целом. Так, клеточный цикл регулируется определенными изменениями температуры в отдельных участках клетки [10]. Совершенно понятно, что такое термо-картирование может оказаться важным источником информации о механизмах функционирования раковых клеток.
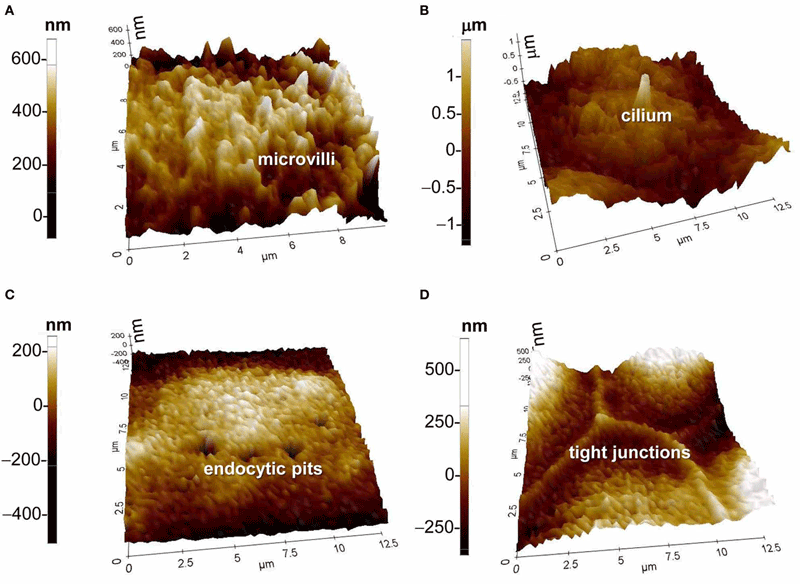
Рисунок 1. Изображение поверхности мышиных клеток коры почки mpkCCDc14, полученное с помощью сканирующей ион-проводящей микроскопии (SICM). А — микроворсинки; B — ресничка; С — эндоцитозные впячивания; D — плотные контакты клеток.
Самые же передовые достижения современных наук формируются на стыке независимо развивающихся направлений. Вот и в сфере визуализации живой клетки появляются технологии, как бы соединенные из нескольких хорошо известных методов. При этом ученые научились искусно обходить фундаментальные ограничения, изначально считавшиеся непреодолимыми — например, объединять методы, работающие по принципу деструкции образца, с классическими щадящими подходами визуализации живых клеток. Из наиболее перспективных таких «симбиозов» стоит выделить сочетание сканирующей электронной микроскопии со стандартной флуоресцентной микроскопией [11]. Введенные в клетку генно-инженерным способом GFP-метки определенных белков помогают регистрировать в режиме реального времени их транспорт через ядерные поры, а параллельная работа сканирующего микроскопа предоставляет изображения структур комплексов ядерных пор с разрешением до 3 нм. В результате обрисовывается динамическая картина транспорта белков, полученная с качеством изображения, обеспечивающегося только статическим методом. Другой метод, разработанный в японском исследовательском центре RIKEN, объединяет рентгеновскую дифракционную микроскопию с подходом использования искусственных мембран в in vitro исследованиях [12]. Клетку заключают в пространство между мембранами, заполненное однородным физиологическим раствором, поэтому на момент облучения клетка находится в неповрежденном состоянии. Когерентная рентгеновская дифракция (CDI) позволяет в этом случае сделать трехмерное изображение клетки с разрешением 25 нм. И это отнюдь не единичный пример использования рентгеновского метода в визуализации живых микросистем. Сочетание микроскопии с масс-спектрометрией ученые уже назвали «новой пост-флуоресцентной эрой» за совершенно новые возможности в получении и обработке информации о протеоме. Основная идея этой методологии кроется в возможности проведения масс-спектрометрического анализа образцов, содержащих практически неограниченное количество различных молекул. Современное программное обеспечение и разрешение приборов позволяют распознавать до 20 000 уникальных белковых молекул одновременно. В сочетании с флуоресцентной микроскопией метод позволяет четко картировать все содержимое клетки и попутно делать выводы о путях биосинтеза и составе интермедиатов [13]. При сочетании микроскопии сверхвысокого разрешения и методологии FRET была получена серия методов, один из которых — dSOFT (прямой Ферстеровский перенос энергии оптических колебаний) — обладает колоссальными возможностями в визуализации живых клеток [14]. Изображение возникает в результате стохастического мерцания FRET-флуорофора, диффундирующего в клетку, преинкубированную со вторым FRET-флуорофором. (рис. 2). Интересен также подход, разработанный в знаменитой оксфордской лаборатории Резерфорда-Эплтона, с использованием фемтосекундного сфокусированного в нанопучок лазера ближнего инфракрасного диапазона, вызывающего незначительные локальные повреждения ДНК с последующим флуоресцентным мониторингом динамики репарации этих повреждений живой клеткой [15].
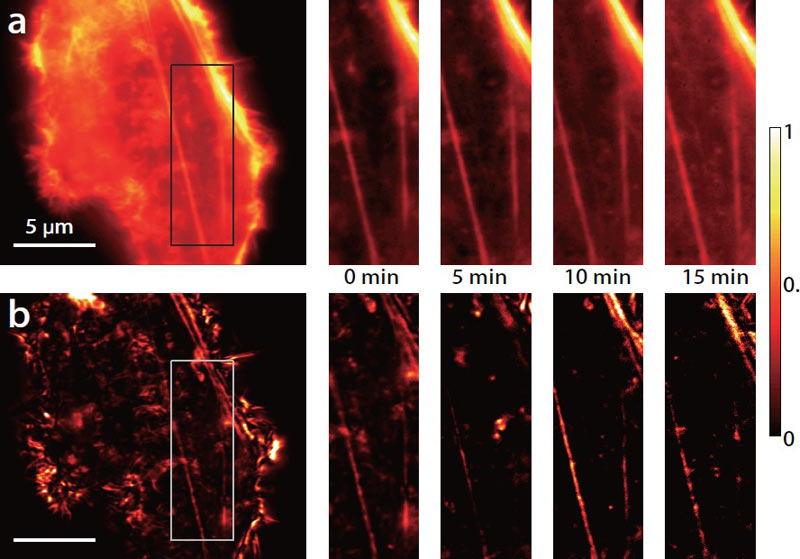
Рисунок 2. Продолжительное наблюдение за FRET-взаимодействием флуоресцентно-меченного актина в живых клетках фибробластов мыши NIH 3T3 приводит к изображению, фиксируемому широкоугольным флуоресцентным микроскопом (А) и микроскопом сверхвысокого разрешения dSOFI (B). Увеличенный участок изображения регистрировался каждые 5 минут в течение 15 минут.
Маловато будет
Какими бы фантастическими не были возможности современных методов визуализации клеток, по сути, они даются ученым за счет многократного повторения сканирования, сложной математической обработки и трудоемкой пробоподготовки, что делает результаты буквально единичными и трудновоспроизводимыми. А если говорить о запросах подобных исследований в области клинической медицины или высокопроизводительного биологического скрининга, то открывается целое поле задач по масштабированию и ускорению анализа [16].
Прежде всего приходится подключать к приборам модули, работающие с комфортными для живых клеток 24-, 96- и 384-луночными планшетными форматами, то есть проводить измерения с использованием автоматизированных сэмплеров и микропланшетных ридеров. Многие современные приборы разрабатываются с учетом такого переоборудования в случае необходимости.
Флуоресцентные методы можно оптимизировать введением большего числа флуорофоров, одновременно присутствующих в образце. К сожалению, существует множество довольно строгих ограничений в этой области, поскольку спектры их возбуждения и эмиссии должны быть легко различимы детекторами. Кроме того, необходимо учитывать теоретическое условие отсутствия аддитивности флуоресцентных сигналов и не пренебрегать контрольными измерениями, дающими информацию о выжигании, тушении и подсвечивании флуорофоров в многоцветном образце.
Некоторые автоматизированные и скрининговые аналитические платформы сталкиваются с необходимостью нумерации и идентификации множества похожих белковых молекул или наночастиц в одной пробирке. Эта проблема решается путем так называемого бар-кодирования аналитов — присвоения им определенной флуоресцентной метки, состоящей из смеси двух или трёх флуорофоров в определенной пропорции, что является их уникальной характеристикой при дальнейшем компьютерном анализе.
Большое будущее
Познание микромира не менее будоражит воображение человека, чем космические пространства и далекие миры. И это не последняя причина, по которой биологи разрабатывают все новые и новые методы отображения живых клеток. А сама тенденция к изучению именно живой, неповрежденной клетки говорит о достаточно высоком инструментальном и научном уровне современной клеточной биологии.
Литература
- Липидный фундамент жизни;
- Флуоресцирующая Нобелевская премия по химии;
- Richard N. Day, Michael W. Davidson. (2012). Fluorescent proteins for FRET microscopy: Monitoring protein interactions in living cells. Bioessays. 34, 341-350;
- Рулетка для спектроскописта;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Квантовые точки — наноразмерные сенсоры для медицины и биологии;
- Maureen Walling, Jennifer Novak, Jason R. E. Shepard. (2009). Quantum Dots for Live Cell and In Vivo Imaging. IJMS. 10, 441-491;
- Bing-Chen Liu, Xiao-Yu Lu, Xiang Song, Ke-Yu Lei, Abdel A. Alli, et. al.. (2013). Scanning ion conductance microscopy: a nanotechnology for biological studies in live cells. Front. Physio.. 3;
- Iestyn Pope, Wolfgang Langbein, Paola Borri, Peter Watson. (2012). Live Cell Imaging with Chemical Specificity Using Dual Frequency CARS Microscopy. Imaging and Spectroscopic Analysis of Living Cells - Optical and Spectroscopic Techniques. 273-291;
- Imaging unveils temperature distribution inside living cells. (2013). ScienceDaily;
- Sheona P. Drummond, Terence D. Allen. (2008). Chapter 6 From Live-Cell Imaging to Scanning Electron Microscopy (SEM): The Use of Green Fluorescent Protein (GFP) as a Common Label. Methods in Cell Biology. 97-108;
- Daewoong Nam, Jaehyun Park, Marcus Gallagher-Jones, Sangsoo Kim, Sunam Kim, et. al.. (2013). Imaging Fully Hydrated Whole Cells by Coherent X-Ray Diffraction Microscopy. Phys. Rev. Lett.. 110;
- H.-W. Rhee, P. Zou, N. D. Udeshi, J. D. Martell, V. K. Mootha, et. al.. (2013). Proteomic Mapping of Mitochondria in Living Cells via Spatially Restricted Enzymatic Tagging. Science. 339, 1328-1331;
- Sangyeon Cho, Jaeduck Jang, Chaeyeon Song, Heeyoung Lee, Prabhakar Ganesan, et. al.. (2013). Simple super-resolution live-cell imaging based on diffusion-assisted Förster resonance energy transfer. Sci Rep. 3;
- Stanley W. Botchway, Pamela Reynolds, Anthony W. Parker, Peter O'Neill. (2012). Laser-Induced Radiation Microbeam Technology and Simultaneous Real-Time Fluorescence Imaging in Live Cells. Imaging and Spectroscopic Analysis of Living Cells - Optical and Spectroscopic Techniques. 3-28;
- Myong-Hee Sung, James G. McNally. (2011). Live cell imaging and systems biology. WIREs Syst Biol Med. 3, 167-182;
- «Микроскопия, конфокальная». Словарь нанотехнологических и связанных с нанотехнологиями терминов;
- Атомно-силовая микроскопия: увидеть, прикоснувшись;
- Миграция энергии плазмонного резонанса: вторая жизнь оптической спектроскопии.