Как распознать рак при помощи биомаркеров?
05 сентября 2013
Как распознать рак при помощи биомаркеров?
- 5018
- 6
- 10
Антитела могут служить не только эффективной системой защиты организма от незванных гостей-патогенов, но и позволяют выявить наличие опухоли на ранних стадиях ее развития
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Смертность от злокачественных опухолей — сравнительно молодая проблема, возникшая, когда средняя продолжительность жизни человека существенно увеличилась благодаря многочисленным победам в борьбе с инфекциями. Практически все опухоли можно излечить на ранних стадиях их возникновения, однако обнаружить новообразование, как правило, удается лишь с появлением симптомов, когда помочь пациенту уже нельзя. В данной статье рассказывается об одном из типов биомаркеров, в последнее время активно разрабатывающихся для ранней диагностики рака, — биомаркерах на основе аутоантител.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Подобно вооруженной до зубов армии, иммунная система защищает организм от проникновения чужаков-патогенов. И, как и полагается действующей армии, в ее состав входят различные специализированные подразделения. Разведчики — дендритные клетки — первыми обнаруживают антиген; пограничники — тканевые макрофаги — следят за порядком в барьерных тканях организма; пехота — в первую очередь, нейтрофилы, а следом за ними и Т-, NK- и NKT-клетки — первая поднимается на борьбу с врагом; наконец, снайперы — В-лимфоциты — «стреляют» антителами в потенциального захватчика, а T- и B-клетки памяти, подобно мудрецам-стратегам, запоминают информацию об инфекции для эффективной и немедленной борьбы с ней при повторной атаке [1]. Для них не существует мирного времени — всегда нужно быть готовым снова вступить в бой без промедленья, например, против «предателей» организма — опухолевых клеток (рис. 1).

Рисунок 1. Иммунная система организма — высокопрофессиональная армия, стоящая на пути полчища патогенов
рисунок Дарьи Боголюбовой-Кузнецовой
Здравствуй, антитело молодое, незнакомое!..
Антитела представляют собой растворимые белки-иммуноглобулины, вырабатываемые так называемыми плазматическими клетками, являющимися конечной стадией дифференцировки B-лимфоцитов и одними из ключевых игроков системы адаптивного (приобретенного) иммунитета. Антигенная стимуляция «наивного» (не встречавшегося с антигеном) B-лимфоцита через B-клеточный рецептор (представляющий собой мембранносвязанную форму антитела) активирует последовательность событий, в результате которых плазматическая клетка оказывается в костном мозге и начинает непрерывно продуцировать большие количества антител, специфичных к конкретному антигену. Участие антител в реализации иммунного ответа может осуществляться как путем прямого действия на молекулы и организмы-носители антигенов, так и косвенно, т. е. путем привлечения дополнительных механизмов (активация системы комплемента, привлечение фагоцитов и т. д.; рис. 2).
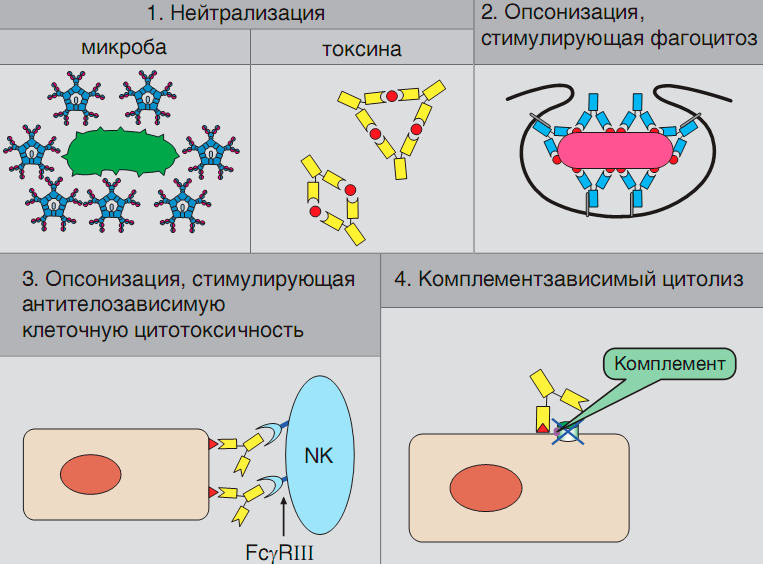
Рисунок 2. Основные механизмы действия антител. Нейтрализующее действие антител (вариант 1) проиллюстрировано на примере IgM-антител, блокирующих микроорганизм, и IgG-антител, формирующих иммунный комплекс с токсином. Варианты 2 и 3 (опсонизация, усиливающая фагоцитоз, и стимуляция цитотоксической активности NK-клеток) реализуются через взаимодействие иммуноглобулинов с Fcγ-рецепторами клеток. Взаимодействие с антигеном (вариант 4) открывает комплементсвязывающие участки IgG-антител, что приводит к запуску комплемента по классическому пути и лизис или опсонизацию клеток-мишеней.
Процесс формирования репертуара B-клеток обязательно включает в себя происходящую в костном мозге «негативную селекцию», в ходе которой из всего множества незрелых B-лимфоцитов удаляются клетки, несущие на своей поверхности B-клеточный рецептор, способный связывать собственные антигены организма (аутоантигены). Этот процесс крайне важен, поскольку он служит залогом того, что мишенями для антител не станут клетки организма-хозяина. Тем не менее, эффективность негативной селекции не является стопроцентной, и в реальности остается большое количество «аутореактивных» (т.е., способных распознавать аутоантигены) B-клеток. В норме данный феномен не оказывает негативного воздействия на организм, поскольку на пути к активации аутореактивной B-клетки лежит целый спектр дополнительных регуляторных барьеров. Тем не менее, иногда аутореактивным клеткам удается преодолеть все препятствия, и это может привести к инициированию аутоиммунного процесса, лежащего в основе всех аутоиммунных заболеваний. Этот же сценарий может развиваться и в случае образования опухоли. Опухолевые клетки, как правило, характеризуются целым спектром нарушений белковых молекул, которые могут быть обнаружены системой адаптивного иммунитета и проявляться в том числе наличием циркулирующих аутоантител к нормальным либо тем или иным образом модифицированным опухолевым белкам (называемым в данном случае опухолеассоциированными аутоантигенами). Последние включают в себя мутантные, неправильно свернутые или гликозилированные, сверхэкспрессированные белки или же белки с эктопической экспрессией, т.е. экспрессируемые опухолью, но не нормальной тканью того же происхождения/анатомической локализации. Источниками антигенов в опухолевой ткани также могут являться белки со скрытыми эпитопами, экспонирующимися в ходе опухолеспецифичного протеолиза.
Рак и ты: кто кого?
Злокачественные новообразования — бич современного человечества. Антибиотики, вакцины [4], лекарственные препараты, иммунные сыворотки и т.д. сделали возможным лечение и предупреждение огромного количества болезней, пандемии которых в прошлом уносили миллионы жизней (чума [2], [5], холера, оспа, сибирская язва и др.; рис. 3). Средняя продолжительность жизни человека увеличилась, и наиболее частой причиной смерти стали сердечнососудистые заболевания и опухоли (25 и 23% от общего числа умерших в год, соответственно, по данным на 2008 г. [6]). Средняя пятилетняя выживаемость пациентов с диагностированными опухолями легкого (первое место по частоте встречаемости у мужчин и второе после рака молочной железы у женщин) составляет 16,3%. Однако, если проанализировать данные по выживаемости отдельно для каждой из стадий диагностированной опухоли, то окажется, что обнаружение новообразования на стадии локализованной опухоли дает 52% выживаемости, а на стадии регионарных и отдаленных метастазов — 24% и 4%, соответственно [7] (рис. 4). Таким образом, наиболее перспективным путем снижения смертности от злокачественных новообразований является разработка и внедрение новых методов их ранней диагностики, наиболее многообещающим из которых является неинвазивное или малоинвазивное выявление биомаркеров опухоли (онкомаркеров) в крови, моче, слюне, бронхоальвеолярной жидкости, мокроте и опухолевой ткани пациента.

Рисунок 3. На сегодняшний день человечество справилось с такими болезнями, как чума и холера, в предыдущие века уносившими миллионы жизней. Картинка: гравюра по дереву «Танец смерти». Mich. Wohlgemuth, 1493.
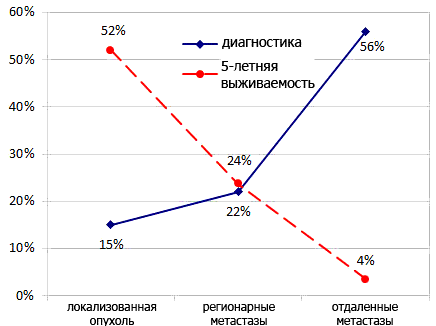
Рисунок 4. Диагностика рака легкого и выживаемость пациентов по стадиям, 2001–2007 гг.
Онкомаркеры (в роли которых может выступать «молекулярный свидетель» наличия опухоли в организме практически любой природы, будь то белок, нуклеиновая кислота или липид) используются для диагностики злокачественных новообразований, их классификации и стадирования, мониторинга рецидивов, а также для оценки прогноза и выбора методики лечения (рис. 5). Аутоантитела, специфичные к опухолеассоциированным аутоантигенам, могут быть использованы практически в любом из вышеуказанных случаев и, в отличие от традиционных биомаркеров, характеризуются целым рядом важных преимуществ, таких как:
- Малая инвазивность при заборе биоматериала.
- Отсутствие специфических требований к забору материала и пробоподготовке.
- Простота и унифицированность определения (используются различные типы иммуноферментного анализа).
- Высокая стабильность в пробах сыворотки и плазмы крови.
- Высокое время полужизни.
- Минимальные концентрационные колебания в зависимости от времени суток, принятия пищи, лекарств, физической активности, фазы менструального цикла, определенных медицинских вмешательств и пр.
- Высокая специфичность.
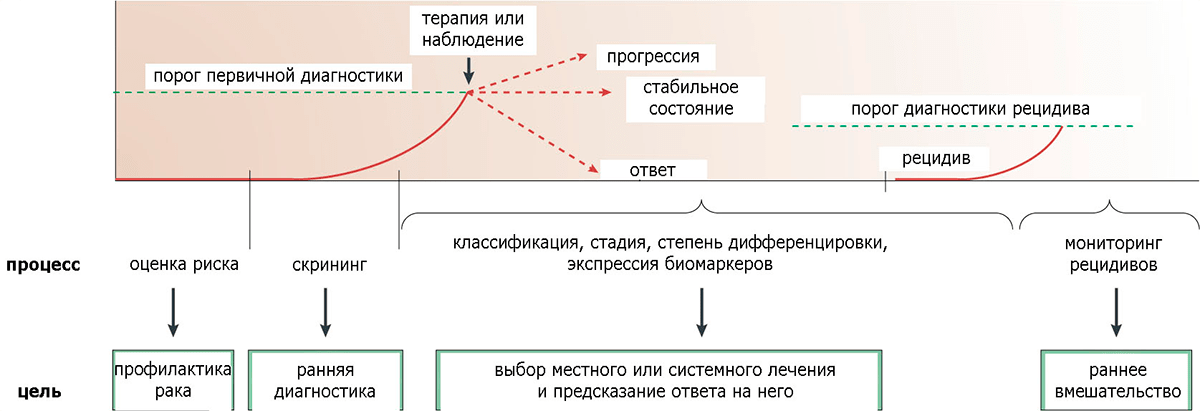
Рисунок 5. Схематическое представление использования биомаркеров на разных стадиях опухолевой прогрессии
Аутоантитела для диагностики — новое решение старых проблем!
Примером успешного применения аутоантител в диагностике злокачественных новообразований могут служить аутоантитела против опухолевого супрессора p53 [9], который часто мутирован в различных типах новообразований человека. Мутации приводят к нарушению третичной структуры белка, и в результате этого многие скрытые эпитопы становятся доступными для презентации их В- и Т-клеткам иммунной системы. Анти-p53 антитела в сыворотке крови рабочих, подвергшихся воздействию винилхлорида, детектируются до клинического диагноза ангиосаркомы печени [10], а у пациентов с хронической обструктивной болезнью легких — до клинического диагноза рака легкого [11]. Некоторые исследования продемонстрировали корреляцию между наличием у пациентов анти-p53 аутоантител и выживаемостью (рак яичников, колоректальный рак и рак легкого); при этом в большинстве случаев регистрация аутоантител против p53 была ассоциирована с неблагоприятным прогнозом.
Нельзя не упомянуть об онконевральных антителах — аутоантителах, специфичных к нейрональным антигенам — белкам, в норме экспрессирующимся только в нервной ткани, однако в силу различных генетических нарушений начинающих продуцироваться в опухолевой ткани, вызывая так называемый паранеопластический синдром (ассоциированное с опухолью патологическое состояние, характеризующееся аутоиммунным поражением различных отделов нервной системы). В качестве примера таких антигенов можно привести белки HuB, HuC и HuD (human antigens B, C, D), которые в норме экспрессируются во всех нейронах, а также при мелкоклеточном раке легкого, раке простаты и нейробластоме, и CDR2, в норме экспрессирующийся только в нейронах Пуркинье и ассоциированный с такими типами рака, как рак молочной железы, яичников и мелкоклеточный рак легкого. Онконевральные антитела обнаруживаются у большей части пациентов с паранеопластическим синдромом, и было показано, что их появление четко и независимо коррелирует с развитием в организме пациента злокачественного новообразования [12]. В настоящее время по наличию тех или иных онконевральных антител можно судить о преимущественной локализации опухолевого очага, который в силу своих малых размеров не был обнаружен в ходе первичного осмотра пациента [13].
Другим примером биомаркеров антительной природы являются аутоантитела против раково-семенниковых (раково-гаметных) антигенов [14]. Они экспрессируются в широком спектре новообразований (меланома, рак яичников, рак легкого), но не в нормальных тканях организма, за исключением мужских семенников. Аберрантная экспрессия этих белков приводит к развитию на них Т-клеточного и/или B-клеточного ответа, т.е. к появлению аутоантител в кровотоке больного. Наиболее известными представителями данного семейства опухолеассоциированных аутоантигенов являются MAGE-1 (он был первым найденным антигеном этой группы), NY-ESO1, MAGE-3 и SSX2.
Пожалуй, наиболее ярким успехом в области разработки аутоантительных биомаркеров является диагностикум EarlyCDT-Lung, основу которого представляют антитела против семи опухолеассоциированных антигенов, созданный в 2007 году и уже успешно применяющийся для выявления рака легкого на его ранних стадиях. В данной панели присутствуют раково-семенниковые антигены (NY-ESO-1, CAGE, MAGE A4), опухолевый супрессор p53, транскрипционный фактор SOX2, онконевральный антиген HuD и GBU4-5 — белок, функция которого в клетке до сих пор плохо изучена. Интересно, что состав антигенной панели менялся в процессе разработки в сторону более высокой чувствительности и специфичности, которые в конечном счете удалось поднять до 41% и 91%, соответственно. Рутинным тестом для обнаружения карцином легкого на Западе является компьютерная томография (КТ), однако было показано, что EarlyCDT-Lung диагностикум справляется с этой задачей лучше. КТ в силу разрешающей способности метода может не дать достоверных результатов при наличии у пациента опухоли с малыми линейными размерами, тогда как адаптивный иммунный ответ, формирующийся на опухолеассоциированные аутоантигены, может быть детектирован на самых ранних этапах развития новообразования.
Поиск антител против опухолеассоциированных аутоантигенов и разработка диагностикумов на их основе на сегодняшний момент являются одной из многообещающих ветвей современной диагностической онкоиммунологии. Простота исполнения и дешевизна, а, следовательно, доступность широкому кругу лиц, в будущем делает возможным применение таких диагностикумов в рамках планового медицинского обследования граждан, что является залогом своевременного обнаружения опухоли и полного выздоровления больного.
Вот так иммунная система не только стоит на страже организма, препятствуя развитию патогенов и опухолей, но и помогает исследователям находить все новые и новые методы диагностики различных заболеваний, — в частности, опухолей. Стрелы-антитела, прицельно пущенные В-клетками в мятежников, позволяют врачам найти и обезвредить последних, продлив тем самым жизнь пациента на долгие-долгие годы.
Литература
- Иммунологическая Нобелевская премия (2011);
- Смертельный поцелуй чумы;
- Ярилин А.А. Иммунология. М.: «ГЭОТАР-Медиа», 2010. — 752 с.;
- Вакцины в вопросах и ответах;
- Это чума;
- Miniño A.M., Xu J., Kochanek, K.D. (2010). Deaths: preliminary data for 2008. Natl. Vital. Stat. Rep. 59, 1–52;
- Lung cancer fact sheet. (2018). American Lung Association;
- Joseph A. Ludwig, John N. Weinstein. (2005). Biomarkers in Cancer Staging, Prognosis and Treatment Selection. Nat Rev Cancer. 5, 845-856;
- p53 — 30 years on. (2009). Nature;
- G. E. Trivers, H. L. Cawley, V. M. G. DeBenedetti, M. Hollstein, M. J. Marion, et. al.. (1995). Anti-p53 Antibodies in Sera of Workers Occupationally Exposed to Vinyl Chloride. JNCI Journal of the National Cancer Institute. 87, 1400-1407;
- Trivers G.E., De Benedetti V.M., Cawley H.L., Caron G., Harrington A.M., Bennett W.P. et al. (1996). Anti-p53 antibodies in sera from patients with chronic obstructive pulmonary disease can predate a diagnosis of cancer. Clin. Cancer Res. 2, 1767–1775;
- Sean J. Pittock, Thomas J. Kryzer, Vanda A. Lennon. (2004). Paraneoplastic antibodies coexist and predict cancer, not neurological syndrome. Ann Neurol.. 56, 715-719;
- C. A. Vedeler, J. C. Antoine, B. Giometto, F. Graus, W. Grisold, et. al.. (2006). Management of paraneoplastic neurological syndromes: report of an EFNS Task Force. Eur J Neurol. 13, 682-690;
- Maurizio Chiriva-Internati, Apurva Pandey, Radhi Saba, Minji Kim, Charles Saadeh, et. al.. (2012). Cancer Testis Antigens: A Novel Target in Lung Cancer. International Reviews of Immunology. 31, 321-343.