Биомеханика живой клетки
30 сентября 2013
Биомеханика живой клетки
- 5852
- 0
- 9
Некоторые механические параметры, которые способна чувствовать клетка
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Мы познаём окружающий мир, используя свои чувства. Одно из них — осязание — привычная для каждого из нас способность ощущать твердость предметов, фактуру поверхности, давление. Оказывается, каждая клетка нашего тела тоже способна чувствовать механические параметры окружающей среды, реагировать на них или пытаться их контролировать. Механические воздействия играют важную роль в самых разных процессах жизнедеятельности клетки внутри организма — как в норме, так и при патологиях. Более того, каждую клетку можно рассматривать как материальное тело, имеющее определенные механические свойства и способное физически воздействовать на окружающую среду. Именно этими вопросами занимается биомеханика клетки — междисциплинарная область естественных наук, применяющая биофизические методы и подходы для ответа на вопрос: чем же является клетка с точки зрения механики, и какова роль механических сил в её функционировании.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Клетки являются строительными блоками организмов. Обычно работа клетки рассматривается с биологической точки зрения — описываются такие процессы, как потребление энергии, скорость деления, экспрессия генов, активность ферментов и многие другие. Однако в то же время, с точки зрения физики, клетка является материальным объектом с характерными механическими свойствами, определяющими её способность сопротивляться внешним силам или генерировать их. В ходе выполнения своих функций клетки (впрочем, как и сами организмы) подвергаются влиянию огромного количества внешних физических силовых воздействий. Часть из этих сил они намеренно контролируют — например, сохраняя свою форму или перемещаясь в пространстве (как эритроциты, проходящие через узкие капилляры, или фагоциты, мигрирующие к зоне воспаления). Изучением механических свойств клеток, а также многоклеточных организмов и даже отдельных белковых молекул занимается особый раздел биофизики — биомеханика. Выражаясь точнее,
Что же именно изучает биомеханика клетки? Конечно, в первую очередь, это механические свойства самих клеток. Под механическими свойствами здесь понимаются модуль Юнга (обычный или комплексный), вязкость, времена релаксации и другие параметры из механики сплошных сред (подробнее в разделе «Немного о механике сплошных сред»). Их измерение является довольно трудной задачей в силу ряда причин, таких как малые размеры клеток (десятки микрометров), необходимость поддержания их жизнеспособности во время экспериментов, очень низкие значения модулей упругости (на 7–9 порядков ниже, чем для привычных нам материалов — металлов, пластика, стекла). Однако уже сейчас для измерения механических свойств клеток существует довольно широкий набор методов, о которых будет рассказано ниже.
Биомеханика изучает процессы, в которых механические свойства клетки играют ведущую роль. К ним относятся взаимодействия клетки с субстратом, внеклеточным матриксом, другими клетками; движение клетки как целого и отдельных её частей, механизмы механочувствительности и механотрансдукции — преобразования механических сигналов в биохимические. Механический ответ клеток особенно важен при развитии эмбриона, сокращении мышц, работе связок, перемещении клеток в кровеносных сосудах и тканях, при развитии злокачественных опухолей и метастазировании, и это лишь малая часть примеров.
Скелет и мышцы клетки
Что же удалось узнать в ходе экспериментов по изучению механики клетки? Было обнаружено, что для большинства типов клеток ведущую роль в определении их механических свойств играет цитоскелет — динамическая структура, образующая клеточный каркас [1], [2], [16], [31]. Цитоскелет представляет собой сложно структурированную трёхмерную сеть, состоящую из нитей (фибрилл и филаментов) трёх типов: актиновые нити, микротрубочки и промежуточные филаменты. По сравнению со скелетом человека, цитоскелет имеет намного больше функций: это и поддержание формы клетки, и сократительная функция, и обеспечение подвижности, и даже активный внутриклеточный транспорт. Как выяснилось, модуль упругости клетки также сильно зависит от строения цитоскелета — в основном той его части, которая образована актиновыми филаментами. Больше всего актина в мышечных клетках, где он приспособлен для согласованной работы, приводящей к сокращению мышц. В других клетках присутствует его близкий родственник — так называемый немышечный актин. О нём дальше и пойдет речь.
Разрушение актинового цитоскелета приводит к радикальному (в несколько раз) снижению жесткости клетки [3]. Клетки с более развитым и плотным актиновым цитоскелетом имеют более высокий модуль Юнга. Например, было показано, что раковые клетки намного «мягче» здоровых клеток и клеток доброкачественных опухолей, и что их актиновый цитоскелет более дезорганизован (рис. 2) [4]. Модуль Юнга может выступать своего рода маркером для выявления раковых клеток на ранних стадиях заболевания [5]. Возможно, пониженная жесткость и высокая эластичность помогают раковым клеткам перемещаться во внутритканевых полостях и проходить через стенки сосудов во время метастазирования. Регистрируемые изменения в механических свойствах клеток происходят и при других заболеваниях [6].
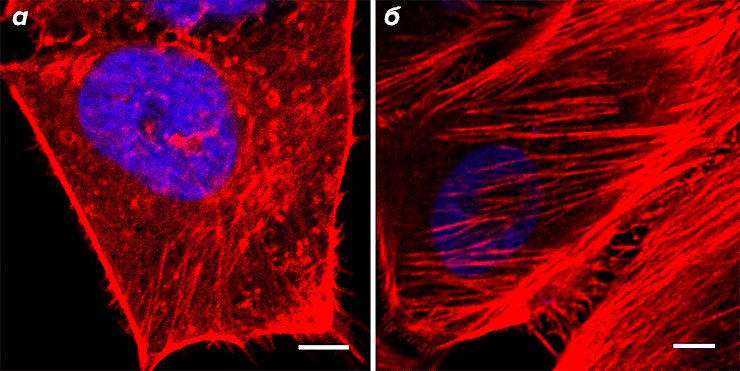
Рисунок 2. Актиновый цитоскелет клетки рака (а) и клетки доброкачественной опухоли (б) молочной железы. У доброкачественных клеток отчетливо видны упорядоченные фибриллы актина. У раковых клеток наблюдается менее развитая и более хаотичная сеть актиновых филаментов.
Клеточное осязание
Оказалось, что клетки даже в состоянии покоя находятся в напряженном состоянии [8]. За счет работы молекулярных моторов актиновые фибриллы стремятся сократиться и оказывают деформирующее воздействие на субстрат. Была выявлена способность клеток чувствовать жесткость окружающей среды и подстраиваться под неё (механочувствительность) [9]. Например, клетки могут двигаться в направлении градиента жесткости — явление, которое называется дуротаксис [9], — или по градиенту натяжений — тензотаксис [10]. Эти способности особенно важны при эмбриогенезе, когда происходят скоординированные движения групп клеток: механические напряжения и натяжения приводят к самоорганизации клеточных масс [11].
Клетки, растущие на более жестких субстратах, обычно имеют более развитый цитоскелет и сами становятся жестче [9]. Жесткость субстрата оказывает влияние на дифференцировку стволовых клеток. Так, мезенхимальные стволовые клетки [12], растущие на матриксах с модулем Юнга как у мягких тканей мозга, дифференцируются в нейроны (нейрогенная дифференцировка) [13]. Рост на жестких матриксах приводит к появлению остеобластов (остеогенная дифференцировка), а на матриксах с жесткостью как у мышечной ткани — мышечных клеток (миогенная дифференцировка) (рис. 3).
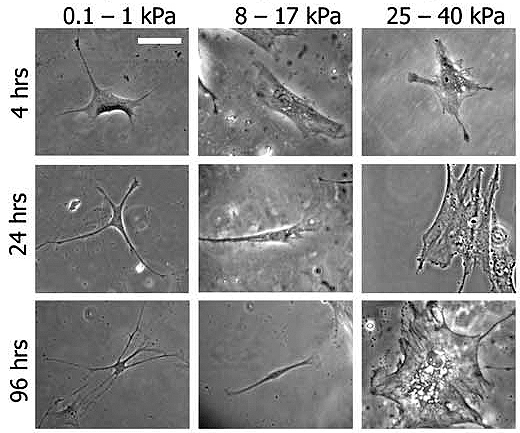
Рисунок 3. Мезенхимальные стволовые клетки на субстратах с различной жесткостью: различные пути дифференцировки. Левая колонка — мягкий субстрат (нейрогенная дифференцировка): видно наличие большого числа отростков, характерных для нейрона. Средняя колонка — субстрат с промежуточной жесткостью (миогенная дифференцировка): на нижнем изображении клетка приобретает характерную вытянутую форму. Правая колонка — жесткий субстрат (остеогенная дифференцировка): клетка увеличивается в размерах и распластывается.
Механизмы механочувствительности в настоящее время до конца не ясны. Основными кандидатами на роль сенсоров, чувствующих упругие свойства окружающей среды, являются фокальные адгезии и адгезионные контакты [14]. Это трансмембранные белковые комплексы, связанные с актиновым цитоскелетом с внутриклеточной стороны (рис. 4). Первые образуются между клеткой и субстратом, вторые — между самими клетками. Актиновый цитоскелет генерирует определенную силу натяжения, и эта сила может передаваться и на фокальные адгезии, и на адгезионные контакты, а через них — соответственно на субстрат или соседние клетки. Если субстрат имеет достаточно высокий модуль упругости, то на белки фокальных адгезий будут действовать значительные растягивающие силы. В итоге могут произойти разворачивание отдельных доменов, составляющих фокальные адгезии белков, появление мест связывания для регуляторных молекул и другие процессы, которые, в конечном счете, ведут к запуску регуляторных каскадов. Вышесказанное может относиться и к адгезионным контактам. Гипотетически возможно даже воздействие внешних сил через актиновый цитоскелет напрямую на клеточное ядро с изменением структуры хроматина и профиля экспрессии генов [15].
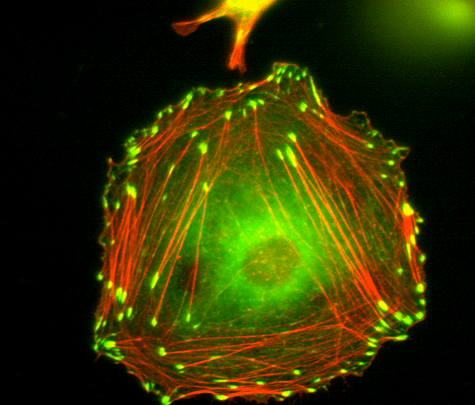
Рисунок 4. Актиновый цитоскелет и фокальные контакты в фибробластоподобной клетке
Кроме этого, в мембране клеток были обнаружены механозависимые ионные каналы, способные активироваться при растяжении мембраны [17]. Возможно, они участвуют в поддержании и регуляции объема клетки, а также в механорецепции. Механорецепторы — специализированные структуры, образованные группами клеток с участием нервных волокон. Они преобразуют механические сигналы в нервный импульс и, таким образом, служат для восприятия этих сигналов организмом. К ним относятся тактильные рецепторы кожи, механорецепторы вестибулярного аппарата, звуковые рецепторы и другие.
3D vs 2D
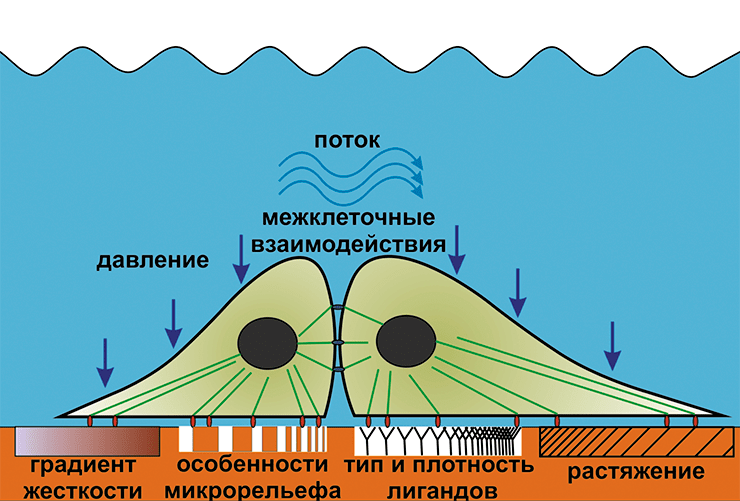
На поведение клеток влияет не только жесткость субстрата, но и микрорельеф поверхности, а также тип и плотностью лигандов, участвующих в образовании фокальных адгезий [18]. Кардинальные изменения происходят при помещении клетки в трёхмерный матрикс. Культивирование в трёхмерных (3D) матриксах намного ближе к нативным условиям, чем выращивание клеток в традиционных чашках Петри с плоским дном. В 3D-матриксах с правильно подобранными составом, структурой и механическими свойствами клети могут формировать ткани и органоподобные структуры, повторяющие структуру и функции органа их происхождения.
Например, эпителиальные клетки молочных желез человека, растущие на поверхности культурального пластика, утрачивают присущие им in vivo характеристики, в том числе и способность к синтезу молока — лактации. Однако стоит их поместить в трёхмерную среду, соответствующую по жесткости ткани молочной железы и содержащую белки внеклеточного матрикса — и через некоторое время клетки начнут формировать замкнутые полости — аналоги ацинусов (структурно-функциональная единица молочной железы) — и синтезировать в них молоко (рис. 5) [19]. Интересно, что клетки рака молочной железы, помещенные в аналогичные условия, формируют лишь неупорядоченные скопления [20]. Что еще более интересно, если слегка изменить взаимодействия между матриксом и раковыми клетками (добавить всего лишь один ингибитор, действующий на белки фокальных адгезий), то они приобретут фенотип, характерный для здоровых клеток, и также начнут формировать полости и производить молоко [21]. Описанный выше случай — один из примеров преобладания условий среды над генотипом: генотип раковой клетки изменён, но микроокружение заставляет её вернуться к здоровому фенотипу.
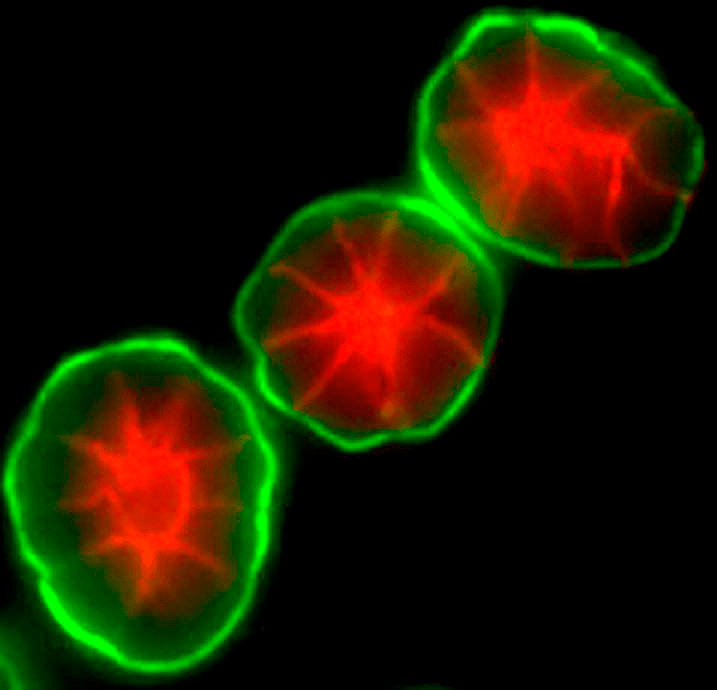
Рисунок 5. Клетки молочной железы, культивируемые в трёхмерном геле, воспроизводят ацинусы — структурные единицы молочной железы
Механические взаимодействия между клетками играют важную роль в тканевой инженерии. Проводятся попытки создания искусственных органов на основе искусственных или естественных каркасов, поддерживающих правильное пространственное взаимодействие между клетками и внеклеточным матриксом. Например, для искусственного выращивания почки крысы исследователями был использован остов почки другой, погибшей крысы [22], [23]. Остов был получен путём удаления всех клеток и представлял собой лишь внеклеточные структурные элементы — трёхмерный каркас органа. Дальше он «заселялся» двумя типами клеток: формирующими сосуды и остальную ткань почки. Трёхмерная структура почки восстанавливалась, и после трансплантации крысе она начинала работать, хотя и менее эффективно, чем естественный аналог.
Взаимодействия с соседними клетками и с внеклеточным матриксом в условиях организма также важны при развитии эмбриона и при патологиях, таких как развитие опухолей. Поверхностные опухоли часто можно диагностировать путем пальпации — ощупывания, ручного обследования больного. Опухоль проявляется как плотное, бугристое, неопределенной формы образование. На первый взгляд, здесь есть противоречие с ранее представленным фактом, что раковые клетки становятся мягче, чем обычные. Ответ, по-видимому, заключается в том, что кроме увеличения мягкости клеток происходит увеличение жесткости окружающего их внеклеточного матрикса, что и чувствуется при пальпации. Раковые клетки стимулируют увеличение жесткости матрикса, так как жесткий матрикс в ответ стимулирует размножение раковых клеток, и скорость роста опухоли увеличивается [24].
Методы биомеханики клетки: как это работает
Развитие биомеханики клетки как самостоятельной науки напрямую связано с развитием её методической базы. Многие методы пришли из области физики и были адаптированы для работы с биологическими образцами. Условно методы изучения механических свойств клеток можно разделить на активные и пассивные. К активным относят те методы, которые в процессе измерения прикладывают к клетке некоторую силу и регистрируют ее отклик. Такими методами являются, например атомно-силовая микроскопия (АСМ), различные виды индентирования (синонимы — продавливание, углубление), оптический и магнитный пинцеты, всасывание в микропипетку и другие [8], [25], [26].
Для примера остановимся более подробно на экспериментах по наноиндентированию с помощью атомно-силового микроскопа. Принцип действия АСМ заключается во взаимодействии наноразмерной иглы (кантилевера) с образцом [27]. Благодаря особенностям конструкции с помощью атомно-силового микроскопа можно измерять силы порядка наноНьютон и осуществлять перемещение зонда с нанометровой точностью. Для измерения механических свойств проводят силовую спектроскопию — снятие силовых кривых в ходе эксперимента по индентированию (продавливанию) объекта зондом. Грубо говоря, чем тверже объект, тем сильнее он сопротивляется продавливанию.
Пассивные методы не прикладывают силовых воздействий к клетке напрямую. Они изучают её собственную механическую активность и способность к генерации сил. Сюда можно отнести методы микрореологии и микроскопию сил натяжения. Методы микрореологии основаны на наблюдении движения микрочастиц в клетке — как эндогенных (например, липидные гранулы), так и искусственно введенных [28]. Наблюдая броуновское движение частицы в идеально вязкой жидкости можно определить механические свойства этой жидкости (в данном случае вязкость) с помощью уравнения Стокса-Эйнштейна. Если же частица находится не в вязкой жидкости, а в вязко-упругой среде, то, конечно, уравнения, описывающие её поведение, примут намного более сложный вид. Тем не менее, существующие модели позволяют извлечь из экспериментальных данных параметры среды — комплексный модуль Юнга, а также изучить его вариации в различных областях клетки.
Другая экспериментальная процедура — микроскопия сил натяжения, — как следует из названия, изучает генерируемые клеткой силы, которые действуют на подлежащий субстрат и растягивают его [29]. На практике это осуществляется следующим образом. На основе акриламида (или других материалов) изготавливают тонкие и мягкие гели-подложки, несущие в себе флуоресцентные микрочастицы. Клетки, растущие на такой подложке, деформируют её, в результате чего происходит смещение микрочастиц. Анализируя эти смещения и зная свойства геля, можно рассчитать силы, сгенерированные клеткой и вызвавшие эти смещения. Также можно построить карты распределения этих сил и найти места их приложения.
Наблюдение за поведением и динамикой клеток на субстратах различной жесткости и с различным микро- и нанорельефом, под потоковым или растягивающим воздействиями, в трёхмерных матриксах — все это является важным источником информации в биомеханике. Огромную роль в подобных экспериментах играют оптическая микроскопия (конфокальная лазерная сканирующая и другие разновидности), а также моделирование. При помощи микроскопии проводятся исследования структуры цитоскелета.
Создание моделей для физического описания клетки помогает упорядочить получаемые данные и сделать предсказания о поведении клетки в различных условиях [30]. Часть моделей пытается описать клетку как сплошную среду, состоящую из слоёв/компонентов с различными свойствами. По большей части эти модели взяты из механики сплошных сред. Например, сейчас большой популярностью пользуется модель, описывающая клетку как мягкое стекловидное тело, находящееся вблизи точки стеклования [30]. Применяются также модели Максвелла, Кельвина (представляющие собой различные комбинации пружин и вязких элементов) и более сложные. Другой подход основан на изучении внутренних микро- и наноструктур клетки, их индивидуальных механических свойств и взаимодействий, влияющих на механику всей клетки. В таких моделях основная роль отводится обычно элементам цитоскелета и клеточной мембране.
 | Атомно-силовая микроскопия. С помощью кантилевера с микросферой на конце осуществляется индентирование (продавливание) клетки. Кантилевер опускается вертикально вниз и начинает продавливать клетку. Чем мягче клетка, тем больше величина продавливания [3]. |
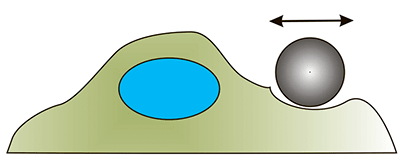 | Оптический и магнитный пинцет. Перемещение микросферы осуществляется с помощью оптической ловушки или магнитного поля (частица должна обладать магнитными свойствами) [26]. |
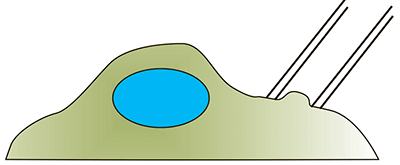 | Всасывание в микропипетку. Микропипетка находится в контакте с поверхностью клетки. В пипетке создается пониженное давление, в результате чего клетка начинает засасываться внутрь неё. Наблюдая за этим процессом, можно определить различные механические параметры клетки [26]. |
 | Методы микрореологии. Группа методов, основанная на изучении поведения микрочастиц внутри клетки, как эндогенных, так и искусственно введенных. Броуновское движение микрочастиц отражает свойства среды, в которой они находятся [28]. |
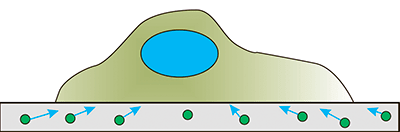 | Микроскопия сил натяжения. Клетки сажают на специальные подложки, сделанные из мягких гелей и несущие в себе флуоресцентные микрочастицы. Клетка деформирует субстрат и смещает микрочастицы. По этим смещениям можно рассчитать места приложения, направления и модули сил [29]. |
Заключение
В рамках небольшого обзора невозможно полностью осветить многообразие направлений биомеханики клетки. Множество прорывов было сделано и в смежных областях науки: механике тканей, органов и целого организма, с одной стороны, и механике единичных молекул — с другой. Многие методы биомеханики сейчас находятся в стадии развития и еще не полностью реализовали свой потенциал. Когда-нибудь они раскроют истинную роль сил и механических напряжений в жизни клетки, при развитии нового организма и при патологиях.
Литература
- Васильев Ю.М. (1996). Клетка как архитектурное чудо. Часть I. Соросовский образовательный журнал. 2;
- Васильев Ю.М. (1996). Клетка как архитектурное чудо. Часть II. Соросовский образовательный журнал. 4;
- Christian Rotsch, Manfred Radmacher. (2000). Drug-Induced Changes of Cytoskeletal Structure and Mechanics in Fibroblasts: An Atomic Force Microscopy Study. Biophysical Journal. 78, 520-535;
- Małgorzata Lekka, Katarzyna Pogoda, Justyna Gostek, Olesya Klymenko, Szymon Prauzner-Bechcicki, et. al.. (2012). Cancer cell recognition – Mechanical phenotype. Micron. 43, 1259-1266;
- Małgorzata Lekka. (2012). A tip for diagnosing cancer. Nature Nanotech. 7, 691-692;
- Hayden Huang, Roger D. Kamm, Richard T. Lee. (2004). Cell mechanics and mechanotransduction: pathways, probes, and physiology. American Journal of Physiology-Cell Physiology. 287, C1-C11;
- Q.S. Li, G.Y.H. Lee, C.N. Ong, C.T. Lim. (2008). AFM indentation study of breast cancer cells. Biochemical and Biophysical Research Communications. 374, 609-613;
- Karen E Kasza, Amy C Rowat, Jiayu Liu, Thomas E Angelini, Clifford P Brangwynne, et. al.. (2007). The cell as a material. Current Opinion in Cell Biology. 19, 101-107;
- D. E. Discher. (2005). Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310, 1139-1143;
- L. V. Beloussov, N. N. Louchinskaia, A. A. Stein. (2000). Tension-dependent collective cell movements in the early gastrula ectoderm of Xenopus laevis embryos. Development Genes and Evolution. 210, 92-104;
- Lev V. Beloussov, Vassily I. Grabovsky. (2006). Morphomechanics: goals, basic experiments and models. Int. J. Dev. Biol.. 50, 81-92;
- Ствол и ветки: стволовые клетки;
- Adam J. Engler, Shamik Sen, H. Lee Sweeney, Dennis E. Discher. (2006). Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689;
- Andrew W Holle, Adam J Engler. (2011). More than a feeling: discovering, understanding, and influencing mechanosensing pathways. Current Opinion in Biotechnology. 22, 648-654;
- Ning Wang, Jessica D. Tytell, Donald E. Ingber. (2009). Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82;
- Васильев Ю.М. (1999). Клетка как архитектурное чудо. Часть III. Соросовский образовательный журнал. 8;
- Diana E. Jaalouk, Jan Lammerding. (2009). Mechanotransduction gone awry. Nat Rev Mol Cell Biol. 10, 63-73;
- Adam Engler, Lucie Bacakova, Cynthia Newman, Alina Hategan, Maureen Griffin, Dennis Discher. (2004). Substrate Compliance versus Ligand Density in Cell on Gel Responses. Biophysical Journal. 86, 617-628;
- Ben Short. (2009). Mina Bissell: Context is everything. J Cell Biol. 185, 374-375;
- O. W. Petersen, L. Ronnov-Jessen, A. R. Howlett, M. J. Bissell. (1992). Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells.. Proceedings of the National Academy of Sciences. 89, 9064-9068;
- V.M. Weaver, O.W. Petersen, F. Wang, C.A. Larabell, P. Briand, et. al.. (1997). Reversion of the Malignant Phenotype of Human Breast Cells in Three-Dimensional Culture and In Vivo by Integrin Blocking Antibodies. J Cell Biol. 137, 231-245;
- Стасевич К. (2013). Заново выращенная искусственная почка может заменить настоящую. «Новостей.COM»;
- Тканевая инженерия — окно в современную медицину;
- Sui Huang, Donald E. Ingber. (2005). Cell tension, matrix mechanics, and cancer development. Cancer Cell. 8, 175-176;
- S SURESH. (2007). Biomechanics and biophysics of cancer cells☆. Acta Biomaterialia. 3, 413-438;
- Brenton D. Hoffman, John C. Crocker. (2009). Cell Mechanics: Dissecting the Physical Responses of Cells to Force. Annu. Rev. Biomed. Eng.. 11, 259-288;
- Атомно-силовая микроскопия: увидеть, прикоснувшись;
- B. D. Hoffman, G. Massiera, K. M. Van Citters, J. C. Crocker. (2006). The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences. 103, 10259-10264;
- James H-C. Wang, Jeen-Shang Lin. (2007). Cell traction force and measurement methods. Biomech Model Mechanobiol. 6, 361-371;
- C.T. Lim, E.H. Zhou, S.T. Quek. (2006). Mechanical models for living cells—a review. Journal of Biomechanics. 39, 195-216;
- Васильев Ю.М. (2000). Клетка как чудо архитектуры. Часть IV. Соросовский образовательный журнал. 6.