СПИД: как ВИЧ разрушает нашу иммунную систему
14 октября 2013
СПИД: как ВИЧ разрушает нашу иммунную систему
- 35808
- 3
- 16
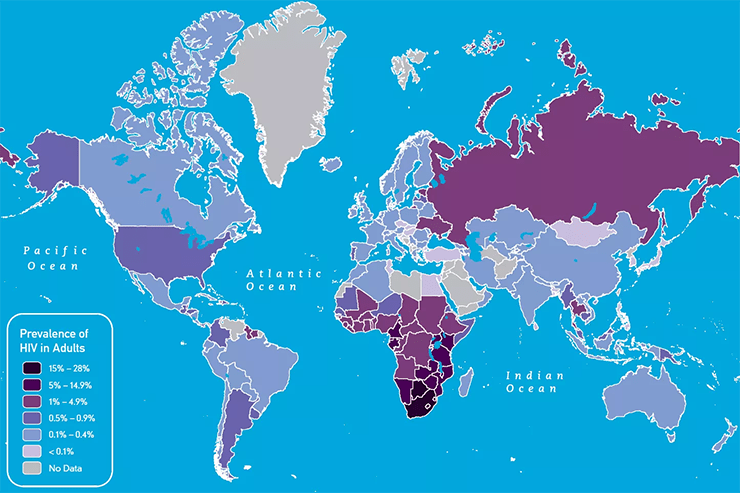
Распространенность СПИДа в мире на 2009 год.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: СПИД — это болезнь иммунной системы, вызываемая вирусом иммунодефицита человека (ВИЧ). При СПИДе у человека медленно, но верно (в течение нескольких лет) развивается тотальный иммунодефицит, когда организм не может справиться почти ни с какими микробами (даже теми, которые никогда не заражают здорового человека). Так как иммунитет борется не только с микробами, но и с раковыми клетками, еще у заболевшего СПИДом резко повышается вероятность заработать рак. ВИЧ использует изощренные механизмы обхода и уничтожения нашей иммунной системы, всегда идя на шаг впереди нее.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
Для того чтобы разобраться, как вирус иммунодефицита человека (а именно так расшифровывается ВИЧ) разрушает иммунную систему, нужно прежде всего понять, что же это такое — иммунная система. Согласно одному из определений (по Р.В. Петрову), иммунитет — это способ защиты организма от живых тел и веществ, несущих в себе признаки генетической чужеродности. Проще говоря, иммунитет — это то, что защищает нас от бактерий, вирусов, любых высокомолекулярных чужеродных веществ (вспомним иммунитет против змеиного яда), попавших в организм, а также раковых клеток. В его основе лежат фагоциты (у животных называемые макрофагами), собственно уничтожающие (поглощающие) чужеродные тела, а также Т- и В-клетки иммунитета, осуществляющие точное «наведение» фагоцитов на патоген. При проникновении микроба в организм фагоциты его поглощают и переваривают [29].
Первичное распознавание врага происходит при помощи Toll-like рецепторов, или TLR [30]. Эти молекулы распознают структуры, общие для многих классов патогенов, но отсутствующие у человека (к примеру, TLR5 распознает белок флагеллин — главный компонент жгутиков бактерий, — а TLR3 активируется при наличии двухцепочечной РНК, появляющейся в жизненном цикле многих вирусов, в частности вируса гриппа А). После поглощения микроба его остатки «показываются» (презентируются) Т-хелперам. Т-хелперы активируются, и в свою очередь помогают активироваться B-лимфоцитам (последним для активации нужны молекулы патогена и сигналы активации от Т-хелпера). После этого B-лимфоциты превращаются в плазматические клетки и начинают синтез антител — молекул иммунитета, маркирующих вещества, подобные тем, что активировали B-лимфоциты. Антитела циркулируют в кровотоке и маркируют структуры патогена. Маркированные микробы и другие чужеродные тела поглощаются фагоцитами более эффективно.
Такой «сценарий» работает, когда микроб находится вне клеток организма (в случае заражения большинством бактерий и грибов). Если же враг проникает внутрь клетки (вирусы, некоторые бактерии, простейшие), а также когда враждебной становится сама клетка организма (в случае рака), в дело вступают Т-киллеры. Они находят и уничтожают зараженные клетки, после чего остатки этих клеток поглощаются все теми же фагоцитами. Для активации Т-киллерам требуются Т-хелперы. Помимо Т-киллеров в этом «сценарии» участвуют антитела (и, соответственно, B-лимфоциты), но их роль меньше, чем T-киллеров. Разумеется, в иммунитете есть и другие участники, но основной акцент в борьбе с ВИЧ приходится на тех, что были названы выше.
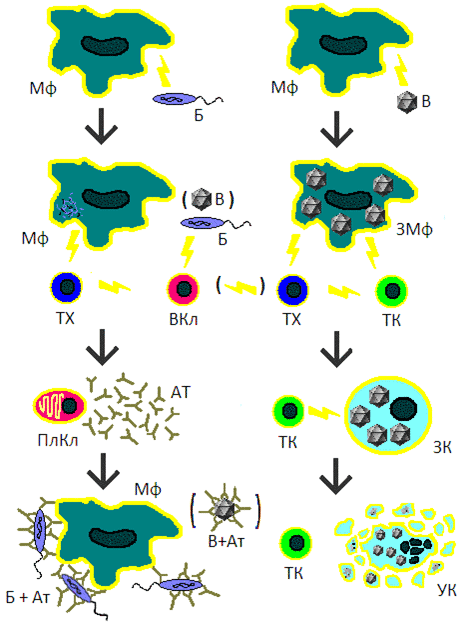
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Рассмотрим жизненный цикл ВИЧ (см. видео). Первая стадия — это проникновение вируса. Сначала любой вирус должен как-нибудь «зацепиться» за клетку, и у разных вирусов для этой цели есть разные «якоря». Имеется таковой и у ВИЧ — белок gp120, который способен взаимодействовать с белком СD4 поверхности человеческой клетки. Это рецептор, присутствующий на многих клетках организма, но больше всего его на Т-хелперах (другое их название — СD4+ T-лимфоциты), — именно на них и направлен ВИЧ в первую очередь. При первоначальном связывании gp120 с CD4 вирусный белок изменяет свою форму и связывается с другими белками поверхности клетки — СХСR4 и ССR5, после чего происходит погружение другого вирусного белка — gp41 — в мембрану клетки. Вслед за этим оболочки клетки и вируса сливаются, и наследственный материал вируса попадает в цитоплазму клетки.
Видео. Жизненный цикл ВИЧ.
Нормальная функция СХСR4 и ССR5 — рецепция цитокинов (небольших растворимых молекул иммунной системы, посредством которых клетки иммунитета «общаются» друг с другом и другими клетками организма). Именно с мутацией ССR5 (Δ32 CCR5) связана врожденная устойчивость некоторых людей, гомозиготных (имеющих 2 копии мутированного CCR5) по этому гену, к ВИЧ [12], [18] (таких людей до 2% в Европе, Индии и странах Ближнего Востока [13]). К сожалению, эта устойчивость не является полной [3]; есть штаммы, заражающие и таких людей. Зато она в какой-то степени проявляется даже у гетерозигот (имеющих одну копию мутированного и одну копию обычного ССR5 ) [12], [18].
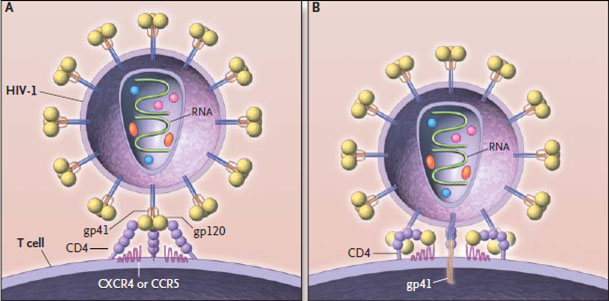
Рисунок 2. Проникновение вируса в клетку. А — первоначальное «зацепление» вируса с клеткой; В — начальный этап слияния вируса с клеткой. Условные обозначения: HIV-1 — поверхность капсида наиболее распространенной разновидности вируса - ВИЧ-1; Т-cell — поверхность Т-хелпера; gp120 — вирусный рецептор к к человеческому белку CD4; CD4 —корецептор во взаимодействии Т-лимфоцитов и антиген-презентирующих клеток; одновременно является рецептором к gp120; gp41 — вирусный белок, за который закреплен gp120; помимо этого играет важную роль в слиянии мембран вируса и клетки; CXCR4 или ССR5 — рецепторы хемокинов; корецепторы для белка gp120; RNA — вирусный геном.
После проникновения наследственного материала ВИЧ в клетку происходит процесс обратной транскрипции, то есть перенос информации с вирусной РНК на ДНК. Происходит это потому, что вирусный геном записан в виде РНК, а геном человека — в виде ДНК. Вирусу же «хочется» записать себя в геном клетки, ведь именно он управляет последней. К тому же, если иммунитет имеет средства для распознавания вирусных белков и РНК, то ДНК, интегрированную в геном клетки, иммунитет распознать не может.
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10−9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10−3 замен на сайт в год (у гена env ВИЧ: 10−2–10−3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
После обратной транскрипции геном вируса вставляется в геном человека вирусным белком интегразой. Проникнув в геном, вирус может «сидеть» в нем несколько лет, никак себя не проявляя. В основном, вирус начинает размножаться в активированных (делящихся) T-лимфоцитах, хотя по немногу он может работать и в неделящейся клетке [17]. Это главная причина, почему ВИЧ неизлечим (но есть работа, в которой полностью удалось излечить от ВИЧ клеточную культуру [32]) — в человеке всегда есть «дремлющие» копии вируса, неопределимые для иммунной системы, но способные к «пробуждению» в любой момент (та же история и с герпесом - его как и ВИЧ невозможно полностью удалить из организма).
«Будильником» для вируса служит активация клетки: промотор вируса содержит последовательность, гомологичную последовательности NF-κB [10], [15], каковая есть у многих генов иммунитета. (Промотор регулирует работу гена и определяет, как, когда и в каких количествах будет появляться белок в той или иной клетке.) Вспоминая о том, что ВИЧ заражает в основном Т-хелперы, мы получаем интересную картину: пока клетка не активирована, вирус «спит»; как только клетка начинает выполнять свою функцию (иммунитет) — вирус «просыпается» и убивает эту клетку. Можно также добавить, что при ВИЧ-инфекции активируются в первую очередь те клоны Т-клеток, которые специфичны для ВИЧ-белков.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
Перейдем теперь к тому, как вирус уничтожает иммунную систему. В основном все сводится к включению у Т-клеток запрограммированной клеточной гибели, или апоптоза (В норме апоптоз включается у клеток, которые дефектны или не нужны организму - например, у клеток хвоста эмбриона человека. Большинство потенциальных раковых клеток умирает путем апоптоза. Более того, если клетка «почувствует» при помощи TLR'ов заражение вирусом, она попытается умереть опять-таки через апоптоз (хотя почти у всех вирусов есть механизмы его блокирования)). Само производство вируса не проходит для Т-хелпера бесследно, и со временем он погибает. Причины этого до конца не понятны, но можно выделить несколько возможных.
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4+-клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
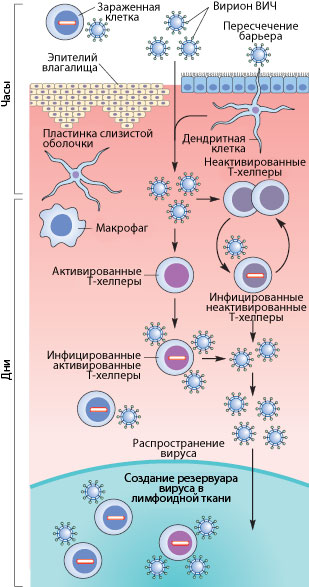
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Но даже в отсутствии микротравм ВИЧ может проникнуть внутрь организма через дендритные клетки (разновидности макрофагов), которые могут выпускать свои отростки в просвет слизистой. Там они захватывают вирусы и бактерии, после чего происходит презентация захваченного материала Т-хелперам. Таким образом организм готовится «тепло встретить» микробов, присутствующих в окружающей среде. Но в нашем случае, дендритные клетки лишь заражаются вирусом — напрямую свободными вирионами или же при контакте с зараженными лимфоцитами, которые могут присутствовать в сперме (общее число лимфоцитов в сперме — до 1 млн/мл и больше).
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
О том, как вести себя, чтобы не заразиться ВИЧ, и что делать, если это все-таки произошло, читайте в статье «Связанные одной лентой» [33]. — Ред.
Заключение
На данный момент имеется огромное количество информации о ВИЧ; известны его структура, последовательность генома, жизненный цикл; изучен почти каждый шаг вируса в организме. Уже сейчас на стадии клинических испытаний находится множество лекарственных средств, а ВААРТ (высокоактивная антиретровирусная терапия) позволяет зараженному ВИЧ иметь почти такую же продолжительность жизни, как у здорового человека. Науке известно и два случая полного излечения от ВИЧ. Один из них известен как случай «берлинского пациента», которому пересадили костный мозг от донора с мутацией Δ32 ССR5. Другой прецедент произошел в США, где ребенка, родившегося от ВИЧ-инфицированной матери, сразу после рождения подвергли ВААРТ. Через два года после рождения девочки мать отказалась продолжать ее лечение, и через 10 месяцев при повторном осмотре врачи констатировали полное выздоровление девочки.
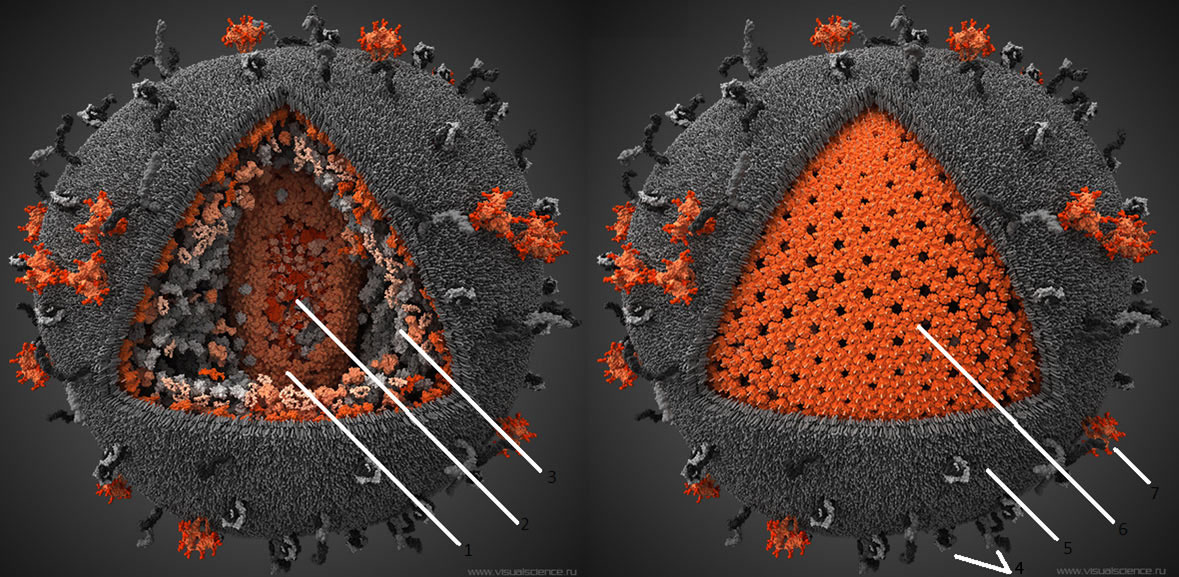
Рисунок 4. Компьютерная модель ВИЧ. Серым цветом показаны человеческие структуры, «украденные вирусом из клетки», красным — вирус-специфические белки. 1 — капсид вируса, состоит из 250 гексамеров и 12 пентамеров белка p24. 2 — Геном вируса, а также связанные с ним белки, представлен двумя идентичными молекулами РНК по ~10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
сайт Visual Science
...Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Литература
- J. B. Alimonti. (2003). Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS. Journal of General Virology. 84, 1649-1661;
- Bartz S.R. and Emerman M. (1999). Human immunodeficiency virus type 1 Tat induces apoptosis and increases sensitivity to apoptotic signals by up-regulating FLICE/caspase-8. J. Virol. 73, 1956–1963;
- Robyn Biti, Rosemary Ffrench, Judy Young, Bruce Bennetts, Graeme Stewart, Tong Liang. (1997). HIV-1 infection in an individual homozygous for the CCR5 deletion allele. Nat Med. 3, 252-253;
- Chang H.S., Samaniego F., Nair B.C., Buonaguro L., Ensoli B. (1997). HIV-1 Tat protein exits from cells via a leaderless secretory pathway and binds to extracellular matrix-associated heparan sulfate proteoglycans through its basic region. AIDS. 11, 1421–1431;
- Kevin M. De Cock, Mary Glenn Fowler, Eric Mercier, Isabelle de Vincenzi, Joseph Saba, et. al.. (2000). Prevention of Mother-to-Child HIV Transmission in Resource-Poor Countries. JAMA. 283, 1175;
- Mari´a Eugenia Gonza´lez, Luis Carrasco. (2001). Human Immunodeficiency Virus Type 1 VPU Protein Affects Sindbis Virus Glycoprotein Processing and Enhances Membrane Permeabilization. Virology. 279, 201-209;
- Marko Salmi, Sirpa Jalkanen. (2005). Cell-surface enzymes in control of leukocyte trafficking. Nat Rev Immunol. 5, 760-771;
- Gero Hütter, Daniel Nowak, Maximilian Mossner, Susanne Ganepola, Arne Müßig, et. al.. (2009). Long-Term Control of HIV byCCR5Delta32/Delta32 Stem-Cell Transplantation. N Engl J Med. 360, 692-698;
- Jewett A., Giorgi J.V., Bonavida B. (1990). Antibody-dependent cellular cytotoxicity against HIV-coated target cells by peripheral blood monocytes from HIV seropositive asymptomatic patients. J. Immunol. 145, 4065–4071;
- Kawakami K., Schidereit C., Roeder R.G. (1988). Identification and purification of a human immunoglobulin-enhancer-binding protein (NF-kappa B) that activates transcription from a human immunodeficiency virus type 1 promoter in vitro. Proc. Natl. Acad. Sci. USA. 85, 4700–4704;
- J. Michael Kilby, Joseph J. Eron. (2003). Novel Therapies Based on Mechanisms of HIV-1 Cell Entry. N Engl J Med. 348, 2228-2238;
- Marmor M., Sheppard H.W., Donnell D., Bozeman S., Celum C. (2001). Homozygous and Heterozygous CCR5-[DELTA]32 Genotypes Are Associated With Resistance to HIV Infection. J. Acquir. Immune Defic. Syndr. 27, 472–481;
- Jeremy J. Martinson, Nicola H. Chapman, David C. Rees, Yan-Tat Liu, John B Clegg. (1997). Global distribution of the CCR5 gene 32-basepair deletion. Nat Genet. 16, 100-103;
- RADMILA METLAŠ, VESNA SKERL, VELJKO VELJKOVIČ, ALFONSO COLOMBATTI, SÁNDOR PONGOR. (1994). Immunoglobulin-Like Domain of HIV-1 Envelope Glycoprotein gp120 Encodes Putative Internal Image of Some Common Human Proteins. Viral Immunology. 7, 215-219;
- Gary Nabel, David Baltimore. (1987). An inducible transcription factor activates expression of human immunodeficiency virus in T cells. Nature. 326, 711-713;
- Avi Nath. (2002). Human Immunodeficiency Virus (HIV) Proteins in Neuropathogenesis of HIV Dementia. J INFECT DIS. 186, S193-S198;
- Nathanson N., Overbauch J. (2007). HIV, SIV and the Pathogenesis of AIDS. Viral Pathogenesis and immunity. Second edition, p. 185–200;
- Michel Samson, Frédérick Libert, Benjamin J. Doranz, Joseph Rucker, Corinne Liesnard, et. al.. (1996). Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 382, 722-725;
- G. Shaw, B. Hahn, S. Arya, J. Groopman, R. Gallo, F Wong-Staal. (1984). Molecular characterization of human T-cell leukemia (lymphotropic) virus type III in the acquired immune deficiency syndrome. Science. 226, 1165-1171;
- Peter J. Southern. (2013). Missing out on the biology of heterosexual HIV-1 transmission. Trends in Microbiology. 21, 245-252;
- D A Steinhauer, J J Holland. (1987). Rapid Evolution of RNA Viruses. Annu. Rev. Microbiol.. 41, 409-431;
- Tateyama M., Oyaizu N., McCloskey T.W., Than S., Pahwa S. (2000). CD4 T lymphocytes are primed to express Fas ligand by CD4 cross-linking and to contribute to CD8 T-cell apoptosis via Fas/FasL death signaling pathway. Blood. 96, 195–202;
- V. Veljković, R. Metlaš. (1992). Identification of immunoglobulin recombination elements in human immunodeficiency virus type 1 envelope gene. Immunology Letters. 31, 11-14;
- Michael O. Westendorp, Rainer Frank, Christina Ochsenbauer, Kirstin Stricker, Jens Dhein, et. al.. (1995). Sensitization of T cells to CD95-mediated apoptosis by HIV-1 Tat and gp120. Nature. 375, 497-500;
- M. B. ZAITSEVA, S. A. MOSHNIKOV, A. T. KOZHICH, H. A. FROLOVA, O. D. MAKAROVA, et. al.. (1992). Antibodies to MHC Class II Peptides are Present in HIV-1-Positive Sera. Scand J Immunol. 35, 267-273;
- Zauli G., Gibellini D., Secchiero P., Dutartre H., Olive D., Capitani S., Collette Y. (1999). Lymphoid Cells to Apoptosis via Functional Upregulation of the CD95/CD95 Ligand Pathway. Blood. 93, 1000–1010;
- Зайхнер С. Молекулярная биология ВИЧ для клиницистов;
- Хаитов Р.М. и Игнатьева Г.А. СПИД. Народная академия культуры и общечеловеческих ценностей, 1992;
- Ярилин А.А. Иммунология. ГЭОТАР-Медиа, 2010;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- «Швейцарский нож» вирусной армии: разгадан секрет обратной транскриптазы;
- Как «вырезать» вирус?;
- Связанные одной лентой.