
Включать или не включать, вот в чем вопрос
26 октября 2013
Включать или не включать, вот в чем вопрос
- 703
- 0
- 1
Нефтяные разливы опасны для окружающей среды и здоровья человека. Но есть микроорганизмы, которые используют компоненты нефти в качестве субстрата и, поедая их, живут и размножаются.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Кристально чистая вода, свежий воздух, зеленые луга и леса — превосходное место для проживания человека. Нефтяные разливы, ядерный реактор ЧАЭС, кислотные озера — отличное место для обитания микроорганизмов. Причем они не просто терпеливо переносят столь суровые условия, они прекрасно живут в них и, главное, размножаются. И даже такие опасные для человека загрязнители окружающей среды, как полициклические ароматические углеводороды, служат для бактерий вполне обычным ростовым субстратом. Разгадка таких способностей кроется в генах. И об одном таком наборе генов — генов деградации нафталина — пойдет речь в этой статье.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Большие города
Многие технологические сферы загрязняют окружающую среду токсичными соединениями, а некоторые отрасли промышленности (производство резиновых изделий и кокса, газификация угля, нефтепереработка) являются источниками таких опасных соединений, как полициклические ароматические углеводороды (ПАУ). К ПАУ относят соединения, имеющие в своей химической структуре два и более конденсированных бензольных кольца. Многие ПАУ не только токсичны, но и могут провоцировать мутации, приводящие к появлению раковых опухолей, а также оказывать негативное воздействие на развитие плода в утробе матери.
Шестнадцать гомологов ПАУ в странах Евросоюза и США включены в список приоритетных загрязнителей окружающей среды. В России в настоящее время установлен контроль за содержанием нафталина, фенантрена, пирена и бенз(а)пирена в воздухе рабочей зоны и в водоемах. В почвах и грунтах предельно допустимая концентрация (ПДК) нормативно закреплена только для бенз(а)пирена (0,02 мг/кг). Всего известно более ста полициклических ароматических соединений, большинство из которых устойчиво в экосистеме в течение продолжительного времени. Так, период полураспада трехкольцевой молекулы фенантрена в почве может составлять от 16 до 126 дней, в то время как период полураспада пятикольцевого бенз(а)пирена — 229–1400 дней [1].
Разложение ПАУ в почве и в воде связано, в первую очередь, со способностью микроорганизмов, обитающих на загрязненных территориях, использовать эти соединения в качестве ростового субстрата [2].
Как происходит деградация ПАУ?
Первоначальной реакцией бактериальной деградации полициклических ароматических углеводородов является модификация группы заместителя, за которой следует расщепление ароматического кольца. В конечном счете, пути деградации ароматических соединений сводятся к нескольким ключевым реакциям и одним и тем же промежуточным продуктам. Одним из таких продуктов, в том числе и для нафталина, является салициловая кислота (рис. 1).
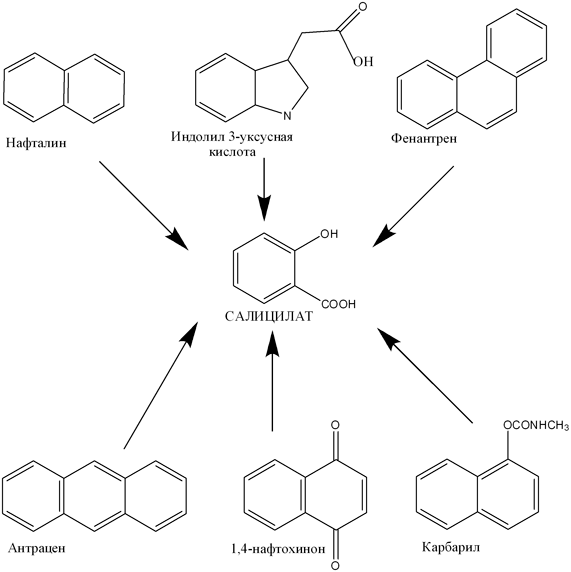
Рисунок 1. Салицилат — промежуточный продукт деградации многих ПАУ-соединений
Сам же салицилат в дальнейшем окисляется двумя путями: во-первых, через катехол (посредством салицилат-1-монооксигеназы), во-вторых, через гентизиновую кислоту (при участии салицилат-5-гидроксилазы). В конечном счете, все сводится к промежуточным соединениям цикла Кребса (рис. 2).
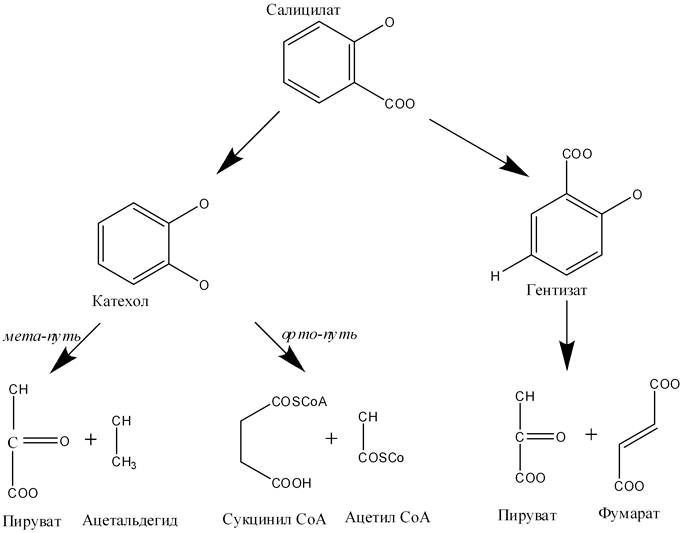
Рисунок 2. Биохимические пути бактериальной деградации салицилата
Нафталиновая плазмида NAH7 — грациозная модель
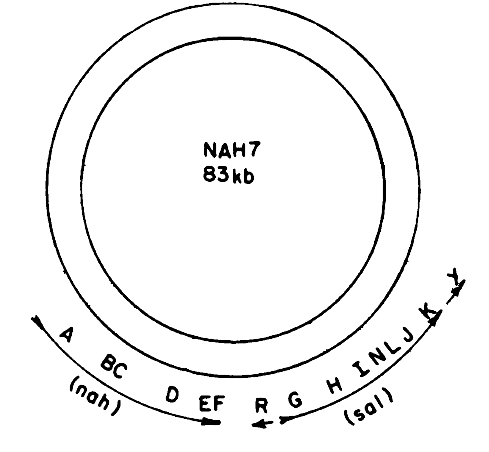
Рисунок 3. Нафталиновая плазмида NAH7. nahABCDEF — набор генов (оперон), кодирующих ферменты разложения нафталина до салицилата; nahGHINLJK — оперон, кодирующий ферменты разложения салицилата до элементов цикла Кребса; nahR — ген, кодирующий белок-регулятор этих двух оперонов; nahY — ген, кодирующий хеморецептор.
Моделью для исследования механизма деградации нафталина через салициловую кислоту стала нафталиновая плазмида NAH7, выделенная из штамма Pseudomonas putida G7. Гены деградации нафталина и салицилата в этой плазмиде имеют структуру двух оперонов, то есть все гены, участвующие в разложении нафталина или салицилата, расположены вместе, друг за другом. При такой упаковке синтез ферментов в пределах одного оперона запускается одновременно, что позволяет микроорганизму при необходимости быстро активировать весь этот массив (рис. 3) [3]. Салицилат в данном случае является своего рода «контрольной точкой», разделяющей длинный путь на два сравнительно коротких участка. В связи с тем, что салицилат является общим звеном пути деградации многих соединений (о чем упоминалось выше), такое разделение на участки облегчает обмен «запчастями» одного пути: приобретение недостающих элементов или замену уже имеющихся на более эффективные.
Такой мобильный обмен генетической информацией становится возможным также благодаря мобильным генетическим элементам — транспозонам. Эти элементы, как правило, располагаются попарно по краям функциональных генов и при действии специального фермента — транспозазы — могут вырезаться из одного участка генома и встраиваться в другой.
Но вернемся к салицилату. Его роль «контрольной точки» — не единственная в плазмиде NAH7. Салицилат участвует в регуляции синтеза ферментов всего пути разложения нафталина до ЦТК.
Салицилат способен включать гены
У любого оперона есть два участка, участвующие в контроле синтеза белков с генов: оператор — участок связывания белка-регулятора с ДНК — и промотор — участок связывания РНК-полимеразы с ДНК. Взаимодействие этих двух элементов и определяет активность оперона. В плазмиде NAH7 имеется регуляторный белок, отвечающий за активность двух оперонов: деградации нафталина (nahABCDEF) и салицилата (nahGHINLJK). Ген, кодирующий этот белок, располагается рядом со вторым опероном (рис. 3). Регуляторный белок имеет две равновесные формы: неактивную (NahRi) и активную (NahRa). Когда салицилат в среде отсутствует, этот регуляторный белок неактивен (NahRi) и он не обладает сродством к ДНК. РНК-полимераза не присоединяется к промоторной области, потому что без активного белка-регулятора распознать эту область как место своей посадки она не может.
Когда в среде появляется салицилат, регуляторный белок активируется (NahRa), присоединяется к ДНК и помогает РНК-полимеразе закрепиться в промоторной области. Запускается транскрипция, и синтезируются ферменты, кодируемые оперонами. Процесс продолжается до тех пор, пока все молекулы загрязнителя не будут разрушены, и в среде не останется салицилата, активирующего белок-регулятор. Этот белок вновь перейдет в неактивную форму, РНК-полимераза перестанет распознавать место своей посадки, и наработка ферментов прекратится. Подобная схема позволяет нарабатывать фермент только в случае необходимости (рис. 4) [4].
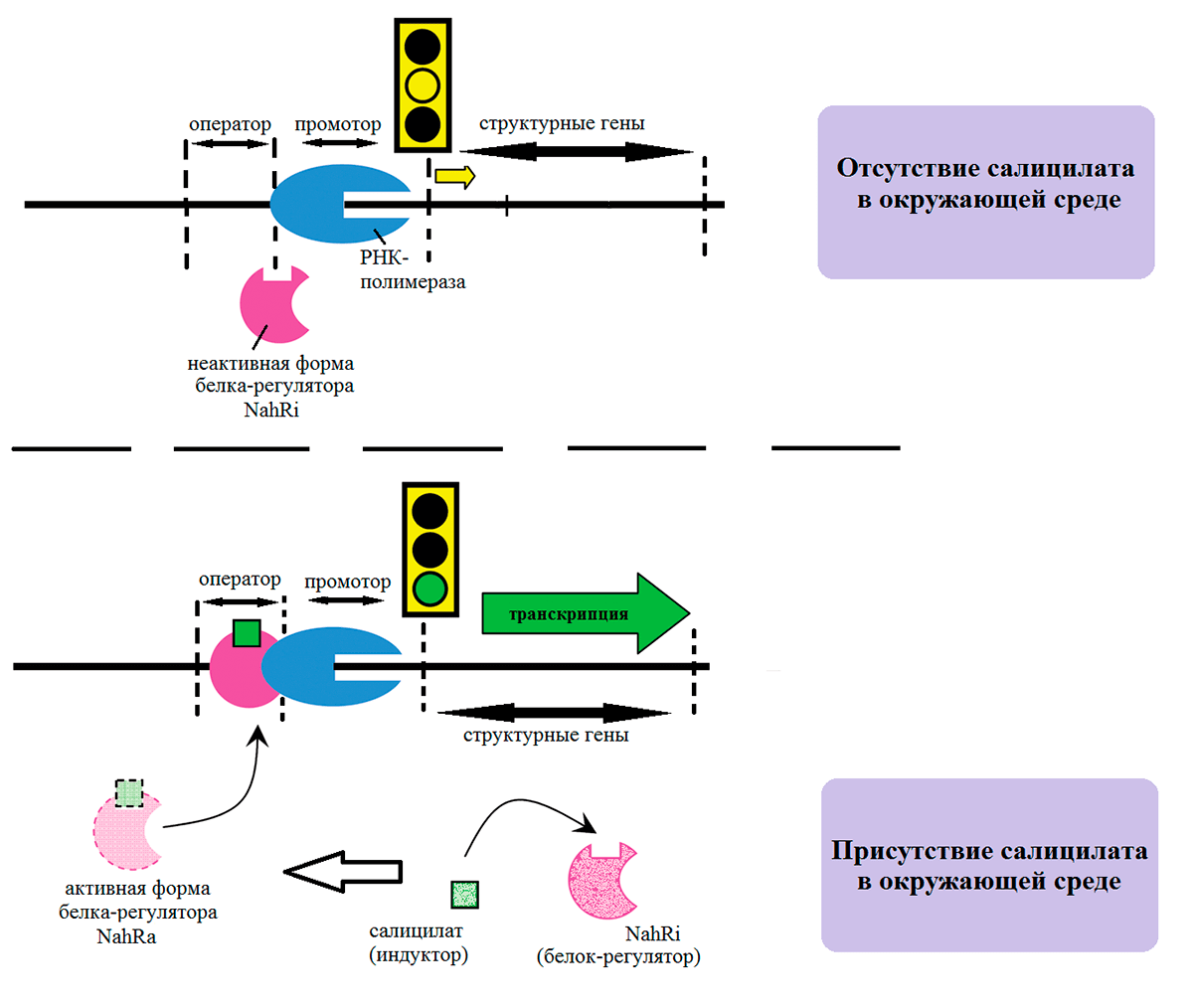
Рисунок 4. Влияние салицилата на экспрессию nah-генов плазмиды NAH7
Хемотаксис до субстрата доведет
Способность быстро обнаружить цель (молекулу загрязняющего вещества) и атаковать ее (деградировать эту молекулу) дает преимущества штамму-деструктору перед другими штаммами в условиях загрязненной окружающей среды. А некоторые микроорганизмы научились не просто распознавать наличие загрязнителя, но и осуществлять целенаправленный поиск ростового субстрата. Подобное явление называется хемотаксисом.
При наличии определенного белка — хеморецептора — бактериальная клетка приобретает способность чувствовать химический состав окружающей среды. В нафталиновой плазмиде NAH7 такой белок имеется и реагирует он, разумеется, на нафталин. Нафталин в таком случае называется хемоэффектором, или аттрактантом. Ген nahY, который кодирует нафталиновый хеморецептор, расположен рядом с оперонами деградации нафталина. Синтез белка-хеморецептора не зависит от наличия в среде загрязнителя, и, следовательно, этот рецептор нарабатывается в непрерывном режиме. Это значит, что на поверхности бактериальной клетки постоянно присутствуют «антенны», готовые в любую секунду уловить присутствие нафталина.
Еще одной необходимой в погоне за субстратом особенностью микроорганизма является жгутик. Это мотор, который в зависимости от обстоятельств может крутиться то против часовой стрелки, то по часовой стрелке, направляя бактериальную клетку в нужную сторону.
При попадании молекулы аттрактанта на белок-рецептор происходит аутофосфорилирование белка, связанного с хеморецептором (CheA), который, в свою очередь, фосфорилирует два последующих белка — CheB и CheY. Фосфорилированный CheY-P связан со жгутиком и способен переключать направление его вращения. Фосфорилированный CheB-P вместе с ферментом метилтрансферазой обеспечивает адаптацию к имеющейся концентрации субстрата и отключает аутофосфорилирование белка CheA, что приводит к прекращению подачи сигнала на жгутик (рис. 5а).
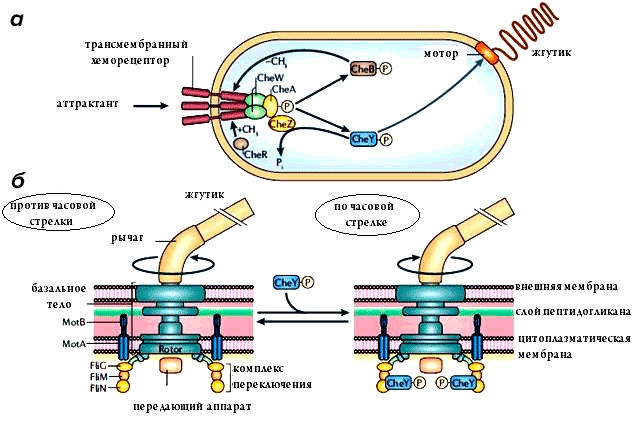
Рисунок 5. Хемотаксис. a — Реакция хеморецептора на наличие субстрата. Связывание молекулы субстрата с хеморецептором запускает каскад фосфорилирования белков, приводящий к переключению направления вращения жгутика (б). Связывание фосфорилированных белков с компонентами комплекса переключения приводит к сдвигу баланса в сторону вращения по часовой стрелке. Чем больше молекул субстрата связывается с хеморецептором, тем больше фосфорилированных белков связываются с компонентами комплекса переключения, что, в свою очередь, учащает вращение по часовой стрелке по сравнению с вращением против часовой стрелки.
Движение бактериальной клетки в однородной среде происходит по ломаной траектории; время одного «шага» составляет около одной секунды, а перерыв между шагами — около 0,1 секунды. Во время передвижения вперед жгутики остаются позади клетки. Во время пауз, вызванных вращением одного или нескольких жгутиков в противоположную вращению всего пучка сторону, происходит расплетание всего пучка, что дезориентирует всю клетку. В результате клетка беспорядочно блуждает в пространстве, что обеспечивает эффективный поиск субстрата, который может быть еще эффективнее за счет случайных неоднократных перемещений в одном направлении (обозначено зеленым пунктиром на рис. 6а).
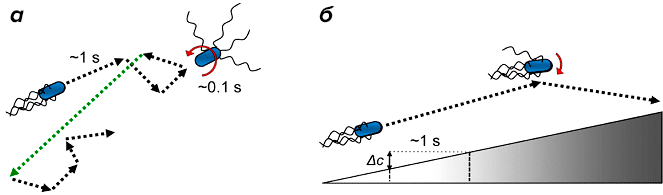
Рисунок 6. Стратегия бактериального хемотаксиса. а — Перемещение в отсутствии градиента аттрактанта. Движение клетки в однородной среде более-менее хаотично. Вращение жгутика против часовой стрелки периодически сменяется вращением по часовой стрелке, что переориентирует бактериальную клетку в пространстве. Такое «блуждание» является частью эффективной стратегии поиска ростового субстрата. б — Хемотаксис в градиенте концентрации субстрата. Когда в среде появляется субстрат, вращение жгутика чаще происходит по часовой стрелке (и реже — против часовой), что придает движению бактериальной клетки направленность. Чем выше концентрация аттрактанта, тем активней к нему движется бактериальная клетка.
Когда клетка приближается к местонахождению субстрата и начинает улавливать его молекулы, движение становится более направленным . Хеморецептор, улавливая молекулы субстрата, запускает вращение жгутиков по часовой стрелке. Чем выше концентрация субстрата, тем чаще жгутики вращаются по часовой стрелке и, как следствие, клетка меньше переориентируется в пространстве, а значит — двигается в направлении повышения концентрации (рис. 6б). Эта стратегия перемещения клетки позволяет не останавливаться, когда в месте ее пребывания заканчивается субстрат. Она движется дальше — в поисках нового, богатого пищей, места. И, разумеется, находит его.
Что интересно, поисковое поведение совсем других организмов — насекомых — устроено во многом похоже (см. статью «Ускользающая нить» [6]). — Ред.
Подводя итог
Нафталиновая плазмида NAH7 — яркий пример того, как бактериальная клетка способна использовать имеющийся у нее потенциал: осуществлять направленный поиск субстрата, при нахождении субстрата включать синтез ферментов для его деградации, а не очень функциональные гены деградации заменять на нечто более эффективное. Поэтому даже в самых экстремальных условиях микроорганизмам удается приспосабливаться и использовать самые опасные (для человека) загрязнения в качестве источника углерода, а значит — и источника жизни.
Литература
- Ri-He Peng, Ai-Sheng Xiong, Yong Xue, Xiao-Yan Fu, Feng Gao, et. al.. (2008). Microbial biodegradation of polyaromatic hydrocarbons. FEMS Microbiol Rev. 32, 927-955;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- I S You, D Ghosal, I C Gunsalus. (1988). Nucleotide sequence of plasmid NAH7 gene nahR and DNA binding of the nahR product.. J. Bacteriol.. 170, 5409-5415;
- Woojun Park, Saraswathi Padmanabhan, Eugene L. Madsen, Parasuraman Padmanabhan, Gerben J. Zylstra. (2002). nahR, encoding a LysR-type transcriptional regulator, is highly conserved among naphthalene-degrading bacteria isolated from a coal tar waste-contaminated site and in extracted community DNA b. Microbiology. 148, 2319-2329;
- Steven L. Porter, George H. Wadhams, Judith P. Armitage. (2011). Signal processing in complex chemotaxis pathways. Nat Rev Microbiol. 9, 153-165;
- Ускользающая нить;
- Victor Sourjik, Ned S Wingreen. (2012). Responding to chemical gradients: bacterial chemotaxis. Current Opinion in Cell Biology. 24, 262-268.








