Сероводород — новое лекарство для сосудов
02 ноября 2013
Сероводород — новое лекарство для сосудов
- 5365
- 1
- 0
Трудно поверить, что столь неприятная для нашего обоняния молекула может быть полезной...
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Сероводород (H2S) наряду с другими газообразными молекулами, такими как монооксид углерода и монооксид азота, является важной внутриклеточной сигнальной молекулой, которая в последнее время стала объектом большого числа фундаментальных исследований. Как оказалось, H2S участвует в регуляции разнообразных физиологических процессов, связанных с регуляцией гомеостаза, иммунитета, передачи нервных импульсов в клетках центральной и периферической нервной системы. Однако среди огромного разнообразия биологических функций этой молекулы особое место выделяют ее роли в регуляции работы сердечнососудистой системы, в частности — формировании нормальных показателей артериального давления. Обнаружение такого свойства молекулы H2S положило начало новому направлению в фармакологии, связанному с поиском и созданием принципиально новой группы антигипертензивных препаратов, действие которых основывалось бы на высвобождении молекул H2S.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Сероводород многим известен как газ, обладающий дурным запахом тухлых яиц. Первые упоминания о сероводороде датируются 16 веком, когда в 1713 году итальянский врач Бернардино Рамадзини описал влияние сероводорода на организм человека в своем труде «De Morbis Artificum», или «Заболевания рабочих». В главе «Болезни очистителей уборных и выгребных ям» он описывает болезненное воспаление глаз, которое было распространено среди таких рабочих. Воспаление это часто приводило к присоединению вторичной инфекции, а иногда и к полной слепоте. Рамадзини предположил, что во время работы из разрушенных экскрементов выделяются неизвестные летучие кислоты, которые и вызывают раздражение глаз. Как известно в настоящее время, сероводород образуется везде, где органическое вещество подвергается гниению [20].
В 1863 году Феликс Гоппе-Зейлер исследовал влияние чистого сероводорода на кровь человека и по изменениям в видимой области спектра поглощения, соответствующей гемоглобину, обнаружил зеленый пигмент. Он назвал новую форму гемоглобина сульфгемоглобином. Эта находка в дальнейшем привела к рождению гипотезы о том, что сероводород наряду с нитритом натрия и оксидом углерода (угарным газом) является кровяным ядом. Однако в условиях in vivo этот пигмент так и не был обнаружен.
Непосредственные исследования биологического действия сероводорода начались на рубеже XX века, но посвящены они были преимущественному изучению токсических свойств сероводорода [20]. Рассматривать сероводород в качестве сигнальной молекулы, которая не только является токсическим агентом, но и участвует в регуляции функциональной активности различных клеток нашего организма, стали только в конце XX века. Начало исследованиям в этой области положили японские ученые Абе и Кимура, которые в 1996 г. впервые описали возможность синтеза сероводорода в тканях головного мозга и указали на его способность регулировать функции клеток [4].
Хотя сероводород был обнаружен в тканях головного мозга еще в 1980-х годах, первоначально его сочли за артефакт, который образовался вследствие быстрого увеличения концентрации сульфидов в тканях после смерти. При этом появление сероводорода связывали с его высвобождением из дисульфидных соединений серы (так называемых «sulfane sulfur») во время препарирования тканей [16].
В настоящее время сероводород отнесен к группе так называемых газотрансмиттеров — газообразных внутриклеточных сигнальных молекул, выполняющих в клетке специфические регуляторные функции. H2S хорошо растворим в липофильных веществах. Его растворимость в липидах в пять раз превосходит растворимость в воде, что обусловливает хорошую проникающую способность H2S через мембранные структуры клетки и не требует участия специальных ион-транспортных систем. Константа проницаемости (РМ) сероводорода через бислойные липидные мембраны достаточно высока и составляет 0.5±0.4 см/с (для сравнения РМ для кислорода составляет примерно 0.0050±0.0006 см/с) [17]. Это позволяет считать сероводород высоко доступной молекулой, эффективно осуществляющей свои функции внутри клеток.
Другими молекулами, входящими в группу газотрансмиттеров, являются хорошо известный монооксид азота (NO), а также монооксид углерода (CO).
Синтез сероводорода
Внутриклеточный синтез сероводорода осуществляется в различных клетках нашего организма. В настоящее время известно три фермента, в результате работы которых синтезируется сероводород: цистотионин-β-синтаза (CBS), цистотионин-γ-лиаза (CSE) и 3-меркаптопируватсульфуртрансфераза (3-MST).
При этом CBS осуществляет синтез сероводорода преимущественно в нервных клетках. В гладкомышечных клетках кровеносных сосудов, сокращение-расслабление которых обеспечивает изменение тонуса последних, синтез сероводорода осуществляет фермент CSE [16], [22], а в эндотелиальных клетках, выстилающих изнутри просвет сосуда, — 3-MST [11], [21] (рис. 1).
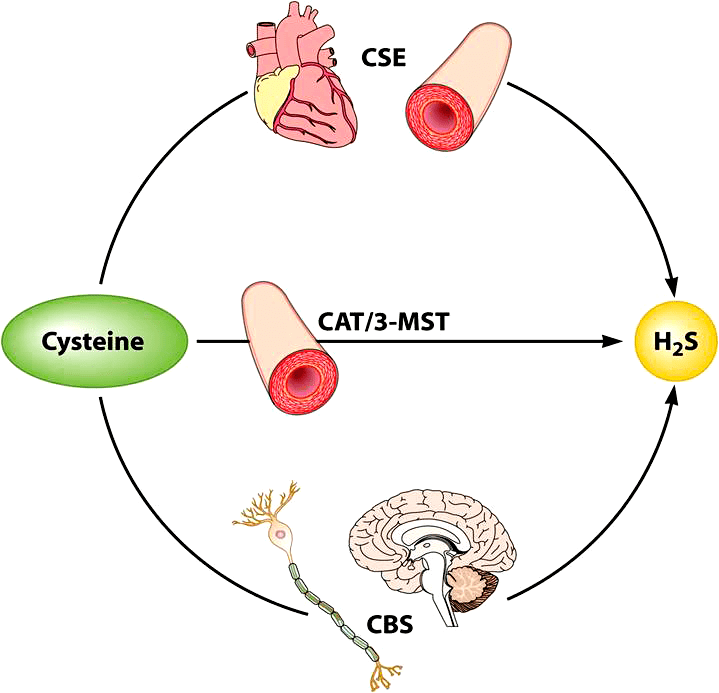
Рисунок 1. Синтез сероводорода. В гладкомышечных клетках кровеносных сосудов, в кардиомиоцитах синтез сероводорода обусловлен активностью фермента цистотионин-γ-лиазы (CSE), тогда как в эндотелиальных клетках — комплекс 3-меркаптопируватсульфуртрансферазы (3-MST) и цистеин-аминотрансферазы (CAT). В клетках органов, не относящихся к кровеносному руслу, сероводород преимущественно синтезируется благодаря активности цистотионин-β-синтазы (CBS). Хотя фермент CBS локализован преимущественно в нейронах и клетках нейроглии, он также был обнаружен в клетках печени, почек, поджелудочной железы.
Все три фермента используют в качестве субстрата для синтеза сероводорода серосодержащую аминокислоту L-цистеин, катализируя реакцию его десульфгидратации: происходит отщепление от цистеина атома серы без последующего его окисления, что ведет к образованию H2S. Под действием CSE происходит преобразование цистина (дисульфид цистеин) до тиоцистеина, пирувата и аммиака, с последующим неферментативным преобразованием тиоцистеина до цистеина и H2S (рис. 2). В то же время, CBS использует несколько другой путь синтеза H2S, который заключается в конденсации гомоцистеина с цистеином, и последующим образованием цистатионина [16]. В качестве субстрата синтеза сероводорода могут использоваться и другие серосодержащие аминокислоты, такие как метионин и цистин.
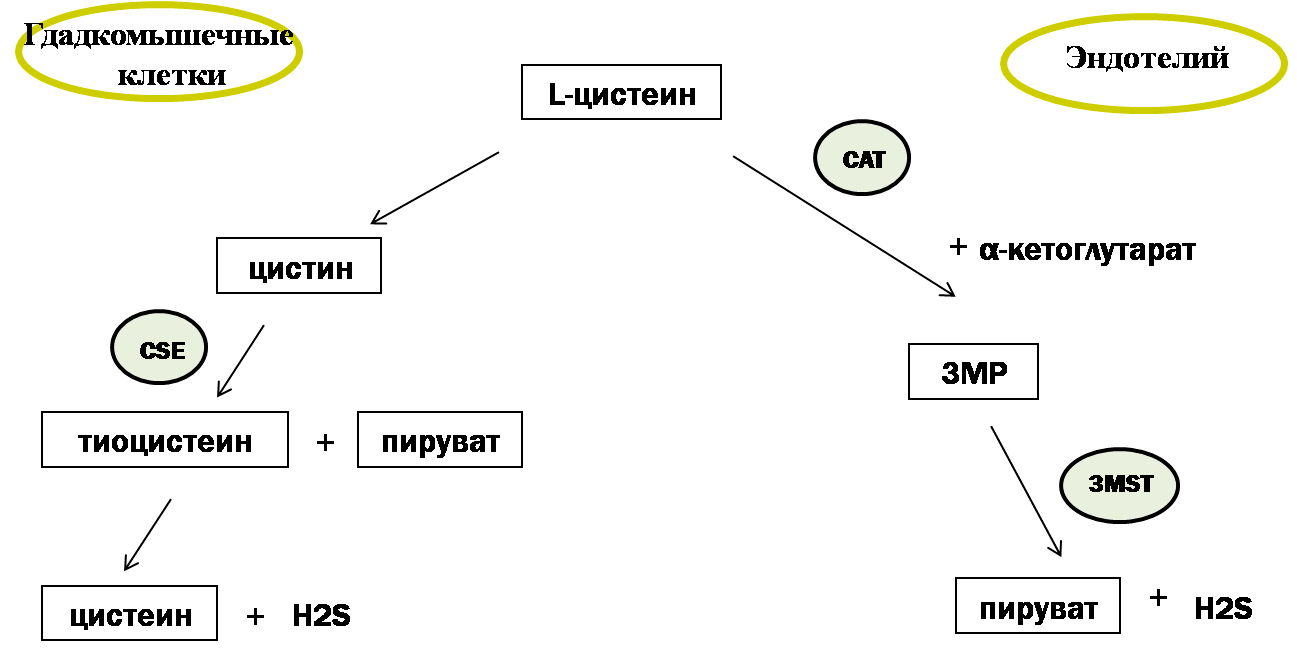
Рисунок 2. Схема синтеза сероводорода в гладкомышечных и эндотелиальных клетках кровеносных сосудов. Условные обозначения: CAT — цистеин-аминотрансфераза; CST — цистотионин-γ-лиаза; 3МSТ — 3-меркаптопируват-сульфуртрансфераза; 3МР — 3-меркаптопируват.
Фермент 3-меркаптопируват-сульфуртрансфераза (3MST) функционирует в комплексе с другим ферментом — цистеин-аминотрансферазой (CAT). Выделяют митохондриальную и цитозольную формы CAT. Используя в качестве субстрата серосодержащую аминокислоту L-цистеин и α-кетоглутарат, CAT продуцирует 3-меркаптопируват (3МР), из которого при участии фермента 3MST синтезируется непосредственно H2S [18]. В отсутствии α-кетоглутарата синтез H2S прекращается.
Сероводород и сердечнососудистая система
Как показали многочисленные исследования, одной из систем, где сероводород играет ключевую роль как сигнальная молекула, является сердечнососудистая система, в частности — кровеносные сосуды. Осуществляя свое регуляторное действие в сосудах артериального русла, он принимает активное участие в регуляции артериального давления [23].
Исследования среди людей показали, что в группе лиц с нормальными показателями артериального давления уровень H2S в плазме крови составлял 34 мкМ, тогда как у больных артериальной гипертонией он был снижен до 20 мкМ. Назначение больным артериальной гипертонией ингаляций сероводорода способствовало снижению показателей артериального давления [29]. При проведении исследований на крысах было обнаружено, что внутривенное болюсное введение раствора сероводорода вызывало у них дозозависимое снижение артериального давления [16].
В условиях in vitro донор сероводорода гидросульфид натрия (NaHS), активно используемый в экспериментальной практике, также вызывал расслабление различных отделов артериального и венозного русла: грудной, мезентериальной, почечной артерий, аорты, воротной вены и т.д. Несмотря на существенную роль эндотелия в регуляции сосудистого тонуса, его удаление не оказывало существенного влияния на эффекты сероводорода в гладкомышечных клетках [16]. Это свидетельствует о прямом влиянии сероводорода на гладкомышечные клетки через присущие им регуляторные механизмы. Расслабляющее действие сероводорода на гладкомышечные клетки связано преимущественно с открыванием особых структур в их мембране — калиевых каналов, чувствительных к концентрации внутриклеточного источника энергии — аденозинтрифосфата (АТФ) [10], [28].
Связываясь с серосодержащими группами белков этих каналов, сероводород изменяет их пространственную конфигурацию и тем самым способствует открыванию каналов [2], [24]. Открывание калиевых каналов ведет к увеличению выхода ионов калия из клетки в межклеточную среду. В то же время, активации АТФ-чувствительных калиевых каналов сопровождается инактивацией потенциал-чувствительных кальциевых каналов L-типа, обеспечивающих поступление ионов кальция (Са2+) в клетку. Высокая внутриклеточная концентрация Са2+ является необходимым условием развития сократительного ответа со стороны мышечной клетки. Закрывание кальциевых каналов способствует снижению концентрации свободного внутриклеточного Са2+ [29]. Эти процессы в совокупности запускают механизмы расслабления в гладкомышечных клетках, что в конечном итоге приводит к снижению тонуса кровеносных сосудов и артериального давления в целом (рис. 3).
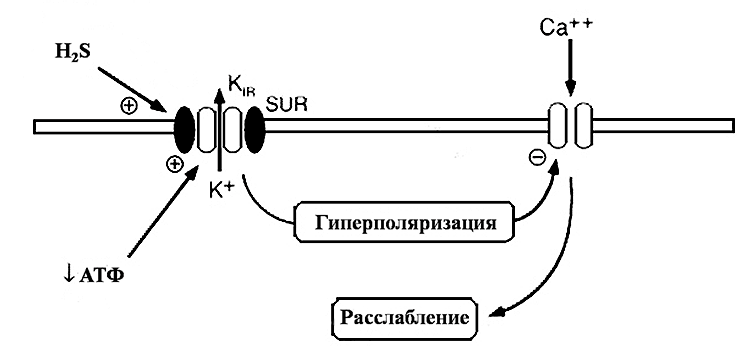
Рисунок 3. Влияние сероводорода на мембранные процессы. Сероводород, взаимодействуя с АТФ-чувствительными калиевыми каналами, вызывает их активацию и увеличение выхода ионов калия из клетки. Вследствие этого снижается мембранный потенциал на мембране (гиперполяризация) и инактивируются кальциевые каналы. В результате прекращения поступления в клетку ионов кальция происходит расслабление гладкомышечной клетки.
В регуляции релаксирующего действия сероводорода участвуют также и другие внутриклеточные молекулярные механизмы, однако их роль не столь выражена и однозначна [23].
В ряде исследований была отмечена интересная особенность сероводорода — его способность в низких концентрациях вызывать сокращение гладкомышечных клеток [1], [6], [15]. Согласно одной из гипотез сероводород связывается с хорошо известной эндотелиальной сигнальной молекулой оксидом азота, снижая тем самым его концентрацию [19], [25]. Снижение концентрации этих двух сосудорасслабляющих молекул является причиной увеличения тонуса сосудов артериального русла. Недавно было показано, что сократительный эффект сероводорода связан с активацией особого мембранного белка — Na+,K+,2Cl−-котранспортера (NKCC), обеспечивающего трансмембранный обмен ионов калия, натрия и хлора [3]. Перераспределение этих ионов является причиной развития сокращения.
Физиологическая роль сократительного эффекта сероводорода до конца не ясна: является ли он побочным продуктом каких-то внутриклеточных молекулярных реакций, или же несет на себе функциональную нагрузку? В первом случае увеличение тонуса сосудов может быть результатом взаимодействия сероводорода с активными формами кислорода, что приводит как к снижению концентрации самого сероводорода, так и образованию продуктов, способных вызывать сократительный ответ со стороны гладкомышечных клеток. Второй же случай предполагает специфическую активацию сероводородом ионных механизмов, направленных на развитие кратковременного локального спазма, например, в случае нарушения целостности сосудистой стенки [12].
В сердце сероводород снижает сократимость миокарда как в условиях in vitro, так и в условиях in vivo [9], [27]. Этот эффект также частично связан с активацией АТФ-чувствительных калиевых каналов мембран кардиомиоцитов [16]. В экспериментах по моделированию инфаркта миокарда у крыс было обнаружено, что концентрация сероводорода в миокарде и плазме крови таких крыс была на 60% ниже по сравнению с контрольной группой. При этом введение NaHS снижало уровень смертности среди крыс с инфарктом миокарда за счет уменьшения его сократимости и торможения некроза кардиомиоцитов [8].
Дальнейшие перспективы
Учитывая роль сероводорода в регуляции тонуса кровеносных сосудов, ученые всего мира активно взялись за разработку лекарственных средств, действие которых основывалось бы на повышении или понижении в крови концентрации этого газотрансмиттера. В настоящее время возможные молекулы-кандидаты на роль лекарственных соединений можно разделить на две группы: молекулы, которые, растворяясь, непосредственно высвобождают сероводород (NaHS, Na2S, GYY4137) и молекулы-предикторы эндогенного синтеза сероводорода (N-ацетилцистеин, L-цистеин) [7].
N-ацетилцистеин и L-цистеин — предшественники синтеза эндогенного H2S. Увеличение внутриклеточной концентрации этих молекул вызывает дополнительную активацию ферментов CSE и CBS и, следовательно, усиление синтеза H2S. Существенным преимуществом этих молекул является практически полное отсутствие побочных эффектов. Однако трудности, связанные с регулированием конечной концентрации образующегося H2S, вносят свои ограничения на использование N-ацетилцистеина и L-цистеина в клинической практике [26].
Возможные молекулы-претенденты на роль нового лекарственного вещества должны обладать рядом свойств. Во-первых, они должны быть хорошо растворимы в воде. Во-вторых, не должны оказывать токсического действия. В-третьих, не должны быстро метаболизироваться в организме. И в-четвертых, обладать пролонгированным действием, что возможно при достаточно медленном высвобождении сероводорода молекулой-донором в условиях in vivo.
В настоящее время в экспериментальной практике наиболее часто в качестве донора сероводорода используются гидросульфид натрия (NaHS) и сульфид натрия Na2S. Однако при растворении этих молекул происходит слишком быстрое высвобождение сероводорода, что в условиях in vivo вызывает резкое падение артериального давления, вплоть до сосудистого коллапса [16]. Процесс высвобождения сероводорода в этом случае трудно контролируется, что делает NaHS и Na2S непригодными для использования в терапевтических целях.
Недавно Ли с соавторами [14] получили из реактива Лавессона новую молекулу-донор сероводорода, которую они обозначили как GYY4137 (рис. 4). В отличие от гидросульфида натрия, GYY4137 высвобождает сероводород постепенно, что делает эту молекулу более перспективной для дальнейших фармакологических исследований. В моделях на крысах в условиях in vivo и in vitro исследователи установили, что GYY4137 обладает сосудо-расслабляющими свойствами и оказывает антигипертензивное действие.
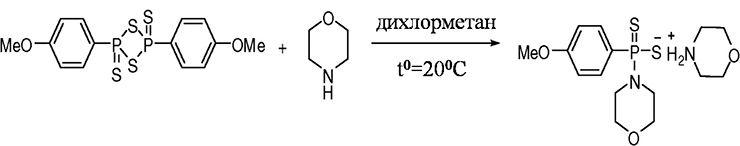
Рисунок 4. Схема синтеза GYY4137 из реактива Лавессона
Другим направлением в разработках «сероводородных» препаратов является встраивание сероводород-высвобождающих группировок в уже имеющиеся и широко используемые лекарственные молекулы. Альтернативные доноры сероводорода могут быть получены путем добавления сульфидных групп к нестероидным противовоспалительным препаратам. Например, S-диклофенак содержит тионовые группы, прикрепленные эфирными связями к молекуле-носителю, которые в растворе играют роль источника сероводорода [13]. Встраивание тиоловых группировок в молекулу силденафила приводит к развитию эффекта, связанного с существенной релаксацией гладкомышечных клеток кавернозных тел [7].
В последние годы большое внимание привлекли полисульфидные соединения чеснока. Были обнаружены их вазоактивные свойства: одно из соединений — диаллил дисульфид (DADS) — вызывало расслабление кольцевых сегментов аорты крысы. Полисульфидные соединения чеснока не только являются предшественниками H2S, но и способны самостоятельно вызывать изменения конформации молекул белков в клеточных мембранах.
Перспективной молекулой-донором сероводорода является получаемый из чеснока S-аллилцистеин, который обладает выраженным кардиопротекторным действием (рис. 5). Однако пока не до конца ясно, является ли он предшественником сероводорода или же модулирует функцию ферментов, связанных с синтезом последнего [26].
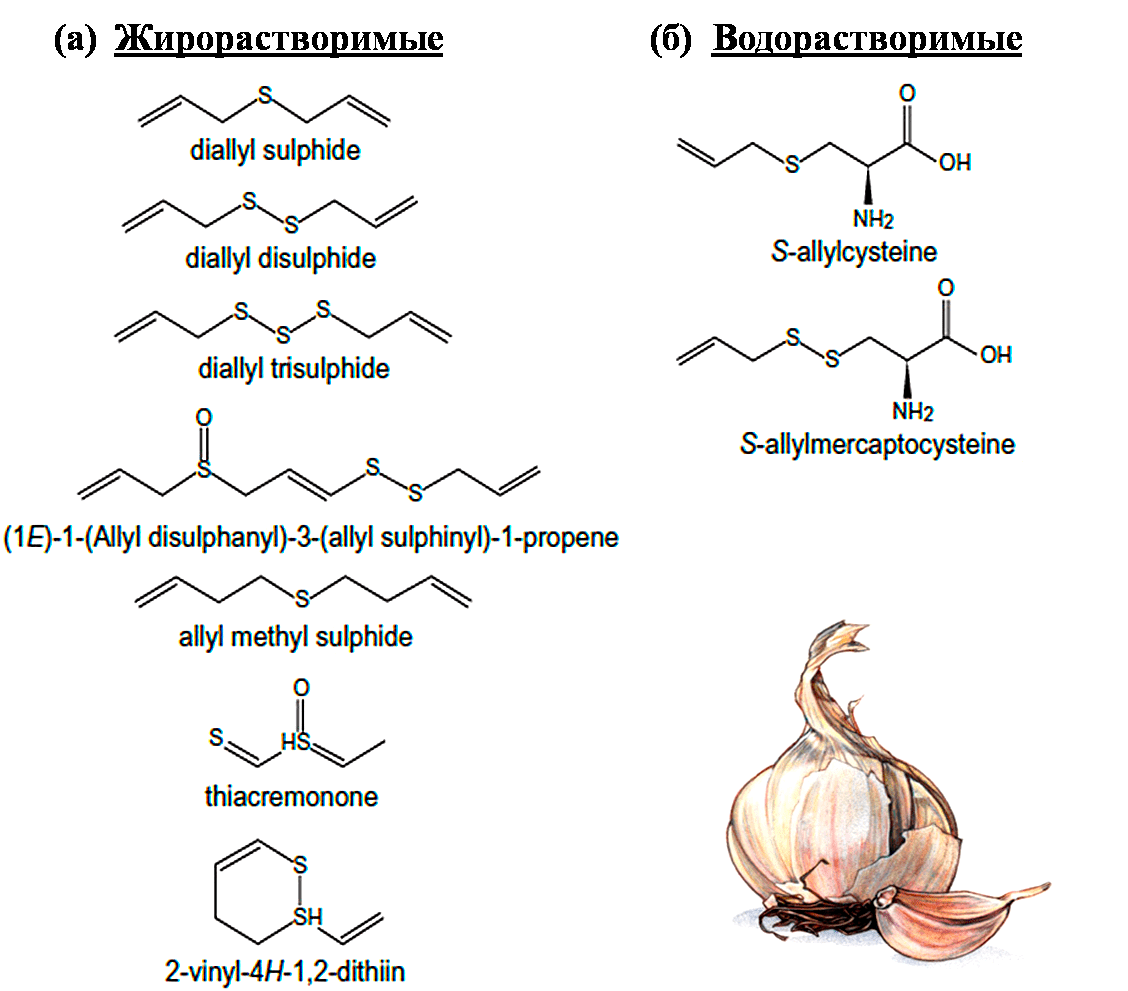
Рисунок 5. Серосодержащие соединения чеснока. Из чеснока получают два класса органических соединений серы: жирорастворимые (а) и водорастворимые (б) аллильные соединения серы, образующиеся из гликозида аллиина. Жирорастворимые аллильные соединения серы, такие как диаллил сульфид (DAS), диаллил дисульфид (DADS) и диаллил трисульфид (DATS) освобождаются из аллиина. Эта реакция катализируется ферментом аллииназой, который высвобождается при измельчении чеснока. Водорастворимые соединения серы (S-аллилцистеин (SAC) и S-аллилмеркаптоцистеин) получают при длительной инкубации дробленого чеснока в водных растворах.
С целью снижения патологически высокой концентрации сероводорода можно использовать ингибиторы ферментов его синтеза. К ним относится DL-пропаргилглицин, который, обладая высокими липофильными свойствами, легко проникает через мембрану клетки, не вызывая видимых ее повреждений. Однако DL-пропаргилглицин ингибирует не только CSE-фермент синтеза сероводорода в сердечнососудистой системе, но и CBS, что может стать причиной появления множества нежелательных побочных эффектов, связанных с нарушением регуляции функции других органов [26].
Таким образом, существующие в настоящее время наработки в области создания доноров сероводорода, пригодных для использования в терапевтических целях, находятся на ранней стадии своего развития и явно недостаточны. Разработка, синтез и описание свойств новых доноров сероводорода и селективных ингибиторов ферментов его эндогенного синтеза имеет чрезвычайно важное значение для создания новой группы лекарственных препаратов и, возможно, позволит продвинуться вперед в борьбе с сердечно-сосудистыми заболеваниями [5].
Литература
- Баскаков М.Б., Гусакова С.В., Желудева А.С., Смаглий Л.В. и др. (2010). Влияние сероводорода на сократительную активность гладкомышечных клеток аорты крысы. «Бюлл. сиб. мед.». 6, 12–17;
- Резник Н.Л. (2009). Третий газ. «Химия и жизнь». 10, 40–46;
- Смаглий Л.В. (2013). Роль Na+,K+,2Cl−-котранспорта в механизмах вазоконстрикторного действия сероводорода. «Современные проблемы науки и образования». 2;
- K Abe, H Kimura. (1996). The possible role of hydrogen sulfide as an endogenous neuromodulator. J. Neurosci.. 16, 1066-1071;
- Giuseppe Caliendo, Giuseppe Cirino, Vincenzo Santagada, John L. Wallace. (2010). Synthesis and Biological Effects of Hydrogen Sulfide (H2S): Development of H2S-Releasing Drugs as Pharmaceuticals. J. Med. Chem.. 53, 6275-6286;
- Roberta d'Emmanuele di Villa Bianca, Rosalinda Sorrentino, Ciro Coletta, Emma Mitidieri, Antonietta Rossi, et. al.. (2011). Hydrogen Sulfide-Induced Dual Vascular Effect Involves Arachidonic Acid Cascade in Rat Mesenteric Arterial Bed. J Pharmacol Exp Ther. 337, 59-64;
- David J Elsey, Robert C Fowkes, Gary F Baxter. (2010). Regulation of cardiovascular cell function by hydrogen sulfide (H2S). Cell Biochem. Funct.. 28, 95-106;
- Bin Geng, Lin Chang, Chunshui Pan, Yongfen Qi, Jing Zhao, et. al.. (2004). Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol. Biochemical and Biophysical Research Communications. 318, 756-763;
- Bin Geng, Jinghui Yang, Yongfen Qi, Jing Zhao, Yongzheng Pang, et. al.. (2004). H2S generated by heart in rat and its effects on cardiac function. Biochemical and Biophysical Research Communications. 313, 362-368;
- Guanghua Tang, Lingyun Wu, Wenbin Liang, Rui Wang. (2005). Direct Stimulation of KATP Channels by Exogenous and Endogenous Hydrogen Sulfide in Vascular Smooth Muscle Cells. Mol Pharmacol. 68, 1757-1764;
- P. Kamoun. (2004). Endogenous production of hydrogen sulfide in mammals. Amino Acids. 26;
- Madhav Lavu, Shashi Bhushan, David J. Lefer. (2011). Hydrogen sulfide-mediated cardioprotection: mechanisms and therapeutic potential. Clinical Science. 120, 219-229;
- Ling Li, Giuseppe Rossoni, Anna Sparatore, Lin Chiou Lee, Piero Del Soldato, Philip Keith Moore. (2007). Anti-inflammatory and gastrointestinal effects of a novel diclofenac derivative. Free Radical Biology and Medicine. 42, 706-719;
- Ling Li, Matthew Whiteman, Yan Yi Guan, Kay Li Neo, Yvonne Cheng, et. al.. (2008). Characterization of a Novel, Water-Soluble Hydrogen Sulfide–Releasing Molecule (GYY4137). Circulation. 117, 2351-2360;
- Jia Jia Lim, Yi-Hong Liu, Ester Sandar Win Khin, Jin-Song Bian. (2008). Vasoconstrictive effect of hydrogen sulfide involves downregulation of cAMP in vascular smooth muscle cells. American Journal of Physiology-Cell Physiology. 295, C1261-C1270;
- Lowicka E., Beltowski J. (2007). Hydrogen sulfide — the third gas of interest for pharmacologists. Pharmacol. Reports. 59, 4–24;
- J. C. Mathai, A. Missner, P. Kugler, S. M. Saparov, M. L. Zeidel, et. al.. (2009). No facilitator required for membrane transport of hydrogen sulfide. Proceedings of the National Academy of Sciences. 106, 16633-16638;
- N. Shibuya, Y. Mikami, Y. Kimura, N. Nagahara, H. Kimura. (2009). Vascular Endothelium Expresses 3-Mercaptopyruvate Sulfurtransferase and Produces Hydrogen Sulfide. Journal of Biochemistry. 146, 623-626;
- Nini Skovgaard, Anja Gouliaev, Mathilde Aalling, Ulf Simonsen. (2011). The Role of Endogenous H2S in Cardiovascular Physiology. CPB. 12, 1385-1393;
- Smith R.P. (2010). A short history of hydrogen sulfide. American Scientist. 98, 6;
- M H Stipanuk, P W Beck. (1982). Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat. Biochemical Journal. 206, 267-277;
- Wagner C.A. (2009). Hydrogen sulfide: a new gaseous signal molecula and blood pressure regulator. J. Nephrol. 22, 173–176;
- RUI WANG. (2002). Two’s company, three’s a crowd: can H2S be the third endogenous gaseous transmitter?. The FASEB Journal. 16, 1792-1798;
- Warenycia M.W., Steele J.A., Karpinski E., Reiffenstein R.J. (1989). Hydrogen sulfide in combination with taurine or cysteic acid reversibly abolishes sodium currents in neuroblastoma cells. Neurotoxicology. 10, 191–199;
- George D. Webb, Lay Har Lim, Vernon M. S. Oh, Soh Bee Yeo, Yoke Ping Cheong, et. al.. (2008). Contractile and Vasorelaxant Effects of Hydrogen Sulfide and Its Biosynthesis in the Human Internal Mammary Artery. J Pharmacol Exp Ther. 324, 876-882;
- Wei Guo, Ze-yu Cheng, Yi-zhun Zhu. (2013). Hydrogen sulfide and translational medicine. Acta Pharmacol Sin. 34, 1284-1291;
- Xu M., Wu Y.-M., Li Q. et al. (2007). Electrophysiological effects of hydrogen sulfide on guinea pig papillary muscles in vitro. Acta Physiol. Sinica. 59, 215–220;
- Weimin Zhao, Rui Wang. (2002). H2S-induced vasorelaxation and underlying cellular and molecular mechanisms. American Journal of Physiology-Heart and Circulatory Physiology. 283, H474-H480;
- W. Zhao. (2001). The vasorelaxant effect of H2S as a novel endogenous gaseous KATP channel opener. The EMBO Journal. 20, 6008-6016.