
Рак молочной железы с семейной историей
28 сентября 2014
Рак молочной железы с семейной историей
- 4909
- 0
- 7
История о том, как мировой секс-символ познакомилась со словами BRCA1 и CHEK2. В коллаже использована схема участия белков BRCA в репарации ДНК.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Результат генетического тестирования здоровой женщины может прозвучать как смертный приговор. Но внимательный индивидуализированный подход врача к пациентке с наследственным раком молочной железы способен помочь в выборе верной стратегии. Имеет ли смысл удаление груди — или лучше, понадеявшись, что «пронесет», ждать болезнь?
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
«Решение сделать мастэктомию далось нелегко. Но я счастлива. Теперь риск рака молочной железы у меня ниже 5%», — сказала Анжелина Джоли, сообщив об уже проведенной подкожной мастэктомии с одновременным протезированием. На радикальную профилактику РМЖ актриса, активный общественный деятель и мать шестерых детей согласилась, узнав о мутации в гене BRCA1, из-за которой риск возникновения РМЖ врачи оценили почти в 90% (рис. 1).
Профилактическая мастэктомия — один из наиболее эффективных и дискуссионных способов предупреждения рака груди. Хотя распространенность наследственного рака невысока (10–15% от всех случаев РМЖ), шанс заболеть у женщин-носительниц предполагаемых мутаций повышается — вплоть до почти 100% вероятности в некоторых случаях. Роковые цифры рассчитывают для каждой пациентки индивидуально.
И если с помощью профилактической мастэктомии риск наследственного РМЖ удается снизить на 95%, это является значимым аргументом в пользу операции. Хотя достоверно оценить пользу для конкретной пациентки очень сложно, в масштабе всего мира ученые оценивают превентивную мастэктомию положительно. К тому же женщинам сейчас можно меньше волноваться из-за эстетической стороны вопроса: реконструктивные операции стали широко доступны. Импланты вставляют незамедлительно после удаления молочной железы — это так называемая подкожная мастэктомия с одновременным протезированием. Однако возникает и новая проблема: у небольшой части женщин, вместо серьезного взвешивания «за» и «против» операции, на первый план выходит соблазн подправить форму/размер груди даже при относительно маленьком риске развития рака.
Рисунок 1. Анджелина Джоли на премьере фильма «Малефисента» (2014)
Число женщин, выбирающих превентивную мастэктомию, увеличивается с каждым годом. В Англии, по данным NHS (национальной системы здравоохранения), операцию на здоровых железах в 2002 году провела 71 пациентка, а в 2011 — уже 255 [1].
Частота подобной операции больше всего растет в США: как сообщил Доктор Келли Хант на ежегодной конференции американского общества клинической онкологии (ASCO), в 2010 году в Anderson Cancer Center (Хьюстон, США) здоровые железы удалили 8% пациенток, в 2011 году — 12,6%, в 2012 — уже 14,1% [2]. Что же это: массовая истерия или разумный выход из положения?
Отеческая забота
Первое зафиксированное хирургическое вмешательство при РМЖ связано, как часто бывает, с древними греками: врач Леонид советовал выжигать грудь раскаленной кочергой до грудной клетки. Практика «постоперационного» ухода за пережившей это пациенткой началась еще на сотню лет позже. В эпоху Ренессанса всё, что могли сделать хирурги, — это отрезать грудь как можно скорее и, желательно, неожиданнее. «По факту, хирурги появлялись в доме женщины без предупреждения, — пишет Кристина Ларонга в историческом обзоре The changing face of mastectomy: an oncologic and cosmetic perspective. — Несколько мужчин, сопровождавших хирурга, держали женщину на ее же кухонном столе, позволяя доктору выполнить необходимую процедуру...» [3].
Первая профилактическая мастэктомия была проведена еще в 1917 году, и ее необходимость обосновывали парадоксально: «страх получить увечье заставляет женщину избегать как диагностики, так и лечения, позволяя заболеванию прогрессировать...» [4]. Едва ли не насильственную превентивную мастэктомию можно объяснить, наверное, отеческой заботой, говорит не без сарказма Франсуа Айзингер из французского института Паоли-Кальметте в этико-историческом обзоре по РМЖ [5].
В наше время уровень безопасности и качество помощи при мастэктомии несоизмеримо возросли, и сейчас женщины нередко сами настаивают на операции, несмотря на то, что заболевание должно проявиться только через десятилетия. Цель профилактической (превентивной) мастэктомии — это снижение риска РМЖ, то есть именно заболевания, а не его исхода. Айзингер пишет, что при выборе превентивной мастэктомии обеспокоенность женщин по поводу лучевой и химиотерапии идет не на последнем месте. «Я не боюсь второго рака, но я не хочу заново проходить химиотерапию», — так пациентки с мутациями в BRCA1 объясняют свой интерес к проведению контралатеральной мастэктомии при локализации опухоли в одной груди.
ДНК под микроскопом
Развитие наследственного рака напрямую связано с двумя процессами — насколько оперативно клетка замечает повреждение генома и как она его чинит. На настоящий момент «опасных» генов уже выделено более 40, а мутации в них обуславливают около 14% заболеваний РМЖ. На BRCA1 и BRCA2, например, приходится 2,5% всех случаев рака груди. Помимо BRCA, среди так называемых генов восприимчивости к РМЖ с высокой пенетрантностью — то есть, с наибольшими шансами развития опухоли среди носителей мутации — есть еще p53, PTEN, STK11/LKB1 и CDH1. К умеренно-пенетрантным, то есть связанным с меньшим риском возникновения РМЖ, относятся, например, ATM, CHECK2, BRIP1 и PALB2. Около 70% случаев наследственного РМЖ соотносят с аллелями низкопенетрантных генов или с неизвестными генетическими факторами. Граница разделения пока не очень четкая, хотя все-таки считается, что мутации в высокопенетрантных генах увеличивают риск РМЖ в 5–20 раз, в низкопенетрантных генах — максимум в 1,5 раза [6].
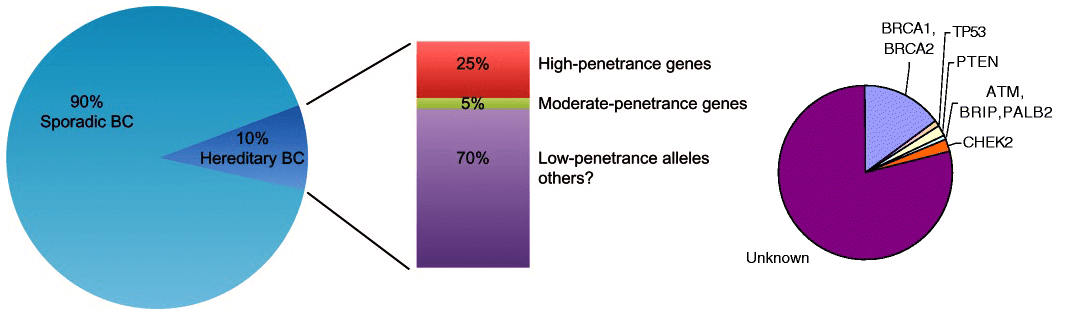
Рисунок 2. Генетическая структура рака молочной железы. Слева: Генетическая предрасположенность к развитию рака груди составляет около 10–15% от всех случаев РМЖ, причем высокопенетрантные гены ответственны примерно за четверть опухолей, передающихся по наследству. Справа: Соотношение основных генов, мутации в которых задействованы в развитии наследственного РМЖ: среди известных генов BRCA1 и 2 занимают лидирующую позицию.
Высокопенетрантные гены
Еще в начале 90-х годов BRCA1 и BRCA2 были идентифицированы как гены предрасположенности к раку молочной железы и раку яичников. Они находятся в длинных плечах 17-й и 13-й хромосом и имеют 24 и 27 экзонов соответственно, причем мутации чаще всего встречаются в самом крупном — одиннадцатом экзоне. Ортологи BRCA1 и BRCA2 определены и у других млекопитающих; всего в генах BRCA зарегистрировано свыше 2000 (!) различных мутаций, среди которых есть и делеции, и вставки, и замена одиночных нуклеотидов.
Ген BRCA1 кодирует ядерный белок, который участвует в восстановлении двухнитевых разрывов ДНК (double-strand breaks, DSB), транскрипции, регуляции гомологичной рекомбинации (процесса обмена двух одинаковых или идентичных молекул ДНК нуклеотидными последовательностями, чаще всего именно при DSB), контроле митотических чекпойнтов (система, следящая за состоянием клетки, которая может «запретить» ее дальнейшее деление, если что-то идет не так — например, при вероятности ракового перерождения; если же этот контроль ослабевает или выключается, то клетка с поломкой продолжает делиться, и через какое-то количество делений получается опухоль). Совместно с другими супрессорами опухолей, сенсорами повреждения ДНК и прочими молекулами он образует сложный комплекс из множества субъединиц — BRCA1-associated genome surveillance complex, контролирующий стабильность генома. Регуляция транскрипции происходит через взаимодействие домена BRCT с гистондеацетилазами — белками, которые с помощью удаления ацетильных групп с гистонов увеличивают плотность упаковки ДНК и тем самым снижают скорость транскрипции генов.
Помимо рака молочной железы, мутации в гене BRCA1 проявляются при раке яичников, причем оба типа опухолей развиваются в более раннем возрасте, чем при ненаследственном РМЖ. BRCA1-ассоциированные опухоли в целом связаны с неблагоприятным прогнозом для пациентки, поскольку чаще всего относятся к трижды негативному РМЖ. Этот подтип назван так из-за отсутствия в клетках опухоли экспрессии сразу трёх генов — HER2, рецепторов эстрогенов и прогестерона, поэтому и лечение, основанное на взаимодействии лекарств с этими рецепторами, невозможно.
Ген BRCA2 также вовлечен в процессы репарации ДНК и поддержание стабильности генома, — отчасти вместе с комплексом BRCA1, отчасти через взаимодействие с другими молекулами (например, белком RAD51). «Отличительными чертами мутаций BRCA2 являются более частое возникновение рака молочной железы у мужчин и больший риск развития молочно-яичникового синдрома», — пишут Е.М. Бит-Сава и М.Б. Белогурова в обзорной статье по наследственному раку молочной железы [7].
Наиболее распространены мутации в BRCA1/2 у евреев Ашкенази. Мутации, характерные для определенных сообществ и географических групп, описаны также и для жителей нашей страны. Так, в России мутации BRCA1 представлены в основном пятью вариациями, 80% из которых — 5382insC. Мутации генов BRCA1 и BRCA2 приводят к хромосомной нестабильности и злокачественной трансформации клеток молочной железы, яичников и других органов. Кумулятивный риск рака молочной железы и яичников у всех женщин с мутацией BRCA1/BRCA2 на протяжении всей жизни оценивается как минимум в 60–80% (средний суммарный риск — 65% для BRCA1 и 45% для BRCA2). Однако, обращают внимание ученые, едва ли не большинство случаев семейного РМЖ и рака яичников невозможно объяснить уже изученными мутациями, поэтому биологи изучают возможные вариации в других генах, контролирующих клеточный цикл.
Один из наиболее известных генов, на активность которого влияют белки BRCA1, — это специфический регулятор транскрипции TP53 (tumor protein 53 из 17p13.1). Им кодируется «страж генома» — белок p53, не дающий сосудам прорастать в «горячую точку» — опухоль — и участвующий в процессах апоптоза и репарации ДНК. Количество различных мутаций оценивается примерно в полторы тысячи; влияние этого гена на развитие РМЖ отмечено в 20–35% случаев. Например, мутации в этом гене вызывают синдром Ли-Фраумени — довольно редкое заболевание с высокой ранней смертностью, характеризующееся возникновением множественных опухолей.
PTEN (phosphatase and tensin homologue) кодирует фермент, среди субстратов которого — фосфатидилинозитол-3-фосфаты, важнейшие передатчики сигнала по пути PI3K/AKT/mTOR, который вовлечён в развитие опухоли. После «общения» с ферментом белки теряют свою активность (за счет чего и осуществляется антиопухолевое действие), поэтому PTEN называют негативным регулятором этого сигнального пути. При появлении в гене мутаций риск развития новообразований повышается — например, риск РМЖ увеличивается на 4%. И именно этому гену приписывают «заслугу» в развитии болезни Коудена (синдром множественных доброкачественных узловых образований — гамартом).
CDH1 кодирует Е-кадгерин — молекулу, обеспечивающую межклеточную адгезию, т.е. скрепление клеток между собой. Ученые используют Е-кадгерин и эстрогеновый рецептор (ER, рецептор основной группы «женских» гормонов) в клинической практике как первичные маркеры одного из типов РМЖ — люминального эпителиального рака. У женщин с мутацией в CDH1 риск развития РМЖ повышен на 39–52%, а пониженная экспрессия Е-кадгерина связана с большим количеством метастазов и худшим прогнозом. Это в общем-то предсказуемо — чем хуже соединены клетки друг с другом, тем легче они распространяются по организму. Зародышевые мутации CDH1 также связывают с развитием диффузной желудочной карциномы и раком прямой кишки.
К активно изучаемым генам с высокой пенетрантностью относятся и STK11/LKB1 (он кодирует белок, который участвует в регуляции клеточного цикла, поддержании полярности клеток — что особенно важно при метастазировании — и может менять активность других белков), PALB2 (образует мостик-связку между белками BRCA1 и BRCA2, и, соответственно, помогает синхронизировать их работу при репарации ДНК), комплекс MRE11A/RAD50/NBN (благодаря им, клетка «узнает» о разрывах хромосом и активирует в ответ на это «спасательную бригаду» других белков).
Гены с умеренной и низкой пенетрантностью
Большинство умеренно- и низкопенетрантных генов напрямую взаимодействует с BRCA1 (например, BARD1, ABRAXAS, BRIP1, BABAM1), следовательно, их поломки мешают ему нормально выполнять свою работу.
Ген CHEK2 кодирует белок под названием «чекпоинт-киназа 2», который может взаимодействовать с p53 и BRCA1. CHEK2 не дает клетке делиться дальше, если ее геном поврежден, — клеточный цикл останавливается на стадии G1.
Белок, кодируемый геном ATM, выполняет множество функций, связанных с ответом на повреждение и с репарацией ДНК, в том числе в сигнальных путях, включающих TP53, BRCA1 и CHEK2.
RAD51 и его паралоги (т.е. гены, появившиеся в результате дупликаций RAD51 внутри генома) — это ключевые медиаторы гомологической рекомбинации. Самые важные с «онкологической» точки зрения — это RAD51C и RAD51D, которые взаимодействуют с BRCA2.
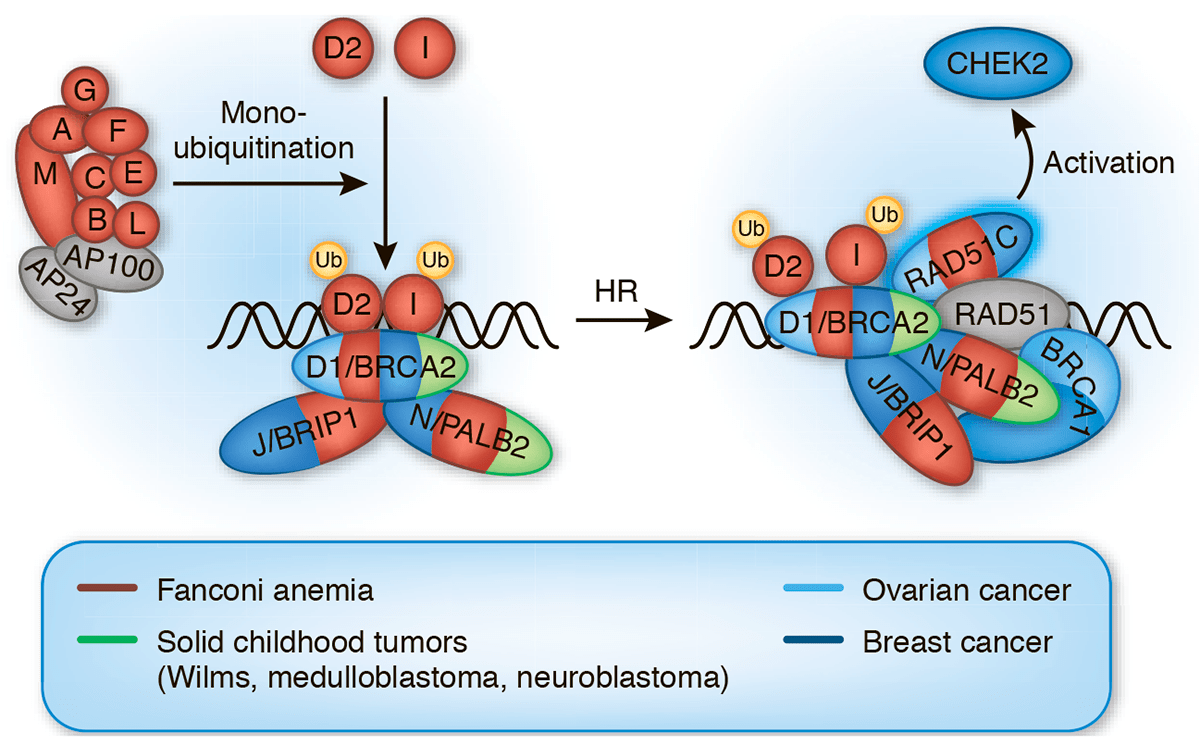
Рисунок 3. Белковый комплекс репарации ДНК. На заключительном этапе — гомологической рекомбинации — требуются Rad51 и RAD51C и их взаимодействие с BRCA1 и BRCA2. RAD51C также активирует CHEK2. Окраска белков соотносится в мутациями в соответствующих генах, отвечающих за развитие заболевания: анемия Фанкони (красный), детские солидные опухоли (зеленый), РМЖ (темно-синий), рак яичников (светло-голубой). Ub — убиквитин.
«Семена и почва»
Поскольку до 90% смертей от рака вызваны не первичной опухолью, а ее метастазами, то наиболее интересная тема научной дискуссии — это изучение активности генов в метастазах. Пока корреляция между наследственными факторами, агрессивностью опухоли и ее способностью к метастазированию не подтверждена: исследований конкретно этой связи практически нет, но это не значит, что связь отсутствует. К примеру, в некоторых работах установлено, что риск метастазирования увеличивается при наличии, например, полиморфизмов в генах Rrp1b и SIPA1, а также и гомо- или гетерозиготности по ним [8].
Остаются невыясненными многие факторы, приводящие к «расселению» рака, и связанные с ними сигнальные каскады. Сейчас существуют несколько теоретических моделей — например, модель Ноувелла (Nowell) и модель Вейсса (Weiss); также изучается роль стволовых клеток. Кажется невероятным, но, всего лишь посмотрев на геном опухолевой клетки, возможно предсказать ее склонность к метастазированию и локализацию будущих метастазов. К примеру, если раковые клетки гиперэкспрессируют один набор генов (CXCR4, PLHLP, IL11, MMP1 и OPN), то они обладают способностью образовывать метастазы в костной ткани, если другой (COX, EREG, ANGPTL4) — то в легких, а если третий (ST6GALNAC5, COX2, HBEGF, ANGPTL4) — то в нервной системе [9]. Если не знать результатов изучения генной экспрессии, то можно подумать, что ученые изобрели магический шар с провидческой функцией.
Изучение метастатических ниш в будущем может указать не только на орган, но и на месторасположение будущего метастаза в этом органе, уверены исследователи.
Профилактика РМЖ
«...Ка-кой там дурак любит за характер!?! ... Кому нужна одногрудая?! ... Да как же я на пляж пойду?!» — так А. Солженицын в романе «Раковый корпус» описывает переживания Аси, у которой врачи обнаружили рак груди. Действительно, несмотря на возможности современной реконструктивной хирургии, утрату женственности, связанную с мастэктомией, врачи и сейчас относят едва ли не к основным психологическим проблемам пациентки. Здоровые женщины, у которых нашли наследственные мутации, находятся под дамокловым мечом психологического и эмоционального стресса — поддержка необходима не только им, но и их родственникам. «Я не хочу делать ничего кардинального с моим телом», «Я хочу завести детей, двух или трех подряд, и потом удалю это все к черту», «Вы чувствуете себя так, будто только что диагностирован рак, хотя этого и не было», — вот как комментируют женщины результаты генетического тестирования.
Превентивный подход предусматривает несколько альтернатив [10]:
- самостоятельное обнаружение уже появившегося рака на ранней стадии (регулярные маммографические и МРТ обследования, самообследование груди на предмет опухоли);
- двухсторонняя радикальная мастэктомия;
- профилактическая овариэктомия / сальпинго-овариэктомия — удаление яичников/яичников и матки;
- химиопрофилактика (пока что все еще находится в процессе разработки и изучения).
Значимо выигрывают, к сожалению, только те, кто прошел через удаление и молочных желез, и яичников. Ученые считают, что если психологический гнет для женщины слишком силен, у нее уже есть дети и ее не устраивает длительный прием препаратов, то радикальные операции могут быть оптимальным решением — ведь после них пациентка может вести более-менее нормальную жизнь.
Например, профилактическая сальпинго-овариэктомия в зависимости от возраста пациентки может снизить вероятность возникновения рака от 60% до 90%: на 75–96% рака яичников и фаллопиевых труб и примерно на 50% — риск РМЖ, если ее провели до менопаузы [11]. Однако принимая во внимание предпочтения и качество жизни женщин, удаление яичников рекомендуют делать лишь после 40 лет, и если угроза жизни действительно высока.
National Cancer Institute советует лекарственную терапию женщинам с «промежуточными» рисками; все еще не критические, но высокие по сравнению с общей популяцией. Правда, для пациенток именно с мутациями в генах BRCA1/2 достоверных данных на этот счет еще не получено.
Пиар и пустоцвет
Список генов, связанных с развитием опухоли и метастазированием, значительно расширен. Найдены новые взаимодействия белков, уточнены сигнальные пути и механизмы защиты нормального функционирования ДНК, внесены свежие данные по возникновению ракового перерождения. Новые технологии секвенирования помогут сделать еще не одно открытие и создать новые пути применение генетики для продления и спасения жизней.
«Ищите информацию и медицинских экспертов, — именно так закончила свое публичное выступление Джоли, которая сейчас, по заявлениям в прессе, готовится к овариэктомии. — В жизни много препятствий. Но нас не должны пугать те, в которых мы можем что-то контролировать».
Не все оценивают действия Джоли позитивно: есть мнение, что в ее случае мастэктомия и публичные выступления — это пиар. Не давая оценку действиям Джоли, ученые и врачи констатируют: уровень знаний о наследственном РМЖ необходимо поднимать, а хороший шанс сделать это не был использован должным образом. «Из 2500 американцев более 75% знают об истории Джоли, — пишут исследователи в Genetics in Medicine [12]. — Но менее 10% опрошенных могут ответить на вопросы о наследственном РМЖ и генетических рисках».
Литература
- Jenny Neuburger, Fiona MacNeill, Ranjeet Jeevan, Jan H P van der Meulen, David A Cromwell. (2013). Trends in the use of bilateral mastectomy in England from 2002 to 2011: retrospective analysis of hospital episode statistics. BMJ Open. 3, e003179;
- Gilbert A. (2013). Why more women are choosing double mastectomies. CNN;
- Christine Laronga, Jaime D. Lewis, Paul D. Smith. (2012). The Changing Face of Mastectomy: An Oncologic and Cosmetic Perspective. Cancer Control. 19, 286-294;
- N Jacobson. (1998). The socially constructed breast: breast implants and the medical construction of need.. Am J Public Health. 88, 1254-1261;
- François Eisinger, Claire Roussel, Jean-François Morère, Jérôme Viguier. (2011). Cancer screening. European Journal of Cancer Prevention. 20, S42-S44;
- Lorenzo Melchor, Javier Benítez. (2013). The complex genetic landscape of familial breast cancer. Hum Genet. 132, 845-863;
- Бит-сава Е.М. и Белогурова М.Б. (2013). Наследственный рак молочной железы. «Сибирский онкологический журнал». 1, 75-81;
- Szu-Min Hsieh, Maxime P Look, Anieta M Sieuwerts, John A Foekens, Kent W Hunter. (2009). Distinct inherited metastasis susceptibility exists for different breast cancer subtypes: a prognosis study. Breast Cancer Res. 11;
- Nuria Ribelles, Angela Santonja, Bella Pajares, Casilda Llácer, Emilio Alba. (2014). The seed and soil hypothesis revisited: Current state of knowledge of inherited genes on prognosis in breast cancer. Cancer Treatment Reviews. 40, 293-299;
- Wylie Burke. (1997). Recommendations for Follow-up Care of Individuals With an Inherited Predisposition to Cancer. JAMA. 277, 997;
- Amy Finch, Gareth Evans, Steven A Narod. (2012). BRCA Carriers, Prophylactic Salpingo-Oophorectomy and Menopause: Clinical Management Considerations and Recommendations. Womens Health (Lond Engl). 8, 543-555;
- Dina L.G. Borzekowski, Yue Guan, Katherine C. Smith, Lori H. Erby, Debra L. Roter. (2014). The Angelina effect: immediate reach, grasp, and impact of going public. Genet Med. 16, 516-521;
- Laura Ottini, Piera Rizzolo, Valentina Silvestri, M Falchetti. (2011). Inherited and acquired alterations in development of breast cancer. TACG. 145;
- Petra van der Groep, Elsken van der Wall, Paul J. van Diest. (2011). Pathology of hereditary breast cancer. Cell Oncol.. 34, 71-88;
- Ephrat Levy-Lahad. (2010). Fanconi anemia and breast cancer susceptibility meet again. Nat Genet. 42, 368-369;
- Alfons Meindl, Nina Ditsch, Karin Kast, Kerstin Rhiem, Rita K. Schmutzler. (2011). Hereditary Breast and Ovarian Cancer. Deutsches Aerzteblatt Online;
- Seth M. Dever, E. Railey White, Matthew C.T. Hartman, Kristoffer Valerie. (2012). BRCA1-directed, enhanced and aberrant homologous recombination. Cell Cycle. 11, 687-694;
- Thomas Helleday. (2011). The underlying mechanism for the PARP and BRCA synthetic lethality: Clearing up the misunderstandings. Molecular Oncology. 5, 387-393;
- Terri Jabaley Leonarczyk, Barbara E. Mawn. (2015). Cancer Risk Management Decision Making for BRCA+ Women. West J Nurs Res. 37, 66-84.







