
ДНК стволовых клеток крови повреждается при выходе из состояния покоя
30 марта 2015
ДНК стволовых клеток крови повреждается при выходе из состояния покоя
- 1448
- 0
- 5
Гемопоэтическая стволовая клетка.
рисунок с сайта компании Pharmacells
-
Автор
-
Редактор
Ученые установили связь между стресс-индуцируемым гемопоэзом, возникновением повреждений ДНК в стволовых клетках крови, истощением их запаса и нарушениями в их функционировании. Оказывается, если в организме постоянно возникают инфекции или травмы, то постепенно в ДНК стволовых клеток крови накапливаются повреждения. Они приводят к истощению запасов стволовых клеток и, следовательно, к «старению» кроветворной системы. А в случае, если в системах репарации повреждений ДНК есть дефекты (как, например, при редком заболевании — анемии Фанкони), то истощение запаса стволовых клеток наступает гораздо быстрее.
Существует много разновидностей клеток крови (рис. 1). Каждый вид выполняет важные функции, но живут клетки крови сравнительно недолго: например, эритроциты живут около 120 дней, а лейкоциты — до нескольких месяцев. Для того чтобы постоянно пополнять запас выбывающих из строя бойцов, нужны кроветворные (их называют еще гемопоэтическими) стволовые клетки (ГСК). Популяция ГСК достаточно разнородна: клетки могут находиться на разных стадиях дифференцировки, то есть быть разной степени зрелости, могут обладать разным временем жизни, разной — краткосрочной и долгосрочной — регенеративной активностью, разными профилями экспрессии генов и разными эпигенетическими программами дальнейшей дифференцировки. В связи с этим среди стволовых кроветворных клеток особенно выделяют тип клеток с долгосрочной регенеративной активностью (ДР-ГСК), то есть способных воспроизводить популяцию клеток крови на протяжении всей жизни организма [1].
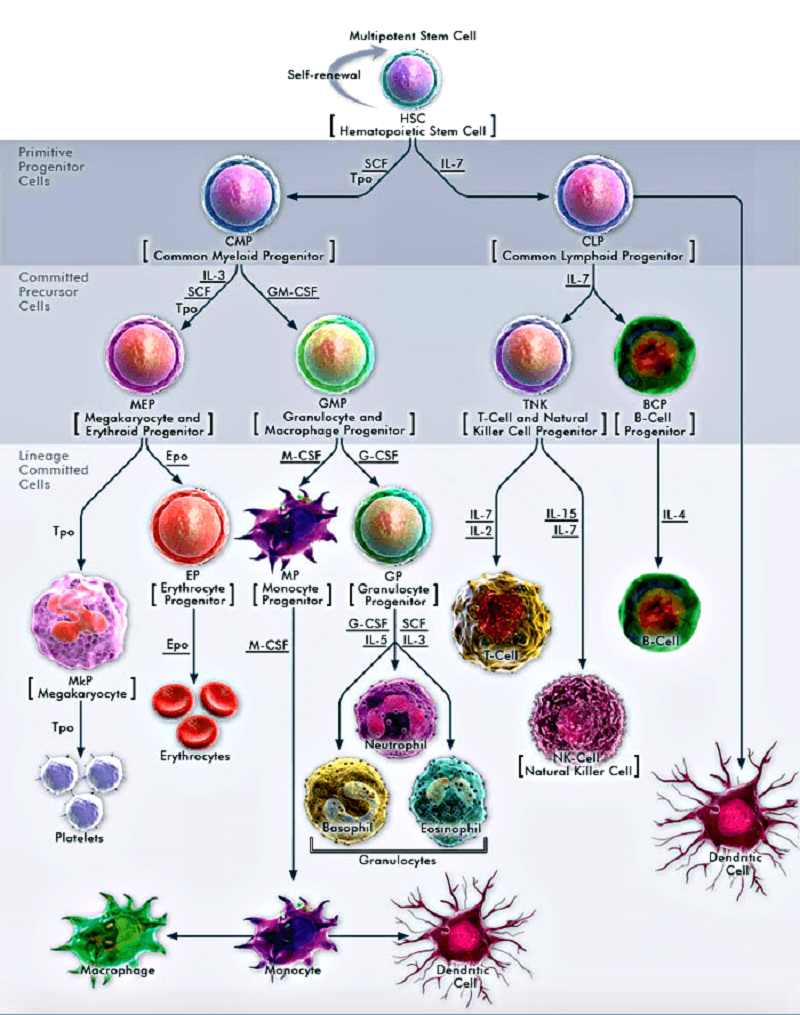
Рисунок 1. Разнообразие клеток крови и их происхождение от общего предшественника — гемопоэтической стволовой клетки. Из нее образуются более зрелые, но всё еще способные к дифференцировке миелоидные и лимфоидные предшественники. Миелоидные клетки, постепенно дифференцируясь, дают начало тромбоцитам, эритроцитам, моноцитам (а с ними — макрофагам и миелоидным дендритным клеткам), эозинофилам, нейтрофилам, базофилам. Лимфоидные клетки порождают естественных киллеров, Т-клетки, В-клетки и плазмоцитоидные дендритные клетки.
рисунок с сайта eBioscience
В норме ГСК, как ценное сокровище, спрятаны в костном мозге, внутри твердых костей. Они покоятся в особых нишах, в нежной соединительной ткани, богатой сосудами [2]. Такая серьезная защищенность ГСК от воздействия внешних факторов неслучайна: спонтанное повреждение ДНК этих клеток может привести к онкологическим заболеваниям или попросту к истощению запаса клеток крови — постепенному старению кроветворной системы и даже острому дефициту клеток (цитопении).
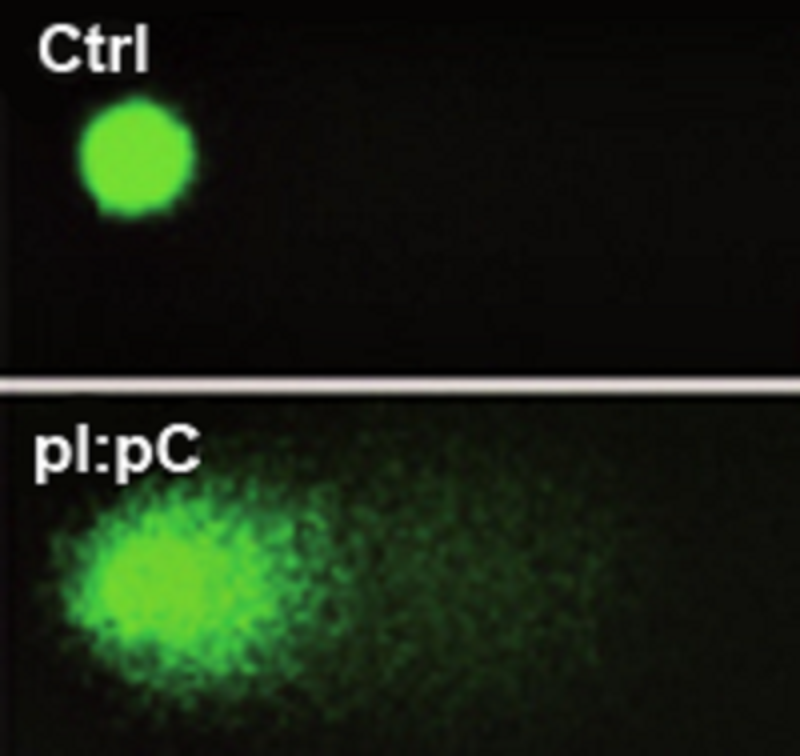
Рисунок 2. Обнаружение двунитевых разрывов в активированных ДР-ГСК. Вверху — неповрежденное ядро контрольной клетки, не прошедшей стресс-индуцируемую активацию. Внизу — ядро активированной клетки, окруженное «хвостом» из кусочков поврежденной ДНК.
Немецкие исследователи под руководством Майкла Мильсома и их коллеги из Швейцарии, Австралии и США выяснили, что повреждение ДНК гемопоэтических стволовых клеток крови случается во время активной стимуляции этих клеток к выходу из состояния покоя [3]. Активация ДР-ГСК может стимулироваться спектром вырабатывающихся организмом веществ, которые напрямую не приводят к повреждению ДНК: интерферонами, гранулоцитарно-макрофагальным колониестимулирующим фактором, тромбопоэтином. Толчком к активации ДР-ГСК может стать и острая потеря крови. В своих экспериментах ученые имитировали заражение организма вирусной инфекцией, вводя мышам смесь полиинозиновых-полицитидиновых кислот для стимуляции выброса интерферонов: ведь известно, что интерфероны выделяются клетками организма именно в ответ на вторжение вируса. Затем ДР-ГСК извлекали, помещали в агарозный гель, лизировали и проводили электрофорез (такое исследование называется «метод ДНК-комет»). Отрицательно заряженная ДНК при приложении напряжения направляется к положительно заряженному электроду. Если ДНК повреждена, ее кусочки отрываются от ядра и под действием электрического тока образуют в геле так называемый «хвост кометы» (рис. 2). Именно так ученые обнаружили множество одно- и двунитевых разрывов ДНК в извлеченных стволовых клетках. О повреждениях ДНК свидетельствовало также появление в ДР-ГСК промежуточных белков и модификаций гистонов, необходимых для процесса репарации ДНК, то есть починки ее поломок.
Пожалуй, один из самых неприятных результатов разрывов ДНК — это последующая ковалентная сшивка двух ее цепей. РНК-полимераза во время транскрипции и ДНК-полимераза во время репликации не могут преодолеть такие структуры, а для их репарации необходима так называемая система репарации анемии Фанкони.
Анемия Фанкони — редкое наследственное заболевание, для которого характерно появление опухолей и злокачественной анемии. Известно, что анемия Фанкони возникает из-за дефектов в генах белков, отвечающих за репарацию ДНК. К ним относятся 15 белков группы FANC и еще два белка системы репарации RAD51C и XPF [4].
Большинство типов репарации ДНК не обходится без участия белков системы репарации Фанкони. Однако если часть репарационного пути вышла из строя, то починка повреждений осуществляется с помощью других систем репарации. И только ковалентные сшивки между цепями ДНК не поддаются починке в отсутствие белков системы репарации Фанкони [5].
И действительно, ученые заметили повышенный уровень экспрессии генов FANС и обнаружили скопления этих белков в клетках ДР-ГСК во время их стресс-индуцируемой активации. Кроме того, у мышей, которым была внесена делеция в ген белка FANCA (Fanca −/−) и, соответственно, нарушения структуры ДНК не могли быть ликвидированы, количество повреждений было существенно выше, чем в клетках животных с нормальной системой репарации.
На самом деле причина возникновения повреждений ДНК при стрессовой активации ДР-ГСК точно не известна. Зато известно, что одной из причин возникновения ковалентных сшивок двух соседних нуклеотидов в ДНК являются активные формы кислорода [6]. Свободные радикалы, которые образуются в митохондриях, способны «сшивать» структурные единицы белков, жиров и ДНК [7]. Существует даже теория, в рамках которой считается, что активные формы кислорода именно за счет внесения сшивок в молекулы провоцируют образование морщин [8] и другие формы старения организма [9]. Так или иначе, ученые обнаружили, что в активно пролиферирующих ДР-ГСК митохондриальный мембранный потенциал повышается по сравнению с клетками в состоянии покоя, а это может приводить к значительному увеличению количества активных форм кислорода.
При активации ДР-ГСК с поврежденной системой репарации не в живом организме, а в чашке Петри, ученые наблюдали быструю гибель уже второго поколения стволовых клеток. Также выяснилось, что если активация ДР-ГСК клеток происходит неоднократно, то почти у 80% мышей Fanca −/− наступает апластическая анемия, в то время как у мышей с нормальной системой репарации заболевание не возникает. Таким образом, без действующей системы репарации запасы ДР-ГСК костного мозга истощаются. Более того, ДР-ГСК здоровых мышей после стимуляции их делений имели сниженную способность к трансплантации и производили неполноценные миелоидные клетки в организме мышей-реципиентов.
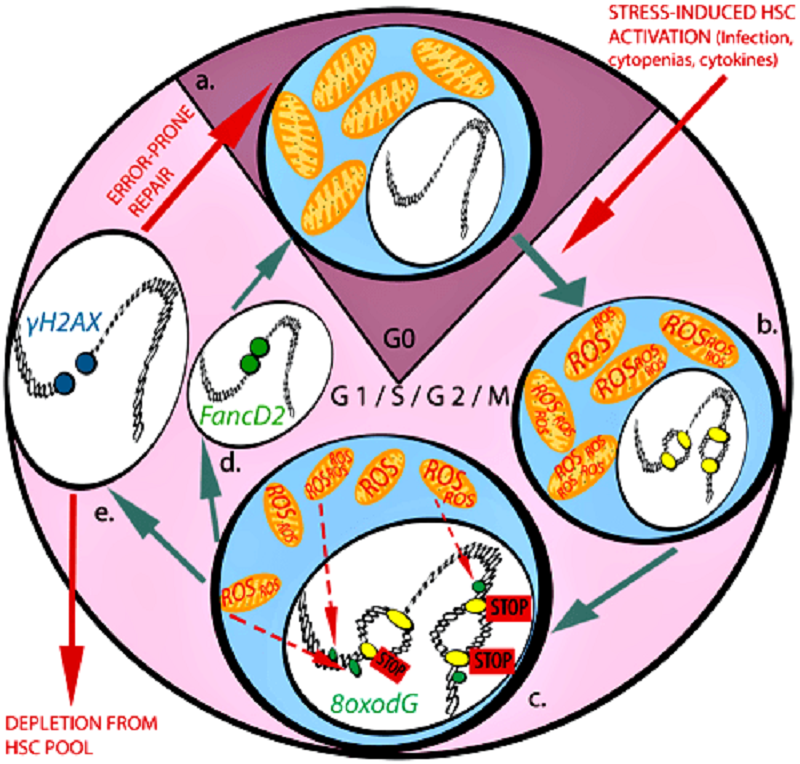
Рисунок 3. Белки репарационного пути Фанкони и их участие в репарации повреждений ДНК. Киназа ATR активирует белки репарации FANCI, FANCD2, FANCA и, возможно, FANCG. Ферменты USP1 и UAF1 удаляют убиквитин с белков FANCD2 и FANCI, подавляя репарацию. Деградация белка FANCM происходит после его фосфорилирования в период митоза с помощью киназы Plk1 и последующего убиквитинилирования [10], [11]. FANCE деградирует после фосфорилирования киназой Chk1.
В результате, ученые предложили следующую модель (рис. 3). Когда ДР-ГСК находятся в состоянии покоя и делятся редко, их энергетические запросы невелики. Поэтому митохондрии работают в обычном режиме, и образования активных форм кислорода не происходит. При инфекционных заболеваниях или потере крови пул клеток крови пополняется за счет активации ДР-ГСК. В этот момент в клетках усиливаются окислительные процессы, образуются свободные радикалы, которые могут приводить к повреждениям ДНК [12]. Сама ДНК в этот период тоже находится в уязвимом состоянии из-за активных процессов репликации (удвоения ДНК, предшествующего делению клетки). Если репарация повреждений ДНК неэффективна, то клетки погибают. Или выживают, но несут мутации. В здоровом организме каждый раунд стресс-индуцируемой активации приводит к гибели/старению/накоплению мутаций в небольшом количестве ДР-ГСК. Однако на протяжении всей жизни подобная активация клеток случается многократно. Это может привести к тому, что запас ДР-ГСК истощится, и они больше не смогут эффективно производить новые клетки крови. А если системы репарации работают плохо (речь идет в основном о белках Фанкони), то пул ДР-ГСК истощается стремительно, что ведет к старению кроветворной системы и ее неспособности выполнять свои функции.
Литература
- Kirschstein R. Stem cells: scientific progress and future research directions. Bethesda: National Institutes of Health, 2001. — 220 p.;
- Афанасьев Ю.И., Юрина Н.А., Котовский Е.Ф. Гистология. — 5-е изд., перераб. и доп. — М.: Медицина, 2002. — 744 с.;
- Dagmar Walter, Amelie Lier, Anja Geiselhart, Frederic B. Thalheimer, Sina Huntscha, et. al.. (2015). Exit from dormancy provokes DNA-damage-induced attrition in haematopoietic stem cells. Nature. 520, 549-552;
- Moustacchi E. (2003). Fanconi’s Anemia. Orpha.net Encyclopedia;https://www.orpha.net/en/disease/detail/84;
- George-Lucian Moldovan, Alan D. D'Andrea. (2009). How the Fanconi Anemia Pathway Guards the Genome. Annu. Rev. Genet.. 43, 223-249;
- Yinsheng Wang. (2008). Bulky DNA Lesions Induced by Reactive Oxygen Species. Chem. Res. Toxicol.. 21, 276-281;
- Conor Crean, Nicholas E. Geacintov, Vladimir Shafirovich. (2008). Intrastrand G-U cross-links generated by the oxidation of guanine in 5′-d(GCU) and 5′-r(GCU). Free Radical Biology and Medicine. 45, 1125-1134;
- HERVÉ PAGEON, DANIEL ASSELINEAU. (2005). An in Vitro Approach to the Chronological Aging of Skin by Glycation of the Collagen: The Biological Effect of Glycation on the Reconstructed Skin Model. Annals of the New York Academy of Sciences. 1043, 529-532;
- Elaine Dzierzak, Nancy A Speck. (2008). Of lineage and legacy: the development of mammalian hematopoietic stem cells. Nat Immunol. 9, 129-136;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Miral Dizdaroglu, Pawel Jaruga. (2012). Mechanisms of free radical-induced damage to DNA. Free Radical Research. 46, 382-419.





