
Разоблачитель белков-убийц
26 апреля 2015
Разоблачитель белков-убийц
- 3203
- 2
- 5
Стэнли Бенджамин Прузинер. Родился 28 мая 1942 г. в Де-Мойне, Айова, США. Лауреат Нобелевской премии по физиологии и медицине 1997 года.
Рисунок в полном размере.
-
Автор
-
Редакторы
В истории науки часто одно открытие может растянуться на десятки лет. И почти каждая Нобелевская премия имеет такую предысторию, растянувшуюся на многие годы. Наш случай — именно из таких. Ведь, казалось бы, к середине XX века были известны все виды инфекционных агентов — вирусы, бактерии, грибы, простейшие... Но природа оказалась богаче. И скрытнее: причину некоторых странных и очень страшных заболеваний искали более полувека. За раскрытие этой тайны Стэнли Прузинер в 1997 г. удостоился Нобелевской премии, а возбудитель болезни — упоминания в формулировке Нобелевского комитета: «за открытие прионов, нового биологического принципа инфекции».
История Нобелевской премии 1997 года началась, пожалуй, еще до рождения самого лауреата, за 77 лет до вручения. В 1920 году немецкий нейрофизиолог Ганс Герхард Крейцфельдт (правильнее — Кройцфельдт) (рис. 1, слева) описал весьма необычное заболевание: расстройства поведения и зрения, нарушение координации движений, эпилептические припадки и, как следствие, смерть. Годом позже его соотечественник и коллега, невропатолог Альфонс Мария Якоб (рис. 1, справа) не просто описал симптоматику, но и связал ее с поражениями рогов спинного мозга и пирамидной системы. Так мир узнал о губчатой энцефалопатии, она же — болезнь Крейцфельдта-Якоба (БКЯ), она же — человеческая ипостась коровьего бешенства.

Рисунок 1. Немецкие невропатологи Ганс Крейцфельдт (1885–1964) и Альфонс Якоб (1884–1931). Описали трансмиссивную губчатую энцефалопатию, позже названную болезнью Крейцфельдта-Якоба. Сейчас выделяют несколько ее форм, различающихся происхождением: классическую (возникает спонтанно, 85% всех случаев БКЯ), наследственную (возникают мутации в гене PRNP человеческого прионного белка, 10–15% случаев) и новый вариант (знаменитое коровье бешенство, которым заражаются при поедании прионсодержащей говядины). Ранее встречалась ятрогенная БКЯ, когда патогенных прионов распространяли в процессе медицинских манипуляций или в составе препаратов из тканей и биологических жидкостей животных/человека.

Рисунок 2. Даниель Карлтон Гайдушек (1923–2008). Установил инфекционную природу «болезни каннибалов» — куру. Лауреат Нобелевской премии по физиологии и медицине 1976 года «за открытия, касающиеся новых механизмов происхождения и распространения инфекционных заболеваний». Премию получил совместно с Барухом Бламбергом, открывшим вирус гепатита B и разработавшим соответствующие диагностический тест и вакцину (об австралийском антигене все слышали? Названием он обязан тоже аборигенам — Бламберг его выделил из крови коренного жителя Австралии).
Понимание того, что подобные заболевания носят инфекционную природу, пришло более чем 30 лет спустя. В 1957 году американский вирусолог словако-венгерского происхождения Карлтон Гайдушек (рис. 2) продолжил работы окружного австралийского врача Винсента Зигаса, который с 1953 года изучал странное заболевание, поражавшее коренное население Папуа — Новой Гвинеи. Тогда эта территория находилась под австралийским управлением. Аборигены племени форе называли это странное состояние «куру».
Cлово «куру» переводится как «тряска, дрожь» или «порча». Другое название болезни — «смеющаяся смерть» — целиком на совести газетчиков. Конечно, иногда она сопровождается дерганием головы и странной «сардонической» улыбкой, но всё-таки главный симптом — дрожь, а потом уж и смерть — максимум через год.
Распространялась болезнь весьма страшным способом — через ритуальный каннибализм. Человек ел мозг инфицированного или заболевшего куру (не специально выбирая, конечно) и заражался сам. Потом, когда каннибализм удалось искоренить, исчезла и болезнь. Хотя вспышки наблюдались еще в течение 30 лет: инкубационный период у болезни куру рекордный — до полувека.
Гайдушеку удалось экспериментально установить инфекционный характер заболевания [1], однако он сам считал, что куру (и БКЯ, инфекционную природу которой установил он же) вызывается некими «медленными вирусами». Ведь он был вирусологом. Тем не менее, в 1976 году именно за это открытие он получил Нобелевскую премию (вместе с исследователем гепатита В Барухом Бламбергом). Кстати, «премиальные» Гайдушек пожертвовал племени форе.
Следующий шаг сделали британцы — радиолог Тивах Альпер и математик Джон Стенли Гриффит — в 1960-х годах. Они независимо друг от друга предположили [2], [3], что загадочный болезнетворный агент слишком мал для вирусов — уж очень велика доза ионизирующего излучения, необходимая для того, чтобы уничтожить половину инфекционных частиц (чем меньше размер объекта, тем меньше вероятность попадания в него заряженной частицы, значит, нужно больше частиц). Вывод напрашивался сам собой: если не вирусы, то... белки́. Кстати, потом эту теорию высоко оценил Френсис Крик.
И вот тут настал черёд выхода на сцену нашего героя — Стэнли Прузинера.
Надо сказать, что Стэнли — очередной нобелиат с российскими корнями. В 1896 году его дед по отцовской линии, Беня Прузинер (Пружинер), эмигрировал в США из Москвы. Как писал сам ученый в автобиографии, опубликованной на сайте Нобелевского комитета [4], его жизнь нетипична для американца: родился на Среднем Западе, учился на Востоке, а живет на классическом Западе. Свое имя он получил в честь брата отца, умершего в возрасте 24 лет от лимфомы Ходжкина. Его отец был военным моряком, прошедшим Вторую мировую войну и потом участвовавшим в испытании первой американской водородной бомбы.
Средняя школа Walnut Hills запомнилась Прузинеру исключительно пятилетним курсом латыни (которая, по его словам, потом сильно помогла писать научные статьи), а так показалась скучной. Другое дело — Университет Пенсильвании. Вот тут было много интересных курсов, великих ученых и замечательных умных студентов. Кстати, как отмечает сам лауреат, в Пенне он прошел и первоклассный курс истории России.
Бакалавриат Прузинер закончил по химии, но потом остался в местном меде, где изучал сначала гипотермию, а затем — флюоресценцию жировой ткани сирийских хомячков (!). Интернатуру он проходил уже в Калифорнийском университете, параллельно продолжая карьеру в знаменитом Национальном институте здоровья (NIH), где он изучал ферменты глутаминазы бактерии E. coli под руководством Эрла Стадтмана. Устраиваясь в институт, он долго колебался — сможет ли, однако привилегии, которые давал NIH, перевесили. Результат трех лет работы сам Прузинер описывает коротко: выжил.
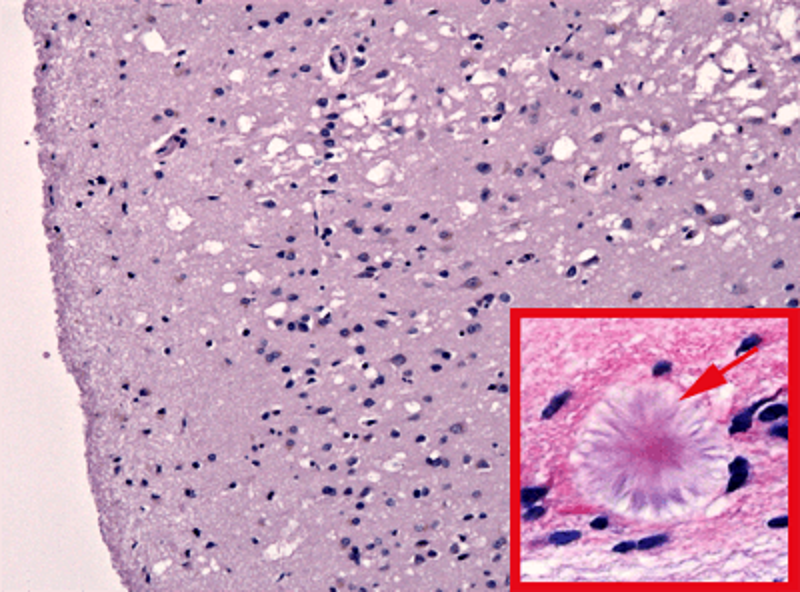
Рисунок 3. Структура нервной ткани при губчатой энцефалопатии. На гистологическом срезе ткани мозга заметна «губчатость» — грубая вакуолизация цитоплазмы нейронов («пустоты»). В зависимости от формы заболевания наблюдают разное количество агрегатов прионного белка — амилоидных бляшек (отмечена стрелкой), повреждающих нервную ткань. Массово гибнут нейроны, вакуолизируются и «разбухают» астроциты.
Наш герой впервые столкнулся с якобы «медленным вирусом» в 1972 году, когда приступил к работе в отделении неврологии Калифорнийского университета (Сан-Франциско). Всего через два месяца после начала работы у него умерла пациентка — от необратимых повреждений мозга (рис. 3), вызванных болезнью Крейцфельдта-Якоба. Именно тогда он узнал, что ученые до сих пор не уверены, что эту болезнь вызывают именно вирусы. И честолюбивый молодой врач решил, что открытие молекулярной структуры возбудителя CJD — такой английской аббревиатурой обозначается в литературе БКЯ — станет хорошим началом самостоятельной научной карьеры.
Два года работы с литературой дали Прузинеру понять: это будет непросто. Тем не менее, он открыл свою лабораторию в 1974 году, хотя для поддержки работ по изучению БКЯ ему пришлось писать заявки на гранты по глутаматному метаболизму. «Скучно, но у меня был опыт», — пишет Прузинер.
В итоге первая статья о выделении нового агента — белка-приона — вышла только в 1982 году [5]. Собственно говоря, именно Прузинер и является автором термина «прион». Это название — «склейка» двух английских слов: proteinaceous infection (белковая инфекция). Статья вызвала настоящую бурю — медицина вообще консервативна, но предположить, чтобы заболевания передавались белками? Далеко не все приняли эту концепцию. Собственно говоря, Гайдушек так и не признал открытие Прузинера до своей смерти в 2008 году. Тем не менее, наука развивалась.
Через некоторое время стало понятно, что прионы — это не новая форма жизни, а собственные белки человека, ставшие патогенными из-за изменения конформации . Оно может быть вызвано разными причинами — от внешних воздействий до генетических изменений. Десять лет спустя Прузинер выпустил солидный итоговый труд — «Молекулярную биологию прионных болезней» [6]. Ну а еще через шесть лет пришла долгожданная Нобелевская премия. Мы же в заключении рассказа приведем две важные цитаты из выступления Прузинера на банкете после вручения премии [7].
Так называемые конформационные болезни связаны с трансформацией α-спиральных участков белковой молекулы в ригидные β-листовые с последующей агрегацией и полимеризацией таких молекул в токсичные для клеток амилоидные сфероиды и фибриллы (внутриклеточные депозиты, «бляшки») [8]. Список белков, способных формировать амилоидные агрегаты, постепенно расширяется. Наиболее известны: β—амилоид и тау-белок (болезнь Альцгеймера), прионный белок БКЯ, α-синуклеин (болезнь Паркинсона), хантингтин (болезнь Хантингтона), β2-микроглобулин (диализный амилоидоз). Амилоидозы развиваются медленно, часто десятилетиями.
Амилоидозы делятся на неинфекционные («возрастные» нейродегенеративные заболевания) и инфекционные — трансмиссивные спонгиоформные (губчатые) энцефалопатии — прионные болезни куру, БКЯ, скрэпи (почесуха) овец и др. Прионными являются и такие наследственные заболевания, как синдром Герстманна-Штраусслера-Шейнкера и фатальная семейная бессонница человека.
Возбудитель прионных болезней — это мутантная (инфекционная) форма обычного, особенно активно синтезируемого в нервной ткани, прионного белка млекопитающих — PrPc (верхний индекс «с» — cellular, клеточный). Переход PrPc в патологическую форму (PrPsc, «sc» — от скрэпи) — склонную к β-агрегации, устойчивую к протеазам и физическим факторам, «заразную» — возникает или спонтанно, или при контакте с PrPsc [9]. Но контактировать должны белки с очень сходной аминокислотной последовательностью (!), поэтому случаи межвидового заражения нечасты.
Что служит провоцирующим фактором превращения нормальных белков, выполняющих какие-то базовые и важные функции (возможно, связанные с клеточным циклом, врожденным иммунитетом [10]) в патогенные — пока не известно (кроме располагающих мутаций в их генах, конечно). Предполагается, что «инфекционность» прионных и иных амилодных белков проявляется только в «содружестве» с другими молекулами: модуляторами конверсии нормальных белков в патогенные могут выступать специфические нуклеиновые кислоты и гликозаминогликаны [11]. Сродство это предлагается использовать и в терапевтических целях.
Вообще, белки, склонные к β-агрегации, встречаются не только у млекопитающих, их эволюционные корни уходят очень глубоко. Относительно недавно амилоидные агрегаты обнаружили у дрожжей, однако особых цитотоксических свойств они не проявляли.
Куда интереснее оказалось обнаружение прионоподобных свойств у белка-инициатора репликации бактериальных плазмид. Домен белка RepA, претерпевающий соответствующие конформационные перестройки при контакте с двухцепочечной ДНК в origin репликации, был назван прионоид. Этот домен (особенно содержащий единственную аминокислотную замену) способен вызывать передающуюся только «вертикально» амилоидную протеинопатию у E. coli и уже без контакта с ДНК инициировать агрегацию молекул гомологичного белка в растворе in vitro [12]. Судя по всему, такие конформационные перестройки лежат в основе регуляции копийности плазмид [13], а это уж совсем древний и базовый процесс. Но всех ведь интересует, чем ещё помимо микробиологических и эволюционных «маленьких прозрений» полезны эти исследования? Дело в том, что разработанная авторами [12] система — самая простая и безопасная модель для изучения первичных процессов, запускающих прионные и прочие нейродегенеративные заболевания: исключается куча эукариотических «помех», легко экспериментировать с любыми «переключателями» конформаций и т.д.
Так что наступление на конформационные болезни ведется по всем фронтам, правда, успехи пока довольно скромные. — Ред.
Люди часто спрашивают меня, почему я упорствовал в исследовании столь спорного предмета. Я обычно отвечаю, что всего лишь нескольким ученым выпала великая удача изучать темы, столь новые и необычные, что только небольшое число людей может осознать значение таких открытий с самого начала. Я — один из тех по-настоящему везучих ученых, которому представилась особая возможность работать над такой проблемой — проблемой прионов
Быть ученым — особая привилегия, дающая возможность быть творческим, страстно искать ответы на самые сокровенные тайны природы и иметь теплые дружеские отношения со многими коллегами. Сотрудничество наше простирается далеко за пределы научных успехов; не важно, насколько велики достижения — крепкая дружба, у которой нет национальных границ, ценится еще больше
Литература
- D. C. GAJDUSEK, C. J. GIBBS, M. ALPERS. (1966). Experimental Transmission of a Kuru-like Syndrome to Chimpanzees. Nature. 209, 794-796;
- TIKVAH ALPER, W. A. CRAMP, D. A. HAIG, M. C. CLARKE. (1967). Does the Agent of Scrapie Replicate without Nucleic Acid ?. Nature. 214, 764-766;
- J. S. GRIFFITH. (1967). Nature of the Scrapie Agent: Self-replication and Scrapie. Nature. 215, 1043-1044;
- Биография С.Б. Прузинера на сайте Нобелевского комитета;
- Stanley B. Prusiner. (1982). Novel Proteinaceous Infectious Particles Cause Scrapie. Science. 216, 136-144;
- Stanley B. Prusiner. (1991). Molecular Biology of Prion Diseases. Science. 252, 1515-1522;
- Речь С.Б. Прузинера на нобелевском банкете (1997).;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Прионы: исследования таинственных молекул продолжаются;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Jerson L. Silva, Tuane C.R.G. Vieira, Mariana P.B. Gomes, Luciana P. Rangel, Sandra M.N. Scapin, Yraima Cordeiro. (2011). Experimental approaches to the interaction of the prion protein with nucleic acids and glycosaminoglycans: Modulators of the pathogenic conversion. Methods. 53, 306-317;
- Rafael Giraldo, Susana Moreno-Díaz de la Espina, M. Elena Fernández-Tresguerres, Fátima Gasset-Rosa. (2011). RepA-WH1prionoid. Prion. 5, 60-64;
- Eva Torreira, María Moreno-del Álamo, Maria Eugenia Fuentes-Perez, Cristina Fernández, Jaime Martín-Benito, et. al.. (2015). Amyloidogenesis of Bacterial Prionoid RepA-WH1 Recapitulates Dimer to Monomer Transitions of RepA in DNA Replication Initiation. Structure. 23, 183-189.






