Опухолевые разговоры, или Роль микроокружения в развитии рака
16 октября 2015
Опухолевые разговоры, или Роль микроокружения в развитии рака
- 7112
- 2
- 16
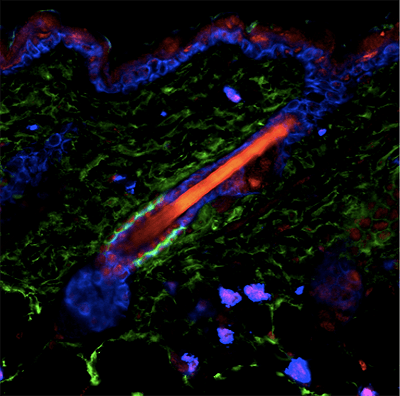
Ниша волосяного фолликула. Стволовые клетки волосяного фолликула окрашены зеленым. Красным окрашены ядра с фосфорилированным Smad1, транскрипционным эффектором сигнального пути морфогенетического белка кости BMP. Ядра клеток кожи (кератин 5) окрашены синим.
-
Автор
-
Редакторы
Клетки многоклеточного организма существуют не сами по себе, а в создаваемом ими самими тканевом окружении, подобно людям, являющимся элементами общества. Клеточная микросреда не только играет важнейшую роль в поддержании функционирования клетки, но и сама активно на него влияет. Реципрокные динамические взаимодействия между клеткой и ее окружением играют решающую роль в развитии онкологических заболеваний, ставших бичом нашего времени. Развитие современных технологий лабораторного изучения клеток и их микроокружения позволяет отследить эти процессы в беспрецедентных деталях и даже смоделировать в лаборатории микросреду по своему желанию.
«Хеликон»
Написание и размещение этой статьи оплачено ООО «Компания Хеликон», специализирующейся на комплексном оснащении биологических лабораторий и поставке решений на основе микрофлюидики. «Хеликон» никак не влиял на содержание этой статьи.
Жизнь на Земле начиналась с простейших организмов, состоящих из одной клетки, которой приходилось быть самостоятельной и самодостаточной. Однако со временем начали появляться и более сложные существа. Клетки в них уже различались внешне и отвечали за разные функции организма, хотя все еще могли быть не разнесены в пространстве. Что же касается современных многоклеточных организмов — тут уже не скроешь высокую сложность их устройства и сотни типов клеток, образующих ткани, складывающие все тело: от носа до кончика хвоста. И здесь клетки должны работать особенно слаженно.
Для этой цели в ходе эволюции выработалась система «общения» между клетками, похожая на нашу речь, только вместо слов в ней используются молекулы. Так, клетки могут «общаться» и с дальними соседями (как это происходит в гормональной системе), и со своим ближайшим окружением — микросредой. Среди важных примеров такого взаимодействия — появление дифференцированных клеток из клетки-предшественницы — например, стволовой клетки (СК). Стоит только вспомнить схему гемопоэза (рис. 1): из одной мультипотентной (способной дать начало целой родословной) клетки в результате многостадийного процесса под влиянием различных сигналов появляются и разнообразнейшие варианты иммунных клеток, и форменные элементы крови.
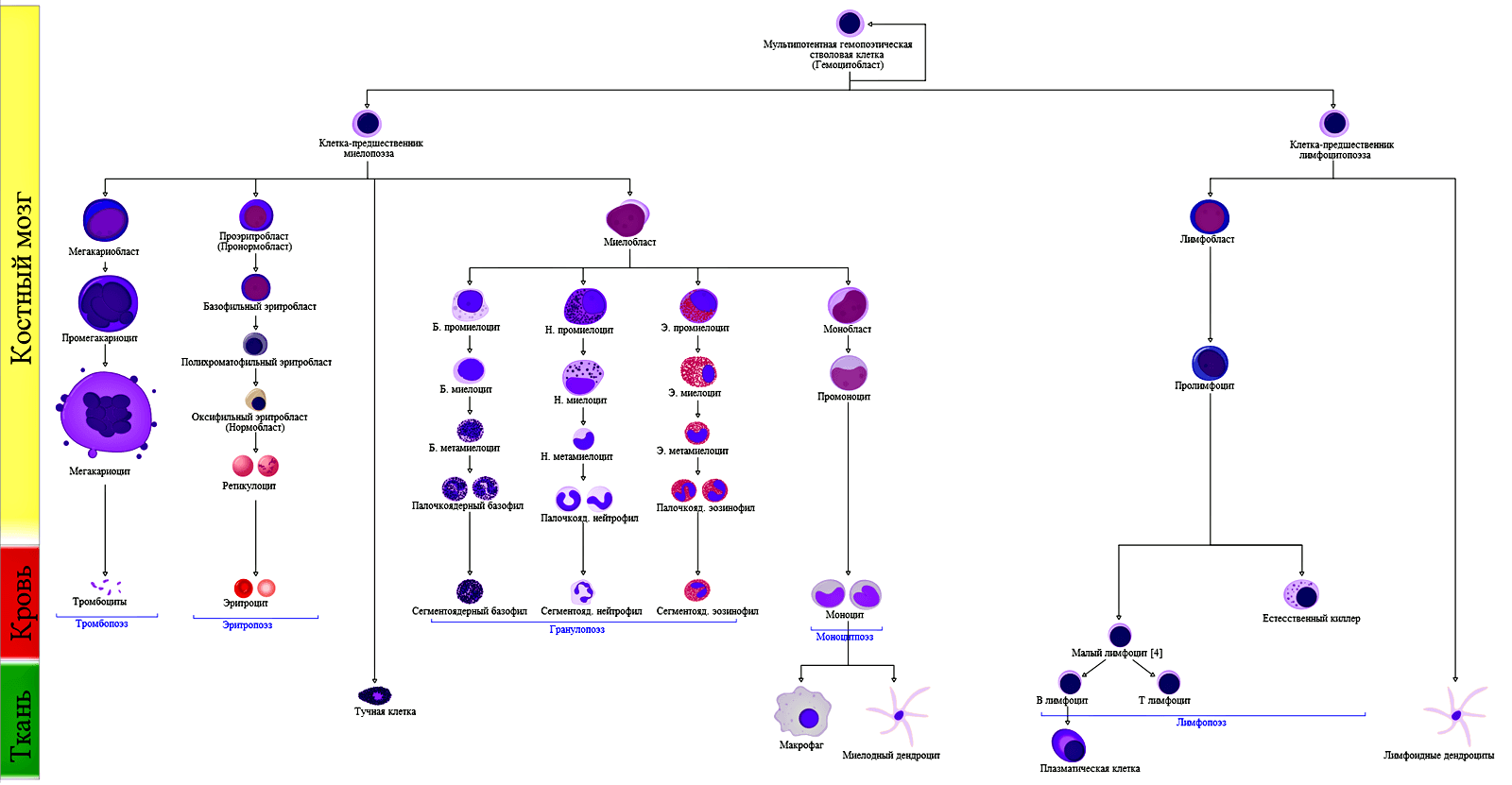
Рисунок 1. Постэмбриональный гемопоэз у человека: гемопоэтическая СК костного мозга дает начало миелопоэзу и лимфопоэзу. Чтобы посмотреть рисунок в полном размере, нажмите на него.
Специализированную физиологическую микросреду, в которой находится СК, называют тканевой нишей. Она поддерживает основные характеристики, отличающие стволовую клетку от всех остальных: плюрипотентность и способность самообновляться [1]. Начнет ли клетка делиться либо останется в покоящемся состоянии, тоже во многом зависит от среды вокруг нее [2], [3].
Однако сложные структуры присущи не только здоровому организму. Нездоровое микроокружение — например, избыток активных форм кислорода и воспалительная реакция — может спровоцировать появление рака [4]. Многие секретируемые в опухолях молекулы участвуют и в «нормальной» передаче сигнала — например, в сигнальных путях Wnt, Notch, Hedgehog, PI3K и JAK-STAT. Появившиеся новообразования тоже очень гетерогенны и «общаются» со своей микросредой. В них присутствуют раковые стволовые клетки (РСК) и клетки с приобретенными «стволовыми» свойствами (рис. 2), которые продолжают делиться и способствуют разрастанию очага болезни. Поскольку противоопухолевые препараты изначально нацелены на определенную субпопуляцию клеток , лечению иногда не под силу полностью справиться с заболеванием. Клетки, устойчивые к лечению, называют резистентными.
Если природа иногда очень неуместно наделяет клетки «стволовыми» свойствами, то человек старается сделать это целенаправленно — не просто индуцировать плюрипотентность у подходящих типов клеток, но учесть все возможные последствия такого перепрограммирования: «Была клетка простая, стала стволовая» [5], «Снежный ком проблем с плюрипотентностью» [6], «В поисках клеток для ИПСК — шаг за шагом к медицине будущего» [7]. — Ред.
О том, как удалось с помощью молекулярного штрихкодирования проследить за судьбой разных субпопуляций (в частности, уличить строителей суррогатной сосудистой сети, по которой другие субпопуляции распространяются по организму), рассказывает статья «Обнаружены организаторы побега раковых клеток из первичного очага» [8]. Вообще, на «Биомолекуле» «раковое» направление довольно развито — можно найти и фундаментальные материалы, и статьи, посвященные разработке новых терапевтических подходов: «Страшней клешней на свете нет...» [9], «Вероятность возникновения рака зависит от количества делений стволовых клеток» [10], «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [11], «Рак молочной железы с семейной историей» [12], «Ударивший гормонами по раку» [13], «Как распознать рак при помощи биомаркеров?» [14], «Генная терапия против рака» [15], «Тернистый путь метастазов: через гипоксию в печень» [16]. — Ред.
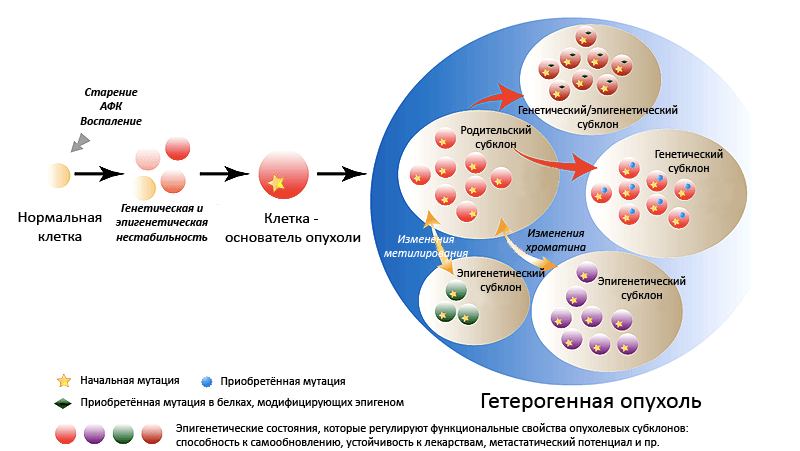
Рисунок 2. Гетерогенная структура опухоли. На начальном этапе онкогенеза хроническое воспаление, накопление активных форм кислорода (АФК) и старение способствуют клональной экспансии клеток с генетическими или эпигенетическими нарушениями. Впоследствии в этих клетках могут произойти дополнительные мутации, и тогда они могут дать начало злокачественной опухоли. Сама опухоль вскоре оказывается гетерогенной, состоящей из нескольких субпопуляций раковых клеток, — благодаря «побочным» мутациям или эпигенетическим изменениям.
[9], рисунок адаптирован
Более того, раковые клетки (РК), выделяя сигнальные молекулы, подготавливают специальные ниши для будущих метастазов. В этой связи крайне перспективной становится возможность манипулировать раковыми стволовыми клетками, влияя не на них самих, а на их микросреду или на окружение метастазов. Некоторые исследователи утверждают, что будущее противоопухолевой терапии — это разработка препаратов, направленных на РСК и метастатические ниши.
Структура микроокружения
Микроокружение первичной опухоли (появившейся недавно «с нуля» и еще только готовящейся дать метастазы) очень разнородно. В него входят другие клетки, кровеносные сосуды, внеклеточный матрикс (ВКМ) и целый коктейль из сигнальных молекул. Эти факторы не только поступают извне, но и секретируются самими РК. Иными словами, это двунаправленный процесс: и рак влияет на свою среду, и среда влияет на рак (рис. 3) [17]. Один из классических примеров — это то, как опухоли увеличивают для себя приток питательных веществ. Они выделяют молекулы (например, фактор роста эндотелия сосудов, VEGF), воздействующие на соседние эндотелиальные клетки и провоцирующие рост сосудов — ангиогенез [18].
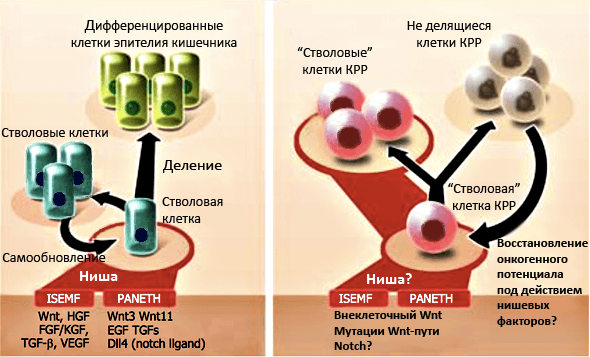
Рисунок 3. Регуляция ниши стволовых клеток нормального кишечного эпителия и колоректального рака. Слева — Сигнальные молекулы, секретируемые кишечными субэпителиальными миофибробластами (ISEMFs) и клетками Панета (Paneth), способствуют обновлению пула СК и нормальной кишечной пролиферации. Справа — Состав микроокружения способствует размножению клеток колоректального рака (КРР) либо их переходу в состояние покоя, из которого они — под влиянием того же микроокружения — могут выйти и восстановить свой онкогенный потенциал.
[17], рисунок адаптирован
Роль воспалительных реакций
Микроокружение опухоли характеризуется постоянным воспалением. М2-макрофаги, нейтрофилы, тучные клетки, повышенная концентрация медиатора воспаления оксида азота (NO), многие провоспалительные цитокины — все это способствует процветанию РК и увеличению агрессивности рака [19]. Поддерживают развитие опухоли также регуляторные Т-клетки и Т-хелперы 2 типа.
Среди сложнейшей сети сигнальных путей особое место по отношению к раку отводится двум системам, приводящим к активации генов, — NF-κB и STAT3. Эти факторы транскрипции могут начать работу в ответ на многое: воспаление, бактериальные или вирусные антигены, стресс, свободные радикалы. Используя эти пути, опухоль образуется, пролиферирует, активирует процессы ангиогенеза и инвазии, метастазирует — в общем, делает практически все для собственного развития. Как оказалось, активация NF-κB задействована даже в формировании резистентности рака к химиотерапии и облучению. Эти виды лечения эффективно убивают дочерние раковые клетки, но редко уничтожают сами РСК [19], что обычно имеет печальные последствия в форме обострения болезни спустя какое-то время.
Однако иммунное микроокружение опухоли может оказывать и обратное влияние. Тогда в него включены другие клетки: M1-макрофаги, Т-хелперы 1 типа, цитотоксические Т-клетки, АПК и естественные киллеры [20]. Переключение с антиопухолевого режима на проопухолевый сейчас активно изучается. К примеру, недавно показано, как рак подавляет нормальные функции эффекторных Т-клеток [21].
Внеклеточный матрикс
Внеклеточный матрикс — это каркас микроокружения, формирующий его механическую структуру . Его создают мезенхимальные клетки: фибробласты, хондроциты, остеобласты. Состав внеклеточного матрикса очень сложен и многообразен: в него входят коллагены — основные белки соединительной ткани (например, коллаген типа IV), протеогликаны, гликопротеины (фибронектин и ламинин-1) и другие компоненты. Ключевые ферменты матрикса — матриксные металлопротеиназы (ММП), разрушающие практически любой белок внеклеточного пространства и тем самым преобразующие его структуру. Двунаправленное влияние ВКМ и РК при некоторых условиях может способствовать прогрессированию опухоли, влиять на ее агрессивность и способность расселяться по всему организму [20]. Например, не только опухолевая клетка для своего роста ремоделирует матрикс, выделяя ММП, но их могут выделять и стромальные клетки микроокружения, облегчая инвазию РК.
Внеклеточный матрикс — это вообще святая святых многоклеточной организации. Это «духовные скрепы» и платформа для реализации «организменного законодательства», призванного ограничить права (свободу) индивидуальных клеток и навязать обязанности — все сугубо для процветания целого организма. Почему это выгодно отдельным клеткам, как неразумные бунтуют, формируя опухоли, и как вообще складывалась в эволюции вся эта система клеточной кооперации, рассказано в статье «Дипломатия клеток: взлеты и падения» [22]. — Ред.
Метастазирование и метастатические ниши
Метастазирование — это процесс распространения и расселения клеток первичной опухоли по организму и образования новых опухолей. Оказывается, вторичная опухоль образуется не в случайном месте, а в зоне с подходящим микроокружением, которую дистанционно «подготовила» первичная опухоль посредством сигнальных молекул. До попадания РК такая ниша считается преметастатической, а после — метастатической (рис. 4). Сложные взаимодействия между попавшей в нишу клеткой и микросредой обеспечивают успешное разрастание метастаза из одной клетки, принимающейся активно делиться.
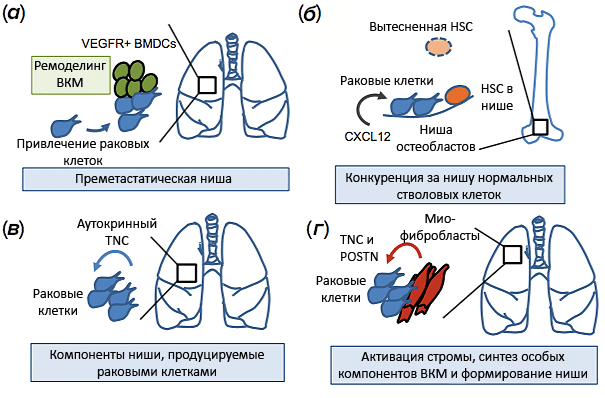
Рисунок 4. Метастатические ниши в период ранней колонизации отдаленных органов. а — Системные изменения, вызванные первичной опухолью молочной железы: мобилизация рецептора 1 фактора роста эндотелия сосудов (VEGFR1) и клеток костного мозга (BMDCs), привлечение РК в легкие, ремоделирование внеклеточного матрикса (ВКМ) и формирование преметастатической ниши, которая способствует колонизации легких клетками рака молочной железы. б — Клетки рака простаты попадают в нишу остеобластов, конкурируя с гемопоэтическими стволовыми клетками (HSCs). Хемокин CXCL12 способствует колонизации путем взаимодействия с рецептором CXCR4. в — Клетки рака молочной железы приносят с собой свой «нишевый материал», тенасцин C (TNC), ускоряя этим колонизацию легких. г — Активированные миофибробласты секретируют компоненты метастатической ниши TNC и периостин (POSTN), усиливая рост метастаза.
[2], рисунок адаптирован
Метастатические ниши (МН) рассеяны по всему организму и даже могут перемещаться с развитием болезни. Их можно найти и в гипоксичных областях, и во фронтах инвазии, и даже в обычных нишах СК [2]. Влияние РК на микроокружение позволяет перенастроить изначально неподходящие окружающие условия себе на пользу. Состав МН схож с микроокружением первичной опухоли: он представлен сосудистой сетью, компонентами внеклеточного матрикса и стромы — мезенхимальными и иммунными клетками. Микросреда отличается крайне активной «жизненной позицией». Она не только может «спрятать» РК от атак иммунной системы, но и перепрограммировать дифференцированную РК в РСК. Сложная смесь из факторов роста, хемокинов, гормонов и ферментов помогает РСК выжить и образовать метастаз.
У опухолевой клетки, попадающей в нишу, есть два пути. При неблагоприятных условиях она может перейти в состояние покоя, а при благоприятных — напротив, начать делиться и формировать метастаз. Предполагается, что РК может оставаться в нише, не делясь даже несколько десятков лет. Некоторые ученые выдвигают гипотезу, что покоящиеся метастазы присутствуют в организме с первой стадии рака, а не с четвертой (терминальной), как принято считать. В таком случае РК просто выжидает подходящего момента, а с изменением внешней среды «просыпается» и берется за работу.
Такое «переключение режимов» тоже регулируется молекулярным содержанием ниши и взаимодействием между МН и РК. Например, для регуляции состояния покоя, как показывают исследования, важен баланс между концентрацией белков семейства TGFβ и промитогенными цитокинами. У покоящихся клеток обнаружены и особые взаимодействия с внеклеточным матриксом — временная адгезия к его компонентам [23].
Как считают исследователи, терапия, нарушающая функцию микроокружения раковой клетки, очень перспективна. Например, если мишенью препарата станет МН, то можно добиться невероятных результатов: не только предотвратить появление метастазов, но и вылечить уже существующие. Но для этого сначала предстоит узнать больше о взаимодействии окружения и клетки, находящей приют в этой «тихой гавани».
Модели изучения микроокружения
Сегодня существует множество моделей изучения того, как микросреда изменяет отдельные клетки и их ДНК, и сопутствующее оборудование становится все более компактным, автоматизированным и многофункциональным.
Раньше для выращивания клеток в культуре преимущественно использовались двухмерные (плоские) матрицы. На них было показано, что ограничением формы или подвижности клетки можно спровоцировать деление, апоптоз или даже дифференцировку мезенхимальных СК человека. Сейчас к этим моделям добавились и трехмерные модели из синтетических гидрогелей и матриц, основанных на коллагеновых волокнах. С их помощью удалось обнаружить, что у клеток, культивируемых в 2D- или 3D-окружении, различаются фенотип, клеточно-матриксная адгезия и даже экспрессия генов.
О том, как чипы различных размеров и разной архитектурной сложности направляют дифференцировку мышиных нейрональных клеток-предшественниц в нейроны либо глию, можно прочитать в статье [24].
Для более корректного сравнения клеток, выращенных в двух- и трехмерной среде, разработаны специальные микролунки: одиночная клетка контактирует с плоской поверхностью, на которую нанесены адгезивные лиганды. Так, изменяя упругость подложки, можно манипулировать формой клетки в пространстве [25].
Близкий подход применяется для изучения метастатических ниш. Например, в 2013 году ученые создали модель спящих костных метастазов при раке груди. К этому исследователей подтолкнуло то, что примерно у трети больных раком груди уже на ранней стадии в костном мозге обнаруживают раковые клетки. Метастазы же развиваются только у половины из них — иногда спустя десятилетия после постановки диагноза. Возникло предположение, что «пробуждение» РК провоцируют факторы микросреды и (или) системные изменения. Эту гипотезу ученые и проверили на модели. 3D-коллагеновая биоматрица, в которой культивируют клетки костного мозга вместе с разными раковыми клетками, во многом воспроизводит естественную костную метастатическую нишу. Как оказалось, с помощью изменения ключевых сигнальных путей, отвечающих за переход клетки в состояние «спячки», можно манипулировать РК: искусственная ниша может и поддерживать, и ингибировать переход клеток в состояние покоя [26].
На похожей модели другая группа исследователей показала, что фармакологическое ингибирование сигналинга киназ определенного семейства не дает спящим клеткам рака груди вновь начать делиться. Поскольку для пролиферации нужна также активация другого гена, то параллельная терапия двумя ингибиторами вызывает апоптоз и задерживает рост метастазов. Авторы указывают, что такое комбинированное лечение может предотвратить повторное развитие рака молочной железы [27].
В наш век развития передовых биотехнологий было бы странно, если бы уже не были придуманы специальные приборы для отслеживания процессов опухолевой инвазии и эпителиально-мезенхимального перехода. К примеру, появились микрофлюидные технологии с различными механическими препятствиями и хемотаксическими градиентами. На одной из таких моделей обнаружено, что мигрирующая эпителиальная РК движется быстрее, если митохондрия находится в ее «головной» части [28].
Литература
- Honoki K., Fujii H., Tsujiuchi T. (2011). Cancer stem cell niche: the role of mesenchymal stem cells in tumor microenvironment. INTECH Open Access Publisher;
- Lander A.D., Kimble J., Clevers H., Fuchs E., Montarras D., Buckingham M. et al. (2012). What does the concept of the stem cell niche really mean today? BMC Biol. 10, 19;
- Volckaert T. and De Langhe S. (2014). Lung epithelial stem cells and their niches: Fgf10 takes center stage. Fibrog. Tissue Repair. 7, 8;
- Blaylock R.L. (2015). Cancer microenvironment, inflammation and cancer stem cells: A Hypothesis for a paradigm change and new targets in cancer control. Surg. Neurol. Int. 6, 92;
- Была клетка простая, стала стволовая;
- Снежный ком проблем с плюрипотентностью;
- В поисках клеток для ИПСК — шаг за шагом к медицине будущего;
- Обнаружены организаторы побега раковых клеток из первичного очага;
- Страшней клешней на свете нет...;
- Вероятность возникновения рака зависит от количества делений стволовых клеток;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Рак молочной железы с семейной историей;
- Ударивший гормонами по раку;
- Как распознать рак при помощи биомаркеров?;
- Генная терапия против рака;
- Тернистый путь метастазов: через гипоксию в печень;
- Ong B.A., Vega K.J., Houchen C.W. (2014). Intestinal stem cells and the colorectal cancer microenvironment. World J. Gastroenterol. 20, 1898–1909;
- Neviani P. and Fabbri M. (2015). Exosomic microRNAs in the tumor microenvironment. Front. Med. (Lausanne). 2, 47;
- Easwaran H., Tsai H.C., Baylin S.B. (2014). Cancer epigenetics: tumor heterogeneity, plasticity of stem-like states, and drug resistance. Mol. Cell. 54, 716–727;
- Bhome R., Bullock M.D., Al Saihati H.A., Goh R.W., Primrose J.N., Sayan A.E. et al. (2015). A top-down view of the tumor microenvironment: structure, cells and signaling. Front. Cell Dev. Biol. 3, 33;
- Wu A.A., Drake V., Huang H.S., Chiu S., Zheng L. (2015). Reprogramming the tumor microenvironment: tumor-induced immunosuppressive factors paralyze T cells. Oncoimmunology. 4, e1016700;
- Дипломатия клеток: взлёты и падения;
- Bleau A.M., Agliano A., Larzabal L., de Aberasturi A.L., Calvo A. (2014). Metastatic dormancy: a complex network between cancer stem cells and their microenvironment. Histol. Histopathol. 29, 1499–1510;
- Moe A.A., Suryana M., Marcy G., Lim S.K., Ankam S., Goh J.Z. et al. (2012). Microarray with micro- and nano-topographies enables identification of the optimal topography for directing the differentiation of primary murine neural progenitor cells. Small. 8, 3050–3061;
- Ochsner M., Dusseiller M.R., Grandin H.M., Luna-Morris S., Textor M., Vogel V. et al. (2007). Micro-well arrays for 3D shape control and high resolution analysis of single cells. Lab Chip. 7, 1074–1077;
- Marlow R., Honeth G., Lombardi S., Cariati M., Hessey S., Pipili A. et al. (2013). A novel model of dormancy for bone metastatic breast cancer cells. Cancer Res. 73, 6886–6899;
- El Touny L.H., Vieira A., Mendoza A., Khanna C., Hoenerhoff M.J., Green J.E. (2014). Combined SFK/MEK inhibition prevents metastatic outgrowth of dormant tumor cells. J. Clin. Invest. 124, 156–168;
- Desai S.P., Bhatia S.N., Toner M., Irimia D. (2013). Mitochondrial localization and the persistent migration of epithelial cancer cells. Biophys. J. 104, 2077–2088;
- Shalek A.K., Satija R., Shuga J., Trombetta J.J., Gennert D., Lu D. et al. (2014). Single-cell RNA-seq reveals dynamic paracrine control or cellular variation. Nature. 509, 363–369;
- Gawad C., Koh W., Quake S.R. (2014). Dissecting the clonal origins of childhood acute lymphoblastic leukemia by single-cell genomics. Proc. Natl. Acad. Sci. USA. 111, 17947–17952;
- Описание прибора Polaris. Сайт fluidigm.com;
- High H. (2015). Fluidigm debuts newest state of the art single cell system. Сайт fluidigm.com.