
Как пережить инфекцию: искусство быть болезнеустойчивым
29 ноября 2015
Как пережить инфекцию: искусство быть болезнеустойчивым
- 707
- 1
- 1
Доктор Шнабель фон Ром
Гравюра Поля Фюрста, 1656
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Нет такого организма на земле, который не был бы подвержен заражению бактериями или вирусами. Иммунная система призвана защищать организм от инфекций и вредных воздействий. Наиболее изученная стратегия защиты — сопротивление — включает в себя механизмы распознавания, уничтожения или изгнания патогена. Существует и другая стратегия защиты — проявление устойчивости к негативному воздействию патогена на организм хозяина. Рассмотрим возможные механизмы болезнеустойчивости и перспективы их изучения.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Ohhh, great warrior. Wars not make one great.
Yoda
(О, хе-хе, великий воин? О, хе-хе, не война делает великим, хе-хе.
Магистр Йода)
Каждому человеку знакомо состояние болезни, вызванное, например, вирусной инфекцией: повышенная температура, усталость, отсутствие аппетита и нежелание куда-либо идти. Как такое состояние организма помогает выздороветь? Чтобы понять это, разберем стратегии, которые организм использует для защиты от инфекций [1].
Первая и наилучшая стратегия — избежать заражения. Если это возможно, то организм будет избавлен от энергетических затрат на борьбу с микробами. Если заражение все же произошло, то применяется вторая стратегия — избавиться от патогена. Механизмы этой стратегии включают в себя распознавание чужеродных молекул, нейтрализацию токсинов, уничтожение вирусов и бактерий и изгнание паразитов. Недавно внимание иммунологов было привлечено к существованию третьей стратегии защиты организма от инфекции — болезнеустойчивости (disease tolerance), которая заключается в снижении негативного воздействия патогена на организм хозяина, иначе говоря, в уменьшении симптомов болезни [2], [3]. Очень важно, что численность патогена при этом не снижается — организм хозяина не препятствует его размножению.
Усилия, направленные на изучение механизмов борьбы иммунной системы с микробами, привели к значительному прогрессу в области лечения инфекционных заболеваний [4]. Например, к созданию противовирусных вакцин, что, прежде всего, помогло снизить детскую смертность. Теперь мамы стали больше бояться самих прививок, чем детских инфекционных болезней. Другое достижение — лечение антибиотиками [5] — долгое время создавало иллюзию, что человек может контролировать размножение любых бактерий.
Несмотря на такие успехи, целый ряд инфекционных заболеваний продолжает вызывать высокую смертность. Например, лечение туберкулеза очень длительное и не всегда приводит к успеху; септический шок остается одной из ведущих причин смерти в больницах; пока не удается создать вакцины против многих смертельно опасных вирусов (ВИЧ, вирус Эбола), и даже вирус гриппа периодически вызывает серьезные эпидемии с высокой смертностью. Тем не менее каждую инфекцию какая-то часть людей может пережить. Очевидно, что традиционно упускалось изучение важной составляющей защиты организма от инфекций. Стратегию болезнеустойчивости только недавно начали изучать применительно к инфекциям человека, и понимание ее механизмов может открыть путь к разработке новых лекарств и методов лечения.
Как измерить уровень болезнеустойчивости?
Чтобы изучать механизмы болезнеустойчивости, необходимо научиться ее измерять. Впервые это было сделано у растений в конце 19 века. Исследования урожайности пшеницы привлекли внимание к некоторым сортам, урожайность которых не снижалась так значительно, как у других сортов, при заражении патогенами растений. При этом количество патогенов и интенсивность проявления болезни у двух групп сортов не различались [6]. Эти исследования позволили понять, что способность растений противостоять болезни и приносить хороший урожай и их способность контролировать размножение патогена могут быть отделены друг от друга. Эти две характеристики кодируются разными генами и могут эволюционировать независимо. Также стало ясно, что для оценки болезнеустойчивости растения измерение потерь урожайности имеет смысл при одновременном измерении количества патогенов.
Растениям, устойчивым к болезням, были присущи некоторые характерные черты. Например, очень часто эти сорта растений также проявляли устойчивость к засухе. У некоторых сортов кукурузы рост новых корней ускорялся по мере того, как старые поражались гнилью. Несмотря на то, что большинство механизмов устойчивости и их генетические детерминанты остаются неизвестными, высказывалось предположение, что болезнеустойчивые растения не проявляют свой полный метаболический потенциал в урожайности, направляя оставшиеся энергетические резервы на борьбу с возникшей болезнью [6].
Аналогичные исследования на животных были проведены и опубликованы в 2007 году [7]. Пять различных видов лабораторных мышей (с разными генотипами [8]) были заражены паразитом Plasmodium chabaudi, который вызывает снижение веса и анемию за счет разрушения эритроцитов. Численность паразитов измерялась у каждой мыши во время пика инфекции (на восьмой день после заражения). Ухудшение здоровья оценивалось по минимальному весу во время болезни и минимальному числу эритроцитов. Так как состояние здоровья отдельных мышей было разным и до заражения, сравнивать степень его ухудшения в зависимости от количества паразитов нужно было между группами мышей одного генотипа с разными уровнями заражения (рис. 1).
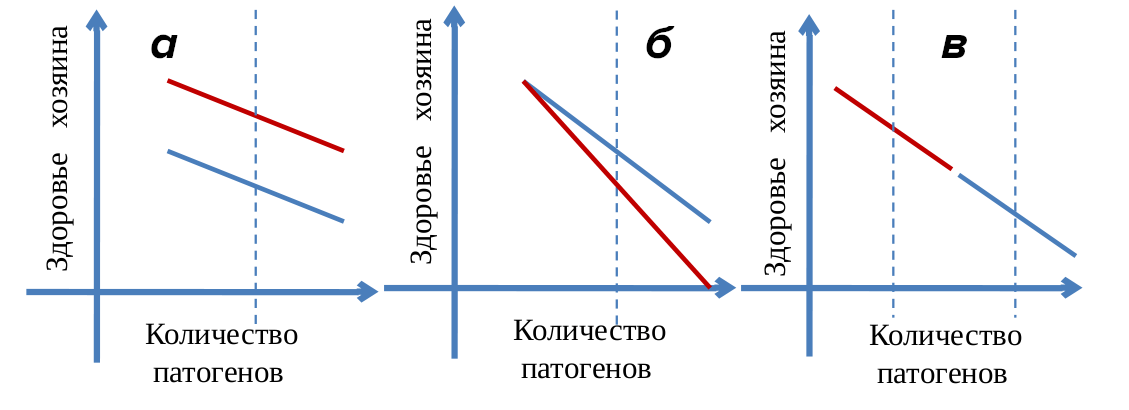
Рисунок 1. Зависимость здоровья хозяина от количества патогенов. Среднее количество патогенов отражает уровень сопротивления инфекции, коэффициент наклона прямой — уровень болезнеустойчивости данного генотипа. а — Представители этих генотипов одинаково устойчивы к инфекции, разница — в общем состоянии здоровья до заражения. б — Представители красного генотипа менее болезнеустойчивы, чем представители синего. в — Болезнеустойчивость этих двух генотипов одинакова, но сопротивление выше у представителей красного генотипа.
[7], рисунок адаптирован
Снижение веса и количества эритроцитов по мере роста числа паразитов коррелировало с генотипом мышей. Для каждого вида мышей был характерен свой коэффициент наклона прямой, выражающей зависимость здоровья от размеров популяции патогенов. Более того, была выявлена отрицательная зависимость между уровнем устойчивости к болезни и интенсивностью иммунного ответа против паразита [7].
Генетическая обусловленность болезнеустойчивости была выявлена и у дрозофил. Некоторые мутации у мух, приводящие к летальному исходу при заражении бактерией Listeria monocytogenes, не снижали иммунный ответ (что приводило бы к увеличению количества патогенов), а снижали устойчивость к болезни при таком же количестве бактерий, как и у мух дикого типа [9].
Эксперименты как на растениях, так и на животных доказали существование генетически закодированной устойчивости к болезни как отдельной, не зависящей от количества микроорганизмов-возбудителей, стратегии защиты организма от инфекции.
Возможные механизмы болезнеустойчивости
К настоящему времени известно очень мало экспериментальных данных относительно механизмов болезнеустойчивости. Наиболее полную теоретическую характеристику таких возможных механизмов [2] дал Руслан Меджитов [10], [11], и в будущем это облегчит их экспериментальный поиск. Прежде всего, они должны быть тесно связаны с физиологическими процессами, направленными на поддержание гомеостаза и обеспечивающими стрессоустойчивость организма.
Гомеостаз — это поддержание постоянства внутренней среды организма, несмотря на воздействие различных внешних и внутренних факторов. Гомеостаз является непременным условием существования живого организма [12], [13]. В постоянном диапазоне поддерживаются параметры как на уровне целого организма (например, температура тела, концентрация кислорода или кальция в крови), так и на уровне тканей и клеток (например, ионный состав цитоплазмы) [13]. Принцип поддержания гомеостаза универсален: отклонение каждого параметра от нормы распознается специальным сенсором, который запускает совокупность приспособительных реакций, направленных на возвращение этого параметра в приемлемый диапазон.
На уровне индивидуальной клетки в ответ на стрессовое воздействие сенсор активирует специальный транскрипционный фактор, который индуцирует экспрессию генов, запускающих механизм устойчивости к данному стрессу. Например, такой стресс, как накопление в эндоплазматическом ретикулуме большого количества белков с ненативными конформациями, вызывает активацию трех сенсоров (unfolded protein response, UPR), которые уменьшают синтез белков в клетке, вызывают деградацию неправильно свернутых белков и другие изменения, которые помогают клетке пережить этот стресс (рис. 2) [13].
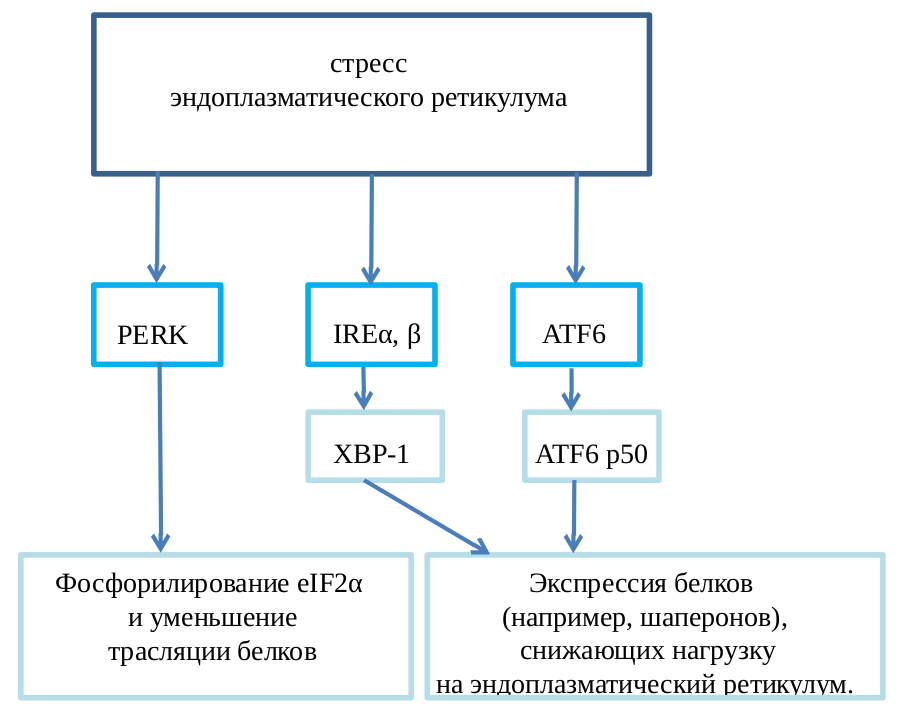
Рисунок 2. Пример стрессового ответа. Стресс эндоплазматического ретикулума вызывает активацию трех сенсоров: PERK, IRE1α/β, ATF6. Два транскрипционных фактора, XBP-1 и ATF6, стимулируют экспрессию генов, кодирующих шапероны, а также белки, способствующие деградации неправильно свернутых белков, и другие факторы, которые помогают клетке справиться с этим стрессом.
рисунок автора
Негативное влияние патогена на физиологические процессы в организме хозяина можно рассматривать как внешнее воздействие, нарушающее гомеостаз. Если механизмы поддержания гомеостаза достаточны для восстановления равновесия, то симптомы болезни не возникают. Когда стресс настолько велик, что приводит к повреждению макромолекул или клеток, то помимо механизмов стрессоустойчивости запускаются процессы репарации клеток и тканей. Таким образом, процессы поддержания гомеостаза и репарации клеток — главные кандидаты в механизмы болезнеустойчивости [2], [4].
Инфекция создает стрессовые условия для клеток и тканей организма хозяина за счет их поражения двумя факторами: либо токсинами и другими молекулами, вырабатываемыми самим патогеном, либо эффекторными молекулами иммунной системы, направленными на уничтожение патогена. Поэтому можно выделить два компонента в механизмах болезнеустойчивости: один ориентирован на нейтрализацию токсичных молекул возбудителя, другой — на уменьшение чувствительности тканей организма к эффекторным молекулам иммунной системы [2].
Механизмы болезнеустойчивости могут быть патоген-специфичными. Каждый класс патогенов вызывает свои патологии в организме хозяина и таким образом индуцирует соответствующие механизмы репарации тканей и стрессоустойчивости. Значит, устойчивость к одному виду патогена (например, вирусу) может быть несовместима с устойчивостью к другому виду (например, бактерии) [2].
Многие механизмы болезнеустойчивости подчиняются принципу гормезиса: небольшие дозы негативного воздействия помогают организму впоследствии пережить более высокие дозы, которые иначе были бы смертельны [2]. Впервые этот эффект был обнаружен для небольших доз ядов. Известно также, что небольшие дозы липополисахарида (компонента клеточной стенки некоторых бактерий) вызывают состояние устойчивости организма к более высоким его дозам.
Примеры механизмов болезнеустойчивости
Теоретически предсказанные характеристики механизмов болезнеустойчивости поддерживаются экспериментальными данными.
1. Нарушение нормальной репарации тканей выявили в экспериментальном исследовании бактериальной и вирусной коинфекции. Всем известно, что не столько опасен сам вирус гриппа, сколько вызываемые им осложнения. Одно из таких осложнений — бактериальная пневмония — характеризуется высоким уровнем смертности. Вероятно, причиной летального исхода становится недостаточная активация механизмов болезнеустойчивости.
Для исследования причин смертности была выбрана следующая модель коинфекции: мышей заражали сначала вирусом гриппа, а через несколько дней — бактерией Legionella pneumophila [14]. Эту бактерию выбрали потому, что скорость ее размножения в организме хозяина не увеличивается из-за ослабления иммунитета после вируса гриппа. В качестве контроля использовали две группы мышей: первую инфицировали только вирусом гриппа, а вторую — только L. pneumophila. Количество вирусов и бактерий было одинаковым у мышей, зараженных каждым патогеном в отдельности, и у коинфицированных. Тем не менее после вирусной или бактериальной инфекции все грызуны выздоравливали, а у коинфицированных мышей наблюдался 100-процентный летальный исход (рис. 3) [14].
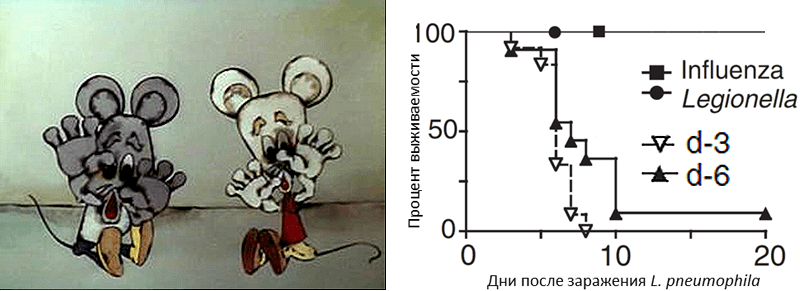
Рисунок 3. Выживаемость мышей после заражения вирусом гриппа, бактерией L. pneumophila или после коинфекции. Заражение L. pneumophila происходило на третий (d-3) или шестой (d-6) день после инфицирования вирусом гриппа.
кадр из м/ф «Леопольд и золотая рыбка» и [14], с изменениями
В этой модели коинфекции очень тщательно были проанализированы механизмы иммунного ответа и вирулентность патогенов как возможные причины смерти. Ослабление L. pneumophila до такой степени, что бактерия с трудом могла выживать и была почти невидима для иммунной системы мышей, не влияло на уровень смертности. Мыши с инактивированными сигнальными путями иммунной системы, распознающими вирус гриппа или L. pneumophila, и их собратья без эффекторных молекул воспалительного ответа все равно умирали от коинфекции.
Как известно, вирус гриппа вызывает повреждение эпителиальных клеток легких. В результате коинфекции площадь некроза эпителия значительно увеличивалась по сравнению с инфекцией только вирусом гриппа, что, вероятно, и приводило к смерти. Экспрессия генов, вовлеченных в процесс репарации тканей, была снижена у коинфицированных мышей. Таким образом, нарушение процесса репарации тканей, одного из предсказанных механизмов болезнеустойчивости, приводило к летальному исходу.
Известно, что эпителиальный фактор роста амфирегулин уменьшает повреждения легочного эпителия при инфекции вирусом гриппа [15]. Амфирегулин в эксперименте приводил к снижению смертности от коинфекции, но только в группе мышей с ослабленной иммунной системой, которые были заражены ослабленной бактерией. Этого фактора роста было недостаточно для спасения мышей с нормальной иммунной системой.
2. Активация стрессового сигнального пути (XBP-1-зависимого UPR) — необходимое условие для защиты тканей организма от повреждений, вызываемых не самим патогеном, а иммунным ответом против него [16].
Бактерия Pseudomonas aeruginosa может инфицировать личинки нематоды Caenorhabditis elegans и задерживать их развитие. Заражение P. aeruginosa активирует один из сигнальных путей, которые уменьшают стресс эндоплазматического ретикулума. Активируемый транскрипционный фактор называется X-box binding protein 1 (XBP-1). Личинки C. elegans, лишенные XBP-1, гибнут в присутствии патогена значительно быстрее, чем личинки дикого типа. Морфология эндоплазматического ретикулума у таких особей сильно изменена. Мутантные личинки C. elegans, которые не могут активировать механизмы врожденного иммунитета в ответ на инфекцию P. aeruginosa, не способны к активации (особому сплайсингу мРНК) и XBP-1 в присутствии патогена (рис. 4). Значит, синтез активного XBP-1 индуцируется не просто при заражении патогеном, а в ответ на запуск иммунного ответа.
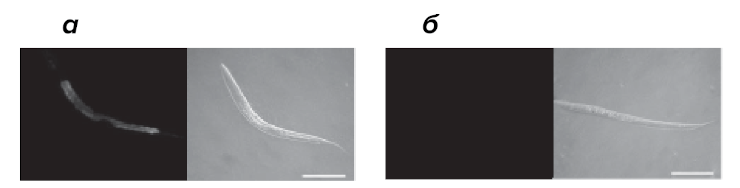
Рисунок 4. Флуоресцентная микроскопия (левые фото) и микроскопия методом дифференциального интерференционного контраста (правые фото) личинок C. elegans дикого типа (а) и мутантов, неспособных активировать иммунный ответ (б). В качестве питательного субстрата использовались патогенные бактерии P. aeruginosa. Флуоресцентный транскрипционный репортер отражает активацию XBP-1.
Интересно, что сам транскрипционный фактор XBP-1 не нужен для иммунного ответа против P. aeruginosa, так как количество патогена у C. elegans, лишенных XBP-1, оказалось таким же, как и у нематод дикого типа. Более того, активация иммунного ответа у C. elegans даже в отсутствие патогена приводила к гибели мутантных особей. Напротив, мутантные личинки, у которых нет XBP-1, но которые при этом не могут активировать иммунный ответ, переживают заражение P. aeruginosa почти так же хорошо, как и личинки нематод дикого типа. Таким образом, активация стрессового сигнального пути является одним из механизмов болезнеустойчивости, направленным на защиту тканей организма от повреждений собственной иммунной системой.
3. Эффект гормезиса лежит в основе механизмов болезнеустойчивости, помогающих организму пережить общее заражение крови — сепсис. Обычно сепсис — это осложнение после операции, большой кровопотери, тяжелого воспалительного процесса. В настоящее время основу лечения сепсиса составляет вовремя начатое применение антибиотиков. Это приводит к снижению численности бактерий, но не всегда может предотвратить летальный исход. Если системный воспалительный ответ уже развился, он может привести к повреждению жизненно важных органов, например, легких [17].
При исследовании мышиной модели сепсиса было обнаружено, что применение небольших доз антрациклинов приводило к снижению смертности мышей на 80%, при этом количество бактерий в легких, печени и других органах было таким же, как и у мышей, не получавших антрациклины [18].
Антрациклины — это класс лекарств, применяемых в химиотерапии злокачественных новообразований. Они вызывают повреждение молекул ДНК (генотоксический стресс), что активирует многокомпонентный клеточный ответ — DNA damage response (DDR) — с вовлечением ряда сигнальных путей, систем репарации, контрольных точек клеточного цикла и т.д. Этот стрессовый ответ включает в себя и индукцию аутофагии — процесса разрушения в лизосомах собственных макромолекул и органелл клетки, которые получили повреждения [19]. Выяснилось, что активация антрациклинами процесса аутофагии в эпителиальных клетках легких совершенно необходима для защитного эффекта. Значит, небольшой стресс (повреждение ДНК) помогает клеткам легких впоследствии перенести более сильный стресс при системном воспалительном ответе.
Рассмотренные примеры дают основание предполагать, что медикаментозное поддержание механизмов болезнеустойчивости может стать важным направлением в терапии инфекционных заболеваний.
Заключение
Один из видов терапии, направленной на поддержание механизмов болезнеустойчивости, уже широко применяется для лечения острых кишечных инфекций, сопровождаемых диареей. Это — регидратация организма. Также можно предположить, что болезненное состояние во время инфекции (повышенная температура, усталость и другие симптомы) помогает организму пережить инфекцию [2]. Несомненно, что изучение других механизмов болезнеустойчивости, особенно на уровне клеток и тканей, приведет к появлению новых лекарств и методов лечения.
Литература
- Rivas F.V., Chervonsky A.V., Medzhitov R. (2014). ART and immunology. Trends Immunol. 35, 451;
- Medzhitov R., Schneider D.S., Soares M.P. (2012). Disease tolerance as a defense strategy. Science. 335, 936–941;
- Ayres J.S. and Schneider D.S. (2012). Tolerance of infections. Annu. Rev. Immunol. 30, 271–294;
- Soares M.P., Gozzelino R., Weis S. (2014). Tissue damage control in disease tolerance. Trends Immunol. 35, 483–494;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Schafer J.F. (1971). Tolerance to plant disease. Annu. Rev. Phytopathol. 9, 235–252;
- Raberg L., Sim D., Read A.F. (2007). Disentangling genetic variation for resistance and tolerance to infectious disease in animals. Science. 318, 812–814;
- Грызун особого назначения;
- Ayres J.S., Freitag N., Schneider D.S. (2008). Identification of Drosophila mutants altering defense of and endurance to Listeria monocytogenes infection. Genetics. 178, 1807–1815;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Goldstein D.S. and Kopin I.J. (2007). Evolution of concepts of stress. Stress. 10, 109–120;
- Chovatiya R. and Medzhitov R. (2014). Stress, inflammation, and defense of homeostasis. Mol. Cell. 54, 281–288;
- Jamieson A.M., Pasman L., Yu S., Gamradt P., Homer R.J., Decker T., Medzhitov R. (2013). Role of tissue protection in lethal respiratory viral-bacterial coinfection. Science. 340, 1230–1234;
- Monticelli L.A., Sonnenberg G.F., Abt M.C., Alenghat T., Ziegler C.G., Doering T.A. et al. (2011). Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nat. Immunol. 12, 1045–1054;
- Richardson C.E., Kooistra T., Kim D.H. (2010). An essential role for XBP-1 in host protection against immune activation in C. elegans. Nature. 463, 1092–1095;
- Medzhitov R. (2013). Septic shock: on the importance of being tolerant. Immunity. 39, 799–800;
- Figueiredo N., Chora A., Raquel H., Pejanovic N., Pereira P., Hartleben B. et al. (2013). Anthracyclines induce DNA damage response-mediated protection against severe sepsis. Immunity. 39, 874–884;
- Аутофагия, протофагия и остальные.






