Кто рубит коллагеновый лес
24 ноября 2015
Кто рубит коллагеновый лес
- 4534
- 0
- 11
Рыхлая соединительная ткань.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Окружение, в котором «живет» клетка, влияет на все аспекты ее существования. Поэтому любые изменения в этом окружении неизбежно отразятся и на самой клетке — элементарной единице живого организма. Как говорится, ломать — не строить. Проще всего его изменить (кроме прямого физического разрушения) химическим путем, «включив» специальные белки — матриксные металлопротеиназы (ММП). Это семейство протеолитических ферментов, которые специфически разрушают многочисленные компоненты клеточного окружения и тем самым способствуют ряду важных функций организма — от обеспечения миграции клеток до заживления ран.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Дремучий коллагеновый лес
Ни для кого не секрет (и, честно говоря, это просто следует из названия), что все многоклеточные организмы состоят из клеток. Но для многих невдомек, что эти клетки окружает. Часто клетки в организме ошибочно представляют себе как плотно уложенные кирпичики, накрепко сцементированные между собой.
На самом деле это справедливо (да и то лишь отчасти) для клеток эпителиальной ткани, что выстилает полости нашего тела, слизистые оболочки внутренних органов, дыхательной системы, пищеварительного тракта и мочеполовых путей, а также образует большинство желез организма. В остальных же случаях клетки, как правило, располагаются не так близко друг к другу, а в случае крови (это же тоже ткань, хоть и жидкая!) клетки вообще практически не связаны и относительно свободно переносятся по всему организму, выполняя свои физиологические функции. Некоторые клетки даже могут самостоятельно передвигаться и проникать в ткани, ориентируясь на биологические, химические и физические аттрактанты (примерно так же ориентируются в пространстве одноклеточные эукариоты — протисты).
Можно сказать, что клетки нашего организма (за исключением самых первых в эмбриогенезе — бластомеров) окружены субстанцией, поддерживающей их на определенном месте относительно других клеток организма. Субстанцией, интегрирующей все клетки, ткани и органы нашего тела в отдельные кластеры, а уже затем в единую систему, называемую организмом. Клетки можно сравнить с грибами, растущими в лесу — некоторые, как опята, грузди или лисички, растут скученно (эпителиальная, мышечная ткани), а некоторые — порознь, как боровики и белые грибы (соединительная, нервная ткани) (рис. 1). Как известно из школьного курса биологии, грибы вступают в очень тесный симбиотический контакт с деревьями, поэтому на рост грибов влияет состояние леса, в котором они растут, а рост леса, в свою очередь, зависит от грибов . Клетки в нашем организме тоже живут в «лесу», который прямо или косвенно влияет на их рост, и который растет благодаря им. Этот лес — внеклеточный матрикс (рис. 2). Быстро пройдемся по видовому разнообразию матрикса.
Да простят меня читатели за столь однобокое рассмотрение симбиотических связей в лесу, здесь стоит понимать эти сравнения лишь в художественном смысле. — Прим. авт.
Внеклеточным матриксом (далее ВКМ) называют все внеклеточные структуры ткани с белками и полисахаридами, входящими в его состав. «Деревья» клеточного леса можно разделить на несколько групп: гликопротеины, протеогликаны и гиалуроновая кислота.
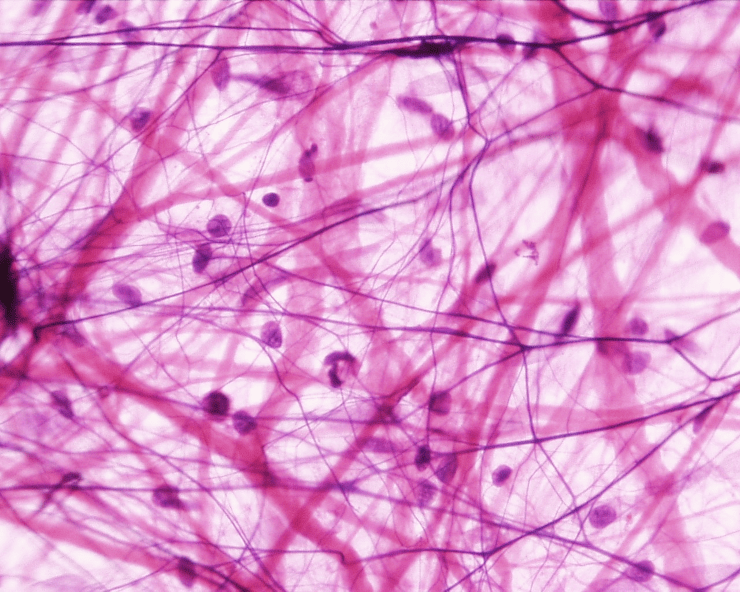
Рисунок 1. «Коллагеновый лес». На фото представлена так называемая рыхлая соединительная ткань. Тонкие нити представляют собой волокнистые компоненты внеклеточного матрикса, а клетки как бы «подвешены» на них.
Особо стоит выделить гликопротеин под названием коллаген, ведь это самый распространенный белок не только во внеклеточном матриксе, но и во всем организме человека. Можно сказать, что наши клетки действительно живут в самом настоящем «коллагеновом лесу». Коллаген обеспечивает структурную поддержку ткани, придает ей твердость и стойкость. Вторым замечательным гликопротеином ВКМ является эластин. Он, в противоположность коллагену, наоборот придает ткани упругость и растяжимость; находится, соответственно, там, где эта растяжимость больше всего нужна (гладкая мышечная ткань; стенки артерий, легких, связок).
Особняком стоит подкласс гликопротеинов, называемый протеогликанами. Протеогликаны — особые белковые молекулы с очень высокой степенью гликозилирования (насыщенностью углеводами) (около 90–95% массы белка), соединенные с молекулами гликозаминогликанов. Гликозилирование обусловливает исключительную способность протеогликанов накапливать воду и полезные вещества, вроде факторов роста. Они чем-то похожи на сфагнум — подстилку болота.
Третий основной компонент клеточного леса — гиалуроновая кислота. Ее главное отличие от всех остальных гликозаминогликанов в том, что она не подвергается сульфированию и синтезируются на клеточной стенке. Не обладая большой склонностью к образованию комплексов с другими компонентами ВКМ, гиалуроновая кислота тем не менее выполняет ряд важных функций. Так, гиалуроновая кислота необходима для поддержания гидродинамики тканей, играет важную роль в процессах миграции и пролиферации клеток.
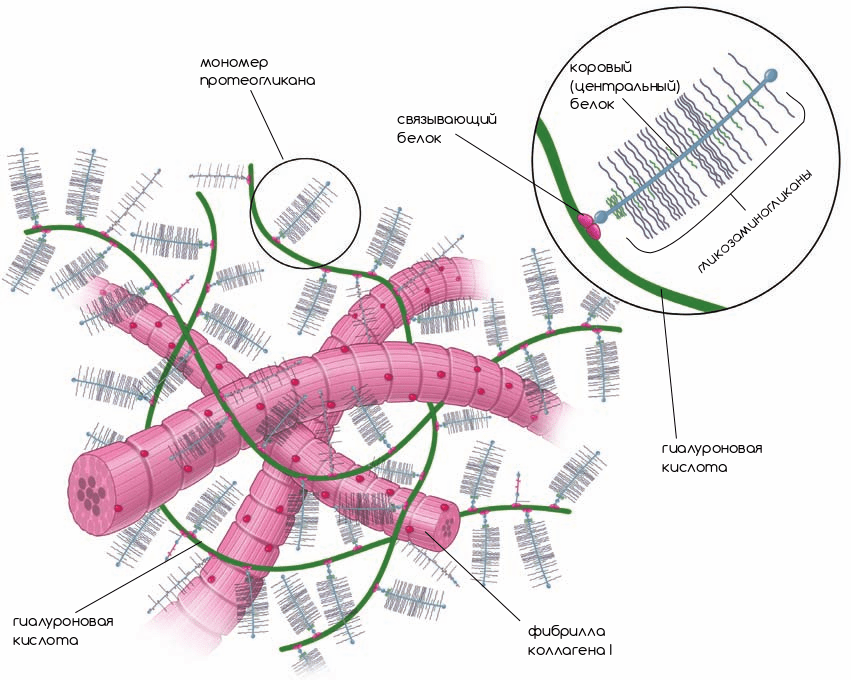
Рисунок 2. Внеклеточный матрикс. Компоненты внеклеточного матрикса органично переплетаются друг с другом и образуют каркас для клеток.
На границе клетка—ВКМ существуют интересные белки — интегрины и фибронектины. Первые как бы находятся и в клетке, и вне ее, называясь трансмембранными, а вторые соединяют внешние концы интегринов. Это те белки, через которые ВКМ может прямо влиять на жизнь клетки (заставить ее делиться, двигаться, умереть и т.д.) [1].
ВКМ выполняет интегрирующую функцию по отношению ко всем клеткам организма. Можно сказать, что ВКМ «склеивает» вместе клетки и органы многоклеточного организма. Даже эпителиальная ткань, чьи клетки словно сшиты и плотно прилегают друг к другу, также интегрирована в общую организменную среду через особую прослойку ВКМ, называемую базальной ламиной.
Не всё так спокойно в коллагеновом лесу
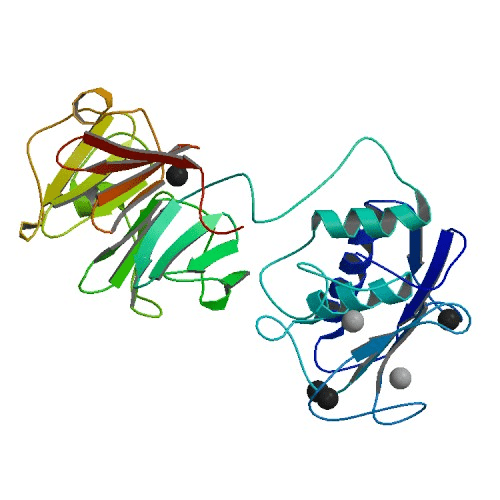
Рисунок 3. Структура коллагеназы ММП-1, полученная методом рентгенкристаллографии.
Коллагеновый лес систематически вырубают. Не подчистую, конечно же, к тому же на месте поваленных деревьев появляются новые (не без участия окружающих клеток), и экологическое равновесие не нарушается. Но зачем кому-то вырубать лес, а главное, кто его вырубает?
ВКМ, конечно, выполняет доброе дело, поддерживая клетки, ткани и органы, но протиснуться сквозь дебри коллагеновых волокон среднестатистической клетке довольно проблематично, а двигаться клеткам порой приходится очень много, особенно тем, что защищают организм от интервентов. Да что там говорить, даже очень активной раковой клетке необходимо как-то метастазировать и буквально прорубать себе путь. Клеткам необходима помощь тех, кто мог бы снаружи разрушать коллаген и прочие молекулы ВКМ и отцеплять клетку от внешних волокон. Эту роль лесорубов в организме многоклеточных животных выполняют несколько крупных семейств молекул, из которых самым многочисленным является семейство матриксных металлопротеиназ (далее ММП) (рис. 3) [2–5].
В семейство ММП входит более 20 ферментов. Это семейство способно расщеплять почти все компоненты внеклеточного матрикса соединительных тканей. ММП сопровождают нас на протяжении всей нашей жизни — от момента прикрепления эмбриона к матке до самой смерти. Структура ММП незатейлива и мало отличается в целом по группе, однако функции разных ММП могут порой отличаться довольно сильно. Основой протеиназы являются два домена: про-домен и каталитический домен (рис. 4) [2], [6].
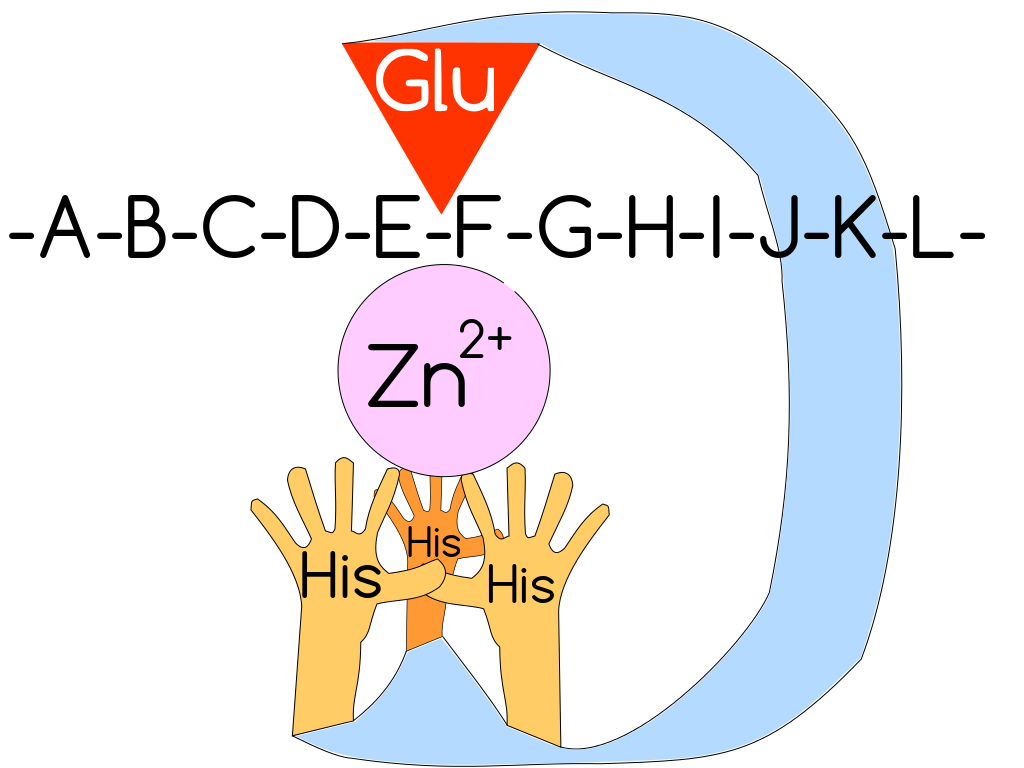
Рисунок 4. Схематическое строение активного центра ММП. Три «гистидиновые руки» удерживают ион цинка и координируют его относительно остатка глутаминовой кислоты. «-A-B-C-D-E-F-G-H-I-J-K-L-» — последовательность аминокислот белка. Суть протеолиза ММП в разрушении пептидной связи — «дефиса» между двумя буквами.
[6], рисунок адаптирован
Про-домен нужен ММП чтобы активироваться лишь в нужный для клетки момент. Действительно, если мы начнем беспорядочно рубить коллаген налево-направо, от этого будет мало толку (скорее, организм превратится в бесформенную массу). Поэтому на про-домене также располагается так называемый «цистеиновый переключатель», который предотвращает доступ воды к иону цинка, тем самым оберегая ММП от активации. Каталитический же домен обусловливает собственно реакцию разрушения белка, и в типичной ММП содержит в своем активном сайте ион цинка (Zn2+) (поэтому матриксные металлопротеиназы имеют приставку металло-), который как бы удерживается на весу тремя гистидиновыми «руками», которые координируют цинк [3], [6]. Кратко механизм катализируемой протеолитической реакции изображен на рис. 5.
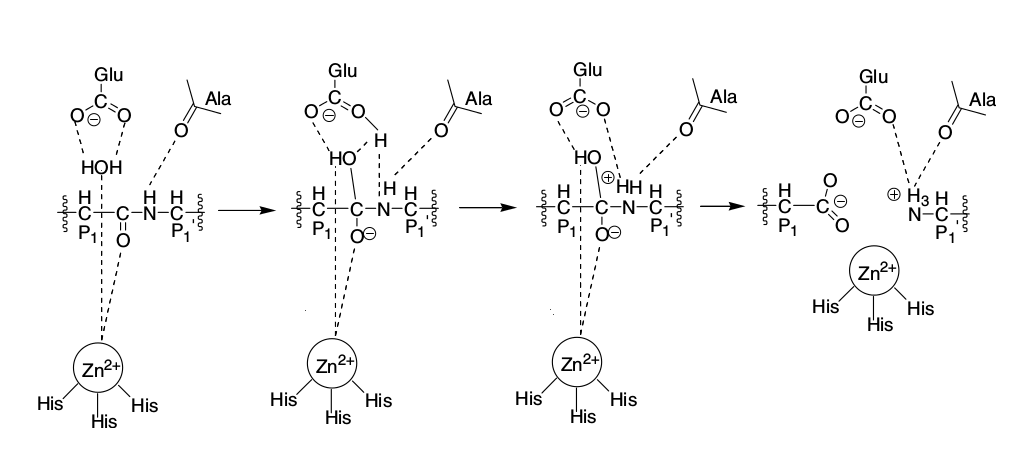
Рисунок 5. Механизм реакции протеолиза при участии ММП. Пептидная связь расщепляемого белка ориентируется на активный цинковый центр. Карбонильная группа атакуется молекулой воды, которая связана водородными связями с глутаминовой кислотой и также сориентирована на активный цинковый центр. Молекула воды жертвует протон остатку глутаминовой кислоты, который переносит его к атому азота расщепляемой пептидной связи [3].
Рисунок 6. ММП разрушают внеклеточный матрикс.
[6], рисунок адаптирован
Кроме того, за исключением некоторых представителей, ММП имеют гибкую богатую аминокислотой пролином шарнирную область и карбокси-(C)-концевой гемопексин-подобный домен, чья функция заключается в специфичном распознавании субстрата. Другие домены «протеазоспецифичны» и выполняют специфические функции. Например, четыре мембранные ММП (ММП-14, -15, -16 и -24) имеют так называемый трансмембранный цитозольный домен, который позволяет закрепляться им на поверхности мембраны клетки и «рубить» по мере того, как клетка продвигается вперед [6].
Без дровосеков никуда
Так как ВКМ представлен практически во всех тканях в более или менее выраженной степени, ММП простирают свои цинко-глутаминовые щупальца на все ткани организма. Такое фундаментальное значение определяет роли, выполняемые ММП — как положительные, так и отрицательные.
Миграция клеток
На первый взгляд клетки человека кажутся статичными — движутся разве что форменные элементы крови. Однако на самом деле в организме постоянно происходят миграции клеток (от эпителиальных и мезенхимальных, до нервных и костных), причем на довольно приличные для клетки расстояния.
Замечательным примером служит миграция клеток нервного гребня (рис. 7). Нервный гребень — совокупность клеток позвоночных животных на определенной стадии эмбриогенеза, выделяющаяся из краевых отделов нервного желобка во время его замыкания в нервную трубку. В процессе индивидуального развития организма клетки нервного гребня мигрируют порой в самые неожиданные места и на очень далекие расстояния.
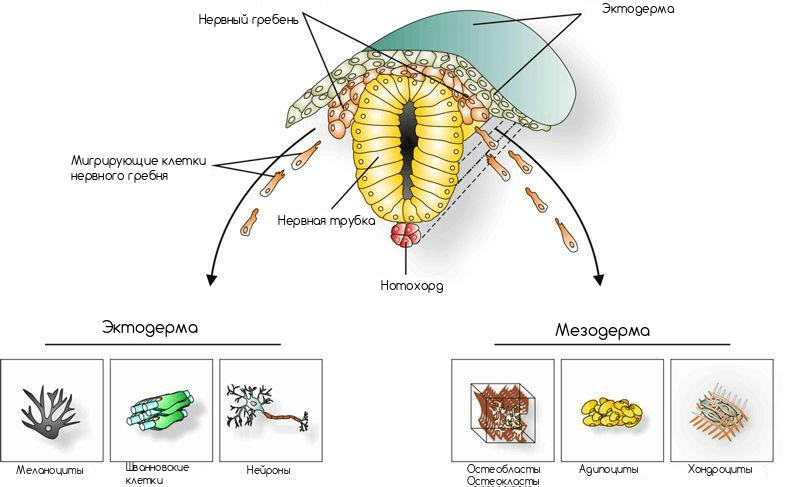
Рисунок 7. Схематическое расположение клеток нервного гребня на этапе эмбриогенеза.
Есть три основных пути миграции:
- Вниз, образуя симпатические и парасимпатические ганглии, вещество надпочечников;
- Также вниз, но с образованием спинальных ганглиев;
- Прямо под эктодерму, радиально в стороны от нервной трубки с образованием меланоцитов (специализированных клеток кожи, вырабатывающих пигмент меланин).
Движение клетки является многоэтапным процессом. Сначала клетка должна сменить свою стратегию поведения с прикрепительной (адгезивной) на миграционную. Затем следует активация двигательной функции цитоскелета клетки, изменение адгезивных сайтов и адгезивных молекул на поверхности клетки и «вырубка» ВКМ для устранения физических барьеров. Отдельная роль отводится хемоаттрактантам (химическим веществам, по которым клетка ориентируется в пространстве), так как именно они будут вести клетку в нужном направлении. Очевидно, что главным препятствием для клетки является тот самый коллагеновый лес, которым она окружена со всех сторон. Ключевая роль здесь отводится ММП, которые как раз и прочищают путь для клетки [2], [4], [6].
ВКМ управляет делением клеток и их запрограммированной смертью
Давно известно, что взаимодействия между ВКМ и молекулами на поверхности клетки регулируют поведение клетки. Опосредованную роль в фундаментальных клеточных процессах, таких как: деление, апоптоз (запрограммированная клеточная смерть), дифференцировка и жизнь клетки вообще — играют ММП. Хотя исследований на эту тему довольно мало, достоверно известно, что их опосредованная роль заключается в изменении окружения клетки и в специфических взаимодействиях с молекулами на поверхности клетки.
Были проведены эксперименты на разных культурах клеток, и во всех результаты оказались схожими — подавление (ингибирование) ММП приводило к уменьшению пролиферативной активности клеток (они просто меньше делились) и увеличению общего содержания компонентов ВКМ. Можно считать, активность ММП может быть необходима для запуска пролиферативного сигнала.
В то же время ММП могут вызвать запрограммированную смерть клетки — апоптоз. Протеиназы или «неправильные» молекулы ВКМ (т.е. поврежденные или бракованные) могут привести к такому исходу возможно из-за того, что они изменяют сигналы, которые приходят на интегрины [5], [6].
Морфогенез тканей
Морфогенез — возникновение и развитие органов, систем и частей тела организмов в онтогенезе (индивидуальном развитии) и филогенезе (историческом развитии). ММП принимают непосредственное участие в морфогенезе тканей, и неправильное функционирование и пространственное расположение ММП могут существенным образом влиять на процессы тканеобразования, приводя к печальным последствиям. В большинстве случаев возможны вариации активности ММП, что приводит к появлению в процессе онтогенеза различных морфологических структур.
Эксперименты на адипоцитах (клетках жировой ткани), помещенных на базальную мембрану, показали, что они мигрируют и самоорганизуются в большие многоклеточные кластеры. Эти клетки секретируют ММП-2, а ингибирование ММП приводит к подавлению миграции клеток и организации их в трехмерные структуры (рис. 8) [6].
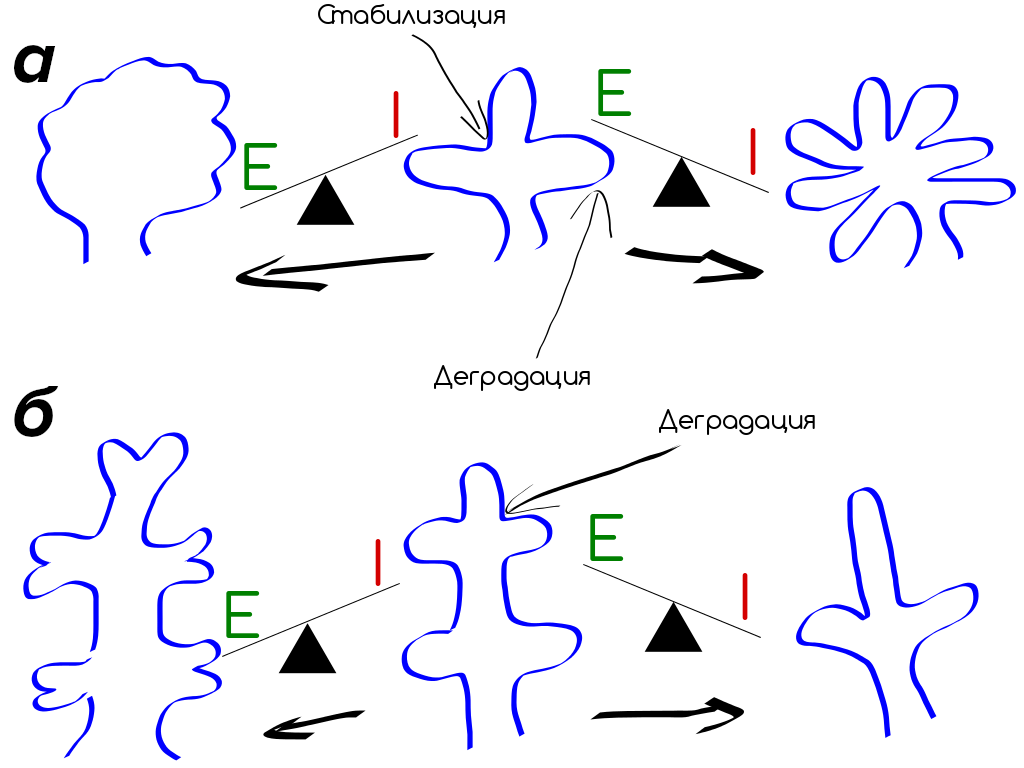
Рисунок 8. «Разветвление» эпителия в процессе морфогенеза зависит от баланса протеиназ и ингибитора протеиназ.
а — Подчелюстной железистый эпителий разветвляется с образованием стабилизированных коллагеновых расщелин, что сопровождается ростом эпителия, проникающего дальше. В этом случае высокая активность протеаз приводит к меньшему ветвлению, а высокая активность ингибитора наоборот — к большему ветвлению.
б — Эпителий почек ветвится почкованием, которое требует активности протеаз для того, чтобы прорасти в окружающую мезенхиму. В этом случае, высокая активность протеаз будет приводить к повышенному уровню ветвления, а высокая активность ингибирования — к пониженному.
[6], рисунок адаптирован
Заживление ран
Заживление кожи — комплексный процесс, в который вовлечены несколько подпроцессов: миграция клеток, деградация ВКМ и реорганизация ткани (рис. 9).
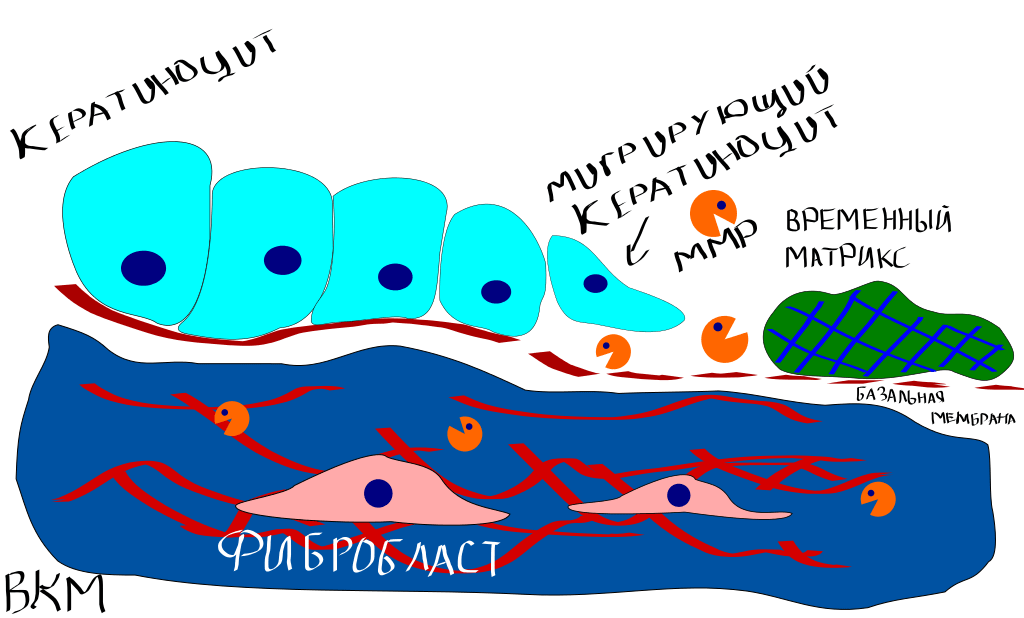
Рисунок 9. Заживление раны на коже. Кератиноциты на самом краю раны должны мигрировать внутрь нее, дабы рана смогла зарасти новыми клетками кожи. Затем богатый фибрином временный матрикс (так называемая «корочка», которая лежит на ране) должен быть разрушен. Дерма также вносит свой вклад в затягивании раны, стягивая ВКМ. Сам же процесс миграции кератиноцитов, как уже можно было догадаться, также опосредован ММП [5], [6].
[6], рисунок адаптирован
Заключение
Взаимодействия клеток с внеклеточным матриксом всё более интересуют исследователей по всему миру. Очевиден прикладной аспект таких исследований — причиной многих заболеваний является нарушение баланса между деградацией и синтезом компонентов внеклеточного матрикса. Например, характер ремоделирования поврежденных тканей сердца после инфаркта миокарда определяет будущую судьбу человека — нарушение тонкого баланса может повлечь как неправильную работу главной насосной станции нашего тела, так и полную ее остановку. Регуляция процесса ремоделирования сердечной ткани есть перспективное направление исследований в регенеративной медицине , которое позволит несколько сократить потребность в серьезных хирургических вмешательствах [7].
Действительно, в последние годы роль микроокружения в развитии всех клеток (в том числе и раковых) внезапно настолько хорошо осозналась, что и само развитие рака, и потенциальные пути его полного излечения начинают искать не только в «сошедших с ума» клетках, но и в их непосредственном окружении: «Опухолевые разговоры, или Роль микроокружения в развитии рака» [8]. — Прим. ред.
Очевидна роль ремоделирования внеклеточного матрикса при метастазировании опухолей — миграция клеток опухоли на большие расстояния невозможна просто напропалую, опухолевой клетке нужны как ориентиры в пространстве, так и средства для расчистки всего, что попадается ей на пути. Отталкиваясь от этого факта можно заключить, что подавления метастазирования рака можно достичь путем ловких манипуляций характером ремоделирования ВКМ в зоне опухоли [9].
Но за всей прикладной «мишурой» скрывается фундаментальный смысл. Попытки напечатать целый паренхимный (вроде почки, печени, где важна микроструктура) орган from scratch не увенчались успехом из-за нерешенной проблемы васкуляризации (построение кровеносной сети внутри органа). Эта проблема может быть решена, если научиться создавать органы так, как они появлялись на начальных этапах нашего индивидуального развития в ходе эмбриогенеза. А здесь уже, несомненно, решающую роль играет динамическое изменение клеточного окружения, естественно, не без участия матриксных металлопротеиназ.
Тот, кто сможет в процессе индукции собрать все частные сведения о построении тканей и органов в нашем теле и сможет объяснить, как все мельчайшие функциональные составные части нашего тела влияют друг на друга и образуют сложнейший из возможных ансамблей в нашей жизни, сможет раскрыть одну из величайших тайн современной биологии.
Литература
- Ross M.H. and Wojciech P. Histology: a text and atlas: with correlated cell and molecular biology (6th Edition). LWW, 2010. — 974 p.;
- Birkedal-Hansen H., Moore W.G., Bodden M.K., Windsor L.J., Birkedal-Hansen B., DeCarlo A. et al. (1993). Matrix metalloproteinases: a review. Crit. Rev. Oral. Biol. Med. 4 (2), 197–250;
- Verma R.P. and Hansch C. (2007). Matrix metalloproteinases (MMPs): chemical-biological functions and (Q)SARs. Bioorg. Med. Chem. 15, 2223–2268;
- Parks W.C., Wilson C.L., López-Boado Y.S. (2004). Matrix metalloproteinases as modulators of inflammation and innate immunity. Nat. Rev. Immunol. 4, 617–629;
- Rodríguez D., Morrison C.J., Overall C.M. (2010). Matrix metalloproteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39–54;
- Vu T.H. and Werb Z. (2000). Matrix metalloproteinases: effectors of development and normal physiology. Genes Dev. 14, 2123–2133;
- Yabluchanskiy A., Li Y., Chilton R.J., Lindsey M.L. (2013). Matrix metalloproteinases: drug targets for myocardial infarction. Curr. Drug Targets. 14 (3), 276–286;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Deryugina E.I. and Quigley J.P. (2006). Matrix metalloproteinases and tumor metastasis. Cancer Metastasis Rev. 25 (1), 9–34.