Вакцинация в контексте «нано»
01 декабря 2015
Вакцинация в контексте «нано»
- 5159
- 1
- 2
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Инфекционные болезни остаются одной из важнейших проблем человечества. Несмотря на значительные успехи в разработке средств лечения и диагностики инфекций, вакцинация является одним из наиболее востребованных биомедицинских методов контроля и предотвращения распространения патогенов. В связи с этим создание новых биологически безопасных вакцинных препаратов и способов усиления их эффективности является актуальным во всем мире. Для улучшения иммуностимулирующих свойств вакцин часто применяют адъюванты — компоненты вакцин, способные усиливать иммунный ответ на вакцинные антигены. Перспективным направлением в разработке новых эффективных адъювантов является создание наноструктурных адьювантов. Они сочетают в себе функции доставки, направляя вакцины для взаимодействия с клетками иммунной системы и иммуностимуляторов, активирующих различные механизмы иммунного ответа. В данной статье повествуется об основных типах таких адъювантов и о том, каким образом они усиливают эффективность вакцинации.
Иммунологическое введение
Двойная помощь иммунной системе
Прежде чем обсуждать, как можно улучшить иммуностимулирующие свойства вакцин, разберемся в чем суть вакцинации. Проще всего это сделать, прочитав статью «Вакцины в вопросах и ответах» [1]. Как известно, иммунная система помогает организму бороться с потенциально вредоносными патогенами. При первом «знакомстве» с патогеном она отвечает запуском врожденного иммунитета и первичных событий адаптивного (приобретенного) иммунного ответа. Система врожденного иммунитета играет роль «первой линии обороны», неспецифически распознавая характерные для патогенных микроорганизмов группы поверхностных молекул. Если она не уничтожает патоген, то в бой вступает адаптивный иммунитет. Он работает более специфично, т.к. его участники распознают не группы чужеродных молекул, а индивидуальные молекулы — антигены. Это придает высокую избирательность приобретенному иммунному ответу. За изучение механизмов иммунитета в 2011 году вручена Нобелевская премия: «Иммунологическая Нобелевская премия (2011)» [2] и «Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года» [3].
На первом этапе адаптивного ответа, протекающем параллельно с активацией факторов врожденного иммунитета, происходит презентация антигена, то есть передача информации об антигене от антигенпрезентирующих клеток (тип клеток врождённого иммунитета) незрелым Т-лимфоцитам. Антигенпрезентирующие клетки обладают способностью к эндоцитозу (в частности, к фагоцитозу), т.е. к поглощению, антигенов, которые затем расщепляются (процессируются) и выставляются на поверхности в комплексе с молекулами главного комплекса гистосовместимости. T-клетки далее превращаются в тот или иной тип зрелых T-клеток, у каждого из которых свои функции. В частности, хелперные T-лимфоциты (T-хелперы) во многом определяют дальнейшее развитие адаптивного ответа. При их участии происходит дифференцировка (специализация) эффекторных клеток иммунитета, собственно участвующих в ликвидации или обезвреживании патогена, и клеток иммунологической памяти. От характера дифференцировки самих T-хелперов, находящейся под влиянием антигенпрезентирующих клеток, зависит преобладание того или иного типа эффекторного иммунного ответа — клеточного, направленного на элиминацию внутриклеточных патогенов (например, вирусов), или гуморального (антителозависимого), играющего основную роль в борьбе с внеклеточными патогенами (например, бактериями) и макропаразитами. Клетки памяти участвуют в более быстром и интенсивном иммунном ответе при повторной встрече иммунной системы с антигеном — вторичном иммунном ответе, который мы в быту обычно и называем «иммунитетом» к болезни.
Переход от первичных стадий адаптивного ответа к эффективному эффекторному иммунному ответу, непосредственно направленному на элиминацию патогенов, занимает, по меньшей мере, несколько дней. От этой задержки зависит успешность борьбы с быстро размножающимися патогенными микроорганизмами, поскольку за это время болезнь может сильно потрепать организм человека. Отсюда следует, что для успешного противостояния организма патогенам надо его подготовить. Такой подготовкой является вакцинация. Вакцинация против инфекционных заболеваний способствует образованию долгоживущих клеток памяти, а также эффекторных молекул, таких как циркулирующие в крови антитела [4]. Иными словами, делая прививку против возбудителя какого-либо заболевания, человек обеспечивает себя необходимыми средствами защиты от него — антителами, клетками памяти и т.п.
Классические вакцины существуют либо в форме аттенуированных (ослабленных), менее патогенных, но размножающихся патогенных организмов (живые аттенуированные вакцины), либо в виде неразмножающихся инактивированных микробов (инактивированные вакцины) или их компонентов (субъединичные вакцины). В случае живых вакцин есть риск реверсии патогенных свойств вакцинного штамма микроорганизма, поэтому другие типы вакцин считаются более безопасными. Однако иммунизация только очищенными антигенами патогенов или инактивированными микроорганизмами часто оказывается недостаточна для достижения длительного иммунитета к заболеванию. По этой причине субъединичные и инактивированные вакцины обычно содержат компоненты, усиливающие иммунный ответ на антигены в их составе, называемые адъювантами (от латинского adjuvare — помогать, усиливать).
Концепция адъювантов уходит своими корнями глубоко в ранние исследования по вакцинации, выполненные в на рубеже XIX и XX века. Еще в 1889 г. Э. Ру (Е. Roux) и А. Йерсен (A. Yersin) отметили стимулирование антителообразования при иммунизации животных дифтерийным антигеном в сочетании с хлористым кальцием [5]. Позднее, в 1916 году, Ле Муаник (E. Le Moignic ) и Пино (E. Pinoy) обнаружили, что суспензия убитых Salmonella typhimurium в вазелиновом масле с ланолином в качестве эмульгатора усиливает иммунный ответ [6]. Но массовое научное развитие это направление получило, начиная с 1920-х годов, когда появилась первая серия работ выдающегося французского иммунолога Г. Рамона (G. Ramon) и его учеников и последователей, изучавших влияние различных неспецифических (неспецифичных к какому-то антигену) стимуляторов иммунитета.
В 1924 г. Рамон обнаружил, что при инъекции лошадям дифтерийного анатоксина (инактивированного токсина), продукция антитоксина (антител к токсину) интенсивнее в том случае, когда в месте инъекции развивается абсцесс [7]. Добавление к анатоксину гноя и микроорганизмов, вызывающих воспаление, с последующей инъекцией также усиливало антителообразование и подтверждало то, что воспаление является причиной стимуляции иммунного ответа. Стимуляция иммунного ответа наблюдалась также при совместном введении анатоксина и химических веществ различной природы, которые вызывали воспаление в месте инъекции (хлористый кальций, хлористый магний, сапонины, агар, тапиока, крахмал, ланолин, растительное масло, холестерин и др.). В 1926 году британский иммунолог А. Гленни (A. Glenny) с коллегами создали вакцину на основе дифтерийного анатоксина и алюмокалиевых квасцов, положив начало длительному, продолжающемуся по сей день применению алюминиевых адъювантов [8]. Рамон назвал эти соединения адъювантами и определил их как вещества, которые в сочетании с определенным антигеном вызывают более сильный иммунный ответ, чем индивидуальный антиген.
«Маленький грязный секрет иммунологов»
Появление адъювантов значительно повысило эффективность вакцинации, а также дало возможность уменьшить количество антигена в составе вакцины и число иммунизаций. К ним относятся вещества различной природы — как синтетические, так и природные, но все их объединяет способность усиливать или регулировать иммуногенность вакцинных белков и пептидов. Тем не менее, выбор адъюванта для конкретной вакцины — дело непростое, т.к. различные адъюванты стимулируют иммунный ответ по-разному. Это определяется как природой самого адъюванта, так и антигеном, входящим в состав вакцины. Следовательно, трудно предсказать, как будет стимулировать иммунитет конкретный адъювант. Более того, есть сложности с предвидением возможных побочных эффектов. По этим причинам известный американский иммунолог Чарльз Джейнуэй назвал адъюванты «маленьким грязным секретом иммунологов» [9].
Следует заметить, что в настоящее время принцип действия многих адъювантов до конца не выяснен. К основным возможным механизмам относят следующие (рис. 1):
- Формирование депо антигена в сайте (месте) инъекции. По мнению Рамона [10], при подкожном введении адъювант вызывает привлечение к месту инъекции клеток крови, в т.ч. лейкоцитов, а также способствует развитию воспалительной реакции. В очаге воспаления происходит активное размножение (пролиферация) клеток соединительной ткани. Увеличение числа клеток способствует удержанию антигена в тканях и замедлению его всасывания в кровь. А чем дольше находится антиген в организме, тем дольше образуются антитела к нему. Данный механизм действия адъювантов известен как эффект депо, обеспечивающий удержание и длительное поступление вакцинного антигена в организм, а также его защиту от разрушения. Однако есть экспериментальные свидетельства того, что само по себе депонирование не всегда обеспечивает существенное усиление иммунного ответа [11]. В таких случаях это может вызвано либо кратковременностью существования депо в месте инъекции, либо тем, что долговременное депо формируется в другом месте.
- Привлечение иммунных клеток в сайт инъекции. Адъюванты способны привлекать иммунные клетки в сайт инъекции. Было показано, что разные адъюванты активируют синтез различных наборов хемокинов — белков, играющих ключевую роль в миграции иммунных клеток. Благодаря этому в месте инъекции образуется воспалительная зона. При этом, в зависимости от типа адъюванта преимущественно рекрутируются те или иные клетки [12]. Кроме того, привлеченные хемокинами антигенпрезентирующие клетки поглощают антиген и отправляются в лимфатические узлы, где они презентируют его T-лимфоцитам [13].
- Влияние на активацию антигенпрезентирующих клеток и усиление поглощения и презентации антигена. На антигенпрезентирующие клетки (АПК) адъюванты могут действовать по-разному. Воздействие может быть как прямым, путем активации в АПК событий, необходимых для запуска адаптивного иммунного ответа (синтез молекул, необходимых для презентации антигена T-лимоцитам — молекул главного комплекса гистосовместимости I или II класса и костимулирующих молекул), так и опосредованным, посредством повышения эффективности поглощения и презентации вакцинных антигенов [11].
- Индукция синтеза иммуномодулирующих цитокинов. Как уже было сказано, антигенпрезентирующие клетки играют роль в направлении развития (дифференцировки) T-хелперов. Для этого они секретируют белки из группы цитокинов. Цитокины — небольшие белки, участвующие во многих процессах врожденного и адаптивного иммунного ответа (хотя они играют важную роль и в других процессах жизнедеятельности). К цитокинам относятся, кстати, вышеупомянутые хемокины. В зависимости от того, какие цитокины преимущественно секретируются АПК, развиваются T-хелперы разных типов. От этого, в свою очередь, зависит преобладающий вид иммунного ответа — клеточный (T-хелперы 1 типа, Th1), гуморальный (T-хелперы 2 типа, Th2) или сбалансированный. Разные адъюванты направляют различные типы иммунного ответа за счет влияния на выработку цитокинов, хотя в ряде случаев наблюдается смешанный ответ [14].
Основной цитокин, выделяемый Th1-лимфоцитами — интерферон-γ — активирует макрофаги и индуцирует синтез B-лимфоцитами опсонизирующих антител (взаимодействующих с поверхностными структурами клеток микробов или заражённых клеток организма, способствуя поглощению их фагоцитами), обусловливая главным образом клеточный тип иммунного ответа. Клеточный иммунный ответ защищает организм от внутриклеточных патогенов путем активации как цитотоксических T-лимфоцитов, убивающих зараженные клетки, так и естественных киллеров (NK-клетки), вызывающих апоптоз опухолевых и зараженных вирусами клеток. Th2-клетки синтезируют цитокины, в том числе интерлейкин-4, индуцирующие синтез нейтрализующих антител B-клетками, инактивирующих антигены, лишая их возможности проявлять патогенное действие. Тем самым происходит запуск гуморального иммунного ответа, который особо важен для защиты от внеклеточных патогенов. Стоит отметить, что адъюванты, стимулирующие преимущественно клеточный Th1-ответ, разрабатываются очень активно, вследствие того, что этот тип иммунного ответа играет главную роль в устойчивости к таким патогенам как вирус гепатита C, ВИЧ, Mycobacterium tuberculosis, а также к онкологическим заболеваниям. Однако необходимо учитывать, что большинство адъювантов, вызывающих клеточный Th1-зависимый ответ, могут обладать локальной или системной токсичностью [15]. - Активация врожденного иммунного ответа. Система врожденного иммунитета распознает группы молекул, характерные для патогенных организмов — патоген-ассоциированные молекулярные паттерны — с помощью паттерн-распознающих рецепторов, например, Толл-подобных рецепторов (Toll-like receptors, TLR). Многие известные адъюванты осуществляют передачу сигнала через рецепторы врожденного иммунитета или служат их лигандами [16]. Адъюванты могут вызывать локальные повреждения тканей и гибель клеток, приводя к образованию «сигналов опасности». Эти сигналы запускают активацию врожденного иммунитета, впоследствии приводя к активации адаптивного иммунного ответа [11]. Одними из рецепторов врожденного иммунитета, распознающих сигналы опасности, являются цитозольные NOD-подобные рецепторы (nucleotide-binding oligomerization domain like receptors). Как и TLR, они играют важную роль в активации врожденного иммунного ответа. Рецепторы этого семейства входят в состав инфламмасомы — комплекса молекул, участвующего в запуске воспалительной реакции путем протеолитической активации (расщепление молекулы-предшественника с образованием функционально активной) провоспалительных цитокинов — ИЛ-1β, ИЛ-18 и, вероятно, ИЛ-33 [17]. В контексте изучения механизмов действия адъювантов наиболее изученным инфламмасомным рецептором является NLRP3.
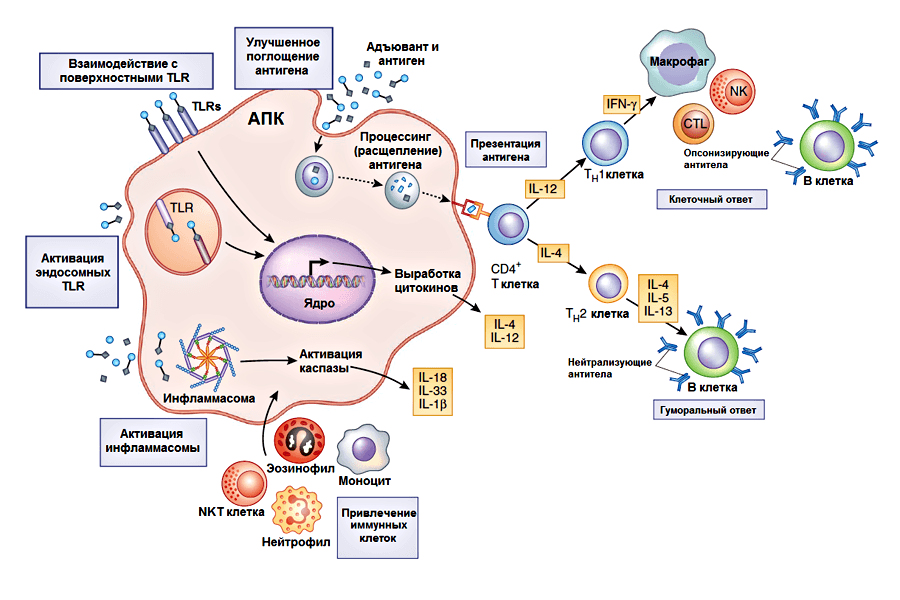
Рисунок 1. Многообразие принципов действия адъювантов. В серых рамочках указаны механизмы действия, а в желтых — цитокины, необходимые для активации процессов иммунного ответа. Детали механизмов описаны в тексте. CTL — цитотоксические T-лимфоциты, NK — естественные (натуральные) киллеры, NKT клетки — популяция T-лимфоцитов, совмещающая большинство функций NK клеток и некоторые функции Т-лимфоцитов. Рисунок из [18].
В рамках данной статьи классификация адъювантов подробно не будет описана, но несколько слов не сказать по этому поводу нельзя. Постоянная разработка новых адъювантов и неоднозначность механизма их действия осложняет их классификацию. Адъюванты делят по источнику получения, по принципу действия, по физико-химическим характеристикам, по способу введения в организм и т. д. Но, несмотря на разнообразие вариантов, существующие адъюванты можно разделить на три большие группы: системы доставки, иммуностимуляторы и комбинированные адъюванты, объединяющие в себе компоненты, отвечающие за доставку и иммуностимуляцию [18]. Первая группа объединяет в себе адъюванты, взаимодействующие с вакцинным антигеном и обеспечивающие его эффективную доставку. Они способны изменять структуру и свойства антигена, усиливать его поглощение антигенпрезентирующими клетками, доставлять антиген в зоны локализации иммунокомпетентных клеток (клеток, взаимодействующих с антигеном), могут выполнять роль депо антигена. Важно отметить, что для адъювантов этой группы характерна корпускулярная природа. Это означает, что они представляют собой небольшие частицы или капли.
Во вторую группу адъювантов входят иммуностимулирующие молекулы, которые стимулируют работу иммунной системы организма. Для большинства из них характерна способность активировать, усиливать и регулировать врожденный иммунный ответ. Они преимущественно являются лигандами Толл-подобных и других рецепторов врожденного иммунитета. Кроме того, в эту группу входят цитокины, которые также могут выступать в роли вакцинных адъювантов.
Таким образом, роль систем доставки заключается в увеличении количества антигена, достигающего клеток, ответственных за запуск иммунного ответа, в то время как иммуностимуляторы напрямую активируют эти клетки. В стремлении создать «идеальный адъювант» исследователи пытаются объединять свойства первых двух групп адъювантов, получая комбинированные «адъюванты нового поколения» [19]. Включение стимуляторов иммунного ответа в состав систем доставки позволяет не только сфокусировать их непосредственно на иммунных клетках, повысить их эффективность, но и минимизировать их воздействие на неиммунные клетки, что делает их более безопасными.
Однако для создания таких «адъювантов нового поколения» не обязательно смешивать компоненты, отвечающие за доставку антигена и иммуностимуляцию. Дело в том, что адъюванты из группы систем доставки часто выполняют также функцию непосредственной стимуляции иммунокомпетентных клеток [18]. Подобная универсальность, скорее всего, обусловлена их корпускулярной природой. Это означает, что адъюванты из первой группы являются по структуре небольшими частицами (корпускулами). Размер этих частиц как правило лежит в нанодиапазоне размеров, что оказывается чрезвычайно важным для механизма их действия.
Нанопомощники
Ни для кого не секрет, что нанотехнологии в наши дни проникли во многие сферы человеческой жизни: от электроники до медицины. Несмотря на спад интереса к финансированию «нанопроектов» в нашей стране, особенно в биологии, нельзя отрицать значимость и перспективность наноматериалов и наночастиц. Несложно заметить, что размеры многих объектов, изучаемых молекулярной биологией, вирусологией, иммунологией и другими биологическими науками, находятся в нанодиапазоне*. И дело тут не в том, есть приставка «нано» или нет, а в том, что огромное количество важных физиологических, биофизических, биохимических процессов осуществляется именно в этом диапазоне.
* — Смыкание естественного масштаба природных субклеточных объектов и недавно достигнгнутого человеком масштаба нанотехнологий порождает ряд интересных вопросов и проблем: «Невидимая граница: где сталкиваются „нано“ и „био“» [20]. — Ред.
Что же обычно понимают под «наноразмерами»? Однозначно не скажешь. Но, поскольку данная статья посвящена биомедицинским проблемам, можно применять критерий Управления по контролю качества пищевых продуктов и лекарственных препаратов США (US Food and Drug Administration), согласно которому размеры наночастиц варьируют от 1 до 1000 нм. И действительно, наночастицы, применяемые в биомедицинских целях, как правило представляют собой коллоидные частицы диаметром 1–1000 нм, состоящие из макромолекулярных соединений (например, полимеров) [21]. Активный компонент — лекарство или биологически активное вещество — может быть растворено в материале наночастицы, заключено внутри (инкапсулировано) нее, и/или прикреплено или адсорбировано на ее поверхности. Многие средства, используемые в современной медицине для адресной доставки лекарств, генной терапии, вакцинопрофилактики, являются по своей природе такими наночастицами. Адъюванты не являются исключением.
Прежде чем обсуждать конкретные наноадъюванты, надо сказать несколько слов о том, как они могут проявлять свою иммуностимулирующую активность. По сути, на них распространяются те же общие принципы действия адъювантов, которые были описаны во введении, но с характерными особенностями. Чтобы не сильно углубляться в этот вопрос, ограничимся тремя основными механизмами (рис. 2), которые позднее будут рассмотрены на конкретных примерах:
- Важным фактором, влияющим на интернализацию (поглощение) антигенов антигенпрезентирующими клетками (макрофагами, дендритными клетками), а значит и на эффективность вакцины, является размер частиц. Дело в том, что АПК преимущественно поглощают антиген, находящийся в составе наночастиц, а не в растворенной форме. Как правило, частицы диаметром свыше 100 нм фагоцитируются АПК в месте инъекции и доставляются ими в лимфатические узлы. А частицы размером менее 50 нм легко проходят через ткани, попадают в лимфатические сосуды (с помощью дренирующей функции лимфатической системы) и в лимфатических узлах поглощаются АПК [21]. Хотя однозначно сказать, как поведет себя частица того или иного размера, очень сложно. Поэтому определение оптимального размера является важным этапом доклинических испытаний адъювантов. Этот механизм является проявлением эффекта «пассивного нацеливания», поскольку наночастицы доставляют антиген просто за счет своей «наноприроды». Различные химические модификации поверхности наночастиц позволяют осуществлять т.н. «активное нацеливание», позволяющее специфически взаимодействовать с нужным типом иммунных клеток. В качестве «молекулярных адресов» (векторов) могут выступать лиганды рецепторов врожденного иммунитета, антитела и другие молекулы [22]. Иногда процессом доставки частиц в организме можно управлять извне [23].
- Эффект депо характерен для биодеградируемых наночастиц, которые по мере своего разрушения высвобождают антиген в течение длительного времени. Это может происходить как в сайте инъекции, так и внутри антигенпрезентирующей клетки после поглощения ею наночастиц. Удержание наночастиц в сайте инъекции происходит не всегда, но это возможно.
- Антигенпрезентирующие клетки могут презентировать антиген, находящийся в составе наночастиц, не только T-хелперам, но T-киллерам (CD8+ T-клетки). Во втором случае происходит перекрестная презентация, о которой будет подробно рассказано позже.
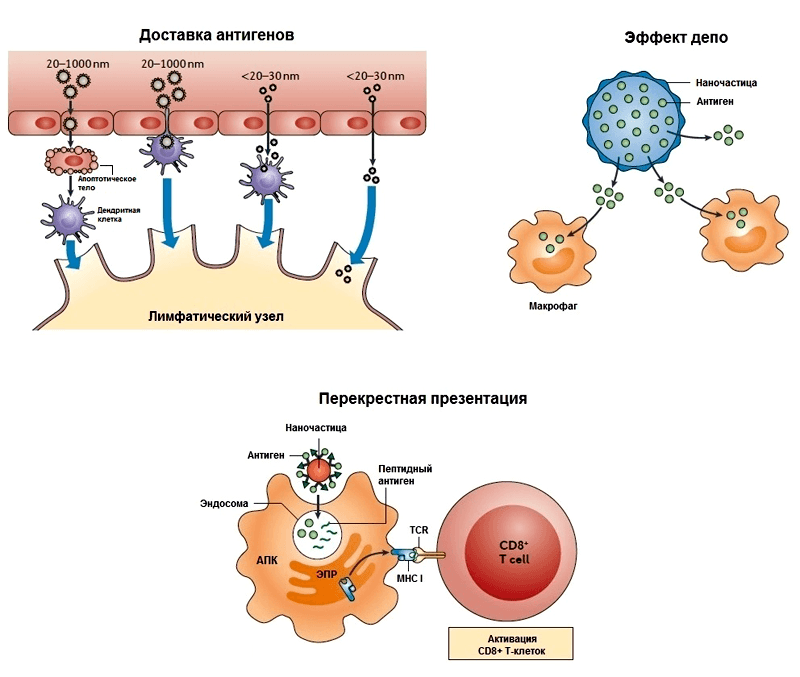
Рисунок 2. Варианты механизмов действия наноадъювантов, обсуждаемые в статье. TCR — T-клеточный рецептор, MHC I — главный комплекс гистосовместимости I класса . Рисунок из [21].
А теперь рассмотрим несколько характерных примеров наноструктурированных адъювантов и постараемся разобраться, как они работают.
Наноэмульсии
Одними из первых разработанных адъювантов являются масляные эмульсии. Они представляют собой комбинации двух несмешиваемых компонентов, обычно воды и масла, один из которых диспергирован (рассредоточен) в составе другого в виде капель. Поскольку в эмульсии сочетаются несовместимые вещества, необходимы стабилизаторы, в роли которых выступают поверхностно-активные вещества и эмульгаторы, покрывающие капли снаружи (рис. 3а). В роли адъювантов применяются так называемые «наноэмульсии» — такие эмульсии, диаметр капель масла или воды в которых составляет 10–1000 нм (в среднем 20–600 нм). Существует два основных типа эмульсий: «масло в воде» (масляно-водные) и «вода в масле» (водно-масляные). Оба типа обладают адъювантной активностью и усиливают выработку антител на вакцинные антигены (это является важным показателем эффективности стимуляции иммунитета), но водно-масляные адъюванты более реактогенны и токсичны. По этой причине масляно-водные адъюванты широко применяются в составе лицензированных человеческих вакцин [24].
Водно-масляные адъюванты, разработанные Ж. Фройндом (J. Freund) в 1930-х годах, являются одними из наиболее известных адъювантов [25]. Полный адъювант Фройнда — это эмульсия типа «вода в масле», содержащая вазелиновое масло, эмульгатор и убитые микобактерии. Неполный адъювант Фройнда отличается отсутствием в своем составе микобактерий. В настоящее время эти адъюванты широко применяются только в лабораторных исследованиях вследствие высокой токсичности [26].
В этой статье преимущественно будут рассмотрены масляно-водные адъюванты. Но не столько потому, что для водно-масляных показаны более выраженные побочные эффекты (этот фактор, по-видимому, зависит также от вакцинных антигенов), сколько из-за сравнительно большого размера капель воды в этих эмульсиях. В среднем, диаметр водных капель в адъювантах Фройнда и других водно-масляных эмульсиях составляет 1 микрометр (хотя бывает и меньше, и больше), а значит это скорее микро-, чем наноадъюванты. В то же время, «наноэмульсиями» чаще называют адъюванты типа «масло в воде», т.к. средний размер капель масла в них обычно находится в пределах от 100 до 500 нм [27].
Большинство масляно-водных адъювантов современных вакцин в качестве масляного компонента содержат сквален — органический полимер из группы каротиноидов. Он является компонентом животных и растительных клеток, промежуточным соединением в биологическом синтезе стероидов, а также синтезируется рядом микроорганизмов. Эти факторы обусловливают биосовместимость и биодеградируемость сквалена. В косметологии, кстати, сквален используется в качестве увлажняющего средства и антиоксиданта. До недавнего времени основным его источником служила печень акул. Однако после обнаружения сквалена в растениях его стали получать из растительных масел, поскольку технология выделения сквалена из печени акулы весьма трудоемкая. В отличие от минеральных масел, входящих в состав многих водно-масляных эмульсий, сквален гораздо быстрее метаболизируется (расщепляется) в организме, а значит, он более биодеградируем и биосовместим.
Примером масляно-водного адъюванта является MF59. Он представляет собой наноэмульсию сквалена в цитратном буферном растворе, стабилизированную поверхностно-активными веществами (Tween 80 и Span 85), образующую стабильные капли диаметром около 160 нм (Рис. 3б). В Европе MF59 лицензирован для применения в составе клинической противогриппозной вакцины FLUAD®, которая была введена внутримышечно десяткам миллионов людей разных возрастных категорий.
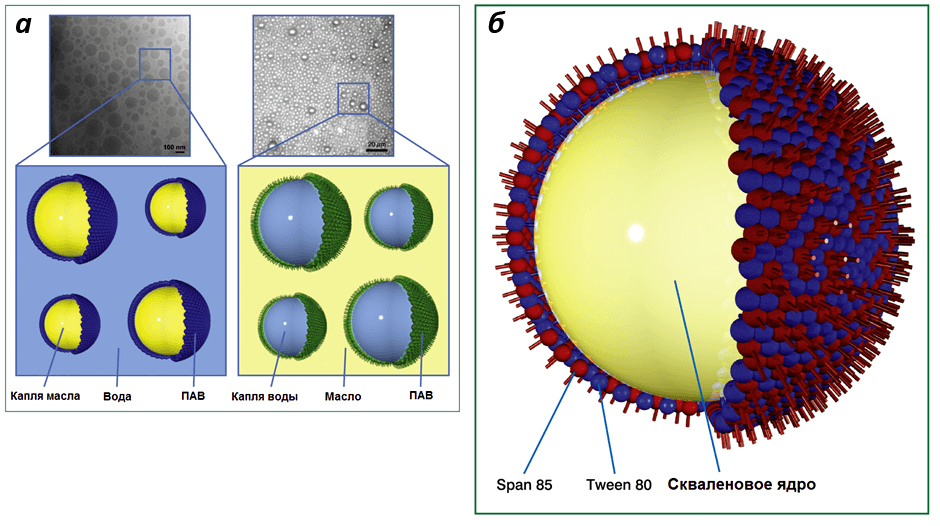
Рисунок 3. Строение наноэмульсий. а — электронные микрофотографии и схемы эмульсий «масло в воде» (слева) и «вода в масле» (справа); б — схема капли масляно-водного адъюванта MF59. Рисунок из [24].
Разберемся, как MF59 работает, попадая в составе вакцины в организм [28, 29]. Надо сразу уточнить, что нельзя сказать со стопроцентной уверенностью, что описанная последовательная схема действия будет в действительности таковой. Все зависит от конкретного человека, от конкретной вакцины, от места инъекции и т. д. Как бы то ни было, на основании существующих экспериментальных данных можно представить себе этот механизм следующим образом (рис. 4). После внутримышечного введения вакцины MF59 и вакцинные антигены поглощаются фагоцитами (в том числе антигенпрезентирующими клетками), привлекаемыми к месту инъекции. Эффективность подобного фагоцитоза обусловлена, по-видимому, тем, что антигенпрезентирующие клетки (АПК) преимущественно поглощают объекты нано- и микроразмеров. Клетки, «поглотившие» MF59, в ответ вырабатывают хемокины, которые привлекают моноциты, гранулоциты и другие иммунные клетки из кровяного русла к месту инъекции. Благодаря хемокинам количество рекрутируемых клеток постоянно увеличивается по принципу положительной обратной связи. В результате формируется иммунокомпетентная зона (immunocompetent environment), в которой под действием MF59 концентрируются иммунные и другие клетки.
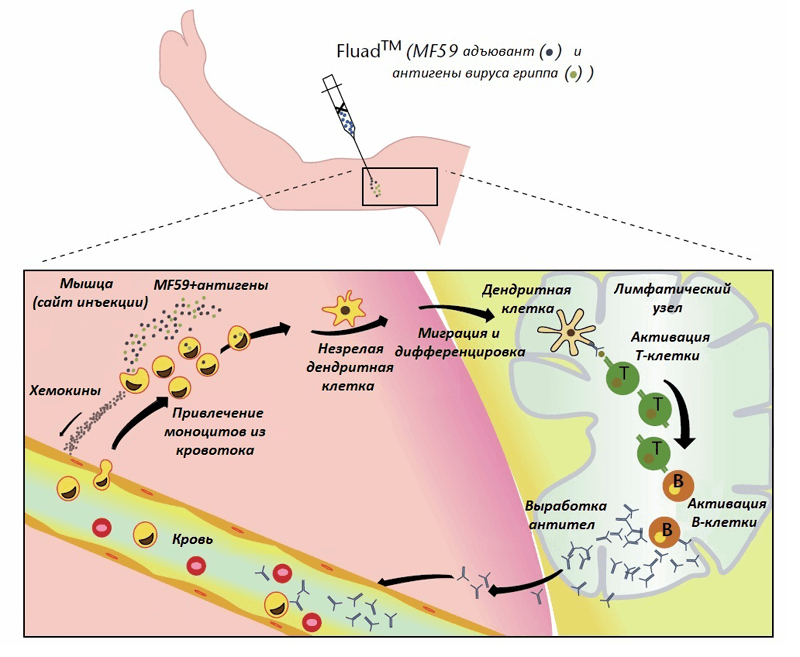
Рисунок 4. Предполагаемый механизм действия масляно-водного адъюванта MF59 в составе вакцины против гриппа FLUAD® (подробности в тесте). Рисунок из [29].
Макрофаги (в том числе те, которые образовались из моноцитов крови), поглотившие антиген, в дальнейшем могут выступать в роли АПК и мигрировать в лимфатические узлы. Моноциты под действием MF59 могут дифференцироваться в другой тип АПК — дендритные клетки, которые отправляются в лимфатический узел и там презентируют антиген незрелым T-хелперам, что приводит к активации последних. T-хелперы, в свою очередь, активируют B-клетки, отвечающих за секрецию антител против антигена, которые поступают в кровь и обеспечивают защиту от инфекции и болезни. Сравнительно недавно было выдвинуто предположение (на основе экспериментальных данных) о том, что MF59 способен оказывать активирующее действие на мышечные клетки [30]. Известно, что скелетные мышцы могут участвовать в локальных иммунных реакциях и синтезировать провоспалительные цитокины, хемокины, Толл-подобные рецепторы, молекулы адгезии. А значит, именно они могут быть клетками, первично взаимодействующими с адъювантом и запускающими систему с положительной обратной связью.
Таким образом, MF59 выполняет функции как системы доставки, способствуя захвату и транспорту антигена в лимфатические узлы для его презентации T-клеткам, так и иммуностимулятора, вызывающего дифференцировку АПК. Но не все так гладко. Во-первых, остается не решенным вопрос, каким-образом MF59 способствует поглощению антигенов, входящих в состав вакцины. Адъювант, по-видимому, способствует фагоцитозу антигена, но не ясно как. Можно было бы предположить, что антигены адсорбируются на поверхности наночастиц MF59 за счет физико-химических взаимодействий, однако эта гипотеза не была подтверждена. Может быть, образуется просто смесь адъюванта и антигена, но пока они не успели далеко разойтись, фагоцитирующие клетки поглощяют их (обоих или каждого по отдельности).
Во-вторых, не ясно, какой именно компонент адъюванта — сквален, Tween 80, Span 85 или мцитратный буфер — является активным компонентом, отвечающим за адъювантную активность. Было показано, что все вышеуказанные эффекты MF59 — увеличение притока клеток, усиление фагоцитоза антигена и активация макрофагов в сайте инъекции, дифференцировка моноцитов в дендритные клетки, «доставка» антигена в лимфатические узлы, повышение выработки антител — проявляется только тогда, когда все компоненты входят в его состав. И все же, было продемонстрировано, что Span 85 способствует активации транскрипции генов в мышечных клетках сайта инъекции (что является еще одним принципом действия MF59) [31]. Скорее всего, решение обеих проблем кроется в наноструктуре MF59 и других масляных адъювантов.
Несмотря на нерешенные вопросы, MF59 показал себя как эффективный вакцинный адъювант. По сравнению с алюминиевыми адъювантами, широко используемыми в современных лицензированных вакцинах, он лучше стимулирует гуморальный и Th1-зависимый клеточный иммунный ответ с широким протективным действием (т.е. обеспечивающим защиту не только от вакцинного штамма вируса, но и от других антигенных вариантов). Не может также не радовать, что при вакцинации против пандемических вариантов вируса гриппа (например, H5N1) MF59, в отличие от алюминиевых адъювантов, обеспечивает протективный противовирусный иммунитет в сочетании с относительно небольшими дозами вирусных антигенов [28].
В заключение разговора о наноэмульсиях рассмотрим еще один пример такого адъюванта — W805EC. В отличие от MF59 в его состав вместо сквалена входит соевое масло (рис. 5). В процессе приготовления адъюванта образуются капли диаметром 400 нм [32].
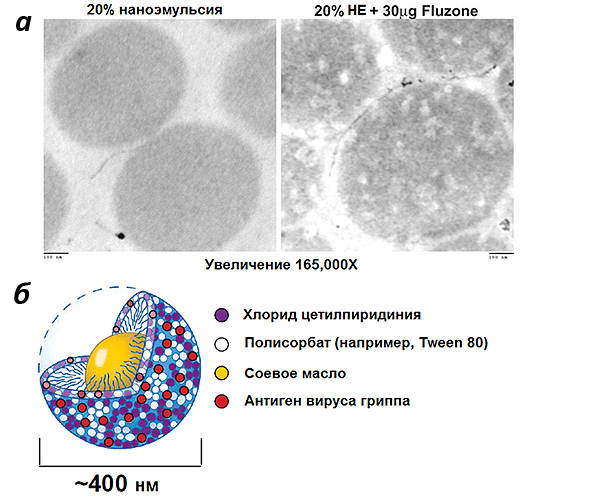
Рисунок 5. Масляно-водная эмульсия W805EC. а — фотографии 20%-адъюванта без и с 30 мкг противогриппозной вакцины Fluzone®, полученные методом просвечивающей электронной микроскопии. Поскольку вакцинные антигены находятся внутри капель, они выглядят светлыми; отдельные молекулы антигенов снаружи от частиц выглядят темными. б — схема строения капли W805EC (хлорид цетилпиридиния и полисорбат стабилизируют эмульсию). Рисунки из [32] и с сайта nanobio.com.
На животных, а также недавно на человеке, было продемонстрировано, что W805EC усиливает взаимодействие вакцинных антигенов с клетками иммунной системы (система доставки) и запускает сильные клеточный, гуморальный и мукозный (иммунитет слизистых оболочек) иммунные ответы при интраназальном введении противогриппозной вакцины Fluzone® [33]. Здесь следует пояснить: вирус гриппа относится к патогенам, проникающим в организм человека через слизистые оболочки верхних дыхательных путей, поэтому велика роль местного мукозного иммунного ответа. Существует две линии защиты от вирусных инфекций в наших верхних дыхательных путях: секреторные иммуноглобулины A (S-IgA), препятствующие вирусной инфекции, и иммуноглобулины G (IgG), помогающие S-IgA боротся с инфекцией, нейтрализуя новообразованные вирусные частицы.
Обычные вакцины против гриппа, вводимые внутримышечно, индуцируют выработку IgG-антител, которые попадают в нижние дыхательные пути, запуская системный иммунный ответ и защищая вакцинированного человека от летальных инфекций. В то же время, мукозная иммунизация приводит преимущественно к местному мукозному ответу. Она специфически действует на слизистые оболочки, вызывая локальную выработку IgG-антител в верхних дыхательных путях, нейтрализуя вирусы в местах их проникновения в организм. Системную выработку антител (IgG) такая иммунизация тоже вызывает. Но вернемся к нашему адъюванту. Активность W805EC прямо зависит от сохранения наноструктуры эмульсии («нанокапель») и от положительного заряда, содействующего связыванию с поверхностью капель отрицательно заряженных белков, например муцинов (белков, входящих в состав слизистых выделений эпителиальных клеток).
Наноразмерность и положительный заряд частиц способствуют их прохождению через слой слизи, покрывающий слизистую оболочку, связыванию с мембранами эпителиальных клеток и эндоцитозу (поглощению), а в итоге — запуску врожденного и адаптивного иммунитета (рис. 6) [34]. Выработка цитокинов клетками реснитчатого эпителия слизистой носа и клетками назально-ассоциированной лимфоидной ткани ведет к поглощению дендритными клетками антигена, их активации и миграции [35]. Интересно, что наноэмульсии способны индуцировать апоптоз и некроз эпителиальных клеток и одновременно активируют синтез кальретикулина на их поверхности, что являющется «приказом» к гибели. Дендритные клетки и другие фагоциты поглощают погибшие, содержащие антиген эпителиальные клетки. Таким образом эпителиальные клетки выступают в роли своеобразного «вторичного адъюванта», усиливающего эффект наноэмульсии [35, 36].
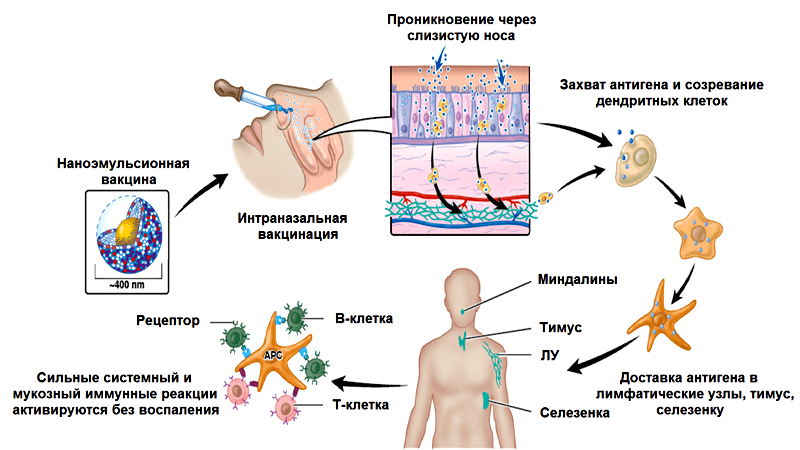
Рисунок 6. Механизм действия наноэмульсионного адъюванта W805EC (подробности в тексте). Схема из презентации с сайта nanobio.com.
Липосомы
Еще одним примером систем доставки являются липосомы — это искусственно созданные везикулы (пузырьки) диаметром от 10 нм до нескольких микрон, состоящие из одного или нескольких липидных бислоев. Способность липосом выступать в роли иммунологических адъювантов была впервые установлена в 1974 году, когда при иммунизации мышей дифтерийным анатоксином, заключенным внутри липосом, наблюдался сильный гуморальный ответ, по сравнению со свободным анатоксином без липосом. При этом в месте введения вакцины не наблюдалось образование гранулем — небольших воспалительных образований, которые изолируют адъювант и антиген, которые часто возникают при использовании алюминиевых и водно-масляных адъювантов [37]. Более того, применение липосом препятствовало развитию реакций гиперчувствительности (повышенная чувствительность к антигену) у мышей. Адъювантные свойства были также показаны для сходных с липосомами ниосом (везикулы, состоящие из неионных поверхностно-активных соединений) и виросом (однослойные липосомы, содержащие в составе своей мембраны вирусные белки (в том числе белки, необходимые для слияния мембран вируса и клетки)). Вакцинный антиген может быть инкапсулирован (заключен внутри), встроен в мембрану липосомы или адсорбирован на ее поверхности (рис. 7) [18].
Функциональность липосом во многом определяется их физико-химическими свойствами. Одним из таких свойств является заряд. Откуда он возникает? Молекулы липидов, входящих в состав липосом, обычно состоят из неполярной гидрофобной части и заряженной полярной части. Заряд полярной части может быть отрицательным, нейтральным или положительным. Так вот на адъювантное этот заряд оказывает очень важное влияние. Как показывают многочисленные исследования in vivo, адъювантная активность катионных (положительно заряженных) липосом выше, чем у анионных (отрицательно заряженных) и нейтральных липосом. Это связывают с высокоэффективным взаимодействием между катионными частицами и отрицательно заряженными молекулами на поверхности антигенпрезентирующих клеток. В то время как анионные липосомы взаимодействуют с очень небольшим количеством дендритных клеток (как человеческих, так и мышиных) in vitro, в то время как катионные липосомы в большом количестве обнаруживаются внутри клеток.
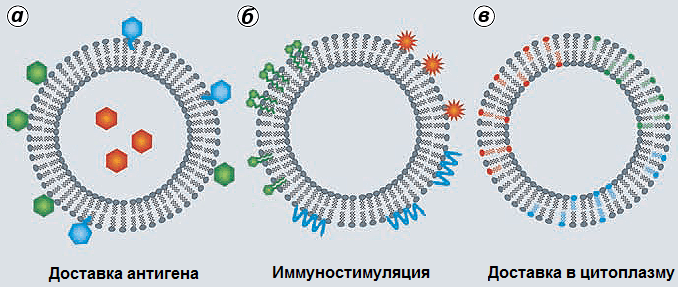
Рисунок 7. Дополнительные элементы липосом. В липосомы могут быть встроены не только антигены (а), но и иммуностимулирующие соединения (например, адъюванты второй группы) (б) и липиды (например, DOPE) , обеспечивающие слияние липосом с мембранами клетки и выход антигена и/или иммуностимулятора в цитоплазму антигенпрезентирующих клеток (в). Рисунок из [39].
Поговорим подробнее о катионных липосомах. Их диаметр, как, впрочем, и у других видов липосом, как правило, составляет 200–1000 нм. Положительный заряд и липидный состав важны для эффективной сорбции антигенов на поверхности липосом в процессе приготовления вакцины, для задержки в месте инъекции, для активации антигенпрезетирующих клеток и для иммуногенности вакцины (включая способность запускать клеточный иммунный ответ). Катионные липиды, входящие в состав таких адъювантов, подразделяются на четвертичные аммониевые соединения (DDA, DOTAP), производные холестерина (DC-Chol), производные имидазола (DOTIM), производные ди-C14-амидина и другие соединения, такие как дибегенат трегалозы (TDB), который является синтетическим аналогом димиколата трегалозы, являющегося компонентом клеточной стенки микобактерий и активатором врожденного иммунитета [21].
Часто эти липиды сами по себе оказывают иммуностимулирующее воздействие, что делает липосомы на их основе комбинированными адъювантами, сочетающими функции систем доставки и иммуностимуляторов. Про димиколат трегалозы уже сказали. Кроме него есть и другие примеры. Так, ди-C14-амидин, связываясь с Толл-подобным рецептором 4 (TLR4) или с его вспомогательными молекулами (CD14, MD2, LPB), активирует TLR4-зависимый путь активации иммунного ответа, вызывая синтез Th1-цитокинов. Другой катионный липид DOTAP могут связываться с рецептором, сопряженным с G-белком (G protein-coupled receptor, GPCR), на поверхности дендритных клеток, запуская MAPK-сигнальные пути (в таких путях сигнал от рецептора передается через молекулы митоген-активируемых протеинкиназ (MAPK)) и приводя к синтезу цитокинов Th1-иммунного ответа и костимулирующих молекул [38].
Поскольку разные липидные компоненты придают липосомам особый механизм действия, их вариации позволяют регулировать тип, качество и силу стимулируемого иммунного ответа. Кроме того, в состав катионных липосом часто входят дополнительные компоненты — стабилизаторы, иммуностимуляторы и липиды, обеспечивающие слияние с клеточными мембранами (рис. 7б, 7в) [39]. В роли иммуностимуляторов могут выступать соединения, относящиеся к адъювантам второго типа, например, монофосфорил липид A и лиганды Толл-подобных рецеторов. При этом липосомы повышают эффективность и уменьшают токсичность иммуностимуляторов [21]. Принимая во внимание вышеизложенные факты, можно сделать вывод: кроме усиления захвата антигена клетками (рис. 8), сложно выделить какой-то общий «консенсусный» механизм действия липосом, так как он во многом зависит от состава липосом, от их физических параметров, а также от антигена.
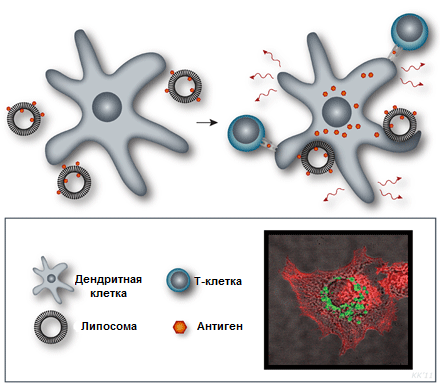
Рисунок 8. Катионный липосомальный адъювант CAF01. Липид DDA в его составе способствует захвату и презентации антигена дендритными клетками (система доставки), а TDB взаимодействует с рецептором врожденного иммунитета CLEC-4, активируя клеточный иммунный ответ. На конфокальной микрофотографии изображена дендритная клетка (красным показаны ее актиновые микрофиламенты) с поглощенным антигеном (зеленый), находящемся в эндосомах. Схема с сайта Statens Serum Institut.
Но все-таки пару замечаний по поводу принципов действия сделать можно [40]:
- Проникновение катионных липосом в клетку: изначально считалось, что липосомы связываются с поверхностью клетки и сливаются с цитоплазматической мембраной, высвобождая антиген в цитоплазму, однако сейчас считается, что это активный процесс, при котором сначала происходит эндоцитоз липосом, которые затем либо сливаются с мембраной эндосомы, либо постепенно разрушаются. На примере DDA-липосом (DDA = диметилдиоктадециламмоний) было экспериментально доказано, что процесс интернализации липосом представляет собой актин-зависимый эндоцитоз. Более того, есть сведения о том, что DDA-липосомы и другие катионные липосомы взаимодействуют с протеогликанами на поверхности дендритных клеток, такими как гепаран сульфаты. Последние играют роль рецепторов, взаимодействие с которыми приводит к эндоцитозу макромолекул.
- Эффект депо: изучение катионных липосом на основе липидов DDA и TDB показало, что удержание в месте инъекции обусловлено электростатическим взаимодействием положительно заряженных липосом и отрицательно заряженными (суммарно) клетками и белками. В результате образуется сеть катионных липосом, задерживающих высвобождение антигена. Интересно, что «покрытие» полиэтиленгликолем (который является очень гидрофильным) препятствует агрегации и длительному депонированию антигена, а также ведет к переключению иммунного ответа с клеточного (Th1) на гуморальный (Th2).
ИСКОМы
Большой группой адъювантов, активно изучаемых в настоящее время по причине их биосовместимости и биодеградируемости являются адъюванты растительного происхождения. К ним относится широкий спектр соединений различной химической природы, встречающихся у растений и обладающих сильными иммуностимулирующими свойствами. Исторически первыми растительными соединениями, для которых была доказана иммуностимуляторная роль являются сапонины (от латинского sapo — мыло). Химически они относятся к гликозидам и обладают широким спектром биологических и фармакологических активностей. Впервые адъювантные свойства сапонинов, а именно неочищенного экстракта сапонинов мыльного дерева (Квиллайя мыльная, Quillaja saponaria Molina), открыл Рамон, который в 1926 году впервые испытал его в качестве адъювантной добавки к дифтерийному и столбнячному анатоксину [41]. В 1930-х годах началось изучение экстракта мыльного дерева в качестве адъюванта к вакцине против вируса ящура, а в 1951 году начали массово производить противоящурную вакцину с сапонинами [42–44].
В 1978 году из коры мыльного дерева была получена обогащенная смесь сапонинов (Quil A), способная эффективно стимулировать гуморальный и клеточный иммунитет [45]. Quil A долгое время использовался в ветеринарии для профилактики ящура и в некоторых экспериментальных вакцинах. Однако сложность получения, токсичность и способность вызывать различные местные реакции препятствовали его широкому использованию в человеческих вакцинах. С тех пор многочисленные методы очистки были применены к неочищенным сапонинам мыльного дерева в попытке отделить нетоксичные иммуностимулирующие сапонины от токсичных. Так, путем очистки была получена фракция сапонинов QS-21, обладающая сравнительно низкой токсичностью и достаточно эффективно стимулирующая иммунный ответ (особенно клеточный) [46]. Однако, несмотря на высокий адъювантный потенциал, существуют два важных ограничения в применении сапонинов. Во-первых, они обладают гемолитической активностью, что приводит к нежелательным побочным эффектам. А во-вторых, в щелочных условиях от молекул сапонинов отщепляются химические группы, важные для адъювантной активности, из чего следует, что при физиологическом значении pH = 7,4 (при котором протекают многие процессы в организме) сапонины нестабильны [4].
Решением этих проблем стало смешивание сапонинов и антигена с холестерином и фосфолипидами с образованием иммуностимулирующих комплексов (ИСКОМов, ISCOMs), представляющих собой сферические, напоминающие клетки (cage-like) структуры диаметром 30–40 нм (рис. 9). В результате получились частицы, которые объединили в себе функцию систем доставки, характерную для наночастиц, и иммуностимулирующие свойства сапонинов [47]. В основе уникальной структуры лежит взаимодействие молекул холестерина и сапонина, которые формируют стабильные кольцевидные структуры в воде в процессе приготовления адъюванта. Соединяясь, они формируют наночастицы, похожие на футбольные мячи. При этом антигены могут быть прикреплены к внутренней или наружной поверхности с помощью своих гидрофобных участков. В связи с этим, гидрофильные белки приходится модифицировать для того, чтобы они могли встраиваться в ИСКОМы. Фосфолипиды ослабляют связи между молекулами холестерина и сапонина и тем самым способствуют заключению вакцинных белков в ИСКОМы. Поскольку классические ИСКОМы заряжены отрицательно, были разработаны положительно-заряженные варианты, например ПЛЮСКОМы (PLUSCOMs).
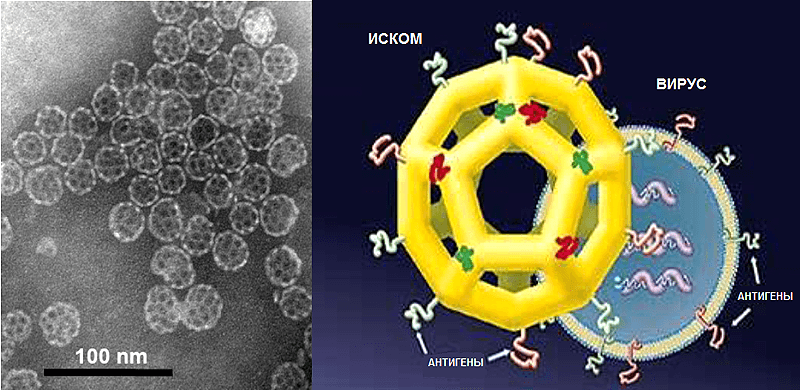
Рисунок 9. Иммуностимулирующие комплексы (ИСКОМы). Слева: фотография комплексов, полученная методом просвечивающей электронной микроскопии. Справа: схемы ИСКОМа и вируса — видно сходство размера и структуры, которое, вероятно, лежит в основе механизма действия ИСКОМов.
Соединение антигена и адъюванта в одной частице играет важную роль в высокой иммуногенности ИСКОМов. На примере различных антигенов была доказана безопасность ИСКОМ-вакцин для животных, их высокая иммуногенность и эффективность, а также была выявлена их способность индуцировать гуморальный и клеточный иммунный ответ [48]. Преимущественно, и это очень важно в случае вакцинации против внутриклеточных патогенов, таких как вирусы, ИСКОМы стимулируют цитотоксический клеточный ответ, связанный с T-киллерами (цитотоксические T-лимфоциты). При иммунизации животных ИСКОМ-вакцины вызывали выработку цитокинов, характерных для Th1-иммунного ответа, и IgG2a-антител, обладающих высокой вируснейтрализующей емкостью и способствующих антителозависимой клеточной цитотоксичности и опсонизации (облегчение фагоцитоза патогена путем адсорбции на его поверхности, соотвтественно, антител или белков-опсонинов). Кроме того, ИСКОМы обеспечивают долговременность протективного иммунитета против разных патогенов. Эти данные свидетельствуют о высоком потенциале ИСКОМов в разработке адьювантов для человеческих вакцин.
Для облегчения массового производства вакцин в 1989 году была разработана технология ИСКОМАТРИКС, которая отличается от ИСКОМов тем, что не требует включения в состав частиц антигена [49]. ИСКОМ-вакцины формируются при смешивании антигена с преформированным (заранее созданным) ИСКОМАТРИКС-адъювантом. ИСКОМАТРИКС сразу же зарекомендовал себя как иммуностимулятор, способный индуцировать значительный клеточный иммунный ответ у приматов [50]. После оптимизации новой технологии был создан ряд экспериментальных человеческих ИСКОМАТРИКС-вакцин (рис. 10): вакцины, содержащие вирус-специфические белки вируса гриппа и очищенные рекомбинантные антигены, такие как слитый белок E7E6 вируса папилломы человека 16 субтипа (Human papillomavirus 16 E6E7 fusion protein) [51], коровый белок вируса гепатита C, раково-семенниковый антиген NY-ESO-1 [52]. В ходе клинических испытаний было показано, что даже при небольших дозах антигена (5 мкг) наблюдался сильный гуморальный иммунный ответ у всех исследуемых людей, иммунизированных ИСКОМАТРИКС-вакцинами, содержащими HPV16 E6E7 или коровый белок вируса гепатита C. T-клеточный ответ также наблюдался у большинства испытуемых [52]. Таким образом, в настоящее время начался этап клинических испытаний ИСКОМ-вакцин, иммуногенных и безопасных для людей.
Механизм индукции ИСКОМами и ИСКОМАТРИКСОМ долговременного ЦТЛ-ответа полностью не выяснен. Сапонины сами по себе обладают адъювантной активностью, но оптимальный цитотоксический клеточный ответ достигается только когда антиген физически ассоциирован с ИСКОМами. Это может быть связано с тем, что ИСКОМы являются наночастицами, которые легко поглощаются антигенпрезентирующими клетками (макрофагами и дендритными клетками).
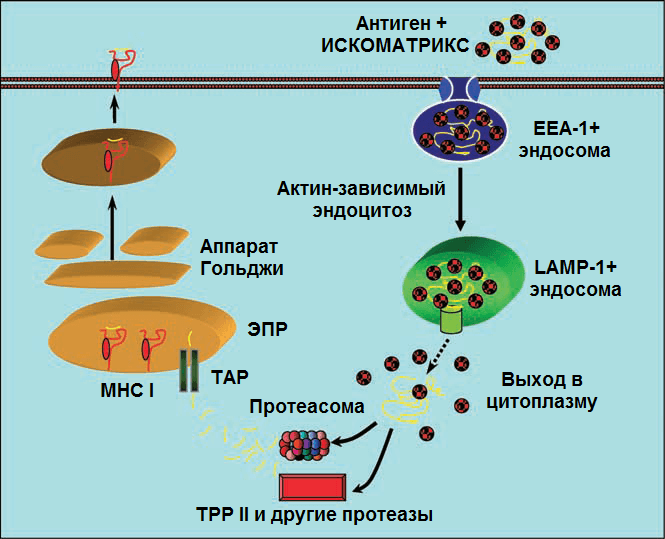
Рисунок 10. Предполагаемая схема действия ИСКОМАТРИКС-вакцины (подробности в тексте). Рисунок из [53].
Однако скорее всего наностуктура ИСКОМов обусловливает, как и в случае других наноадъювантов, захват их антигенпрезентирующими клетками. А что происходит после поглощения клеткой адъюванта? Во введении в свое время было упомянуто, что для презентации антигена T-лимфоцитам АПК синтезируют молекулы главного комплекса гистосовместимости I или II класса (major histocompatibility complex (MHC)). Наступил момент раскрыть значение этого термина.
Молекулы MHC I присутствуют на всех клетках организма. Они связывают и презентируют пептиды внутриклеточного происхождения (в т.ч. вирусные), транспортируемые в эндоплазматический ретикулум — место синтеза MHC — из цитоплазмы. Молекулы MHC II есть только на АПК и презентируют пептиды, попадающие в клетку в результате эндоцитоза. Комплекс антигенный пептид—MHC распознается T-клеточными рецепторами при участии корецепторов — CD4 или CD8, обладающих сродством соответственно к молекулам MHC II и MHC I (но не к антигенному пептиду). Таким образом, антигенный пептид в составе молекул MHC I распознают Т-клетки, несущие корецептор CD8, а в составе MHC-II — Т-клетки, несущие CD4. По наличию того или иного корецептора выделяют CD4+ и CD8+ T-клетки.
После стимуляции антигеном CD4+ Т-клетки выступают в качестве T-хелперов, а CD8+ Т-клетки — в качестве T-киллеров. Возникает вопрос: если ИСКОМ- и ИСКОМАТРИКС-вакцины проникают в антигенпрезентирующую клетку извне, путем эндоцитоза, то как активируется ЦТЛ-иммунный ответ, связанный с CD8+ T-клетками и MHC I? Этот вопрос волновал иммунологов не только в контексте проблемы ИСКОМов. Ответом на этот вопрос послужило описание перекрестной презентации (cross-presentation). На рис. 10 этот механизм показан на примере ИСКОМАТРИКСа [53]. Комплексы вакцинных белков с ИСКОМАТРИКС-частицами, поступившие из внеклеточной среды в ранние EEA-1+ эндосомы, а затем в поздние LAMP-1+ эндосомы (после слияния эндосом с LAMP-1+ лизосомами), могут проникнуть в цитоплазму. По-видимому, именно ИСКОМАТРИКС транспортирует антиген в цитозоль, взаимодействуя с липидами мембран эндосом (какой из компонентов адъюванта — сапониновый или липидный — за это отчечает, формируются ли при этом поры или каналы в мембране пока не ясно).
В цитоплазме антигены расщепляются протеасомами или протеазами (например, протеазой TPP1) до небольших пептидов, которые транспортируются с помощью белка TAP в эндоплазмтический ретиклум. В ретикулуме пептидные фрагменты этих экзогенных белков встраиваются в молекулы MHC I и затем транспортируются на мембрану АПК. А дальше АПК презентирует антиген незрелым CD8+ T-лимфоцитам, которые дифференцируются в цитотоксические T-клетки.
И в заключении небольшая ремарка: подобный механизм кросс-презентации характерен для адъювантов, которые могут заключать в себе антиген и сливаться с мембранами клетки (в т.ч. цитоплазматической) или повреждать их. К таким адъювантам относятся кроме ИСКОМов липосомы, обладающие способностью сливаться с мембранами, полимерные наночастицы, виросомы, вирусоподобные частицы [54]. О двух последних будет рассказано ниже.
Полимерные наночастицы
За последние 30 лет на основе различных полимеров и сополимеров были созданы наночастицы. Среди них биодеградируемые полимерные наночастицы особенно привлекают внимание биологов и врачей, поскольку могут применяться для адресной доставки лекарств, генов, вакцин. Они обладают субклеточным размером (10–1000 нм), биологической совместимостью с тканями и клетками, способностью контролируемо и в течение длительного времени высвобождать содержащиеся в них биологические молекулы. Наночастицы хорошо защищают инкапсулированные в них соединения от воздействия экстремальных значений pH среды, панкреатического сока и желчи [55].
В контексте данной статьи важно заметить, что они также увеличивают иммуностимулирующие свойства вакцинных антигенов, т.е. выполняют функцию адъювантов. Как и другие примеры наноадъювантов, они сочетают в себе функции доставки, обеспечивая захват антигена определенными клетками и стимуляции активации антигенпрезентирующих клеток. Антиген, как правило, находиться внутри частиц, но может сидеть на их поверхности (поверхностная локализация поддерживается электростатическими взаимодействиями или осуществляется химическим пришиванием молекул антигена к наночастицам).
Полимерные частицы делают из самых разных природных и синтетических полимеров. Наиболее изученными являются поли(лактид-со-гликолид) (poly(lactide-co-glycolic acid, PLGA), полилактид (poly(lactic acid), PLA), поликапролактон (poly(ε-caprolactone), PCL) и полисахариды (например, хитозан) [56]. Эти вещества хорошо охарактеризованы и, в частности, PLGA входит в состав ряда биомедицинских изделий. Изначально нано- и микрочастицы PLGA использовались для направленной доставки лекарств. Впоследствии возможность контролируемого высвобождения инкапсулированных антигенов позволила использовать их как потенциальные безопасные адъюванты. Безопасность обусловлена биодеградируемостью: при попадании в организм частиц поли(лактид-со-гликолида) происходит гидролиз сополимера молочной и гликолевой кислот с образованием биологически совместимых и участвующих в обмене веществ молекул молочной и гликолевой кислот, которые, в конечном счете, выводятся из организма посредством цикла Кребса [56].
Кроме химической структуры полимера при создании конкретной вакцины следует учитывать, что на взаимодействие наночастиц с иммунной системой влияют их физические параметры: размер, поверхностный заряд, гидрофобность/гидрофильность. В результате, меняя материал частиц и модифицируя их поверхность можно добиться необходимого влияния на иммунный ответ [57]. Например, размер [58]. Было показано, что полилактидные микрочастицы с инкапсулированным поверхностным антигеном вируса гепатита B (HBsAg) диаметром 2–8 мкм садятся на поверхность макрофагов и вызывают длительную и сильную выработку антител. Кроме того, они стимулируют выработку интерлейкина-4 — цитокина, характерного для гуморального Th2-иммунного ответа — и синтез молекул MHC II. С другой стороны, наночастицы размером 200–600 нм эффективно поглощаются макрофагами и приводят к меньшей выработке антител, в то же время стимулируя синтез MHC I и характерного для клеточного Th1-ответа интерферона-γ. Возможно, наночастицы преимущественно работают по принципу перекрестной презентации, а микрочастицы сорбируются на антигенпрезентирующих клетках и способствуют эндоцитозу высвобождающихся из них антигенов. В тоже время, частицы поли(лактид-со-гликолида) диаметром 1000 нм, заполненные бычьим сывороточным альбумином, эффективнее стимулируют выработку антител, чем частицы диаметром 200 и 500 нм.
И наконец, кратко об иммунологических механизмах [59]. Полимерные наночастицы способны стимулировать как гуморальный, так и клеточный иммунный ответ и делают они это посредством следующих основных механизмов (рис. 11):
- Корпускулярная природа комплексов антиген-наночастица способствует их захвату антигенпрезентирующими клетками и последующей доставке антигена в лимфоидные органы.
- Захваченные АПК наночастицы могут выходить из эндосом в цитоплазму и стимулировать CD8+ T-клеточный ответ (перекрестная презентация).
- Полимерные наночастицы могут выполнять роль депо антигена, высвобождая его в течение длительного времени для презентации АПК. Эффективность этой функции зависит от химического состава частиц, поверхностных свойств, биологической совместимости (содействует взаимодействию с АПК), размер (по сравнению с размером АПК), стабильности антигена, особенностей кинетики его высвобождения. Процесс выхода антигена из депо может искусственно контролироваться изменением pH, температуры, ионной силы или с помощью электрических и магнитных полей.
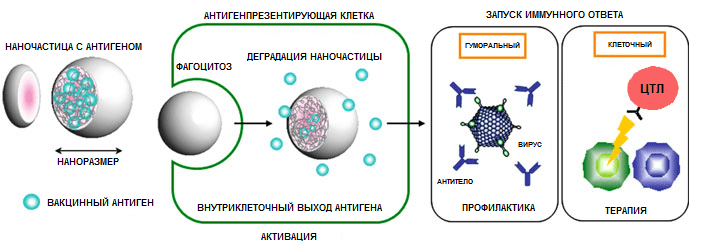
Рисунок 11. Обобщенный механизм действия полимерных наночастиц. Рисунок из [58].
Заключительное слово, или о чем не было рассказано
Целью данной статьи было рассказать об адъювантах, имеющих природу наночастиц, показать их разнообразие и возможные механизмы действия. Задача достаточно амбициозная, поскольку очень многие современные адъюванты в той или иной степени можно назвать наноадъювантами. Поэтому детально в рамках одной статьи описать каждый их тип становиться весьма проблематичным. И действительно, большинство зарубежных обзорных статей, напрямую или косвенно посвященных этой теме, либо кратко повествуют о максимально большем количестве видов адъювантов, либо детально описывают один или несколько характерных примеров.
В настоящей статье реализован некий синтетический вариант, поскольку необходимо было уделить должное внимание общим вопросам, связанным с теорией адъювантов. Из-за этого об адъювантах, имеющих в своем составе вирусные белки, таких как виросомы и вирусоподобные частицы [60], речь не пойдет. Это очень интересная и перспективная тема, и о ней будет рассказано в следующий раз. Также не были отражены некоторые общие вопросы. Во-первых, это проблема размера, оптимального для выполнения теми или иными наночастицами адъювантных функций. Окончательно сказать, каким должен быть оптимальный размер частиц каждого адъюванта сложно, так как он зависит, по-видимому, от многих факторов: свойств антигена, способа введения вакцины в организм, гидрофобности частиц, их поверхностного заряда и т. д. С большей уверенностью, однако, можно сказать, что, по сравнению с микрочастицами, наночастицы эффективнее проходят через биологические барьеры и дольше циркулируют в крови.
И во-вторых, не была раскрыта тема различных модификаций поверхности наночастиц, что обусловлено большим разнообразием вариантов подобных модификаций. Они позволяют наночастицам лучше выполнять функции систем доставки («активное нацеливание» вакцины на конкретный компонент иммунной системы) и непосредственной стимуляции иммунных процессов (например, некоторые химические модификации позволяют наночастицам запускать систему комплемента или активировать инфламмасомы).
В конце хочется сказать о том, что к сожалению, несмотря на перспективность описанных адъювантов, их низкую токсичность, высокую иммуностимулирующую активность и биологическую совместимость немногие из них в настоящее время лицензированы для применения в коммерческих вакцинах. По большей части это различные наноэмульсии. Если говорить на чистоту, то количество адъювантов, разрешенных для применения в человеческих вакцинах, само по себе небольшое и отличается в разных странах. В США это алюминиевые адъюванты (гидроксид и фосфат алюминия, гидроксифосфат-сульфат алюминия) и масляно-водные наноэмульсии AS04 и AS03. В странах Европы и ряде других стран этот список включает: алюминиевые адъюванты (гидроксид и фосфат алюминия); фосфат кальция; масляно-водные адъюванты AS04, MF59, AS03 и AF03; виросомы; Montanide™ ISA51 (водно-масляная эмульсия); аналоги липида A бактерий.
В нашей страны разнообразие лицензированных адъювантов не очень велико. Вакцины, зарегистрированные в России, содержат преимущественно алюминиевые адъюванты. Кроме того, в нашей стране был разработан синтетический адъювант полиоксидоний (полимерный адъювант), включенный в состав субъединичной противогриппозной вакцины Гриппол®. И все же, рано или поздно другие наноадъюванты пополнят список разрешенных для массового применения. Об этом говорит то, что липосомальные адъюванты, ИСКОМы, полимерные наночастицы находятся на разных стадиях клинических испытаний. Медленное внедрение новых адъювантов обусловлено вечными причинами разных задержек: «долго и дорого». Но несмотря на это, хорошие действенные вакцины и адъюванты существуют, поэтому вакцинируйтесь и не болейте!
Литература
- Вакцины в вопросах и ответах;
- Иммунологическая Нобелевская премия (2011);
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Schijns V. and O’Hagan D. Immunopotentiators in modern vaccines. Academic Press, Elsevier. 2006;
- Roux É., Yersin M.A. (1889). Contribution a l’étude de la diphthérie (2e mémoire). Ann. Inst. Pasteur. 3, 273–288;
- Le Moignic E., Pinoy C.R. (1916). Les vaccins en emulsion dans les corps gras ou «lipo-vaccins». C. R. Soc. Biol. 79, 201–203;
- Ramon G. (1924). Sur la toxine et sur I’anatoxine diphtheriques. Ann. Inst. Pasteur. 38, 1–10;
- Glenny A.T., Pope C.G., Waddington H., Wallace U. (1926). Immunological notes. XVII–XXIV. J. Pathol. 29, 31–40;
- Janeway C.A., Jr. (1989). Approaching the asymptote? Evolution and revolution in immunology. Cold Spring Harb. Symp. Quant. Biol. 54, 1–13;
- Рамон Г. Сорок лет исследовательской работы / ред., авт. предисл. Здродовский П.Ф. Москва: Медгиз, 1962. — 459 с.;
- Awate S., Babiuk L.A., Mutwiri G. (2013). Mechanisms of action of adjuvants. Front. Immunol. 4, 1–10;
- Эволюция белков зависит от уровня метаболизма видов;
- Petrovsky N. and Aguilar J.C. (2004). Vaccine adjuvants: current state and future trends. Immunol. Cell Biol. 82, 488–496;
- Egli A., Santer D., Barakat K., Zand M., Levin A., Vollmer M. et al. (2014). Vaccine adjuvants — understanding molecular mechanisms to improve vaccines. Swiss Med. Wkly. 144, w13940;
- Granell A., Fernández del-Carmen A., Orzáez D. (2010). In planta production of plant-derived and non-plant-derived adjuvants. Expert Rev. Vaccines. 9, 843–858;
- Mutwiri G., Gerdts V., Lopez M., Babiuk L.A. (2007). Innate immunity and new adjuvants. Rev. Sci. Tech. Off. Int. Epiz. 26, 147–156;
- Latz E., Xiao T.S., Stutz A. (2013). Activation and regulation of the inflammasomes. Nat. Rev. Immunol. 13, 397–411;
- Reed S.G., Orr M.T., Fox C.B. (2013). Key roles of adjuvants in modern vaccines. Nat. Med. 19, 1597–1608;
- Brito L.A. and O’Hagan D.T. (2014). Designing and building the next generation of improved vaccine adjuvants. J. Control. Release. 190, 563–579;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Smith D.M., Simon J.K., Baker J.R., Jr. (2013). Applications of nanotechnology for immunology. Nat. Rev. Immunol. 13, 592–605;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Наномеханика для адресной доставки лекарств – насколько это реально?;
- Garçon N., Leroux-Roels G., Cheng W.F. (2011). Vaccine adjuvants. Perspectives in Vaccinology. 1, 89–113;
- Freund J., Casals J., Hosmer E. (1937). Sensitization and antibody formation after injection of tubercle bacilli and paraffin oil. Soc. Exp. Biol. Med. 37, 509–513;
- Gupta R.K., Relyveld E.H., Lindblad E.B., Bizzini B., Ben-Efraim S., Gupta C.K. (1993). Adjuvants — a balance between toxicity and adjuvanticity. Vaccine. 11, 293–306;
- Izquierdo P., Esquena J., Tadros T.F., Dederen C., Garcia M.J., Azemar N., Solans C. (2002). Formation and stability of nano-emulsions prepared using the phase inversion temperature method. Langmuir. 18, 26–30;
- O’Hagan D.T., Ott G.S., De Gregorio E., Seubert A. (2012). The mechanism of action of MF59 — an innately attractive adjuvant formulation. Vaccine. 30, 4341–4348;
- O’Hagan D.T. (2007). New generation vaccine adjuvants. eLS. doi: 10.1002/9780470015902.a0020177.pub2;
- Mosca F., Tritto E., Muzzi A., Monaci E., Bagnoli F., Iavarone C. et al. (2008). Molecular and cellular signatures of human vaccine adjuvants. Proc. Natl. Acad. Sci. USA. 105, 10501–10506;
- Calabro S., Tritto E., Pezzotti A., Taccone M., Muzzi A., Bertholet S. et al. (2013). The adjuvant effect of MF59 is due to the oil-in-water emulsion formulation, none of the individual components induce a comparable adjuvant effect. Vaccine. 31, 3363–3369;
- Hamouda T., Simon J., Fattom A., Baker J. NanoBio™ nanoemulsion for mucosal vaccine delivery. In: Novel immune potentiators and delivery technologies for next generation vaccines / ed. Singh M. Springer US, 2013. P. 269–286;
- Stanberry L.R., Simon J.K., Johnson C., Robinson P.L., Morry J., Flack M.R. et al. (2012). Safety and immunogenicity of a novel nanoemulsion mucosal adjuvant W805EC combined with approved seasonal influenza antigens. Vaccine. 30, 307–316;
- Makidon P.E., Bielinska A.U., Nigavekar S.S., Janczak K.W., Knowlton J., Scott A.J. et al. (2008). Pre-clinical evaluation of a novel nanoemulsion-based hepatitis B mucosal vaccine. PLoS One. 3 (8), e2954;
- Makidon P.E., Belyakov I.M., Janczak K.W., Landers J., Bielinska A.U., Groom J.V., Baker J.R., Jr. (2012). Nanoemulsion mucosal adjuvant uniquely activates cytokine production by nasal ciliated epithelium and induces dendritic cells trafficking. Eur. J. Immunol. 42, 2073–2086;
- Myc A., Kukowska-Latallo J.F., Smith D.M., Passmore C., Pham T., Wong P., Bielinska A.U., Baker J.R., Jr. (2013). Nanoemulsion nasal adjuvant W805EC induces dendritic cell engulfment of antigen-primed epithelial cells. Vaccine. 31, 1072–1079;
- Allison A.C. and Gregoriadis G. (1974). Liposomes as immunological adjuvants. Nature. 252, 252;
- Henriksen-Lacey M. and Perrie Y. Designing liposomes as vaccine adjuvants. In: Immunomic discovery of adjuvants and candidate subunit vaccines / eds. Flower D.R., Perrie Y. NY: Springer-Verlag, 2013. P. 181–203;
- Korsholm K.S., Andersen P.L., Christensen D. (2012). Cationic liposomal vaccine adjuvants in animal challenge models: overview and current clinical status. Expert Rev. Vaccines. 11, 561–577;
- Christensen D., Korsholm K.S., Andersen P., Agger E.M. (2011). Cationic liposomes as vaccine adjuvants. Expert Rev. Vaccines. 10, 513–521;
- Ramon G. (1926). Procedes pour accroitre la production des antitoxins. Ann. Inst. Pasteur (Paris). 40, 1–10;
- Galea M. and Tzortzakis N. (1932). Essais d’immunisation antiaphteuse du cobaye à l’aide du virus saponiné. Compt. Rend. Soc. Biol. V. 109, 21–23;
- Николаенко Н.И. (1938). Практическая ценность хлороформ-формолвакцины в борьбе с ящуром. Сов. Ветеринария. 4-5, 25–27;
- Espinet R.G. (1951). Nuevo tipo de vacuna antiaftosa a complejo glucovirico. Gac. Vet. 74, 1–13;
- Dalsgaard K. (1978). A study of the isolation and characterization of the saponin Quil A. Evaluation of its adjuvant activity, with a special reference to the application in the vaccination of cattle against foot-and-mouth disease. Acta Vet. Scand. Suppl. 69, 1–40;
- Sun H.X., Xie Y., Ye Y.P. (2009). Advances in saponin-based adjuvants. Vaccine. 27, 1787–1796;
- Morein B., Sundquist B., Dalsgaard K., Osterhaus A. (1984). Iscom, a novel structure for antigenic presentation of membrane proteins from enveloped viruses. Nature. 308, 457–460;
- Sanders M.T., Brown L.E., Deliyannis G., Pearse M.J. (2005). ISCOMTM-based vaccines: The second decade. Immunol. Cell Biol. 83, 119–128;
- Lövgren K. and Morein B. (1988). The requirement of lipids for the formation of immunostimulating complexes (ISCOMs). Biotechnol. Appl. Biochem. 10, 161–172;
- Polakos N.K., Drane D., Cox J., Ng P., Selby M.J., Chien D. et al. (2001). Characterization of hepatitis C virus core-specific immune responses primed in rhesus macaques by a nonclassical ISCOM vaccine. J. Immunol. 166, 3589–3598;
- Frazer I.H., Quinn M., Nicklin J.L., Tan J., Perrin L.C., Ng P. et al. (2004). Phase 1 study of HPV16-specific immunotherapy with E6E7 fusion protein and ISCOMATRIX adjuvant in women with cervical intraepithelial neoplasia. Vaccine. 23, 172–181;
- http://biomolecula.ru#;
- Maraskovsky E., Schnurr M., Wilson N.S., Robson N.C., Boyle J., Drane D. (2009). Development of prophylactic and therapeutic vaccines using the ISCOMATRIX adjuvant. Immunol. Cell Biol. 87, 371–376;
- Foged C. (2011). Subunit vaccines of the future: the need for safe, customized and optimized particulate delivery systems. Ther. Deliv. 2, 1057–1077;
- De Souza Rebouças J., Esparza I., Ferrer M., Sanz M.L., Irache J.M., Gamazo C. (2012). Nanoparticulate adjuvants and delivery systems for allergen immunotherapy. J. Biomed. Biotechnol. 2012, ID 474605;
- Perrie Y., Rades T. FASTtrack: Pharmaceutics — drug delivery and targeting. London: Pharmaceutical Press, 2012. — 256 pp.;
- Shakya A.K. and Nandakumar K.S. (2012). Polymers as immunological adjuvants: an update on recent developments. J. BioSci. Biotech. 1, 199–210;
- Akagi T., Baba M., Akashi M. Biodegradable nanoparticles as vaccine adjuvants and delivery systems: regulation of immune responses by nanoparticle-based vaccine. In: Polymers in nanomedicine / eds. Kunugi S., Yamaoka T. Springer-Verlag Berlin Heidelberg, 2012. P. 31–64;
- Oyewumi M.O., Kumar A., Cui Z. (2010). Nano-microparticles as immune adjuvants: correlating particle sizes and the resultant immune responses. Expert Rev. Vaccines. 9, 1095–1107;
- Вирусы-платформы: яд во благо.