
Реалии ДНК-«аномалии»
10 декабря 2015
Реалии ДНК-«аномалии»
- 2794
- 5
- 5
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: ДНК — двойная спираль? Не всегда. Отдельные островки наших молекул наследственности могут по ошибке принимать довольно экзотические формы. Например, сворачиваться в спирали из четырех полигуаниновых нитей — вопреки классическим принципам молекулярной биологии. Но действительно ли подобные аномалии возникают «по ошибке»? Или природа давно уже «оседлала» эту странность нуклеиновых кислот, поставив её себе на службу? Можно ли считать четверные G-спирали рабочими «деталями» сложнейшей машины геномной регуляции? И случайна ли их причастность к процессам старения и канцерогенеза?
В мистическом фильме Д. Аронофски «Фонтан» присутствует весьма интересный образ. Конкистадор, отправившийся по велению испанской королевы на поиски древа вечной жизни (далекими прототипами героев здесь, по-видимому, послужили первооткрыватель Флориды Понсе де Леон и король Испании Фердинанд), находит его в храме индейцев Майя в Южной Америке. Однако, вкусив млечного сока этого древа, герой понимает, что что-то пошло не так. Вместо того чтобы обрести бессмертие, он начинает прорастать цветущей травой и полностью становится субстратом для этой буйной, паразитической по сути, растительности. Иными словами, у человека и у природы могут быть разные, если можно так выразиться, представления о жизненной силе и долголетии. И, возможно, именно поэтому в поисках путей продления жизни, мы постоянно натыкаемся на опасность канцерогенеза. Будь это исследования в области стволовых клеток, попытки преодолеть так называемый предел Хейфлика с помощью фермента теломеразы либо иные способы борьбы с клеточным старением. Всякий раз геронтология и онкология идут «рука об руку», теснейшим образом переплетаясь. И одной из точек сопряжения этих двух областей можно считать удивительные структурные аномалии ДНК, носящие название G-квадруплексов...
ДНК не по канону
Мы привыкли думать о ДНК как о двойной спирали, в которой азотистые основания нуклеотидов на противоположных цепях однозначно соответствуют друг другу: аденин — тимину, гуанин — цитозину. Эта, безусловно, фундаментальная особенность нуклеиновых кислот лежит в основе механизмов наследственности. Именно благодаря ей становятся возможными удвоение и корректирование ДНК, а также реализация генетической информации в структуре РНК и белков.
Однако на деле наши молекулы наследственности оказываются куда гибче, подвижнее и причудливее, нежели это было некогда описано легендарными нобелевскими лауреатами Дж. Уотсоном и Ф. Криком. Например, подобно РНК, ДНК может формировать так называемые шпильки, которые на двойной спирали приобретают вид крестообразных структур (рис. 1). Эти «аномальные» образования принимают активное участие в регуляции работы с генетической информацией и задействованы как в копировании ДНК (репликации) [1], так и в переносе информации с ДНК на РНК (транскрипции) [2].
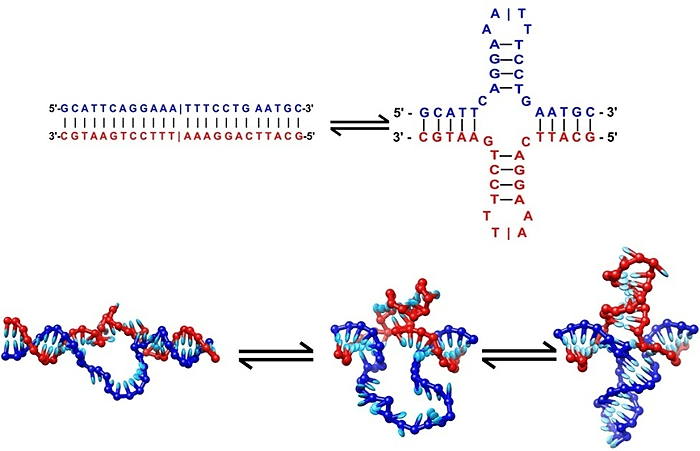
Рисунок 1. Формирование крестоообразных структур ДНК. Рисунок с сайта www.physoc.org.
Конечно, «крестами» и шпильками дело не ограничивается. К числу возможных конформаций ДНК относятся также тройные (рис. 2Б) и даже четверные спирали (рис. 2В), возникающие в результате неканонических связей между азотистыми основаниями [3]. В течение последнего десятилетия заметно возросло внимание к так называемым G-квадруплексам — структурам, представляющим собой спирали из четырех нитей ДНК или РНК, соединенных одними только гуанинами. Постепенно выясняется, что эти образования играют весьма важную роль в регуляции активности генов, в генетической изменчивости и в функционировании теломер [4].

Рисунок 2. Двойная (а), тройная (б) и четверная (в) спирали ДНК. Рисунок с сайта www.konan-fiber.jp.
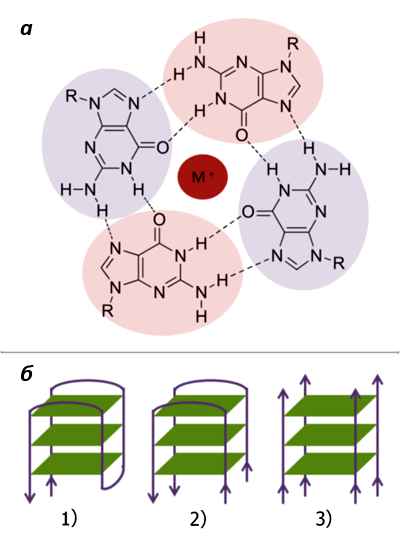
Рисунок 3. «G-ДНК». а. Строение G-тетрады; М+ — одновалентный катион. б. Формирование G-квадруплекса из 1) одной, 2) двух и 3) четырех нитей ДНК. Рисунок с сайта www.chem.cmu.edu.
Способность гуанина к самоассоциации была обнаружена еще в конце 19 века. И только в 1962 году удалось установить, что в растворах он образует агрегаты из четырех молекул (называемых G-квартетом, или G-тетрадой) [5]. Такие тетрады скрепляются между собой неканоническими (то есть, не предусмотренными в модели Уотсона — Крика) водородными связями, называемыми «хугстиновскими» — по фамилии их первооткрывателя [6]. При этом входящие в них гуанины располагаются в одной плоскости и нуждаются в стабилизации моновалентными катионами (например, K+ или Na+) (рис. 3а).
Содержащие гуанин нуклеиновые кислоты в растворе могут образовывать такие структуры из одной, двух или четырех различных нитей (рис. 3б). Однако стабильными они будут лишь в том случае, когда три и более G-тетрады сгруппируются в плотную «стопку», «подперев» друг друга межплоскостными стекинг-взаимодействиями и сформировав тем самым G-квадруплекс (G4-структуру). А для этого, в свою очередь, необходима «счастливая встреча» четырех полигуаниновых участков (GGGn), находящихся либо на одной, либо на разных молекулах ДНК или РНК [7].
Нанопроводники
Интересно, что полигуаниновые цепи ДНК в растворе образуют четырехспиральные жгуты, для которых, к слову, зафиксирована способность эффективно проводить ток. Это свойство создает перспективу их использования в качестве нанопроводников [8, 9].
Правда, на каждое правило есть свои исключения. Здесь можно привести в пример синдром ломкой X-хромосомы, возникающий вследствие экспансии многочисленных (более 200) повторов (CGG) в гене FMR1, необходимом для развития нервной системы. Матричная РНК такого мутантного гена способна формировать вполне стабильные четверные спирали даже из двухгуаниновых мотивов. То есть, в нашей «стопке» будет всего лишь две G-тетрады (рис. 4) [10].
«Значит, это кому-нибудь нужно?» © В. Маяковский
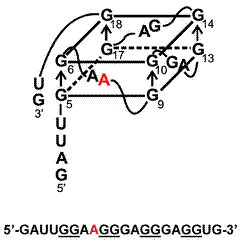
Рисунок 4. «Двуслойный» квадруплекс, формирующийся из четырех мотивов (GG) на РНК гена FMR1 при синдроме ломкой X-хромосомы. Рисунок с сайта www.computer.org.
Разумеется, то, что возможно в пробирке, далеко не всегда имеет место в живой клетке. Однако последние годы было убедительно показано, что G-квадруплексы действительно образуются in vivo в хромосомах живых организмов [11, 12]. И, кроме того, методами биоинформатики в геноме человека обнаружено порядка 376 тысяч районов, в которых потенциально могут возникать эти четырехспиральные образования. Интересно, что такие участки, как правило, находятся в составе регуляторных генетических элементов (промоторов, терминаторов, нетранслируемых последовательностей матричной РНК), теломер, рибосомных РНК и интронов, то есть последовательностей, не кодирующих структуру белка. Тогда как кодирующие фрагменты ДНК (экзоны) преимущественно «очищены» от подобных нуклеотидных мотивов [13, 14]. И неудивительно! Ведь, забегая вперед, нельзя не отметить, что такие гуаниновые «узелки» способны становиться очагами генетической нестабильности, провоцируя появление серьезных мутаций. Поэтому направленность естественного отбора в данном случае вполне понятна.
Однако почему-то всё тот же естественный отбор способствовал заметному скоплению потенциальных G4-структур в области генных промоторов, то есть, участков ДНК, определяющих производительность данного гена и позволяющих её регулировать [13]. Причем особенно ярко это выражено в группе онкогенов, повышенная активность которых необходима для возникновения и развития раковых опухолей. Тогда как, к примеру, встречаемость вероятных G-квадруплексов в промоторах генов — супрессоров раковых опухолей (призванных подавлять канцерогенез) значительно ниже, чем в среднем по геному [15, 16]. Более того, последовательности многих промоторов и интронов, особо обогащенных потенциальными G4-структурами, достаточно консервативны, то есть несут общие черты у целого ряда эукариотических организмов [17, 18].
Картину дополняет то обстоятельство, что живые системы не пожалели времени и сил на выработку специальных белков, способных связываться с G-квадруплексами, либо формируя и стабилизируя их, либо «разворачивая», «расплетая» или просто разрезая [19]. Бесполезным или «не существующим» в клетке структурам (каковыми их вплоть до недавнего времени считали многие исследователи) эволюция столько внимания не уделяет. Как отметил более 30 лет назад нобелевский лауреат Аарон Клуг: «Если G-квадруплексы так легко формируются in vitro, природа, должно быть, нашла путь применения их in vivo» [4]. С каждым годом мы получаем всё больше подтверждений этому прозорливому высказыванию.
Из двойной спирали — в четверную
Чтобы сформировать в ДНК такую крупную структуру, как G-квадруплекс, необходимо предварительно подвергнуть плавлению (разъединить) соответствующий участок классической двойной спирали. Длина таких участков может составлять несколько десятков нуклеотидов. К примеру, общая формула для поиска потенциальных G4-структур в геноме, использованная в работах исследователей из Кэмбриджского университета, выглядела как (G3+N1—7G3+N1—7G3+N1—7G3) — то есть, предполагала длину квадруплекса от 15 до 33 пар оснований [13] (хотя это далеко не единственный вариант [14]). Теоретически G-квадруплексы могут возникнуть практически в любом месте генома— при условии образования достаточно длинного однонитевого ДНК-фрагмента [16]. Другое дело, что по показателям стабильности они будут существенно проигрывать.
Наиболее благоприятные условия для высвобождения протяженных кусочков одноцепочечной ДНК создаются, прежде всего, во время репликации. И действительно: количество G4-структур в клетке заметно (приблизительно в пять раз) возрастает именно при удвоении хромосом [20]. В идеале, по завершении копирования наследственного материала все гуаниновые «узелки» (и старые, и новые) должны удаляться, поскольку в это время клетка буквально «причесывает» свою ДНК. Однако, как показывает практика, часть G-квадруплексов остается и присутствует в геноме на протяжении всего клеточного цикла [11, 12, 20]. Более того, по-видимому, сам процесс репликации нуждается в наличии G4-структур. В частности, они входят в состав ориджинов (геномных районов, с которых начинается репликация) позвоночных животных и, по одной из версий, определяют направление движения ДНК-полимеразы — «копировальной машины» ДНК [21, 22].
Образованию четверных гуаниновых спиралей могут способствовать не только репликация, но и транскрипция (считывание гена), а также репарация (починка) хромосом [23]. Кроме того, в ядре возможно спонтанное плавление двойной спирали ДНК, возникающее в результате тех или иных молекулярных эффектов [24, 25]. В конце концов, появление G4-структур может быть обусловлено целенаправленным воздействием на ДНК специальных белков — шаперонов, призванных формировать квадруплексы там, где это положено [19].
Куда легче дело обстоит с РНК, однонитевыми по своей природе молекулами. Исключительная гибкость и отсутствие «обременения» в виде второй комплементарной цепочки позволяет им свободно принимать самые разнообразные конформации. И не случайно потенциальные G4-спирали нашлись в нетранслируемых (то есть, входящих в состав матричной РНК, но структуру белка не кодирующих) областях более чем 3000 человеческих генов [26, 27]. Кроме того, в последние годы перспективным представляется исследование гибридных квадруплексов, состоящих из ДНК и РНК. Интересно, что для их формирования достаточно не четырех, а всего лишь двух полигуаниновых участков на ДНК (два других автоматически будут присутствовать на считываемой с гена РНК) [28].
На самом краю хромосомы
А теперь — всё внимание таким удивительным ядерным структурам, как теломеры [29]! Располагаясь на концах линейных хромосом ядерных организмов, они призваны защищать генетический материал от разрушения. Структуры всех эукариотических теломер удивительно консервативны: они представляют собой цепочку из многократно повторяющихся нуклеотидных мотивов. В человеческом геноме это мотив (TTAGGG) (обратим внимание читателя на тройной гуанин), воспроизведенный 1000–2000 раз [30]! Не правда ли, идеальная среда для возникновения многочисленных G-квадруплексов? Но и это еще не всё: на конце теломер человека и других теплокровных животных располагается довольно протяженный, 30–300 нуклеотидов, участок однонитевой ДНК со свободным 3’-концом [31]. Состоит он из всё тех же повторов (ТТАGGG). И уж здесь-то образованию гуаниновых узелков ничто не мешает.
Теломерные последовательности, будучи извлеченными из ядра или синтезированными, действительно массово формируют G-квадруплексы [4]. Однако доказательство их наличия в клетке требует куда более тонких подходов. С помощью меченых антител, специфически связывающихся с G4-структурами, было показано, что последние действительно образуются на концах хромосом (правда, не всех). По крайней мере, около 20% всех сигналов были зафиксированы именно там [20]. Возникают ли обнаруженные квадруплексы собственно в теломерах либо в близлежащих областях хромосом, по этим данным сказать трудно, поскольку разрешение метода сильно ограничено. Однако нам достоверно известно, что многие теломерные белки действительно взаимодействуют с G4-структурами (либо формируя их, либо разрушая), и это один из главных аргументов в пользу их полноценного участия в жизни теломер [19]. А уж о том, что эта «жизнь» чрезвычайно важна для нас в контексте вопроса о здоровье и долголетии, говорить не приходится.
Судя по всему, G-квадруплексы задействованы в формировании защитного колпачка, или кэпа, на конце теломеры. В клетках человека такое «кэпирование» осуществляется шелтерином — комплексом из шести белков. Он предохраняет линейную хромосому от излишнего внимания клеточных «контролёров», считающих, что конец цепочки ДНК — это повреждение, требующее соответствующих методов «лечения». А в области теломер такое «лечение» оборачивается катастрофическими последствиями: «сшивкой» разных хромосом и, в итоге, гибелью клетки либо запуском канцерогенеза [32].
С G4-структурами взаимодействуют такие шелтериновые белки, как TRF2 и POT1. При этом TRF2 связывает и стабилизирует квадруплексы на однонитевом 3’-фрагменте, тогда как POT1 обусловливает распад гуаниновых четверных спиралей [19]. Иными словами, квадруплексы при образовании «кэпа» нужны, но дозированно.
Предполагаются самые разнообразные варианты участия G4 ДНК в «кэпировании» хромосом [33]. G-квадруплекс может быть необходим для образования специфической теломерной структуры, именуемой T-петлей (теломерной петлей) (рис. 5, 6а). Он возникает либо при простом запетливании однонитевого 3’-фрагмента (рис. 6б), либо при его внедрении в двойную спираль теломерной ДНК (рис. 6в) [34]. Таким образом осуществляется маскировка свободного 3’-конца (в общем случае распознаваемого клеткой как сигнал тревоги) [33].
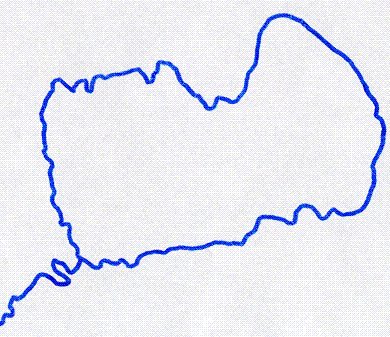
Рисунок 5. Т-петля на конце теломеры под электронным микроскопом. Фото с сайта web.pdx.edu.
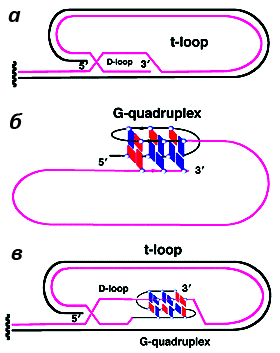
Рисунок 6. Различные виды Т-петель. а. T-петля без квадруплекса; б. T-петля с квадруплексом, замыкающим однонитевой 3’-фрагмент теломеры на себя; в. T-петля, образующая квадруплекс при внедрении однонитевого 3’-конца в двойную спираль теломерной ДНК. Рисунок с сайта pubs.rsc.org.
Помимо этого, обсуждаются альтернативные T-петле способы «кэпирования» хромосом. По одной из версий, одноцепочечная 3’-ДНК формирует плотный ряд G-квадруплексов, стабилизирующих однонитевой фрагмент и предохраняющих его от деградации особо ретивыми клеточными белками (рис. 7) [35]. Вероятно, подобный способ защиты теломеры используется в тех случаях, когда полноценного шелтерина на конце хромосомы не образуется [36].
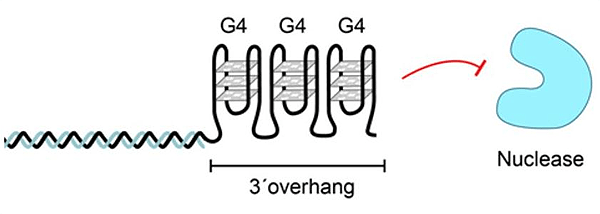
Рисунок 7. Защита теломеры с помощью серии G-квадруплексов, образующихся на однонитевом 3’-конце. Рисунок из [4].
Не исключено, что в клетках человека в той или иной мере реализуются оба способа «обороны» теломеры с участием G4-образований. Иное дело, что такая «оборона» может оборачиваться для нас рядом неприятных моментов.
Точка обратного отсчета
Согласно наиболее популярной точке зрения, именно в теломерах спрятан ключ (по крайней мере, один из главных таких ключей) к пониманию процесса старения и ограниченной продолжительности нашей жизни. Линейные хромосомы, в отличие от циклических, коими могут похвастаться большинство доядерных организмов, как правило, не способны удваиваться вечно. Каждый цикл репликации, в силу особенностей организации этого ферментативного механизма, приводит к укорочению одной из дочерних нитей ДНК на 50–100 нуклеотидов. В итоге, после 50–60 раундов копирования наследственного материала потери в длине теломеры становятся неприемлемыми, поэтому клетка запускает процесс своего старения (сенесценции) либо гибнет [30, 37]. Правда, всем известные стволовые клетки являются ярким исключением из этого общего правила [38, 39]. (А еще — клетки растений, меняющие длину теломер в зависимости от времени года [40].)
Исследуя механизмы старения человека, невозможно обойти вниманием такое наследственное заболевание как синдром Вернера. Проявляется оно в ускоренном старении организма и сопровождается всеми сопутствующими эффектами: снижением иммунитета, повышением риска раковых заболеваний, многочисленными физиологическими нарушениями, характерными для людей преклонного возраста. Причиной этого синдрома оказалось нарушение структуры белка — геликазы WRN, основной функцией которого является расплетание теломерных квадруплексов. В результате во время репликации синтез дочерней цепи ДНК тормозится и обрывается в месте образования G4-структуры. Это приводит к галопирующему укорочению теломер и, соответственно, раннему запуску клеточного старения [41]. Аналогичного эффекта в культурах клеток можно добиться искусственным путем, повышая стойкость квадруплексов за счет их связывания со специальными химическими веществами [42].
Можно спорить по поводу применимости модели наследственного заболевания в деле расшифровки механизмов нормального, не патологичного старения. Однако совершенно не исключено, что не расплетенные вовремя теломерные квадруплексы задействованы и в этом случае. Вспомним, к примеру, как долгое время считалось, что синдром прогерии Хатчинсона-Гилфорда, связанный с преждевременным старением у детей, не имеет отношения к старению как таковому. В дальнейшем же было показано, что вызывающий эту болезнь прогерин образуется и в коже обычных пожилых людей [43].
Помимо этого, не секрет, что одной из вероятных причин старения является накопление в геноме повреждений, вызванных окислением свободными радикалами [44]. Причем существенная часть из них концентрируется именно на теломерах [45]. Возможных объяснений такому предпочтительному поражению кончиков хромосом довольно много. По-видимому, в этом виновны и сниженная (силами шелтериновых белков) активность ферментов «ремонта» ДНК, и особенности нуклеотидной последовательности теломерной ДНК. И здесь опять имеет смысл вспомнить про наши G-квадруплексы! Ведь они, помимо всего прочего, оказываются особенно чувствительными к окислительным повреждениям [46].
Смертельно опасная «вечная» жизнь
Говоря о теломерных G4-структурах, нельзя обойти вниманием тот интригующий факт, что, располагаясь на концах 3’-выступа, они блокируют работу теломеразы. А ведь это тот самый широко популяризованный фермент, на который возлагалось столько надежд, и за изучение которого в 2009 году была вручена Нобелевская премия по физиологии и медицине! Теломераза наращивает 3’-концы теломер и таким образом нивелирует их естественное укорочение. Иными словами — продлевает активную жизнь хромосомам и, соответственно, клетке [29]. Однако G-квадруплексы не просто мешают теломеразе делать свое дело — помимо этого, они, располагаясь в области промотора гена TERT, подавляют ее синтез в клетке [47]. И, конечно, этот эффект можно было бы счесть за негативный, если бы не один весьма печальный факт. Дело в том, что избыточная активность теломеразы создает весьма благоприятную среду для перерождения нормальных клеток в раковые. От работы этого фермента сильно зависят порядка 90% всех злокачественных опухолей, ведь он позволяет перерожденным клеткам делиться бесконечно долго [47].
Блокирование работы теломеразы составляет одну из функций гена BRCA1. BRCA1 — широко известный супрессор раковых опухолей, то есть ген — «борец» с канцерогенезом. Он является важным компонентом системы исправления ошибок в ДНК и контролирует активность целого ряда генов, в том числе задействованных в образовании опухолей [48]. Поэтому мутации в BRCA1 зачастую приводят к развитию рака груди и яичников [49], а в России они — в «лидерах» генетических причин возникновения онкозаболеваний [50]. Интересно, что подавление теломеразы этим (весьма немаловажным, как мы убедились) белком осуществляется не только за счет регуляции активности кодирующего её гена TERT [51], но и за счет прямого вмешательства в её работу на теломерах. В частности, предполагают, что BRCA1 связывается с теломерными квадруплексами и стабилизирует их, в результате чего наш «фермент молодости» остаётся не у дел [19].
Как было отмечено выше, TERT — отнюдь не единственный регулируемый G-квадруплексами ген, благоприятствующий развитию злокачественных опухолей [15]. Помимо него в этом ряду фигурируют c-MYC, c-KIT, BLC2, VEGF, HIF-1a и целый ряд других известных онкогенов [52]. Разумеется, такая закономерность не могла не привлечь внимания ученых, занятых поиском средств против рака. Сегодня существует целый ряд работ, посвященных влиянию тех или иных квадруплекс-связывающих веществ на рост и развитие раковых клеток. И, по результатам этих исследований, искусственное укрепление G-квадруплексов представляется чрезвычайно перспективным путем лечения онкологических заболеваний [47, 52].
По лезвию бритвы
Как гласит известная легенда, Будда Шакьямуни обрел просветление, услышав фразу учителя музыки, адресованную его ученику: «Если ты ослабишь струну, музыка не зазвучит, а если ты перетянешь её, она порвется». И этот принцип в полной мере относится ко множеству, если не ко всем биологическим процессам.
Те же самые G4-структуры, которые столь перспективны в рамках лечения раковых опухолей, могут сами по себе становиться провокаторами канцерогенных заболеваний. Вспомним вышеупомянутый синдром преждевременного старения Вернера. Возникает он на фоне недееспособности геликазы WRN, в норме «развязывающей» гуаниновые «узелки» на теломерах. В наших клетках существует целый спектр таких белков, призванных тем или иным способом удалять G-квадруплексы, дабы освободить дорогу ферментам репликации. Если же этого не происходит, то копирование ДНК стопорится в месте образования G4-структуры. В результате запускается целый ряд процессов, приводящих к разрывам ДНК, хромосомным перестройкам и мутациям наследственного материала [36, 41].
Так, например, при повреждении гена специализированной на G-квадруплексах геликазы BLM возникает синдром Блума. Проявляется он в низкорослости и ранней предрасположенности к целому ряду онкозаболеваний. Нарушение функции геликазы FANJ приводит к развитию анемии Фалькони, сопровождающейся повышенной хрупкостью хромосом и склонностью к лейкозам. Аналогичным образом мутации в гене геликазы RETL1 увеличивают чувствительность организма к некоторым видам рака. Этот список можно было бы продолжить целым рядом наследственных заболеваний, провоцирующих канцерогенез. И все они связаны с генетической и теломерной нестабильностью, вызванной «стойкими» ДНК- и РНК-квадруплексами [41].
Иными словами, чтобы «музыка», исполняемая оркестром генных и теломерных G-квадруплексов, звучала, необходима тонкая настройка их жесткости. По-видимому, мы имеем дело с чрезвычайно широкой и сложной сетью структурных ДНК-аномалий. Возникающих как спонтанно, так и при помощи специальных белков. Чувствительных как к молекулярному окружению, так и к физико-химическим условиям среды. Способных как предотвращать раковые заболевания, так и провоцировать их. Принимающих участие как в защите теломер, так и в процессах клеточного старения.
Литература
- Pearson C.E., Zorbas H., Price G.B., Zannis-Hadjopoulos M. (1996). Inverted repeats, stem-loops, and cruciforms: significance for initiation of DNA replication. J. Cell Biochem. 63, 1–22;
- Wadkins R.M. (2000). Targeting DNA secondary structures. Curr. Med. Chem. 7, 1–15;
- Франк-Каменецкий М. (2015). Необычные формы ДНК. Портал «ПостНаука»;
- Rhodes D. and Lipps H.J. (2015). G-quadruplexes and their regulatory roles in biology. Nucl. Acids Res. 43, 8627–8637;
- Gellert M., Lipsett M.N., Davies D.R. (1962). Helix formation by guanylic acid. Proc. Natl. Acad. Sci. USA. 48, 2013–2018;
- Hoogsteen K. (1963). The crystal and molecular structure of a hydrogen-bonded complex between 1-methylthymine and 9-methyladenine. Acta Cryst. 16, 907–916;
- Burge S., Parkinson G.N., Hazel P., Todd A.K, Neidle S. (2006). Quadruplex DNA: sequence, topology and structure. Nucl. Acids Res. 34, 5402–5415;
- Kotlyar A.B., Borovok N., Molotsky T., Cohen H., Shapir E., Porath D. (2005). Long, monomolecular guanine-based nanowires. Adv. Mat. 17, 1901–1905;
- Ngo V.A., Felice R.D., Haas S. (2014). Is the G-quadruplex an effective nanoconductor for ions? J. Phys. Chem. B. 118, 864–872;
- Kettania A., Kumara A.R., Patela D.J. (2014). Solution structure of a DNA quadruplex containing the fragile X syndrome triplet repeat. J. Mol. Biol. 254, 638–656;
- Lam E.Y., Beraldi D., Tannahill D., Balasubramanian S. (2013). G-quadruplex structures are stable and detectable in human genomic DNA. Nat. Commun. 4, 1796–1780;
- Rodriguez R., Miller K.M., Forment J.V., Bradshaw C.R., Nikan M., Britton S. et al. (2012). Small-molecule-induced DNA damage identifies alternative DNA structures in human genes. Nat. Chem. Biol. 8, 301–310;
- Huppert J.L. and Balasubramanian S. (2005). Prevalence of quadruplexes in the human genome. Nucl. Acids Res. 33, 2908–2916;
- Todd A.K., Johnston M., Neidle S. (2005). Highly prevalent putative quadruplex sequence motifs in human DNA. Nucl. Acids Res. 33, 2901–2907;
- Eddy J. and Maizels N. (2006). Gene function correlates with potential for G4 DNA formation in the human genome. Nucl. Acids Res. 34, 3887–3896;
- Maizels N. and Gray L.T. (2013). The G4 Genome. PLoS Genet. 9, e1003468;
- Fernando H., Reszka A.P., Huppert J., Ladame S., Rankin S., Venkitaraman A.R. et al. (2006). A conserved quadruplex motif located in a transcription activation site of the human c-kit oncogene. Biochem. 45, 7854–7860;
- Eddy J. and Maizels N. (2008). Conserved elements with potential to form polymorphic G-quadruplex structures in the first intron of human genes. Nucl. Acids Res. 36, 1321–1333;
- Brazda V., Haronikova L., Liao J.C., Fojta M. (2014). DNA and RNA quadruplex-binding proteins. Int. J. Mol. Sci. 15, 17493–17517;
- Biffi G., Tannahill D., McCafferty J., Balasubramanian S. (2013). Quantitative visualization of DNA G-quadruplex structures in human cells. Nat. Chem. 5, 182–186;
- Leonard A.C. and Mechali M. (2013). DNA replication origins. Cold Spring Harb. Perspect. Biol. 5, a010116;
- Valton A.L., Hassan-Zadeh V., Lema I., Boggetto N., Alberti P., Saintome C. et al. (2014). G4 motifs affect origin positioning and efficiency in two vertebrate replicators. EMBO J. 33, 732–746;
- Li W., Wu P., Ohmichi T., Sugimoto N. (2002). Characterization and thermodynamic properties of quadruplex/duplex competition. FEBS Lett. 526, 77–81;
- Miyoshi D., Karimata H., Sugimoto N. (2006). Hydration regulates thermodynamics of G-quadruplex formation under molecular crowding conditions. J. Am. Chem. Soc. 128, 7957–7963;
- Nikolova E.N., Kim E., Wise A.A., O’Brien P.J., Andricioaei I., Al-Hashimi H.M. (2011). Transient Hoogsteen base pairs in canonical duplex DNA. Nature. 470, 498–502;
- Bugaut A. and Balasubramanian S. (2012). 5′-UTR RNA G-quadruplexes: translation regulation and targeting. Nucl. Acids Res. 40, 4727–4741;
- Beaudoin J.D. and Perreault J.P. (2013). Exploring mRNA 3′-UTR G-quadruplexes: evidence of roles in both alternative polyadenylation and mRNA shortening. Nucl. Acids Res. 41, 5898–5911;
- Xiao S., Zhang J.Y., Zheng K.W., Hao Y.H., Tan Z. (2013). Bioinformatic analysis reveals an evolutional selection for DNA:RNA hybrid G-quadruplex structures as putative transcription regulatory elements in warm-blooded animals. Nucl. Acids Res. 41, 10379–10390;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Старение — плата за подавление раковых опухолей?;
- Makarov V.L., Hirose Y., Langmore J.P. (1997). Long G tails at both ends of human chromosomes suggest a C strand degradation mechanism for telomere shortening. Cell. 88, 657–666;
- Sfeir A. and Lange T. (2012). Removal of shelterin reveals the telomere end-protection problem. Science. 336, 593–597;
- Galati A., Micheli E., Cacchione S. (2013). Chromatin Structure in Telomere Dynamics. Front. Oncol. 3, 46;
- Табу в науке: лаборатория, задававшая неправильные вопросы;
- Bochman M.L., Paeschke K., Zakian V.A. (2012). DNA secondary structures: stability and function of G-quadruplex structures. Nat. Rev. Genet. 13, 770–780;
- Brosh R.M. Jr. (2011). Put on your thinking cap: G-quadruplexes, helicases, and telomeres. Aging (Albany NY). 3, 332–335;
- Levy M.Z., Allsopp R.Z., Futcher A.B., Greider C.W., Harley C.B. (1992). Telomere end-replication problem and cell aging. J. Mol. Biol. 225, 951–960;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Длина теломер и времена года;
- Brosh R.M. Jr. (2013). DNA helicases involved in DNA repair and their roles in cancer. Nat. Rev. Cancer. 13, 542–558;
- Incles C.M., Schultes C.M., Kempski H., Koehler H., Kelland L.R., Neidle S. (2004). A G-quadruplex telomere targeting agent produces p16-associated senescence and chromosomal fusions in human prostate cancer cells. Mol. Cancer Ther. 3, 1201;
- Burtner C.R. and Kennedy B.K. (2010). Progeria syndromes and ageing: what is the connection? Nat. Rev. Mol. Cell Biol. 11, 567–578;
- Wickens A.P. (2001). Ageing and the free radical theory. Respir. Physiol. 128, 379–391;
- Sun L., Tan R., Xu J., LaFace J., Gao Y., Xiao Y. et al. (2015). Targeted DNA damage at individual telomeres disrupts their integrity and triggers cell death. Nucl. Acids Res. 43, 6334–6347;
- Clark D.W., Phang T., Edwards M.G., Geraci M.W., Gillespie M.N. (2012). Promoter G-quadruplex sequences are targets for base oxidation and strand cleavage during hypoxia-induced transcription. Free Radic. Biol. Med. 53, 51–59;
- Patel D.J., Phan A.T., Kuryavyi V. (2007). Human telomere, oncogenic promoter and 5′-UTR G-quadruplexes: diverse higher order DNA and RNA targets for cancer therapeutics. Nucl. Acids Res. 35, 7429–7455;
- Rosen E.M. (2013). BRCA1 in the DNA damage response and at telomeres. Front. Genet. 4, 85;
- Рак молочной железы с семейной историей;
- Любченко Л.Н. Наследственный рак молочной железы и/или яичников: ДНК-диагностика, индивидуальный прогноз, лечение и профилактика: дис. ... д-ра мед. наук. — Москва, 2009;
- Xiong J., Fan S., Meng Q., Schramm L., Wang C., Bouzahza B. et al. (2003). BRCA1 inhibition of telomerase activity in cultured cells. Mol. Cell Biol. 23, 8668–8690;
- Balasubramanian S., Hurley L.H., Neidle S. (2011). Targeting G-quadruplexes in gene promoters: a novel anticancer strategy? Nat. Rev. Drug Discov. 10, 261–275..







