
Необычные животные: иммунологические сказки
03 декабря 2015
Необычные животные: иммунологические сказки
- 2749
- 4
- 1
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: «Не ешь меня, я тебе ещё пригожусь!». При прочтении этой фразы вспоминаются детские сказки, где животные предлагают главному герою удивительные способности взамен на то, чтобы он сохранил им жизнь.
— Да, но при чём здесь сказки?! — возмутится читатель. — Я же собирался прочитать научную статью, а не выдуманные истории!
Действительно, вполне справедливое замечание. Однако в этот раз статья наша действительно будет похожа на сказку. Потому что речь в ней пойдёт о животных, обладающих очень необычными «молекулярными» способностями. За счёт чего? Конечно же, за счёт антител!
Что такое антитела? Это особые молекулы иммунной системы, имеющие гликопротеиновую природу и способные распознавать чужеродные для организма структуры, такие как вирусы, бактерии и другие потенциально вредные агенты, называемые одним словом — антигены [1, 2]. При распознавании антигена антителá передают информацию о нём клеткам иммунной системы — лимфоцитам, — и те в свою очередь уничтожают вредоносный агент. У человека и у всех млекопитающих антитело — это структура, состоящая из двух тяжёлых и двух лёгких цепей. Антитела, обладающие такой структурой, называются классическими. Их тяжёлые и лёгкие цепи, в свою очередь, состоят из вариабельных (V) и константных (C) доменов. Тяжёлые цепи содержат один вариабельный (VH) и три константных домена (СH1, СH2, СH3), лёгкие цепи — один вариабельный (VL) и один константный (СL) домены (рис. 1a). Именно такое строение обеспечивает способность антител узнавать конкретные антигены (это называется вариабельностью антител и осуществляется V-доменами) и взаимодействовать с клетками собственной иммунной системы (эффекторная функция антител; за неё ответственны C-домены).
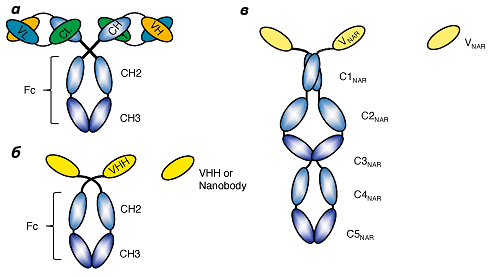
Рисунок 1. Схема строения классического (a), верблюжьего (б) и акульего (в) антител. a — классический Ig G. Состоит из двух легких цепей и двух тяжелых цепей. CH1, CH2, CH3 — константные домены тяжёлой цепи, СL — константный домен лёгкой цепи; VH — вариабельный домен тяжёлой цепи, VL — вариабельный домен лёгкой цепи. Вариабельные домены образуют антиген-распознающий фрагмент, а константные — эффекторный (связывающийся с лимфоцитами). б — верблюжье антитело, HCAb. CH2, CH3 — константные домены. VHH — вариабельный домен. VHH сами по себе образуют наноантитела. в — акулье антитело, Ig-NAR. C1 — C5-NAR — константные домены, V-NAR — вариабельный домен, является функциональным аналогом верблюжьего VHH. Рисунок из [6].
Новое антитело! Откуда? От верблюда! И ещё от акулы
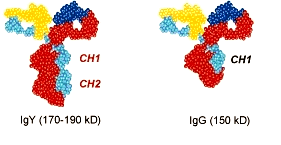
Рисунок 2. Сравнение Ig Y (слева) и Ig G (справа). Ig Y обладает большим размером за счёт дополнительного CH2 района, который отсутствует в Ig G. Рисунок с сайта genwaybio.com.
В 1993 году группа бельгийских учёных обнаружила в крови млекопитающих семейства верблюдовых (верблюдов, лам, викуний и альпак) антитела, структура которых заметно отличалась от структуры вышеописанных классических антител [3]. Антитела, присутствующие в крови у этих животных, имеют уникальную структуру — они состоят только из фрагмента одной укороченной тяжелой цепи, а лёгкие цепи у них отсутствуют (рис. 2).
Эти антитела были названы HCAb («heavy chain antibody»). Антиген-узнающий участок HCAb формируется лишь одним вариабельным доменом — VHH (Variable domain of the Heavy chain of the Heavychain antibody) (рис. 1б). Позднее учёные установили, что VHH — полностью функциональная молекула, которая способна распознавать и связывать антиген ничуть не хуже, чем вариабельные домены классических антител. Даже при их изоляции от константных доменов антитела они сохраняют способность связываться с антигенами так же, как и обычные антитела. Вдобавок к этому, они являются и самыми миниатюрными из всех известных белков с аналогичными свойствами. Их размер достигает примерно 2 × 4 нм. Поэтому этот фрагмент и получил название «наноантитело», «нанотело» или «мини-антитело» [4]*.
* — Подробнее о верблюжьих антителах читайте в статье «От рака вылечит... верблюд!» [5].
Удивительно, но молекула, аналогичная HCAb, была найдена у акул, и получила она название Ig-NAR (NAR — novel antigen receptor) [6]. Подобно верблюжьим антителам, данный иммуноглобулин также состоит из фрагмента одной укороченной тяжелой цепи. Каждая тяжёлая H-цепь содержит один вариабельный домен (V-NAR) и пять константных доменов (рис. 1в). Домены V-NAR также являются аналогами верблюжьих VHH и проявляют сходные свойства — способны связываться с антигенами как самостоятельная молекула.
Верблюжьи и акульи антитела обладают рядом преимуществ по сравнению с классическими антителами. Их небольшой размер и практически идеальная шаровидная форма обеспечивают доступ к эпитопам (участкам молекулы антигена) необычной формы или к труднодоступным эпитопам. Кроме того, за счёт высокой проницаемости в органы эти антитела способны поступать в плотные ткани, в том числе и в опухоли [7]. По своим размерам и молекулярной массе акульи и верблюжьи антитела похожи на некоторые токсины, например, на яд скорпиона, что позволяет предположить у них схожие профили биологического распределения и, как следствие, эффективную нейтрализацию токсинов [8]. Ещё одной привлекательной особенностью этих антител является их устойчивость к жёстким условиям среды, что обеспечивают их более высокую стабильность по сравнению с классическими антителами.
Также на основании VHH и V-NAR можно получить двухвалентные, или биспецифические, антитела. Такие генно-инженерные конструкции нужны для того, чтобы увеличить функциональность антитела: либо путём усовершенствования связывания антигена посредством увеличения авидности, либо путём увеличения антигенной специфичности, либо путём «сшивания» двух антител. Например, известно, что для лечения аутоиммунного ревматоидного артрита необходимо блокировать синтез такой молекулы как TNF (tumor necrosis factor). В норме TNF влияет на липидный метаболизм, коагуляцию, устойчивость к инсулину, функционирование эндотелия, активирует лейкоциты, однако его гиперэкспрессия может привести к нежелательным аутоиммунным заболеваниям, в частности, к артриту.
Было показано, что двухвалентные анти-TNF VHH-антитела являются в 500 раз более эффективными для лечения ревматоидного артрита, нежели аналогичные одновалентные антитела. Проявляемые свойства данного антитела оказались даже сильнее, чем у известных и наиболее эффективных на настоящий момент лекарств против ревматоидного артрита — Инфликсимаба и Адалимумаба [9]. Ещё одно двухвалентное наноантитело, ALX-0081, является перспективным антитромботическим агентом. ALX-0081 связывает фактор Виллебранда — белковый компонент крови, который участвует в её свёртывании на одном из самых ранних этапов. Это антитело успешно прошло первую стадию клинических испытаний, в результате которых было показано, что оно выборочно предотвращает нежелательное тромбообразование в сосудах, минимизируя кровотечения и не мешая нормальному гомеостазу.
VHH и VNAR — идеальные молекулы для построения на их основе очень необычных конструктов, состоящих из двух антител, одно из которых может связываться с чужеродной/злокачественной клеткой, а другое, например, привлекать эффекторные клетки иммунной системы, которые и будут эту самую клетку нейтрализовывать или убивать. Например, уже выделены и охарактеризованы антитела, способные связываться с CD16 — маркерной молекулой клеток иммунной системы — естественных киллеров [10]. Тем самым, соединив их с антителами против, скажем, раковых клеток, можно получить мощное оружие, которое будет целенаправленно уничтожать только раковые клетки, причём силами собственных естественных киллеров организма.
Снесла курочка яичко. Яичко не простое, а... иммунологическое!
У млекопитающих существует пять известных классов антител (иммуноглобулинов) — Ig A, Ig G, Ig D, Ig M, Ig E. Они отличаются друг от друга размерами тяжёлых цепей и по-разному участвуют в иммунном ответе. Например, основная функция Ig A — это защита слизистых оболочек дыхательных, мочеполовых путей и желудочно-кишечного тракта от инфекций, в то время как Ig E обусловливает различные аллергические реакции на антиген. Эти пять классов иммуноглобулинов известны только для млекопитающих. Однако когда учёные решили изучить молекулярный «состав» яйцекладущих животных (птиц, и, в частности, куриц), было обнаружено, что в их крови и в яичном желтке присутствует ещё один вид иммуноглобулинов — Ig Y (от англ. yolk — «желток»). Оказалось, что структура Ig Y похожа на структуру IgG: оба иммуноглобулина имеют две тяжелых и две лёгких цепи. Однако Ig Y содержит в своей тяжёлой цепи дополнительный константный домен CH2, который в Ig G уплотняется, но сохраняется в Ig E (рис. 2). Из этого был сделан вывод, что Ig Y является наследственной молекулой как Ig G, так и Ig E [11]. Поэтому, с одной стороны, функция этого белка сходна с функцией Ig G у млекопитающих — и Ig G, и Ig Y способны бороться с инфекционными агентами и участвовать в передаче иммунитета от матери к развивающемуся эмбриону [12]. А с другой стороны, Ig Y обладает некоторыми функциями Ig E, а именно способностью вызывать анафилактические реакции [13]. В целом, Ig Y имеет больше преимуществ, чем Ig G.
Почему же так интересны яичные антитела? Первое, и самое главное — яйца являются распространенным компонентом нашего рациона и поэтому легко переносятся иммунной системой человека. Вот почему иммунотерапия на основе Ig Y может быть весьма привлекательной с точки зрения её низкой токсичности (рис. 3). Уже изучаются так называемые оральные инъекции антителами Ig Y. По сути — это употребление в пищу яиц, в которых Ig Y имеет специфичность к конкретному антигену. Например, можно получать яйца против, скажем, холеры, или вируса гриппа. Съел яичко — и здоров! И действительно, уже показано, что подобная яичная «инъекция» открывает новые возможности для терапевтического вмешательства по отношению к различным патологиям, в том числе различным лёгочным и желудочно-кишечным инфекциям [14]. Подобный подход эффективен в борьбе с различными вирусами и бактериями — это показано в опытах на животных, а также ведутся клинические испытания на человеке [15, 16]. Здесь, правда, необходимо помнить, что подобные оральные инъекции куриным яйцом не подходят людям, страдающим индивидуальной непереносимостью яичного белка. Поэтому для них вопрос пока остаётся открытым.

Рисунок 3. «Съедобная» яичная вакцина — лекарство будущего! Рисунок с сайта zhit-budete.ru.
Куриные антитела могут использоваться не только в борьбе с вирусными и инфекционными антигенами, но также для блокирования, ингибирования и доставки конкретных реагентов в различные органы при каких-либо патологиях. Также куриные антитела хороши в качестве антитоксинов и/или для пассивной вакцинации. Например, Ig Y против рицина и ботулотоксина (сильнейших ядов) [17] могут нейтрализовывать бактериальные токсины и использоваться для лечения [18]. Такие противоядия на основе куриных антител обладают даже большей биологической активностью по сравнению с антидотами, полученными на основе лошадиной сыворотки [19].
Человек всегда был заинтересован в продуктах питания, которые укрепляют здоровье и снижают риск заболеваний. В современном мире, когда темп жизни крайне высок и дорога каждая минута, к этим требованиям добавляется также и возможность «вылечить» себя самому, не посещая больницы и не тратя время на различные врачебные процедуры. Включение желтков яиц, полученных от иммунизированных кур, в пищевые продукты, например, в майонез, обеспечит потребителей функциональным питанием, которое способно защитить человека от возбудителей — так называемая «съедобная» вакцина. Единственный потенциальный недостаток такой терапии — уменьшение стабильности Ig Y в кислой среде, что как раз актуально для человеческого желудочно-кишечного тракта, в котором содержится соляная кислота. И над решением этой проблемы учёным ещё предстоит поработать.
Тридцать три коровы, тридцать три коровы, и большие их антитела!
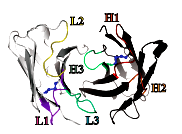
Рисунок 4. Строение антиген-связывающего участка антитела. Антигенсвязывающий участок состоит из аминокислотных остатков, входящих в состав шести гипервариабельных петель (CDR-петель), расположенных на поверхности вариабельных доменов лёгких и тяжёлых цепей. На рисунке гипервариабельные петли отмечены цветом (L1—3 — CDR-петли, входящие в состав лёгкой цепи в порядке их расположения в последовательности, H1—3 — CDR-петли, входящие в состав тяжёлой цепи). Рисунок из [20].
Прежде чем мы приступим к разговору о бычьих антителах, следует более детально рассмотреть строение вариабельных доменов антител вообще. Следует знать, что уровень вариабельности внутри вариабельных доменов распределен неравномерно. Он наиболее высок в коротких, так называемых «гипервариабельных» областях — CDR (complementarity determining regions), определяющих сродство антитела антигену. В вариабельных доменах тяжелой и легкой цепей выделяют по три CDR. В последовательности вариабельного домена эти области чередуются с четырьмя «каркасными» участками (FR — framework region, FR1—FR4). Роль таких участков заключается в поддержании трёхмерной структуры V-доменов. Вариабельные домены легкой и тяжелой цепи (VH и VL) вместе с ближайшими к ним константными доменами (CH1 и CL1) образуют Fab-фрагменты антител (fragment, antigen binding). Остальную часть, представленную C-концевыми константными доменами тяжелых цепей, обозначают как Fc-фрагмент (fragment, crystallizable). На границе Fab и Fc фрагментов располагается «шарнирная область», которая за счет своей гибкой структуры обусловливает подвижность фрагментов молекулы антитела относительно друг друга и содержит дисульфидные связи, соединяющие тяжелые цепи между собой (рис. 4) [20].
Относительно недавно, в 1999 году, учёными были обнаружены необычные антитела — на этот раз в сыворотке крови коровы [21]. Оказалось, что коровьи антитела имеют очень длинный, по сравнению с антителами других животных, CDR H3 район (рис. 5). Он может достигать в длину шестидесяти аминокислот и больше. Данный район был назван «ручкой» антитела (англ. «knob»), и, конечно же, учёные сразу заинтересовались, что это за ручка и откуда она взялась. Выяснилось, что данный участок играет критическую роль в иммунном ответе и связывании антигена. Каждая такая ручка уникальна, и в основном ею распознаётся конкретный вирусный антиген. Почему именно у коров возникли такие антитела? В первую очередь стоит подчеркнуть, что коровы, которые относятся к жвачным животным, очень необычны в плане своей физиологии. Желудок у них состоит из четырёх отделов — рубца, сетки, книжки и сычуга. Рубец является своеобразным «ферментёром», который метаболизирует пищу, поступающую в желудок. Необходимо поддерживать нормальный уровень естественной микрофлоры рубца, для того чтобы избежать инфицирования пищеварительного тракта или крови животного условно-патогенными организмами. Эта цель может быть достигнута за счёт присутствия в организме таких необычных антител, которые обладают крайне высоким разнообразием и могут проникать в различные поры, выступы и канавки на поверхности антигенов, что трудно сделать обычному антителу с короткой ручкой [22].
Пока коровьи антитела изучены слабо. Понятно, что, модифицируя ручку антитела, например присоединяя к ней другую молекулу, можно получить оригинальные конструкты. Проводятся эксперименты по частичной замене ручки биологически активными полипептидами с известными функциями. Уже получены подобного рода гранулоцитарный колониестимулирующий фактор (G-CSF) и эритропоэтин [23, 24]. G-CSF стимулирует рост и дифференцировку гематопоэтических клеток таких линий, как гранулоциты, макрофаги, эозинофилы, а эритропоэтин отвечает за стимуляцию образования эритроцитов. Такие полипептиды, с одной стороны, сохраняют свои естественные функции, а с другой приобретают более длительную устойчивость, которая свойственна классическим антителам. В целом, предполагается что CDR H3, чья ручка по размеру и форме схожа с другими ноттинсами (белковые молекулы, по форме напоминающие узелки), хемокинами, токсинами, ингибиторами протеаз и дефензинами — это будущий перспективный инструмент для распознавания необычных антигенов и их эпитопов.
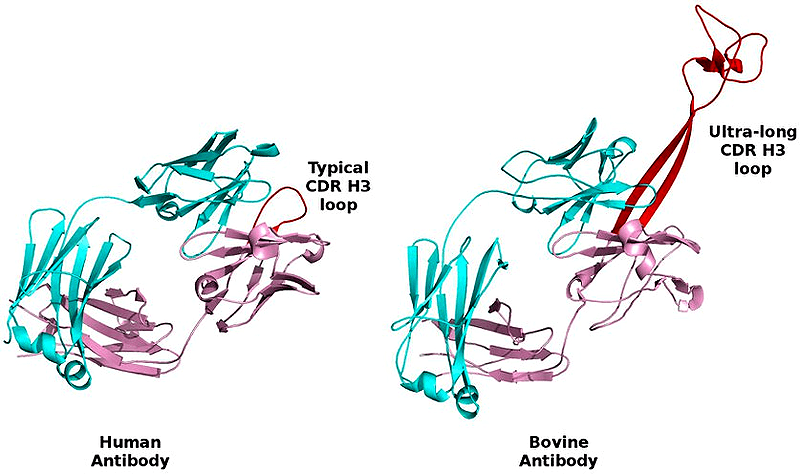
Рисунок 5. Сравнение человеческого (слева) и коровьего (справа) антител. Красным изображён CDR H3 район. Видно, что в бычьем антителе он заметно больше. Рисунок с сайта sandiegouniontribune.com.
«Сказка ложь, да в ней намёк — добрым молодцам урок». Действительно, наши предки не могли научно объяснить то или иное явление, не знали молекулярной биологии, однако были правы — мир природы, который нас окружает, наполнен удивительными вещами. Сейчас наука показывает, что многое из того, что могло когда-то показаться вымыслом, действительно существует. И загадочные обитатели океанических глубин, и птицы, и млекопитающие — всё живое являет собой пример прекрасного совершенства, нет в мире ничего лишнего и бесполезного. И яркое тому подтверждение — обнаружение множества удивительных, разнообразных молекул иммунной системы, антител — у разных представителей мира животных (рис. 6).

Рисунок 6. Вот и сказочке конец, а кто слушал — молодец!
Литература
- Моноклональные антитела;
- Иммунологическая Нобелевская премия (2011);
- Hamers-Casterman C., Atarhouch T., Muyldermans S., Robinson G., Hamers C., Bajyana Songa E. et al. (1993). Naturally occurring antibodies devoid of light chains. Nature. 363, 446–448;
- Saerens D., Ghassabeh G.H., Muyldermans S. (2008). Single-domain antibodies as building blocks for novel therapeutics. Curr. Opin. Pharmacol. 8, 600–608;
- От рака вылечит... верблюд!;
- Dooley H., Flajnik M.F., Porter A.J. (2003). Selection and characterization of naturally occurring single-domain (IgNAR) antibody fragments from immunized sharks by phage display. Mol. Immunol. 40, 25–33;
- Wu A.M., Senter P.D. (2005). Arming antibodies: prospects and challenges for immunoconjugates. Nat. Biotechnol. 23, 1137–1146;
- Hmila I., Ben Abderrazek R., Saerens D., Benlasfar Z., Conrath K., El Ayeb M. et al. (2008). VHH, bivalent domains and chimeric heavy-chain-only antibodies with high neutralizing efficacy for scorpion toxin AahI. Mol. Immunol. 45, 3847–3856;
- Coppieters K., Dreier T., Silence K., de Haard H., Lauwereys M., Casteels P. et al. (2006). Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis Rheum. 54, 1856–1866;
- Behar G., Siberil S., Groulet A., Chames P., Pugniere M., Boix C. et al. (2008). Isolation and characterization of anti-FcγRIII (CD16) llama singledomain antibodies that activate natural killer cells. Protein Eng. Des. Sel. 21, 1–10;
- Warr G.W., Magor K.E., Higgins D.A. (1995). IgY: clues to the origins of modern antibodies. Immunol. Today. 16, 392–398;
- Spillner E., Braren I., Greunke K., Seisman H., Blank S., Plessis du D. (2012). Avian IgY antibodies and their recombinant equivalents in research, diagnostics and therapy. Biologicals. 40, 313–322;
- Gould H.J., Sutton B.J., Beavil A.J., Beavil R.L., McCloskey N., Coker H.A. et al. (2003). The biology of IGE and the basis of allergic disease. Annu. Rev. Immunol. 21, 579–628;
- Mine Y. and Kovacs-Nolan J. (2002). Chicken egg yolk antibodies as therapeutics in enteric infectious disease: a review. J. Med. Food. 5, 159–169;
- Kollberg H., Carlander D., Olesen H., Wejaker P.E., Johannesson M., Larsson A. (2003). Oral administration of specific yolk antibodies (IgY) may prevent Pseudomonas aeruginosa infections in patients with cystic fibrosis: a phase I feasibility study. Pediatr. Pulmonol. 35, 433–440;
- Kruger C., Pearson S.K., Kodama Y., Vacca Smith A., Bowen W.H., Hammarstrom L. (2004). The effects of egg-derived antibodies to glucosyltransferases on dental caries in rats. Caries. Res. 38, 9–14;
- http://biomolecula.ru#;
- Chiou V.Y. (2008). The development of IgY (DeltaFc) antibody based neuro toxin antivenoms and the study on their neutralization efficacies. Clin. Toxicol. (Phila). 46, 539–344;
- Thalley B.S. and Carroll S.B. (1990). Rattlesnake and scorpion antivenoms from the egg yolks of immunized hens. Biotechnol. (NY). 8, 934–938;
- Альтшулер Е.П., Серебряная Д.В., Катруха А.Г. (2010). Получение рекомбинантных антител и способы увеличения их афинности. Успехи биологической химии. 50, 203–258;
- Saini S.S., Allore B., Jacobs R.M., Kaushik A. (1999). Exceptionally long CDR3H region with multiple cysteine residues in functional bovine IgM antibodies. Eur. J. Immunol. 29, 2420–2426;
- Wang F., Ekiert D.C., Ahmad I., Yu W., Zhang Y., Bazirgan O. et al. (2013). Reshaping antibody diversity. Cell. 153, 1379–1393;
- Zhang Y., Wang D., de Lichtervelde L., Sun S.B., Smider V.V., Schultz P.G., Wang F. (2013). Functional antibody CDR3 fusion proteins with enhanced pharmacological properties. Angew. Chem. Int. Ed. 52, 8295–8298;
- Zhang Y, Wang D, Welzel G, Wang Y, Schultz PG, Wang F. (2013). An antibody CDR3-erythropoietin fusion protein. ACS Chem. Biol. 8, 2117–2121..







