
Blue brain project: связи и хаос
21 июня 2016
Blue brain project: связи и хаос
- 2828
- 6
- 5
Арт Джексона Поллока «Jump in».
сайт redbubble.com
-
Автор
-
Редакторы
Как миллиарды нейронов мозга связаны между собой, а нервная активность формирует мысли? В конце 2015 года ученые приблизились к ответу на эти вопросы. В проекте Blue Brain была создана детальная реконструкция небольшого участка моторной коры — 31 тысяча нейронов, связанных друг с другом восьмью миллионами связей. Активность нейронной сети смоделировали на суперкомпьютере. Это позволило ученым проверить важнейшие принципы работы мозга многих млекопитающих, в том числе человека.
Один из подходов к изучению мозга — моделирование. Компьютерные модели в естественных науках используются там, где невозможно или очень трудно провести эксперимент — например в астрофизике, гидродинамике и молекулярной биологии. Математические модели позволяют ученым обобщать большой объем экспериментальных данных в емкие концепции, а также предсказывать новые свойства. В нейробиологии область, которая занимается моделированием мозга, называется вычислительной нейронаукой. Она описывает процессы, происходящие в нервной системе, с помощью математических моделей [1].
О том, как наука, «подсыхая», дает сочные плоды, а именно — об увлекательном процессе и впечатляющих результатах слияния биологии с информатикой, — можно прочитать в статьях: «Пространственно-временное моделирование в биологии» [2], «Вычислительное будущее биологии» [3], «Жизнь — это компьютер» [4] и «Я б в биоинформатики пошёл, пусть меня научат!» [5]. — Ред.
Человеческий мозг — одна из самых сложных систем, которые нам известны. В мозге взрослого человека содержится около 1011 нейронов, которые связаны еще бόльшим количеством связей — примерно 1011–1013 [6]. Многие эксперименты на мозге живого человека ученые не могут проводить по этическим причинам, поэтому они изучают мозг других млекопитающих как наиболее похожий на человеческий. Несмотря на то что человек относится к приматам, а мышь — к грызунам, многие свойства коры мозга у них очень схожи.
В рамках проекта Blue Brain [7], [8] ученые реконструировали небольшой участок соматосенсорной коры размером 0,29 мм3, который называется колонкой. Нейроны этой области управляют телодвижениями, а также анализируют тактильную информацию. В пределах колонки коры нейроны в большей степени связаны друг с другом, нежели с нейронами соседних колонок, что позволяет увидеть такую структуру анатомически [6]. Строение колонки повторяется в зрительной, слуховой и других областях коры. Именно поэтому изучение этого небольшого участка позволяет многое сказать о работе всего мозга.
Чтобы смоделировать колонку, ученые записали активность 14 тысяч нейронов в срезах мозга и воссоздали около 8 миллионов связей между ними. На это ушло около 10 лет.
Реконструкция: лес дендритных деревьев
Небольшой фрагмент соматосенсорной (участвующей в движении) коры мозга мыши был выбран потому, что о его строении уже многое было известно. Изучением связей между отдельными клетками и целыми областями занимается раздел нейронауки под названием коннектомика [9]. Ученые считают, что информация, с помощью которой мозг может обучаться и адаптироваться к внешней среде, записывается в связях между отдельными нейронами — синапсах. Например, в синапсах соматосенсорной коры закодирована информация, необходимая животному для того, чтобы двигать конечностями и понимать, что они чувствуют.
Итак, с чего же начинали моделирование? Для того чтобы изучить, как нейроны отвечают на различные стимулы, активность отдельных клеток в срезе мозга записывали с помощью метода patch-clamp в ответ на электрическую стимуляцию. После этого в «записанные» нейроны добавляли специальную краску, чтобы увидеть устройство клетки. Затем данные о структуре нейрона и его ответы на электрические стимулы записывали в одну базу данных.
На следующем этапе структуру отдельных нейронов и их ответы на стимуляцию классифицировали по специальным алгоритмам. Это позволило понять, какие именно типы нейронов представлены в соматосенсорной коре. Кроме того, результаты классификации сравнили с другими известными данными, чтобы проверить работу таких алгоритмов.
В итоге ученые нашли 55 классов возбуждающих и тормозных нейронов, отличающихся характерной формой. Анализ разных типов клеток позволил моделировать искусственные нейроны, которые по форме и электрическим свойствам похожи на настоящие. Этот этап крайне важен в реконструкции. Поскольку современные методы не позволяют записать активность всех возможных клеток в мозге, важно уметь обобщать информацию об уже «измеренных» нейронах и предсказывать свойства тех, которые только могут быть измерены. Таким образом, 14 000 записанных нейронов позволили смоделировать 31 000 нейронов, из которых затем была построена колонка.
Реконструированные нейроны расставили в модели так, чтобы максимально достоверно сымитировать оригинал (рис. 1). Затем при помощи специального поискового алгоритма дендриты этих нейронов связали с аксонами соседних [10]. Это позволило решить крайне непростую задачу восстановления связей между отдельными клетками. Оказалось, что даже на участке коры размером всего 0,29 мм3 содержится порядка 8 000 000 межнейронных связей, состоящих из 37 000 000 синапсов (каждая связь представлена несколькими синапсами).
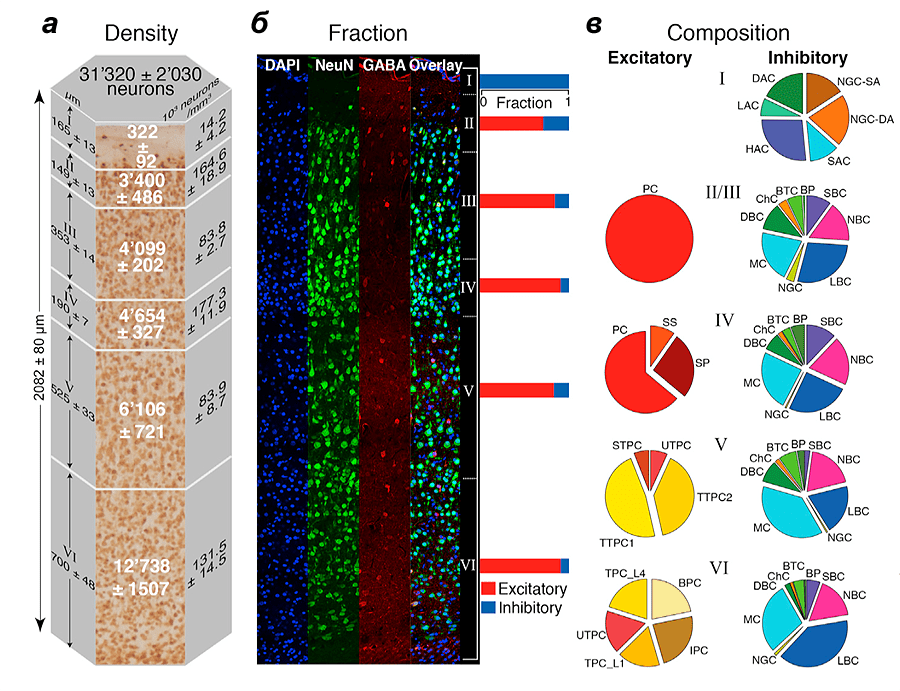
Рисунок 1. Плотность нейронов в колонке коры размером около 0,29 мм3. а — Плотность нейронов в разных частях коры. б — Различные типы нейронов, помеченные с помощью флуоресцентных белков. в — Морфологические типы возбуждающих (excitatory) и тормозных (inhibitory) нейронов в разных слоях коры.
Реконструкция позволила ученым детально проследить практически все возможные связи, которые формирует каждый нейрон в колонке. Но стоит отметить, что такая реконструкция позволяет описать связи только статистически. Иными словами, полученные связи — не единственно возможный вариант, а однин из наиболее вероятных.
Видео 1. Реконструкция связей нейронов в колонке. Фрагмент S1A — реконструкция формы нейронов, цветами показаны клетки различных слоев коры и характерные нейроны. Фрагмент S1B — «пролет» камеры через лес дендритных деревьев.
На видео 1 представлена общая картина таких связей. Каждый нейрон обладает большим количеством ответвлений, которые называются дендритными деревьями. Именно на веточках этих деревьев и формируются отдельные синапсы. Отростки нейронов образуют целый «лес», состоящий из дендритов и аксонов отдельных клеток. Хорошо видно, что даже небольшой участок коры обладает колоссальным числом связей, которые неоднородно распределены между клетками 55 типов.
Динамика: синхронизация и хаос в сети нейронов
Для того чтобы отдельные клетки могли автономно генерировать активность, нейроны в модели соединили в соответствии с реконструированными связями. Оказалось, что сеть, построенная подобным образом, способна генерировать синхронную активность, которая называется популяционными спайками. В случае такой активности все нервные клетки генерируют спайки (нервные импульсы) почти в одно и то же время (рис. 2). Если в сети достаточно возбуждения, почти все нейроны генерируют синхронный популяционный спайк. Затем сеть медленно восстанавливается перед генерацией следующего синхронного импульса. Такое автономное поведение сети характерно для эпилепсии: группа нейронов вынуждена генерировать синхронную активность, которую сложно остановить.

Рисунок 2. Популяционный спайк в модели колонки. а — Реконструированные нейроны в различных слоях коры. б — Популяционные спайки в сети нейронов. Каждая точка соответствует нервному импульсу, по вертикали отложены различные нейроны. в — Потенциал клеток разных типов. г — Распределение интервалов между импульсами во время активности.
При меньшей силе связей в сети возможен и другой вид активности — асинхронное состояние. В этом режиме нейроны могут генерировать импульсы в разное время, то есть вести себя асинхронно: возбуждение в сети сбалансировано с торможением. За счет возбуждающих связей сеть постоянно генерирует спайки, которые поддерживают активность, а тормозные связи не позволяют нейронам слишком сильно синхронизироваться, подавляя слишком активные клетки.
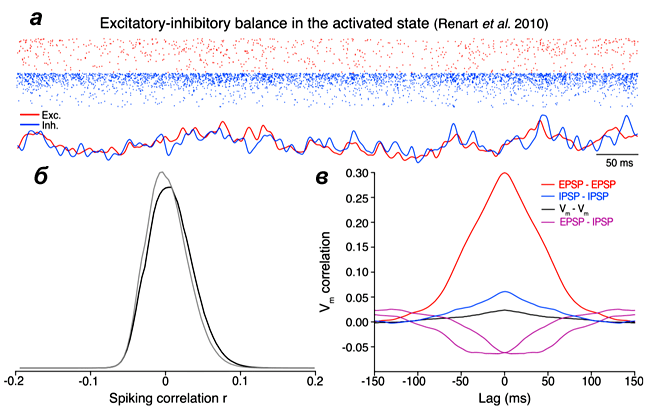
Рисунок 3. Асинхронное состояние в сети нейронов. а — Спайки возбуждающих (красные точки) и тормозных (синие точки) нейронов. Внизу — частота разрядов возбуждающих (красная линия) и тормозных (синяя линия) нейронов. б — Корреляция между спайками отдельных нейронов. в — Усредненная корреляция мембранного потенциала всех нейронов сети, а также усредненных возбуждающих (EPSP) и тормозных (IPSP) токов.
Такое состояние сети называется сбалансированным (англ. balanced state). Баланс между возбуждением и торможением поддерживается за счет постоянной активности возбуждающих и тормозных нейронов (рис. 3). При балансе активность нейронов на первый взгляд кажется не связанной: внешний наблюдатель увидит только случайные разряды отдельных клеток. Но на самом деле поведение сети тонко настроено таким образом, что каждая клетка получает сбалансированный «вход», состоящий из возбуждения и торможения. При внешней стимуляции коры, например при поглаживании связанного с корой участка кожи, активность сети нейронов может немного возрасти. При этом число спайков немного увеличится, но потом сеть довольно быстро вернется к начальному состоянию, в котором она готова обрабатывать новую информацию (видео 2). Иными словами, сбалансированное состояние сети очень устойчиво.
Видео 2. Состояние сети связанных колонок при стимуляции. Активность сети семи связанных колонок (~34 000 нейронов в каждой) при стимуляции нескольких клеток в центральной колонке (вид сверху).
Ключевое свойство асинхронного состояния заключается в том, что нейрон получает импульсы случайно, даже если в сети нет дополнительных источников шума. Такие системы известны в физике как детерминированный хаос.
В состоянии хаоса сеть нейронов чувствительна к начальным условиям, то есть состояние сети в каждый момент времени строго определяется ее предыдущим состоянием. Но стόит хоть немного изменить условия, например немного сместить время генерации спайка одной клетки, и сеть переходит в совершенно другое состояние уже через несколько мгновений [11]. В состоянии хаоса время отдельных спайков нейронов сети случайно, и в каждый следующий момент времени состояние сети уже не такое, как было до этого [12].
Стόит отметить, что сбалансированное состояние сети нейронов коры предсказывалось другими моделями ранее [13], [14]. В работах, посвященных более простым нейронным сетям, механизмы асинхронного состояния системы также объяснились балансом возбуждения и торможения. Таким образом, построенная в рамках Blue Brain подробная модель подтвердила один из известных принципов работы коры.
Анализ модели также показал, что в зависимости от силы возбуждения сеть может находиться либо в асинхронном состоянии (при небольшом возбуждении), либо в состоянии популяционных спайков. Сила возбуждения в сети среди прочего определяется концентрацией внеклеточного кальция, влияющего на выход нейромедиаторов в синапсах [15]. То, что модель учитывала этот параметр, помогло подтвердить ее достоверность большим количеством экспериментальных данных, учитывающих концентрацию кальция.
Чтобы определить эффективность модели для биологических вычислений, ученые сконструировали модель, воспроизводящую сигнал, который получают нейроны коры от таламуса. Похожую стимуляцию получает кора при надавливании двух тонких иголок, расположенных на определенном расстоянии друг от друга. В таком случае нейроны в центре колонки получают два сигнала, разнесенных на разное расстояние, а другие области коры должны определить расстояние между иголками только на основании активности (рис. 4). Оказалось, что нейроны пятого слоя коры могут лучше всего определить расстояние между иголками, если вся сеть находится в асинхронном режиме активности, близком к режиму генерации популяционных спайков.
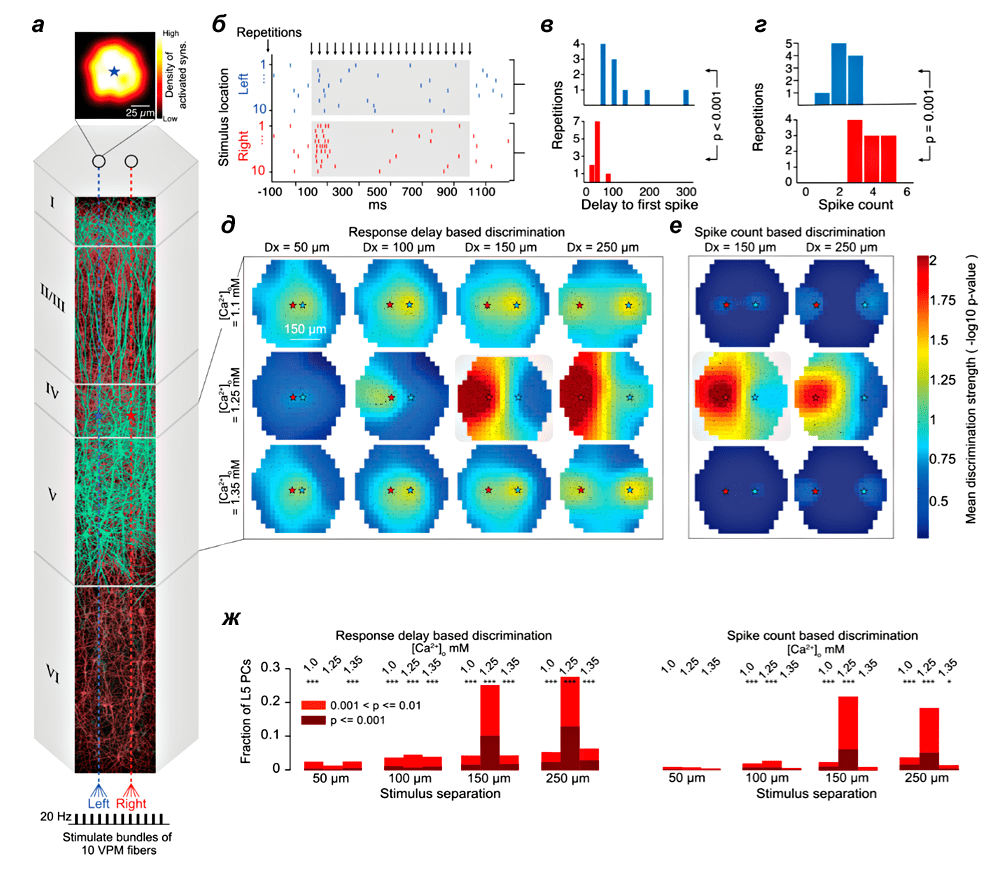
Рисунок 4. Декодирование стимула в коре. а — Модель колонки и стимула. б — Спайки отдельных нейронов при стимуляции двумя иголками. в, г — Распределение времени до первого спайка и количество спайков с момента стимуляции. д, е — Способность определить расстояние между иголками на основании активности нейронов при различных концентрациях кальция, когда декодирование построено на времени задержки до первых спайков (д) и общем их количестве (е). ж — Усредненная способность нейронов пятого слоя определять характеристику стимула при различных концентрациях кальция.
Выводы
Результатом одного из самых многообещающих проектов в области вычислительной нейронауки стала максимально подробная на данный момент реконструкция участка мозга размером около 0,29 мм3. Посмотреть на нее можно на интернет-портале проекта Blue Brain [16]. Модель впервые связала воедино огромное количество данных о работе коры.
Несмотря на успех Blue Brain Project, теоретики нейронауки критикуют его за то, что ничего принципиально нового о работе мозга узнать не удалось [17]. Например, асинхронное состояние сети было предсказано задолго до начала работы над проектом. Кроме того, модель не подходит для проверки многих важных гипотез о механизмах работы коры из-за своей сложности. Интерпретация результатов такого моделирования крайне трудна даже для специалистов.
| Червь С. elegans (гермафродит / самец) | Плодовая мушка, медуллярная колонка | Мышь, IPL-сегмент сетчатки | Мозг плодовой мушки | Мышь, кортикальная колонка | Мозг мыши | Мозг человека | |
|---|---|---|---|---|---|---|---|
| Объем, мм3 | 0,0003 | 0,0001 | 0,001 | 0,071 | 0,12 | 450 | 1400K |
| Воксельные размеры, XxYxZ, нм | 5×5×70 | 3,1×3,1×40 | 16×16×25 | ~83 | ~153 | ~153 | ~153 |
| Воксельный объем, нм3 | ~1750 | 380 | 6800 | ~500 | ~3400 | ~3400 | ~3400 |
| Количество вокселей, ×1012 | 0,13 | 0,3 | 0,15 | 142 | 35 | 130K | 280M |
| Обнаруженные нейроны | 302 | 379 | 950 | ~105 | ~104 | ~108 | ~1011 |
| Описанные синапсы | 7283 | 8637 | - | ~108 | ~108 | ~1012 | ~1015 |
| Время для воссоздания связей в мозге одной особи, годы | >10 | 10 | 10 | 4700 | 1200 | 4,5M | 14G |
При современном уровне развития технологий реконструкция большинства связей между нейронами даже в небольшом мозге мыши может занять несколько миллионов лет (табл. 1). Так что широкое применение этого метода для человека пока невозможно.
Тем не менее модель показала принципиальную возможность реконструкции больших частей нервной системы, таких как колонка коры, на уровне отдельных клеток. Дальнейшее развитие таких моделей и методов реконструкции поможет понять, что именно нужно знать для раскрытия принципов работы мозга.
Видео 3. Визуализация активности нейронов в микросети
Статья написана совместно с Алисой Иваницкой.
Литература
- От живого мозга к искусственному интеллекту;
- Пространственно-временное моделирование в биологии;
- Вычислительное будущее биологии;
- Жизнь — это компьютер;
- Я б в биоинформатики пошёл, пусть меня научат!;
- Principles of neural science / ed. by Kandel E.R., Schwartz J.H., Jessell T.M., Siegelbaum S.A., Hudspeth A.J. NY: McGraw-Hill Education / Medical, 2012. — 1760 p.;
- Blue Brain Project: как все связано?;
- Markram H., Muller E., Ramaswamy S., Reimann M.W., Abdellah M., Sanchez C.A. et al. (2015). Reconstruction and simulation of neocortical microcircuitry. Cell. 163, 456–492;
- «Омики» — эпоха большой биологии;
- Reimann M.W., King J.G., Muller E.B., Ramaswamy S., Markram H. (2015). An algorithm to predict the connectome of neural microcircuits. Front. Comput. Neurosci. 9, 120;
- Strogatz S.H. Nonlinear dynamics and chaos: with applications to physics, biology, chemistry, and engineering. USA, Boulder: Westview press, 2014. — 512 p.;
- London M., Roth A., Beeren L., Häusser M., Latham P.E. (2010). Sensitivity to perturbations in vivo implies high noise and suggests rate coding in cortex. Nature. 466, 123–127;
- van Vreeswijk C. and Sompolinsky H. (1998). Chaotic balanced state in a model of cortical circuits. Neural Comput. 10, 1321–1371;
- Renart A., de la Rocha J., Bartho P., Hollender L., Parga N., Reyes A., Harris K.D. (2010). The asynchronous state in cortical circuits. Science. 327, 587–590;
- Как происходит выделение нейромедиатора;
- The neocortical microcircuit collaboration portal. Сайт Blue Brain Project;
- Kupferschmidt K. (2015). Rat brain — or a smidgeon of it — is modeled in a computer. Science News;
- Plaza S.M., Scheffer L.K., Chklovskii D.B. (2014). Toward large-scale connectome reconstructions. Curr. Opin. Neurobiol. 25, 201–210.






