Антибиотики прямо под нашим носом
16 августа 2016
Антибиотики прямо под нашим носом
- 21919
- 0
- 9
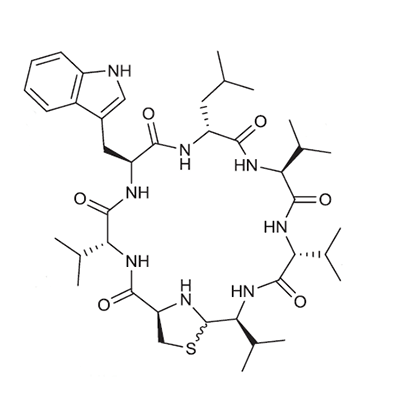
Структурная формула нового пептидного антибиотика.
-
Автор
-
Редакторы
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Доступные населению антибиотики теряют эффективность, а их частое и необоснованное применение приводит к отбору устойчивых форм бактерий внутри организмов людей и животных. MDRO в человеческом микробиоме трудно выявить, ведь обычно их носительство бессимптомно. Однако в стрессовых условиях (после хирургических операций, при травмах или иммуносупрессии) оно может перерасти в агрессивную инфекцию, побороть которую будет крайне сложно. А если еще учесть и частую устойчивость подобных бактерий к классическим дезинфектантам, становится понятным, почему MDRO считают настоящим бичом стационаров и роддомов. Они — куда более осязаемая угроза для населения всех континентов, чем тот же вирус Эбола, поэтому огромные усилия сейчас направляются на поиск и производство новых антибиотиков, способных «взломать» защитные системы MDRO.
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
О пептидных антибиотиках «биомолекула» подробно рассказывала ранее: «Антимикробные пептиды — возможная альтернатива традиционным антибиотикам» [4].
Может показаться странным, что человеческая микробиота производит антибиотики, ведь индустрия поиска противомикробных веществ всегда была сосредоточена на почвенных бактериях: считалось, что именно там бурлит жизнь и активно идет борьба за существование. Однако в микробиоме человека насчитывается более тысячи видов бактерий, конкурирующих за место и питательные вещества. Это способствует появлению настоящего «оружия массового поражения» — бактериоцинов, производимых с помощью ферментов двух типов — поликетидсинтаз и нерибосомных пептидсинтетаз [5].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

Рисунок 3. Антибактериальная активность S. lugdunensis против метициллин-резистентного S. aureus. Слева — дикий штамм IVK28 образует зону лизиса на культуре S. aureus. В центре — штамм IVK28ΔlugD (с «выключенным» встраиванием транспозона геном lugD) не оказывает влияния на золотистого стафилококка. Справа — штамм с восстановленной активностью гена lugD снова лизирует клетки конкурента.
В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Разношерстные участники и пикантные подробности бактериального горизонтального генетического переноса описаны в статье «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [11].
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
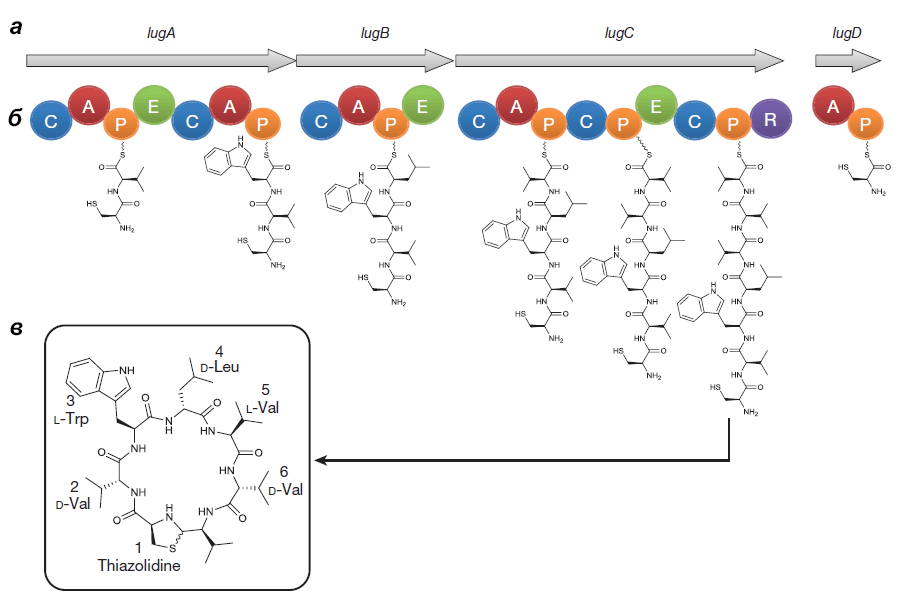
Рисунок 4. Кластер генов, биосинтетический путь и химическая структура лугдунина. а — Гены «субъединиц» (не модулей!) нерибосомной пептидсинтетазы S. lugdunensis: lugA, B, C и D. б — Функциональные домены продуктов оперона: А — аденилирующий, Р — пептидильный, С — конденсирующий, Е — эпимеризующий, R — редуктазный. Их специфические комбинации составляют модули — обособленные каталитические единицы фермента. Биосинтез лугдунина начинается, видимо, в инициирующем модуле LugD и продолжается последовательно с помощью LugA-C. в — Структурная формула лугдунина.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл−1, что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл−1) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
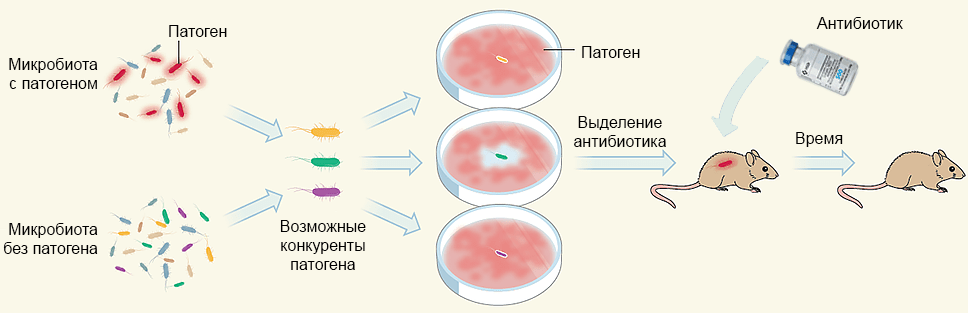
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Из-за высокой эффективности лугдунина авторы обсуждаемой работы предлагают использовать S. lugdunensis в борьбе с золотистым стафилококком, особенно у пациентов с высокими рисками развития инфекции — после операций, иммуносупрессии или гемодиализа. Ранее пробиотическими, как правило, называли бактерий, активно действующих на благо макроорганизма в желудочно-кишечном тракте. Группа Ципперера выступает за расширение понятия «пробиотики» — включение туда бактерий, борющихся с инфекциями и в других местах человеческого тела, таких как носовая полость или кожа.
В очень редких случаях и сам S. lugdunensis может вызывать заболевания, но если удастся создать мутантов, полностью утративших факторы вирулентности, или встроить lug-оперон в абсолютно «мирные» бактерии, можно разработать безопасный пробиотический препарат.
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Литература
- Zipperer A., Konnerth M.C., Laux C., Berscheid A., Janek D., Weidenmaier C. et al. (2016). Human commensals producing a novel antibiotic impair pathogen colonization. Nature. 535, 511–516;
- Dobson A., Cotter P.D., Ross R.P., Hill C. (2012). Bacteriocin production: a probiotic trait? Appl. Environ. Microbiol. 78, 1–6;
- Donia M.S., Cimermancic P., Schulze C.J., Wieland Brown L.C., Martin J., Mitreva M. et al. (2014). A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics. Cell. 158, 1402–1414;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Lewis K. and Strandwitz P. (2016). Antibiotics right under our nose. Nature. 535, 501–502;
- Википедия: «Золотистый стафилококк»;
- Карпов И.А. и Качанко Е.Ф. (2005). Стафилококковая инфекция: клинические аспекты и перспективы терапии. Медицинские новости. 9, 53–56;
- Mandal A. (2012). What is Staphylococcus aureus? News-Medical.net;
- Naber C.K. (2009). Staphylococcus aureus bacteremia: epidemiology, pathophysiology, and management strategies. Clin. Infect. Dis. 48, S231–S237;
- Стафилококк золотистый (Staphylococcus aureus). ГастроСкан;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Википедия: «Нерибосомные пептиды»;
- Caboche S., Pupin M., Leclère V., Fontaine A., Jacques P., Kucherov G. (2008). NORINE: a database of nonribosomal peptides. Nucleic Acids Res. 36, D326–D331;
- Mironovskiĭ M.L., Ostash B.E., Fedorenko V.A. (2010). Diversity of genes encoding nonribosomal peptide synthetases in the Streptomyces sioyaensis genome. Genetika. 46, 896–903.