
Псориаз: Т-хелперы, цитокины и молекулярные шрамы
09 октября 2016
Псориаз: Т-хелперы, цитокины и молекулярные шрамы
- 14743
- 10
- 10
Если бы мир смотрел на меня, он подивился бы, почему живот у меня словно исклеван большой птицей, весь в красных кружках величиной с мелкую монету (Джон Апдайк, «Кентавр»). На рисунке — фонтан «Бабуино» в Риме.
-
Автор
-
Редакторы
-
Рецензент
Темы
Мы продолжаем наш спецпроект по псориазу. Составить общее представление об этом распространенном заболевании позволяет первая статья цикла. А в этот раз мы расскажем о молекулярных механизмах, из-за которых возникают псориатические высыпания, о тонких взаимодействиях между клетками кожи и иммунными клетками, приводящих к развитию болезни, о молекулах, с помощью которых клетки передают друг другу сигналы об опасности, и о молекулярных шрамах, которые заметны в клетках кожи даже тогда, когда, казалось бы, все симптомы заболевания исчезли.
Псориаз
Cпецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Введение
Согласно современным представлениям, псориаз — многофакторная болезнь, которая развивается у людей с генетической предрасположенностью под воздействием внешней среды. До сих пор патогенез псориаза полностью не изучен, но за последние десятилетия ученые далеко продвинулись в его исследовании: нашли объяснения ранее наблюдаемым клиническим феноменам, установили механизмы взаимодействия клеток иммунной системы и клеток кожи, выявили взаимосвязь патогенеза псориаза и других заболеваний. Эта статья посвящена патогенезу псориаза; генетический и эпигенетический аспекты заболевания будут описаны отдельно.
Как уже говорилось во вводной статье [1], при псориазе у больных на коже возникают приподнятые покрасневшие участки — бляшки. Их появление связано с двумя процессами: воспалением в коже и гиперплазией (разрастанием) эпителия. Судя по всему, причина этому — разрегулировка взаимодействия иммунной системы с клетками кожи [2]. Поэтому для того чтобы понять патогенез псориаза, вначале необходимо немного узнать об особенностях строения кожи и принципах работы иммунной системы.
Кожа, в которой я живу
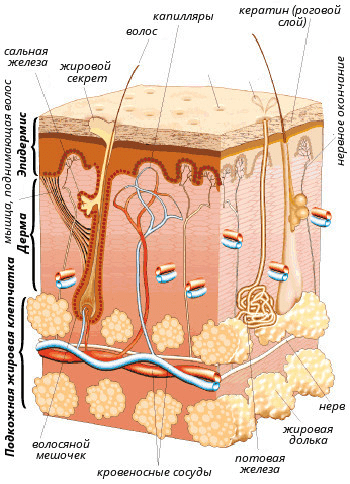
Рисунок 1. Строение кожи.
сайт bono-esse.ru
Кожа — самый крупный орган человека. С учетом подкожной жировой клетчатки она составляет до 17% от массы тела.
Кожа состоит из трех основных частей (рис. 1).
- Эпидермис — это именно та поверхностная часть кожи, доступная нашему взору, которая шелушится после солнечного ожога или образует мозоли после механического воздействия. Благодаря эпидермису формируется защитный барьер организма от патогенных бактерий, грибов, вирусов, температуры, ультрафиолетового излучения, потери воды и механических повреждений. Эпидермис образован несколькими типами клеток, но самый распространенный тип (до 90% от общего количества) — кератиноциты. Называются они так потому, что в огромных количествах вырабатывают структурный белок кератин. Эпидермис состоит из пяти слоев: базального, шиповатого, зернистого, блестящего и рогового (рис. 2). Кератиноциты базального слоя активно делятся, вытесняя старшие клетки к поверхности кожи. По дороге к поверхности клетки дифференцируются — уплощаются, ороговевают (вырабатывают огромные количества кератина) и, постепенно отмирая, теряют ядра. На разных стадиях дифференцировки кератиноциты по-разному выглядят под световым микроскопом, их внешний вид и дал название слоям эпидермиса: базальный — клетки, расположенные на базальной мембране; шиповатый — клетки с отростками-шипами; зернистый — клетки, содержащие в цитоплазме скопления белков и жиров в виде зерен; блестящий — клетки с блестящим белком элеидином; роговой — роговые пластинки (безъядерные, ороговевшие клетки).
Также в эпидермисе находятся клетки меланоциты, синтезирующие пигмент меланин, ответственный за защиту кожи от УФ-лучей, и иммунные клетки (прежде всего дендритные), первыми встречающие инфекционные и неинфекционные агенты, внедрившиеся в кожу. - Дерма — более глубокая часть кожи, отделенная от эпидермиса тонкой пластинкой базальной мембраны, образованная кровеносными сосудами и структурными белками (прежде всего коллагеном и эластином). Дерма состоит из двух слоев: сосочкового, богатого питающими сосудами, и сетчатого, богатого белками, отвечающими за прочность и эластичность кожи. Главные и самые многочисленные клетки этой части кожи — фибробласты, выделяющие коллаген и эластин. Также в дерме присутствуют единичные меланоциты и некоторые иммунные клетки, прежде всего макрофаги.
- Гиподерма — подкожная жировая клетчатка, образованная клетками адипоцитами. Поскольку жир — отличный теплоизолятор, а также энергетическое депо, гиподерма выполняет терморегулирующую и энергетическую функции. К тому же, слой клетчатки служит дополнительной защитой нижележащих тканей от повреждения.
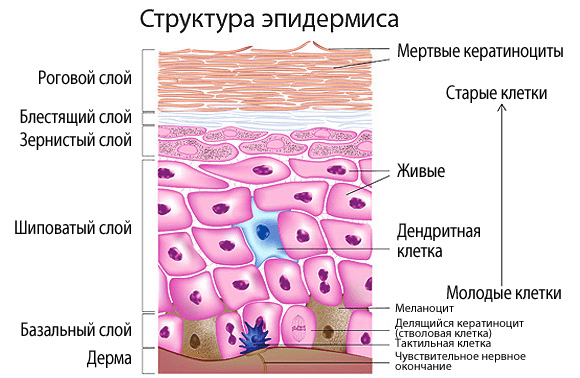
Рисунок 2. Пять слоев эпидермиса.
сайт shugaring-odessa.com
Также в коже находятся сальные и потовые железы, открывающие свои протоки на ее поверхности, волосяные фолликулы, нервные волокна и нервные окончания.
На защите организма
Иммунная система — это система органов и клеток, которые защищают организм от патогенов: вирусов, бактерий, простейших, гельминтов и так далее. Ежедневно организм сталкивается с миллионами микробов, многие из которых являются патогенами, но благодаря иммунным реакциям болезни развиваются редко. Иммунная система потому так хорошо дерется с врагами, что очень точно умеет их определять: она может распознавать характерные кусочки молекул напавших на нее патогенов, в основном, веществ, которыми они покрыты. Такие кусочки называются антигенами.
Для того чтобы общаться друг с другом, иммунные клетки выделяют особые информационные молекулы — цитокины. Цитокины могут быть как возбуждающими («на нас напали, свистать всех наверх!»), так и тормозящими («ложная тревога, возвращаемся к мирной жизни!»). В принципе, цитокины могут выделяться всеми клетками организма, но иммунные клетки общаются на языке цитокинов особенно активно. Ниже в таблице перечислены основные группы цитокинов и их функции.
| Название | Функция | Некоторые представители* | |||||
|---|---|---|---|---|---|---|---|
| Интерфероны | Группа молекул, выделяемых клетками в ответ на вторжение вируса; обладают сходными свойствами и противовирусным действием | Интерфероны альфа (IFN-α), бета (IFN-β), гамма (IFN-γ) | |||||
| Хемокины | Небольшие белки, продуцируемые в клетках и тканях при появлении патогена; стимулируют миграцию, адгезию и активацию клеток | CXC, CC, CX3C, XC | |||||
| Факторы некроза опухоли | Белки, синтезируемые главным образом моноцитами и макрофагами; вызывают некроз опухолевых клеток и усиливают иммунный ответ | Факторы некроза опухоли альфа (ФНО-α), бета (ФНО-β, он же — лимфотоксин-α) | |||||
| Интерлейкины | Растворимые пептиды, синтезируемые в основном Т-лимфоцитами; изолированно стимулируют группы клеток к делению или дифференцировке. Обладают про- и противовоспалительными эффектами в зависимости от интерлейкина и от клетки | IL-6, IL-17, IL-23 | |||||
| Гемопоэтины | Группа молекул со сходными свойствами; стимулируют размножение и дифференцировку клеток крови | Колониестимулирующие факторы (CSF) | |||||
| Трансформирующие факторы роста | Белки, контролирующие пролиферацию, клеточную дифференцировку и другие функции в большинстве клеток, включая иммунные | Трансформирующий фактор роста альфа (TGF-α), бета (TGF-β) | |||||
| * Некоторые цитокины обладают множественным действием и могут относиться сразу к нескольким группам (например, IL-8 — это хемокин CXCL8, а IL-2–4 влияют на гемопоэз) | |||||||
Выделяют два вида иммунитета: врожденный и приобретенный.
- Врожденный иммунитет — сумма всех эволюционно древних иммунных клеток (среди них макрофаги, дендритные клетки, гранулоциты крови и др.) и молекул (противомикробные пептиды, лизоцим, особая группа белков под названием «система комплемента» и др.). Клетки врожденного иммунитета умеют неспецифически (по антигенам, общим для разных групп чужеродных агентов) распознавать патогены и, привлекая другие иммунные клетки и молекулы, немедленно уничтожать их. В патогенезе псориаза особенно большое значение имеют два типа клеток врожденного иммунитета: дендритные клетки и нейтрофилы. Ниже мы поговорим об этих клетках подробнее.
Хотя врожденный иммунитет незаменим для быстрой реакции на врага, но его работе не хватает специфичности: в том случае, если в организме очень сильно размножится, например, какая-нибудь одна бактерия, то врожденный иммунитет в борьбе с нею проиграет — она победит числом. С другой стороны, если организм будет одинаково активно реагировать на чуму и на обычную «простуду», это тоже ни к чему хорошему не приведет. Поэтому следующим этапом эволюции иммунной системы стало появление приобретенного (адаптивного) иммунитета. - Клетки приобретенного иммунитета распознают куда более специфичные антигены. Если клетки врожденного иммунитета в состоянии понять: «наш враг — какая-то бактерия», — то клетки приобретенного подмечают: «на нас напала бактерия, на поверхности которой есть такой-то и такой-то антиген», — что, согласитесь, куда полезнее для победы над врагом. Кроме того, у приобретенного иммунитета есть так называемая иммунологическая память, «черный список», где фиксируются антигены всех когда-либо покушавшихся на целостность организма патогенов (кстати: на феномене иммунологической памяти основано действие прививок).
Боевая единица приобретенного иммунитета — особые иммунные клетки, лимфоциты. Их два вида: В- и Т-лимфоциты.
B-лимфоциты — это, можно сказать, артиллеристы иммунитета. Один из подтипов В-лимфоцитов — плазматические клетки, которые умеют вырабатывать специальные белки против антигенов — антитела. Антитела налипают на антигены, облепляют патогены со всех сторон и делают их более уязвимыми — прежде всего, привлекая к ним клетки врожденного иммунитета, макрофаги, которые узнают антитела и благополучно съедают такие патогены.
Что до Т-лимфоцитов, то они разделяются на три основных типа:- Т-киллеры убивают те клетки, которые были помечены организмом как «неправильные» — например, зараженные вирусами или опухолевые;
- Т-хелперы раздают указания другим иммунным клеткам о том, как нужно работать. Есть разные группы (популяции) Т-хелперов: так, Т-хелперы 1 типа (Th1) подстегивают Т-киллеров. Т-хелперы 2 типа (Th2) вызывают к бою В-лимфоциты; в случае псориаза большое значение имеют Th1, а также еще один подвид Т-хелперов — Th17.
- Т-супрессоры нужны, чтобы успокоить не в меру разбушевавшихся коллег. Они регулируют баланс между активацией и торможением иммунного ответа. Т-супрессоры либо непосредственно взаимодействуют с другими клетками, либо с помощью цитокинов посылают им сигнал торможения и таким образом замедляют или останавливают иммунный ответ. Важность Т-супрессоров демонстрирует тот факт, что развитие хронических инфекций и опухолей связано с их повышенной активностью, а аутоиммунных болезней (когда родной иммунитет восстает против здоровых клеток) — со сниженной.
Связующее звено между врожденным и приобретенным иммунитетами — особые клетки врожденного иммунитета, дендритные. Они встречают патоген, захватывают его, «разбирают» на антигены и мигрируют вместе с ними в ближайший лимфатический узел, где передают информацию о них другим иммунным клеткам. Запускается иммунный ответ, Т-хелперы вызывают к бою Т-киллеры и В-лимфоциты, из наивных Т-клеток созревают популяции Th1, Th2 и Th17, и иммунная реакция разворачивается на полную катушку. И, как уже говорилось, в патогенезе псориаза дендритные клетки играют одну из главных ролей.
Начало: что запускает псориаз
При наличии у человека генетической предрасположенности достаточно небольшого толчка, чтобы запустить развитие псориаза. Сейчас хорошо изучено несколько триггеров, приводящих к проявлению этого заболевания. Их мы и рассмотрим в этом разделе.
Стрептококк и мимикрия
Как уже говорилось во вводной статье «Псориаз: на войне с собственной кожей» [1], псориаз часто возникает после того, как человек переболел стрептококковой инфекцией, например, ангиной. И связано это, видимо, с тем, что стрептококки продуцируют М-протеин — белок, похожий по структуре на белки нормальных кератиноцитов [3]. Иммунные клетки, «разбуженные» стрептококком и «натасканные» на антигены М-протеина, после победы над инфекцией продолжают сторожить границы организма и искать эти антигены. Их они и находят на поверхности кератиноцитов, принимают многочисленные безвредные кератиноциты за опасного стрептококка, бьют в набат (ведь, по их данным, на организм напала многочисленная армия опаснейших возбудителей), запускают в коже иммунный ответ и вызывают псориатические высыпания. Такое явление — когда антиген на поверхности микроорганизма очень похож на поверхностный белок нормальных клеток макроорганизма — называется молекулярной мимикрией. Иммунная система, введенная мимикрией в заблуждение, дает осечку, принимает сотрудников за оккупантов и запускает иммунный ответ там, где он вовсе не нужен.
Дисбиоз и искажение иммунного ответа
Люди живут в гармонии с более чем десятью тысячами видов микроорганизмов и вирусов [4]. Иногда эти создания приносят организму прямую пользу (например, кишечная микробиота допереваривает то, что не смог переварить желудочно-кишечный тракт). Но выгода от микробов этим не ограничивается. Они постоянно держат иммунную систему в тонусе, выступают как бы тренажерами, на которых иммунные клетки учатся распознавать антигены. И микробиота поверхности кожи здесь играет одну из основных ролей [5].
Иногда благополучие нормальной поверхностной микрофлоры кожи нарушается активным размножением «непривычных», хотя и не всегда вредных, микроорганизмов — развивается дисбиоз. Дисбиоз на одном участке кожи влечет за собой изменения в нормальной микробиоте на других участках кожи и слизистых. В результате иммунная система, лишенная привычных «тренажеров», начинает работать со сбоями. Нарушается иммунное распознавание, что, видимо, и приводит к развитию некоторых заболеваний, в частности псориаза и воспалительных болезней кишечника. Подтверждением этой гипотезы служит, например, тот факт, что у больных псориазом в кожной микробиоте повышено количество определенных микроорганизмов — фирмикутов и актинобактерий [6]. Видимо, разбалансировка состава микробиоты, пусть и безвредной, «будит» дендритные клетки, а те запускают снежный ком реакций, приводящих к появлению псориатической сыпи. Правда, в этой истории трудно понять, где здесь причина, а где следствие. Возможно, что именно развитие псориаза «перекашивает» состав микробиоты.
Травма, сигналы опасности и воспаление
Многовековые клинические наблюдения показывают, что часто псориаз развивается и обостряется в ответ на травму — царапину, рану, пирсинг и так далее. Это явление называется феноменом Кебнера. Для него есть объяснение на молекулярном уровне. Погибшие из-за травмы клетки выделяют в окружающую среду особые молекулы, так называемые сигналы опасности. Эти молекулы связываются с рецепторами на поверхности клеток врожденного иммунитета и активируют запуск сигнальных каскадов воспаления, которые приводят к тому, что иммунные клетки начинают выделять много провоспалительных цитокинов, активирующих всё новые клетки — как иммунные, так и кератиноциты. Так запускается воспаление. Вообще, воспаление — совершенно нормальный процесс, который необходим организму — например, чтобы в ранках не развивались бактерии, чтобы кожа поскорее восстанавливалась. Но при наличии генетической предрасположенности воспаление развивается неконтролируемо, кератиноциты делятся слишком активно, их накапливается всё больше (а иммунные клетки продолжают подстегивать их делиться еще и еще) — что и приводит к формированию псориатической бляшки. И специфический антиген здесь не обязателен: любое нарушение целостности кожи вызывает «сигнал опасности», который у людей, генетически склонных к такому неконтролируемому воспалению, может привести к развитию или обострению псориаза.
Боль и дендритные клетки
Возможно, есть и еще один механизм, вносящий вклад в патофизиологию псориаза: стимуляция бляшки нервными волокнами. Дело в том, что большое количество дендритных клеток находится в тесном контакте с кожными ноцицепторами — сенсорными нейронами, стимуляция которых вызывает ощущение боли, или иначе — нейронами, «чувствующими» механические и иные повреждения. Исследование на мышах показало, что рецепторы (ионные каналы) TRPV1 и Nav1.8 на этих нейронах могут активировать кожные дендритные клетки в экспериментально полученных высыпаниях. Дендритные клетки в ответ начинают выделять IL-23 — важный провоспалительный цитокин, который стимулирует дифференцировку самых «роковых» для псориаза лимфоцитов — Т-хелперов 17 — и таким образом усиливает псориатические высыпания (рис. 3) [7]. Иными словами, даже боль может усугублять течение псориаза.
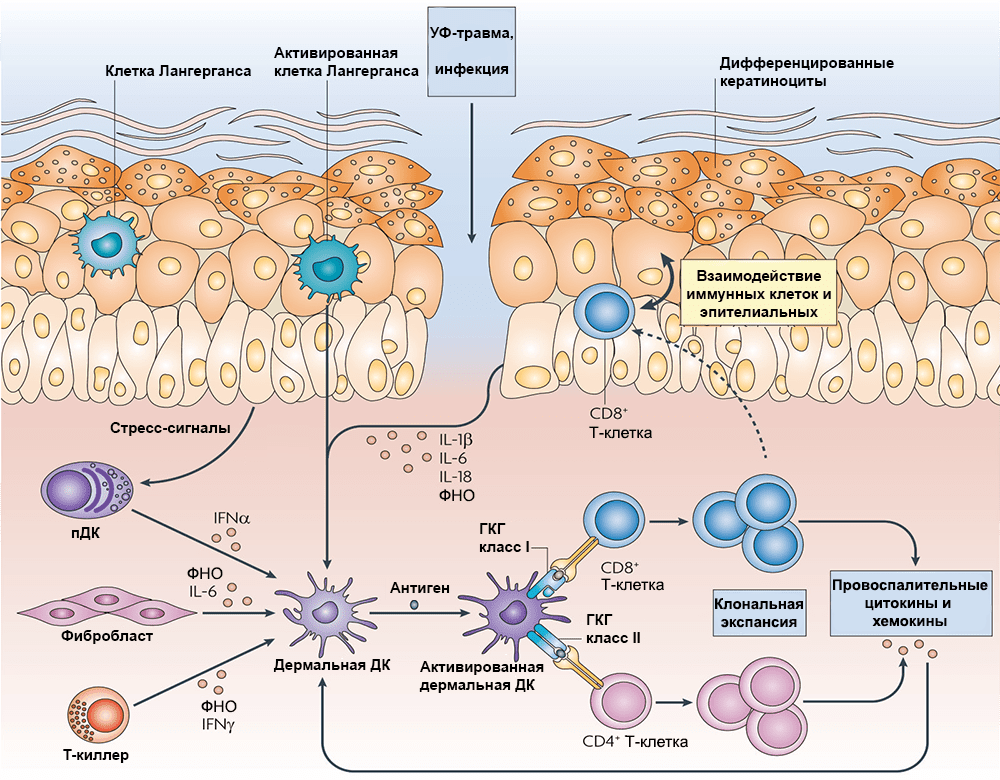
Рисунок 3. Схема работы клеток иммунной системы при псориазе. ДК — дендритные клетки; пДК — плазмацитоидные ДК; ГКГ — главный комплекс гистосовместимости; ФНО — фактор некроза опухоли; IL — интерлейкин; IFN — интерферон. Чтобы увидеть рисунок в полном размере, нажмите на него.
Что происходит с кожей при псориазе
Все вышеописанные события приводят к одному эффекту — гиперактивации иммунной системы, которая начинается, как правило, с дендритных клеток. Эти клетки выделяют различные цитокины, прежде всего, ФНО и IL-23, которые служат сигналом настолько серьезной опасности, что сильно перестраивают метаболизм других клеток и заставляют их выбрасывать всё новые и новые цитокины — идет буквально девятый вал провоспалительных молекул, и запускается воспаление. В результате нарушается нормальная жизнедеятельность практически всех типов клеток кожи. Самые многочисленные клетки кожи — кератиноциты — испытывают колоссальное давление на свои рецепторы и отвечают на воздействие гиперпролиферацией (ускоренным размножением) и продукцией новых цитокинов, а также секрецией антимикробных пептидов. В свою очередь, выделяемые кератиноцитами молекулы привлекают еще больше нейтрофилов и лимфоцитов. Так формируется положительная обратная связь: клетки иммунной системы действуют цитокинами на клетки эпидермиса, а те, в ответ на это действие, дополнительно активируют клетки иммунной системы [8]. Т-супрессоры при таком объеме работы чувствуют себя бухгалтерами, которым нужно было сдать квартальный отчет еще вчера и не могут разрулить сложившуюся патологическую ситуацию.
Гиперпролиферация кератиноцитов приводит к разрастанию эпителиальной ткани в некоторых участках — формируются псориатические бляшки. Из-за того, что размножение кератиноцитов в бляшке ускорено (их клеточный цикл сокращается с 23 до 3–5 дней), они не могут нормально дифференцироваться. Клетки, в норме теряющие свои ядра еще в зернистом слое, при псориазе сохраняют ядра даже при приближении к поверхности эпидермиса. Это явление называется паракератоз и служит диагностическим признаком псориаза. К нему присоединяются нарушения синтеза липидов, в норме скрепляющих клетки рогового слоя эпидермиса. Последнее клинически проявляется шелушением псориатических высыпаний.
Кроме воспаления и разрастания эпидермиса, есть и третий ключевой элемент патогенеза псориаза — ангионеогенез (образование новых сосудов). Воспалительная среда изменяет проницаемость сосудов и вырабатывает факторы, стимулирующие рост новых сосудов. Разрастаются новые сосуды; при этом клетки их эндотелия (внутренней оболочки) под влиянием воспалительного окружения выделяют особые цитокины — молекулы адгезии, которые привлекают в псориатическую кожу всё новые и новые лейкоциты. В то же время микроокружение растущих сосудов влияет на находящиеся в очаге воспаления T-хелперы и киллеры таким образом, что они дополнительно усиливают разрастание эпидермиса [9].
Помимо собственно эпителиальных клеток, при псориазе происходят изменения сальных желез, однако изучены они мало. При высыпаниях на волосистой части головы обычно наблюдается глубокая атрофия сальных желез с уменьшением их числа и размера, а более чем в половине случаев происходит их полная атрофия. В очагах высыпаний вперемешку встречаются как нормальные, так и атрофированные сальные железы. В остро воспаленной коже скальпа атрофия сальных желез сопровождается уменьшением диаметра волоса. В целом, хотя начальные исследования демонстрировали гистологические изменения в сальных железах, изменений в выделяемых ими липидах не выявлено. Но исследования «псориатического» профиля липидов сальных желез немногочисленны, потому необходимо и далее изучать его отличия от нормального, а также оценить перспективы модифицирования работы сальных желез как одной из терапевтических составляющих при псориазе [10].
Особенности работы иммунной системы при псориазе
Вскользь мы уже касались особенностей работы иммунной системы при псориазе, а теперь рассмотрим их подробнее.
Начнем с кератиноцитов. Хотя это не иммунные клетки, а клетки кожи, но они находятся в тесном взаимодействии с иммунитетом и при любой опасности просят иммунные клетки о помощи. Увы, в случае псориаза кератиноциты можно сравнить с гранатой, с которой чуть что срывается чека. Как уже говорилось, при гибели кератиноцитов высвобождаются «сигналы опасности» — антимикробные пептиды (в том числе LL37, S100, β-дефензины). В норме, как понятно из названия, эти пептиды направлены на борьбу с патогенами. Однако при псориазе их выделяется так много, что они привлекают избыточное внимание иммунных клеток. Антимикробные пептиды активируют иммунный ответ, повышая синтез и высвобождение различными иммунными и неиммунными клетками цитокинов IL-6, IL-10, IL-8 (CXCL8) и CXCL10, что в свою очередь привлекает в патологический очаг клетки врожденного иммунитета — нейтрофилы и макрофаги. Кстати, обилие антимикробных пептидов и иммунных клеток в очаге воспаления объясняет интересную особенность псориаза: несмотря на нарушенную структуру кожи, которая в области бляшки скорее похожа на полузажившую рану, вторичные инфекции у больных псориазом встречаются очень редко.
Кроме провоспалительных цитокинов и антимикробных пептидов кератиноциты содержат особые белковые комплексы, запускающие воспаление, — инфламмосомы (отметим в скобках, что инфламмосомы есть также у нейтрофилов и макрофагов). Один из главных белков инфламмосом — каспаза-1 — в случае опасности расщепляет вялые безынициативные предшественники цитокинов pro-IL-1 и pro-IL-8 до активных форм. Дальше начинается цепная реакция: IL-1 и IL-8 влияют на окружающие кератиноциты и инициируют продукцию одного из главных провоспалительных цитокинов — ФНО, — воспалительные реакции нарастают как снежный ком и в результате приводят к образованию и высвобождению сильных провоспалительных цитокинов IL-18 и IL-1β.
Итак, в кожу привлечено слишком много нейтрофилов — клеток врожденного иммунитета, осуществляющих защиту организма от бактериальных и грибковых инфекций. Эти клетки можно сравнить с камикадзе: они фагоцитируют (то есть поглощают) самую разную добычу — от молекул до целых клеток патогенов, — но при преобладании сил противника дают последний залп провоспалительными цитокинами и разрушаются, «выплевывая» наружу бактерицидные молекулы. Кроме того, нейтрофилы умудряются устроить для патогенов ловушку из собственного содержимого: при саморазрушении нейтрофил помимо иммуногенных молекул выбрасывает наружу свою ДНК, в которой, как в паутине, запутываются бактерии и другие чужаки. Увы, такая ловушка оказывается обоюдоострым мечом: при псориазе и некоторых других заболеваниях она вызывает аутоиммунное воспаление.
В норме нейтрофилы циркулируют в кровеносных сосудах дермы и гиподермы и отправляются в эпидермис только если прослышат (словив на рецепторы повышенное количество цитокинов) о проходящем там воспалении. А при псориазе они, наоборот, встречаются преимущественно в эпидермисе, потому что их «позвали» цитокины CXCL1, CXCL2, IL-8 и IL-18.
Нейтрофилы играют важную роль на ранней стадии развития псориаза: они привлекают в формирующуюся бляшку и активируют Т-лимфоциты, а также стимулируют пролиферацию и дифференцировку кератиноцитов.
Роль макрофагов при псориазе как следует не изучена. Имеющиеся наблюдения свидетельствуют об их участии в воспалении и корреляции их количества в очагах болезни с интенсивностью воспаления. Но вопрос об их активной роли остается открытым.
Также важную роль при псориазе играют дендритные клетки. Они, как уже говорилось в разделе об иммунной системе, передают сигнал о напавших на организм патогенах клеткам приобретенного иммунитета — Т-хелперам. Дендритные клетки бывают двух основных видов — миелоидные и плазмоцитоидные. Миелоидные занимаются прежде всего презентацией антигена Т-хелперам: ловят патоген, выделяют его антигены и, повстречавшись с наивным Т-хелпером, эти антигены ему показывают. Плазмоцитоидные же в основном действуют «химическим оружием»: управляют дифференцировкой Т-хелперов с помощью цитокинов.
В патогенезе псориаза основную роль играет кожная субпопуляция дендритных клеток — клетки Лангерганса. Эти клетки бродят в поисках патогенов по всем слоям эпидермиса, кроме рогового; также они встречаются в дерме, слизистой оболочке рта, крайней плоти и влагалища.
При псориазе клетки Лангерганса в силу тех или иных причин избыточно активируют своих «подаванов» — Т-хелперы. Важную роль в начальных стадиях псориаза играют выделяемые клетками Лангерганса цитокины: интегрин альфа-X (CD11c) миелоидных клеток и интерферон I типа плазмоцитоидных.
Возможно, вы уже заметили, что почти все вышеописанные пути в патогенезе псориаза ведут к одному типу клеток — Т-хелперам. Действительно, Т-хелперы — главные иммунные клетки, связанные с псориазом, они и опосредуют основное течение болезни. Их привлекают в кожу цитокины и дендритных клеток, и кератиноцитов, и нейтрофилов. При псориазе бόльшую часть Т-лимфоцитов в коже составляют Т-хелперы I типа (Th1), которые посредством интерферона-γ снижают активность Т-хелперов II типа и повышают активность Т-киллеров. Последние начинают атаковать кератиноциты, которые, разрушаясь, снова выделяют иммуногенные молекулы для привлечения Т-лимфоцитов. Таким образом круг замыкается, и процесс начинает поддерживать сам себя. В результате пациент с высыпаниями на коже, занимающими 20% поверхности тела, имеет около 8 млрд Т-лимфоцитов в циркулирующей крови, в то время как в псориатических бляшках их число достигает 20 млрд (в норме же это количество приходится на всю кожу целиком) [11].
В последние годы обнаружено, что существенную роль в развитии псориаза играет еще одна субпопуляция Т-хелперов — Т-хелперы 17 (Th17). Они производят множество провоспалительных цитокинов, таких как IL-17F, IL-17 (за активное выделение IL-17 лимфоциты Th17 и получили свое название) и IL-22, приводящих среди прочего к пролиферации кератиноцитов — главной характеристике псориаза [12], [13]. Последний «прорыв» в лечении псориаза — препарат секукинумаб (Cosentyx) — представляет собой как раз антитела к выделяемому Th17 цитокину IL-17A.
Наконец, есть еще один тип иммунных клеток, которые участвуют в развитии псориаза. Это миелоидные супрессорные клетки — разнородная группа иммунных клеток, берущих свое начало из костного мозга. Они умеют ингибировать Т-лимфоциты, дендритные клетки и макрофаги [14]. Такое их свойство могло бы сыграть неоценимую роль в лечении псориаза, однако пока исследования функций этих клеток при данном заболевании немногочисленны. Некоторые работы показали повышение количества моноцитарных миелоидных супрессорных клеток в очагах воспаления и в крови. Однако при этом они характеризовались низкой функциональной активностью [15]. Возможно, в перспективе получится разработать способы повышения активности миелоидных супрессорных клеток, то есть использовать для лечения заболевания не внешние ингибиторы иммунитета, а уже существующие в организме регуляторы.
Тонкий шрам на любимой коже
Несмотря на то, что с каждым днем мы всё больше узнаем о вкладе иммунной системы в развитие псориаза, полностью вылечить это заболевание пока не получается. Даже самые успешные методы лечения позволяют добиться лишь периодов ремиссии — но рано или поздно бляшки снова появляются на коже. Поиски причины такого положения дел привели исследователей к внимательному изучению кератиноцитов в том участке кожи, где раньше была бляшка. Выяснилось, что, несмотря на характерное для ремиссии визуальное улучшение, исчезновение характерных гистологических симптомов псориаза и «лишних» иммунных клеток из кожи, экспрессия некоторых генов в кератиноцитах остается измененной. Такое изменение было названо молекулярным шрамом, и, возможно, именно в нём кроется причина того, что болезнь возвращается снова и снова. Вот некоторые гены, активность которых так и не приходит в норму: ген MMP9, кодирующий фермент, который разрушает разные типы коллагена и желатин в коже, помогая клеткам кожи быть более подвижными; ген WNT5A, кодирующий важный регуляторный белок, который следит за правильным развитием кожи и волосяных фолликулов, а также может регулировать цвет кожи, влияя на меланоциты; гены различных цитокинов (CCL2, CXCR4, CCL18, LTB) и еще несколько сотен генов [16]. Может быть, изучение этих генов расскажет нам что-то новое о роли кератиноцитов в развитии и возвращении псориаза.
Заключение
За последние пару лет наше понимание патогенеза псориаза было значительно расширено за счет новых данных о генетике и иммунологии этого заболевания и коморбидностях. Патогенез псориаза заключается в избыточной активации клеток врожденной и приобретенной систем иммунитета. Вышедший из-под контроля воспалительный процесс характеризуется обильной продукцией различных цитокинов (ФНО-α, интерферона-γ, IL-12, IL-17 и IL-23, VEGF) и миграцией активированных Т-лимфоцитов в кожу. Свой вклад в патогенез псориаза вносят вредные и безвредные микроорганизмы, а также травмы. Клинические проявления псориаза, перечисленные во вводной статье, объясняются всеми описанными здесь механизмами. И знание этих механизмов дает нам надежду на разработку эффективных и безопасных способов контроля псориаза, а возможно, и полного излечения от этой болезни.
Литература
- Псориаз: на войне с собственной кожей;
- Michael P. Schön, W.-Henning Boehncke. (2005). Psoriasis. N Engl J Med. 352, 1899-1912;
- Helgi Valdimarsson, Ragna H. Thorleifsdottir, Sigrun L. Sigurdardottir, Johann E. Gudjonsson, Andrew Johnston. (2009). Psoriasis – as an autoimmune disease caused by molecular mimicry. Trends in Immunology. 30, 494-501;
- M. J. Cox, W. O. C. M. Cookson, M. F. Moffatt. (2013). Sequencing the human microbiome in health and disease. Human Molecular Genetics. 22, R88-R94;
- Shruti Naik, Nicolas Bouladoux, Jonathan L. Linehan, Seong-Ji Han, Oliver J. Harrison, et. al.. (2015). Commensal–dendritic-cell interaction specifies a unique protective skin immune signature. Nature. 520, 104-108;
- Akemi Takemoto, Otomi Cho, Yuka Morohoshi, Takashi Sugita, Masahiko Muto. (2015). Molecular characterization of the skin fungal microbiome in patients with psoriasis. J Dermatol. 42, 166-170;
- Lorena Riol-Blanco, Jose Ordovas-Montanes, Mario Perro, Elena Naval, Aude Thiriot, et. al.. (2014). Nociceptive sensory neurons drive interleukin-23-mediated psoriasiform skin inflammation. Nature. 510, 157-161;
- Amanda S. Büchau, Richard L. Gallo. (2007). Innate immunity and antimicrobial defense systems in psoriasis. Clinics in Dermatology. 25, 616-624;
- Christian Rosenberger, Caius Solovan, Alina D. Rosenberger, Li Jinping, Regina Treudler, et. al.. (2007). Upregulation of Hypoxia-Inducible Factors in Normal and Psoriatic Skin. Journal of Investigative Dermatology. 127, 2445-2452;
- Vivian Y. Shi, Michael Leo, Lauren Hassoun, Dev S. Chahal, Howard I. Maibach, Raja K. Sivamani. (2015). Role of sebaceous glands in inflammatory dermatoses. Journal of the American Academy of Dermatology. 73, 856-863;
- J G Krueger. (2005). Psoriasis pathophysiology: current concepts of pathogenesis. Annals of the Rheumatic Diseases. 64, ii30-ii36;
- Lawrence Steinman. (2007). A brief history of TH17, the first major revision in the TH1/TH2 hypothesis of T cell–mediated tissue damage. Nat Med. 13, 139-145;
- Michelle A. Lowes, Toyoko Kikuchi, Judilyn Fuentes-Duculan, Irma Cardinale, Lisa C. Zaba, et. al.. (2008). Psoriasis Vulgaris Lesions Contain Discrete Populations of Th1 and Th17 T Cells. Journal of Investigative Dermatology. 128, 1207-1211;
- Prashant Trikha, William E. Carson. (2014). Signaling pathways involved in MDSC regulation. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1846, 55-65;
- David C. Soler, Andrew B. Young, Lori Fiessinger, Fabrizio Galimberti, Sara Debanne, et. al.. (2016). Increased, but Functionally Impaired, CD14 + HLA-DR –/low Myeloid-Derived Suppressor Cells in Psoriasis: A Mechanism of Dysregulated T Cells. Journal of Investigative Dermatology. 136, 798-808;
- Mayte Suárez-Fariñas, Judilyn Fuentes-Duculan, Michelle A. Lowes, James G. Krueger. (2011). Resolved Psoriasis Lesions Retain Expression of a Subset of Disease-Related Genes. Journal of Investigative Dermatology. 131, 391-400;
- Nestle F.O., Di Meglio P., Qin J.Z., Nickoloff B.J. (2009). Skin immune sentinels in health and disease. Nat. Rev. Immunol. 9, 679–691.








