
Одиссея азота
04 ноября 2016
Одиссея азота
- 3264
- 0
- 4
Азот — один из важнейших лимитирующих факторов жизни на Земле
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Живые организмы состоят всего из шести основных химических элементов: кислорода, углерода, водорода, азота, кальция и фосфора. В этой статье речь пойдет об элементе, стоящем на четвертом месте по массе в живых организмах — азоте. Всего азота в нашем организме около одного килограмма. Но какое большое значение имеет этот жалкий килограмм! Азот входит в состав аминокислот, азотистых оснований (образующих нуклеотиды), хлорофилла, гемоглобина и пр. Аминокислоты входят в состав белков, которые исполняют в клетке ферментативные функции, нуклеотиды составляют ДНК, а про значение гемоглобина и хлорофилла и говорить нечего!
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Что вообще такое азот? На Земле азот представлен своим двухатомным соединением в виде газа (N2) и составляет добрых 76% объема нашей атмосферы. Но, как это ни странно, живым организмам азот достается не так уж и просто. В чем же проблема? Она заключается в тройной ковалентной связи между двумя атомами азота, благодаря которой в нормальных земных условиях азот, можно сказать, инертный газ. Но давайте разбираться, как, откуда и зачем этот азот нам сдался.
Сценарий азота в жизни
Люди получают азот вместе с пищей, где он содержится в аминокислотах. Однако человек и большинство животных не могут сами синтезировать все необходимые аминокислоты. Часть из них (называемая незаменимыми аминокислотами) должна поступать вместе с пищей. И только автотрофным организмам (таким как растения и многие микроорганизмы) дано синтезировать органику из минеральных веществ. Но и им для этого требуется исходный материал.
Итак, перейдем к проблеме с азотом. Когда автотрофным организмам требуется «сырье», они берут его из окружающей среды (на то они и авто-). Но, как известно, у любого колодца есть дно, да и кушать-то всем хочется. Поэтому азотистые соединения из почвы уходят на ура. Но ведь мир растений как-то существовал и до появления и применения удобрений, которые сейчас используют для устранения дефицита азота. Всю идиллию разрушила (как обычно) человеческая цивилизация. Она всё росла и росла, из-за чего пришлось начать заниматься земледелием. Теперь надо было сажать и снимать урожай с одной и той же территории год за годом, из-за чего почва истощалась, ведь никто не возвращал ей минеральных веществ, отданных с урожаем. Перестало образовываться достаточное количество гумуса, из-за чего почвы становились не такими плодородными. Тогда-то люди и поняли, что пора что-то менять. В почву стали вносить удобрения в виде ила (добытого из Нила) или помета животных.
Но цивилизация не стоит на месте, да и удобрения тоже. Так вот. Азотистые соединения. В природе азот фиксируется био- и абиогенным путями (табл. 1). Биогенный способ фиксации азота осуществляется с помощью бактерий; абиогенный — во время грозы, когда на месте удара молнии температура может достигать 25 000 °С, в результате чего образуются оксиды азота. Далее они взаимодействуют с водой и образуют азотистую/азотную кислоту, которая потом прореагирует с солью и образует нитрат или же нитрит какого-либо металла. Но в современном мире этих двух пассивных способов не хватает.
Так в 1901 году был зарегистрирован патент на синтез аммиака из азота и водорода. Этот процесс был назван процессом Габера-Боша: N2 + 3H2 = 2NH3, он проходит при высоких температурах (около 500 °С), высоком давлении (до 1000 атм.) и наличии катализатора. В дальнейшем аммиак используют для получения оксидов азота, синильной кислоты и т.д. Что удивительно, этот «синтетический» процесс на 64% более выгоден по сравнению с биогенным. Так, например, клубеньковым бактериям для синтеза 1,1 грамма азота требуется окислить 10 граммов (!) глюкозы [1].
Как уже было сказано выше, азот — лимитирующий элемент всей жизни на Земле. Ежегодно около 2% всей вырабатываемой человечеством электроэнергии тратится на процесс Габера-Боша для создания азотных удобрений [1]!
| Тип фиксации | N2 фиксировано, млн. тонн в год |
|---|---|
| Абиотический | |
| Азотистые удобрения | 50 |
| Окисление в почве | 20 |
| Грозы | 10 |
| ВСЕГО | 80 |
| Биотический | |
| Агрокультуры | 90 |
| Леса и дикие растения | 50 |
| Море | 35 |
| ВСЕГО | 175 |
| Итого в мире | 255 |
Итак, перейдем к рассмотрению процессов, протекающих у прокариот для столь ресурсоемкой фиксации азота. Для начала стоит заметить, что существует всего несколько родов бактерий, фиксирующих атмосферный азот и выделяющих аммиак в окружающую среду (табл. 2). Всё это — клубеньковые бактерии, симбионты некоторых растений. Они и только они благодаря симбиотическим связям могут позволить себе такую роскошь, как постоянный синтез аммиака. У свободноживущих бактерий образование NH3 при участии специального фермента сопряжено с процессами клеточного биосинтеза, и аммиак практически не выделяется в окружающую среду. При наличии в окружающей среде связанного азота, например, в форме NH3 или NO2, которые могут служить источником этого элемента для ростовых процессов в клетке, гены, отвечающие за выработку фермента-фиксатора, «выключаются», и азот перестает синтезироваться.
| Свободноживущие | Симбионты растений | ||
|---|---|---|---|
| Аэробы | Анаэробы | Бобовые | Другие растения |
| Азотобактер Клебсиеллы(нек.) Цианобактерии | Клостридии Пурпурные серобактерии Пурпурные несерные бактерии Зелёные серобактерии | Клубеньковые бактерии | Франкии Азоспириллы |
Нитрогеназа, или как это сделано
Фермент, отвечающий за фиксацию азота, называется нитрогеназой и представляет собой комплекс из двух железосодержащих белков: Mo-Fe-белка и Fe-белка. Так как железо в них находится в виде ионов Fe2+ и Fe3+, нитрогеназа крайне чувствительна к кислороду и после взаимодействия с ним навсегда утрачивает свои полезные свойства.
Для биологической фиксации азота клетке необходимы:
- активная нитрогеназа;
- Mg2+ и постоянное снабжение АТФ;
- сильный восстановитель, т.е. подходящий источник электронов;
- низкое содержание кислорода.
Общая формула восстановления азота до аммиака выглядит следующим образом:
N2 + 8H+ + 8e− + 16Mg·АТФ = 2NH3 + H2 + 16Mg·АДФ + 16Фн
Формула формулой, но давайте разбираться, как все происходит в жизни:
- Атмосферный азот попадает в клетку прокариотического организма.
- При условии недостатка аммиака и нитратов в окружающей среде клетка начинает процессы транскрипции и трансляции, в результате которых синтезируется фермент нитрогеназа.
- Азот — субстрат нитрогеназы — обеспечивается двумя электронами, протонами и 4-мя молекулами АТФ, связанными с магнием. Далее с ним происходят следующие превращения:
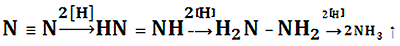
Хотя механизм фиксации азота нитрогеназой изучен пока недостаточно, есть основания полагать, что белок, содержащий молибден (Mo-Fe-белок), реагирует с потенциальными субстратами нитрогеназы, т.е. N2 и C2H2 (нитрогеназа без разбору восстанавливает все соединения с тройной связью), путем взаимодействия восстанавливаемого субстрата с атомами молибдена белка. Fe-бeлок с меньшей молекулярной массой связывает АТФ в виде мономагниевой соли и становится более мощным восстановителем, принимая электроны от физиологической электрон-донорной системы (рис. 1). Находясь в таком восстановленном состоянии, Fе-белок доводит до наиболее восстановленного состояния Mo-Fe-белок. Схематически процесс фиксации включает восстановление атомов Fe в железосодержащем белке с меньшей молекулярной массой, вследствие чего АТФ гидролизуется с образованием АДФ и фосфата (Фн). Электроны атомов железа в Mo-Fe-белке используется затем для восстановления связанного с азотом субстрата. Должно произойти несколько таких переносов электронов, прежде чем фермент высвободит конечный восстановленный продукт (NН3, если субстратом служит N2). При каждом переносе электрона от Fe-белка на Mo-Fe-бeлок АТФ гидролизуется до АДФ [2], [3]. Общая схема этого процесса восстановления показана на рисунке 1.
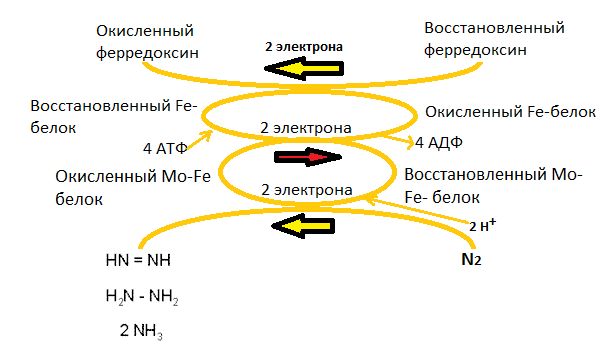
Рисунок 1. Донором электрона в реакции служит восстановленный ферредоксин. Электрон с затратой энергии АТФ переносится Fe-белком с донора на Mo-Fe-белок, который, в свою очередь, трижды отдает пару электронов двум атомам азота, восстанавливая связанную в активном центре молекулу N2 до двух NH3 через следующие стадии: азот → диамин → гидразин → аммиак.
Как известно, вечных двигателей не бывает. Так же и с нитрогеназой. При условиях, оптимальных для фиксации азота, только 75% доступных электронов действительно используются для этой цели. Остальные 25% расходуются на восстановление протонов до водорода в АТФ-зависимом процессе, катализируемом нитрогеназой, который, как и процесс восстановления азота, нуждается в Mg2+ и восстановителе. Многие азотфиксирующие бактерии не могут избежать этой продуцирующей водород побочной реакции, которая и является причиной низкой эффективности фиксации азота этими клетками, ведь на восстановление протонов АТФ тратится впустую, а это до трети энергии, протекающей через нитрогеназу.
Как видно, нитрогеназа — очень невыгодный белок. Но нам известны целые семейства растений, которые принимают азотфиксирующих бактерий в качестве симбионтов. Давайте разберемся, как им удается делать это.
Проникновенные отношения
Заселение клеток корня растения-хозяина происходит после того, как корень натолкнется на симбиотических бактерий, оставшихся в почве с прошлого вегетационного периода. Бактерии подползают к корням, после чего разрушают клеточные стенки растения с помощью фермента пектиназы и размещаются в вакуолях (рис. 2). В результате растительная клетка оказывается переполненной бактериями, которые затем прекращают делиться, увеличиваются в размерах почти в 40 раз и одновременно изменяют свое строение и функцию, превращаясь в бактероиды, богатые нитрогеназой. Одновременно с вторжением бактерий в клетки растения-хозяина начинается активное деление инфицированной клетки и нескольких слоев соседних неинфицированных клеток. Это способствует распространению бактерий и приводит к образованию корневых клубеньков, столь характерных для этой симбиотической ассоциации.
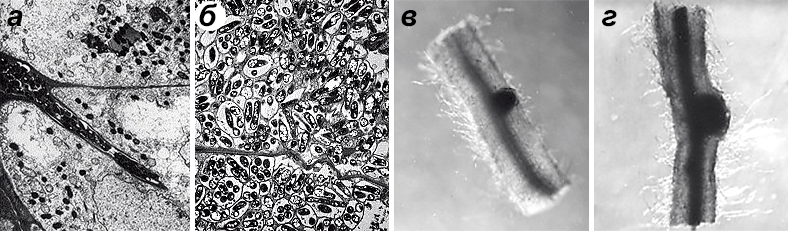
Рисунок 2. Вторжение бактерий в клетки растения-хозяина. а — Бактерии проникли внутрь клеток корня растения. б — Образовавшиеся в корневых клетках бактероиды. в — Деление клеток, инфицированных бактериями-симбионтами. г — Рост клубенька.
сайт biology-pages.info
Внутренняя часть инфицированных и неинфицированных клеток клубенька окружена слоем незараженных клеток хозяина. Инфицированные клетки внутренней зоны зрелого корневого клубенька содержат один или несколько бактероидов (в зависимости от растения-хозяина), окруженных мембранной оболочкой, в которой, по-видимому, локализован красный пигментный белок — леггемоглобин, обусловливающий характерное окрашивание клубеньков, активно фиксирующих азот (рис. 3). Леггемоглобин образуется только в фиксирующих азот клубеньках и внутри таких клубеньков локализован только в инфицированных клетках, где составляет 25–30% всего растворимого белка клетки. По своим свойствам леггемоглобин сходен с миоглобином (мышечным белком, вероятной функцией которого является содействие диффузии кислорода в ткани и, возможно, «запасание» кислорода). Функции леггемоглобина в процессе фиксации азота будут рассмотрены позже.
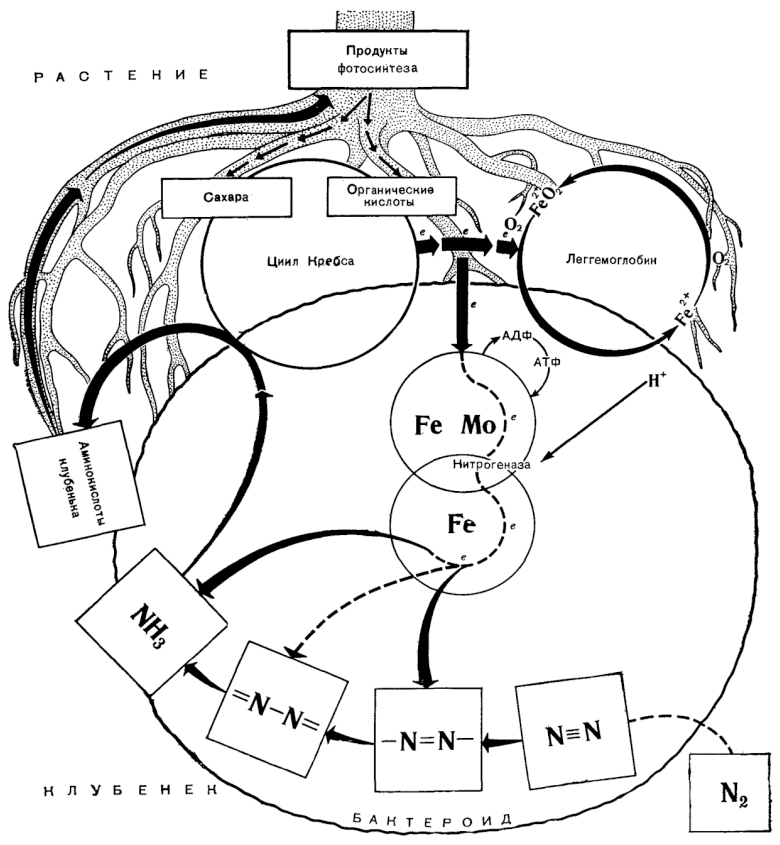
Рисунок 3. Схематичное изображение симбиотических связей клубенькового растения.
сайт plantlife.ru
Чтобы симбиотическая система могла фиксировать азот, она должна удовлетворять трем обязательным требованиям:
- образование корневых клубеньков;
- дифференциация бактерий в бактероиды;
- образование леггемоглобина.
При выполнении этих условий фиксация азота будет продолжаться в течение всего жизненного цикла растения, обычно до формирования семян, когда клубеньки стареют, и фиксация азота прекращается. Некоторые бактероиды утрачивают способность к дальнейшему размножению, однако остальные сохраняют жизнеспособность, и после старения и отмирания растения-хозяина живут в почве до начала нового вегетационного периода [3].
Кислородный искуситель
Фермент нитрогеназа необратимо разрушается при контакте с кислородом, и поэтому микроорганизмы, фиксирующие азот на планете, атмосфера которой содержит аж 20% кислорода, нашли различные способы исключить его из зоны фиксации азота. Такая адаптация не понадобилась лишь облигатным анаэробам, которые решили эту проблему радикальным способом.
Клубеньковые вывернулись с помощью леггемоглобина, который обладает очень высоким сродством к кислороду. Бактерии-симбионты получают этот элемент в концентрации, безопасной для их нитрогеназы: кислород не накапливается в больших количествах, однако его достаточно для обеспечения дыхательного метаболизма бактерий.
Но помимо клубеньков, существуют и свободноживущие ассоциации бактерий. И им тоже надо защищать свою любимицу от «плохого» кислорода. Для этого природа придумала три способа защиты:
- Механизм повышенного уровня дыхания. Азотобактеры удаляют из себя кислород посредством окисления органических веществ. Энергия при этом не запасается.
- Механизм локализации азотфиксации в гетероцистах. Характерен для цианобактерий, способных к фотосинтезу с выделением кислорода. Для защиты нитрогеназы от кислорода они имеют особые, лишенные хлорофилла клетки — гетероцисты (о них будет сказано в последней главе).
- Механизм симбиотической защиты. Характерен для клубеньковых бактерий. В корнях бобовых продуцируется леггемоглобин, выполняющий функцию защиты от избытка кислорода [4].
Синтез жизни
Хорошо, растение добыло себе аммиак, а что дальше? Дальше он включается в реакции синтеза аминокислот. Так из аспарагиновой кислоты синтезируется аспарагин, из глутамата — глутамин (рис. 4). В виде глутамина азот доставляется ко всем клеткам организма, где используется для синтеза азотсодержащих органических соединений [5].
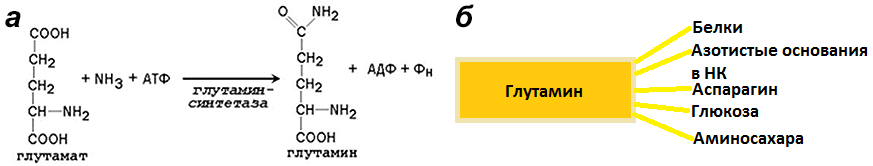
Рисунок 4. Глутамин. а — Реакция превращения глутамата в глутамин. б — Функции глутамина.
Аспарагин также синтезируется с участием аммиака (рис. 5) [6].
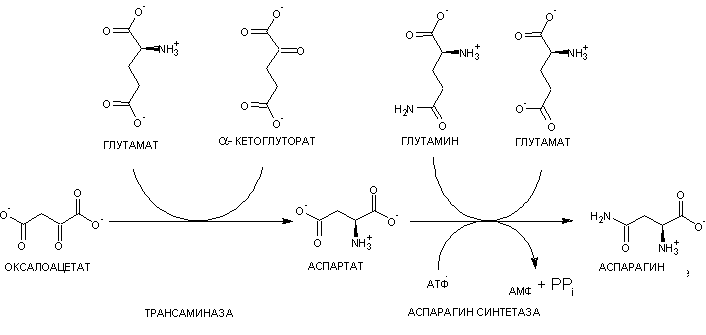
Рисунок 5. Реакции, проходящие у живых организмов для синтеза аспарагина — важного нейромедиатора. Оксалоацетат — название щавелевоуксусной кислоты (ЩУК). Тут она служит каркасом будущей аминокислоты. С глутамата «снимается» азот, в результате чего глутамат превращается в альфа-кетоглутарат, а аммиак переносится на ЩУК. Образуется аспартат, на который далее переносится H2N, и с затратой АТФ аспартат превращается в аспарагин.
«Википедия», рисунок адаптирован
Аспарагин — это очень распространенная заменимая аминокислота, которая включена в состав почти всех белков живых организмов. Глутамин также является «популярной» аминокислотой: в организмах животных с помощью него аммиак выводится из организма или используется повторно.
Побочные ветви цикла азота
Мы полностью разобрали первую стадию цикла азота в природе (рис. 6) — стадию фиксации азота. Но если бы азот только фиксировался, он давно бы ушел из нашей атмосферы и отложился в виде органики. Несложно понять, что такого в действительности не происходит. Фиксацию азота компенсируют бактерии-денитрификаторы. Они занимаются восстановлением оксида азота до азота и кислорода. Но и до того, как уйти в атмосферу, азот должен «подготовиться». Из аммиака, в который азот перешел после фиксации, он должен превратиться в азотную кислоту (нитрат), пройдя при этом долгий путь через цитоплазмы бактерий нескольких видов, и только потом уплыть в воздушный океан Земли. Начальным этапом этого «подготовительного» процесса является нитрификация.
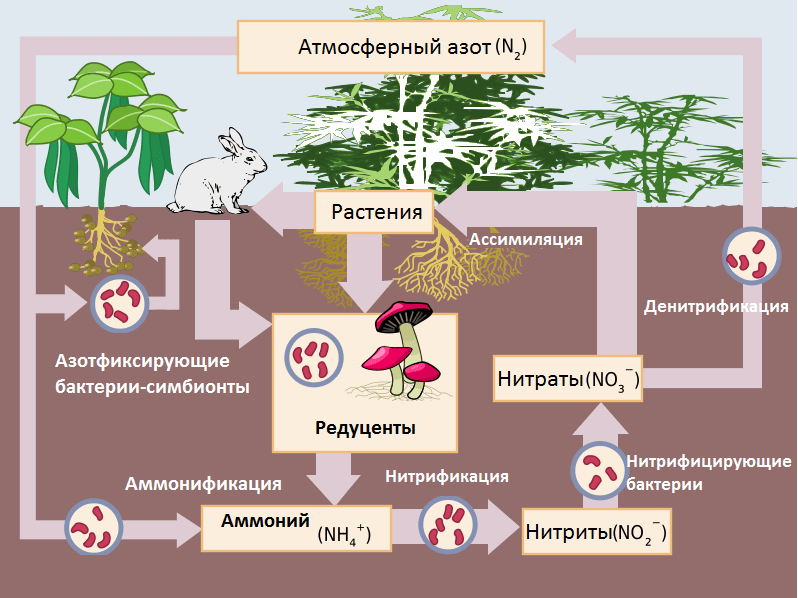
Рисунок 6. Цикл азота в природе.
[7], рисунок адаптирован
Нитрификация — это процесс окисления аммиака до азотистой кислоты, а далее ее окисление до азотной. Сначала аммиак присваивается нитрозными бактериями, которые окисляют аммиак в три стадии:
- NH3 + O2 + НАДН2 → NH2OH + H2O + НАД+
- NH2OH + H2O → HNO2 + 4H+ + 4e−
- 1/2O2 + 2H+ + 2e− → H2O
Далее образованную азотистую кислоту перехватывают нитратные бактерии, которые доокисляют ее до азотной кислоты в ходе одной реакции:
NO2− + H2O → NO3− + 2H+ + 2e−
Двумя этими процессами в почве (или водоеме) заняты различные бактерии. Но все они — хемолитоавтотрофы, то есть получают энергию при окислении аммиака и используют ее для окисления углекислого газа [7].
Только после того, как почвенные бактерии осуществили перечисленные выше процессы, в цикл могут включиться бактерии-денитрификаторы. В их цитоплазмах проходят следующие превращения:
NO3− → NO2− → NO → N2O → N2 ↑
Микробиологическая денитрификация в почве вызывает потерю зафиксированного в солях азота. Это очень распространенное в природе явление, в ходе которого каждый год в атмосферу Земли возвращается 270–330 млн. тонн азота. Поэтому часто денитрификацию рассматривают как невыгодный человечеству процесс и пытаются его избежать. Сами денитрификаторы получают почти 70% энергии, которую они получили бы при проведении реакций аэробного метаболизма. Отлично устроились.
Но, согласитесь, должна же быть у нитрифицирующих бактерий хоть какая-нибудь конкуренция. И, конечно, природа не преминула ее создать. Такие бактерии идут в обход нитрификации и денитрификации. В их цитоплазмах протекает гениально примитивная реакция:
NH4+ + NO2− → N2 + 2H2O.
Эта примитивная, но действенная реакция получила название анаммокс (рис. 7). В масштабах планеты этот процесс дает начало 30–50% азота, образующегося в океанах. Анаммокс представляет большой интерес для биотехнологов, так как промежуточным продуктом этой реакции является гидразин — ядовитое вещество, применяемое как топливо для ракет. Также бактерий, осуществляющих аноммокс, используют для освобождения водоемов от излишков аммиака [8].
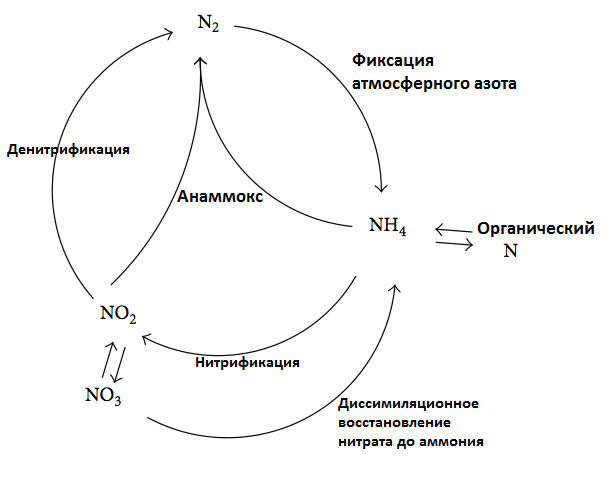
Рисунок 7. Цикл азота в природе с учетом анаммокса. Диссимиляционное восстановление нитрата до аммония — такое «пафосное» название гниения.
Осталось разобрать последнюю ветвь цикла азота. Это гниение. Автотроф, потребляющий нитраты, рано или поздно погибнет. Тут-то в игру включатся различные бактерии-аммонификаторы. Они будут заниматься разложением сначала белков, а затем аминокислот.
Первая стадия разложения белков — гидролиз. Он осуществляется как микробными, так и собственными ферментами клеток погибшего организма, высвобождаемыми из лизосом в результате смерти клеток (аутолиз). Белки распадаются на аминокислоты, которые, в свою очередь, дезаминируются, в результате образуя аммоний и углекислый газ.
Вот так, например, происходит анаэробная аммонификация у некоторых представителей бактериального семейства клостридий:
CH3-CH(NH2)-COOH (аланин) + 2H2O → CH3COOH + NH3 + CO2 + 4H
2H2N-CH2-COOH (глицин) + 4H → 2CH3COOH + 2NH3
На этом мы завершили рассмотрение цикла азота, и можно смело перейти к рассмотрению организмов, азот фиксирующих [9].
Бактериальные собственники
Не стоит думать, что только клубеньковые растения могут иметь бактерий-симбионтов, которые будут усваивать им азот. Неужели эволюция могла остановиться на каком-то жалком клубеньке? Конечно, нет. Так, например, нитчатые цианобактерии «заставляют» заниматься фиксацией азота одну или несколько клеток в своем звене. Этих отщепенцев они образуют только при недостатке азотных соединений в окружающей среде. Клетка такого типа имеет специальное название — гетероциста (рис. 8). В колонии она повторяется через каждые 9–15 клеток. Каждая гетероциста обладает следующими отличиями от остальных клеток в колонии:
- производят три дополнительные клеточные стенки, в том числе однy из гликолипида, который образует гидрофобный барьер для кислорода;
- производят нитрогеназу и другие белки, участвующие в фиксации азота;
- утрачивают фотосистему II, которая производит кислород;
- производят белки, которые «нейтрализуют» любой оставшийся кислород.
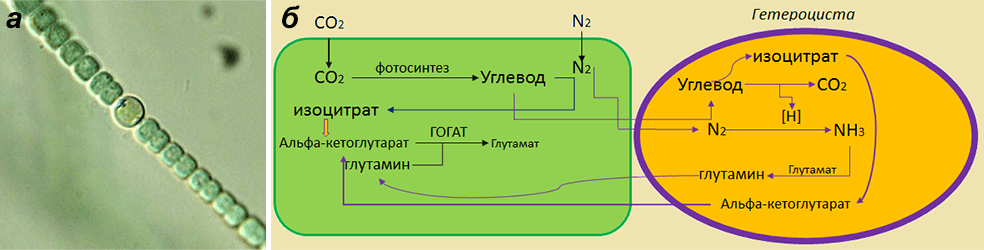
Рисунок 8. Гетероциста. а — гетероциста в составе нитчатой водоросли; б — схематическое изображение процессов, протекающих в гетероцисте. В гетероцисте молекулярный азот с помощью нитрогеназы переводится в аммиак, затем при участии глутамин-синтазы аммоний с глутаматом превращаются в глутамин. Поскольку глутамат-синтаза (ГОГАТ) находится, в основном, в вегетативных клетках, образованный глутамин передается туда из гетероцист и посредством ГОГАТ превращается в глутамат. Глутамат поступает из вегетативной клетки обратно в гетероцисту, и цикл замыкается. Из глутамата и глутамина образуются остальные аминокислоты в вегетативных клетках. Связанный азот запасается в гранулах в виде аргинина и аспартата. Усваиваемый атмосферный углерод при фотосинтезе в вегетативных клетках переходит в органическую форму — глюкозу, которая может метаболизироваться до пирувата, а тот в изоцитрат в цикле Кребса. Углевод (глюкоза/сахароза), поступая в гетероцисту, окисляется в пентозофосфатном цикле до углекислоты. При этом образуются протоны и электроны, необходимые для синтеза аммония из молекулярного азота. В гетероцистах обнаружена инвертаза, разлагающая сахарозу на глюкозу и фруктозу. Изоцитрат с помощью изоцитратдегидрогеназы преобразуется в α-кетоглутарат.
сайт lasso.wikispaces.com (рисунок а)
Азотфиксирующих симбионтов имеют не только вышеперечисленные зеленые «овощи». Относительно недавно было выяснено, что азот фиксируют симбиотические симбионты термитов. Да-да, именно симбиотические симбионты! Видите ли, термиты питаются исключительно древесиной (целлюлозой), и для ее переваривания им нужна помощь. Она приходит в виде многожгутиковых простейших — гипермастигин. Но они, по сути, являются посредниками: внутри них живут бактерии, которые и занимаются расщеплением целлюлозы до глюкозы. Но где же тут про азот? Оказалось, эти бактерии еще и фиксируют азот, который так необходим термитам, питающимся бедной азотом древесиной [10].
Итак, в этой статье хоть и поверхностно, но охвачены все аспекты цикла азота, которые известны науке на сегодняшний день. Может быть, вскоре мы научимся использовать процессы, протекающие в бактериях, для чистой добычи азотных соединений, ведь у них огромный для этого потенциал. Надеюсь, что эта статья заинтересовала вас. Спасибо за прочтение!
Литература
- The Haber Process. Сайт chemguide;
- Механизм биологической фиксации молекулярного азота. Сайт «Академик»;
- Брей С.М. Азотный обмен в растениях. М.: Агропромиздат, 1986. — 199 с.;
- Mylona P., Pawlowski K., Bisseling T. (1995). Symbiotic nitrogen fixation. Plant Cell. 7, 869–885;
- Lacey J.M. and Wilmore D.W. (1990). Is glutamine a conditionally essential amino acid? Nutr. Rev. 48, 297–309;
- Barnes M.R. and Gray I.C. Bioinformatics for geneticists. Wiley, 2003. — 350 p.;
- Википедия: «Нитрификация» (en.);
- Kuenen J.G. (2008). Anammox bacteria: from discovery to application. Nat. Rev. Microbiol. 6, 320–326;
- Devol A.H. (2003). Nitrogen cycle: solution to a marine mystery. Nature. 422, 575–576;
- Hongoh Y., Sharma V.K., Prakash T., Noda S., Toh H., Taylor T.D. et al. (2008). Genome of an endosymbiont coupling N2 fixation to cellulolysis within protist cells in termite gut. Science. 322, 1108–1109.








