
Наука из первых рук: как гомеостаз хлора влияет на возникновение эпилепсии
02 декабря 2016
Наука из первых рук: как гомеостаз хлора влияет на возникновение эпилепсии
- 1902
- 5
- 3
рисунок Ольги Пташник
-
Автор
-
Редакторы
Эпилепсия — хроническое неврологическое заболевание, при котором в нервной системе нарушается правильный баланс между возбуждением и торможением. Из-за этого в мозге возникают очаги неконтролируемого возбуждения, что проявляется в виде судорожных приступов. Только что наша международная исследовательская группа опубликовала работу о том, как гомеостаз ионов хлора может повлиять на развитие эпилепсии.
Короткая история звучит примерно так. У пациентов с эпилепсией височной доли мозга было найдено, что в небольшой группе нейронов отсутствует молекула, которая поддерживает гомеостаз ионов хлора (KCC2, potassium chloride cotransporter 2, т.е. хлорно-калиевый котранспортер 2). Эта молекула относится к целому классу сходных молекул, которые называются cation chloride cotransporters.
Эти белки занимаются тем, что поддерживают баланс различных ионов внутри и вне клетки [1]. Котранспортерами их называют потому, что за один раз они переносят сразу несколько ионов, например, KCC2 переносит ионы калия и хлора. Поскольку заряды этих ионов компенсируют друг друга, такой перенос можно проводить без затрат энергии. Энергия, конечно, используется, но та, которая запасена за счет натрий-калиевой помпы. Стоит помнить о том, что баланс именно этих ионов позволяет запускать потенциал действия , чтобы нейроны могли генерировать спайки в принципе.
О путешествиях ионов сквозь мембрану нейронов и мембранных потенциалах подробнее можно прочитать в статьях: «Формирование мембранного потенциала покоя» [2] и «Метроном: как руководить разрядами?» [3]. — Ред.
Зачем же нужен KCC2 в нейроне? Дело в том, что баланс хлора крайне важен для того, чтобы торможение было эффективным. Если хлора в нейроне слишком много, это может привести к тому, что тормозные синапсы могут стать возбуждающими (рис. 1) [4]. Причина в том, что из-за накопления хлора потенциал реверсии для тормозных ГАМК-синапсов начинает расти, и торможение перестает быть столь эффективным. Если таких клеток в сети накапливается слишком много, это может привести к увеличению возбуждения за счет рекуррентных синапических связей. В норме баланс возбужения-торможения регулируется для того, чтобы нейроны могли эффективно обрабатывать информацию и генерировать небольшое количество спайков. Существуют теории о том, что именно редкое срабатывание спайков может помогать сетям мозга оптимально кодировать информацию. Но об этом в другой раз, а пока вернемся к эпилепсии.
О возникновении вихрей возбуждения (но уже в сердечной мышце) и их изучении рассказывает обзор «Лаборатория биофизики возбудимых систем: сердце, его вихри и фотоуправление» [5]. — Ред.
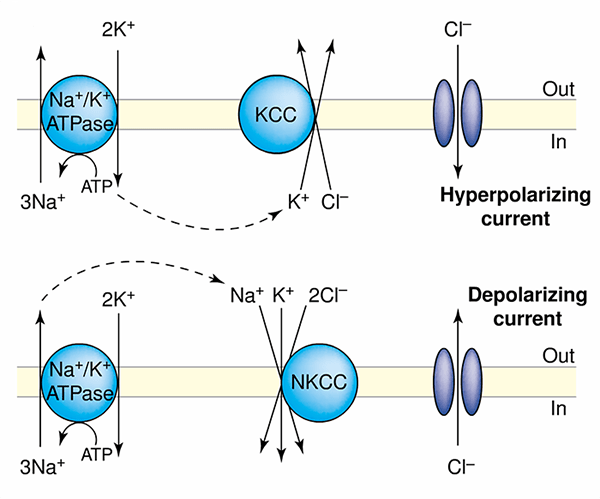
Рисунок 1. Схема работы хлорно-калиевых котранспортеров. Стрелочками показано направление тока ионов. Оба котранспортера, KCC2 и NKCC1, работают за счет поддержание натрий-калиевого гомеостаза с помощью натрий-калиевой АТФазы.
Если визуализировать эпилептический приступ в мозге крысы с помощью ультразвукового имиджинга мозга [6], то он будет выглядеть так:
Видео. Эпилептический приступ в мозге крысы, записанный с помощью ультразвукового имаджинга
Было известно, что у некоторых пациентов, страдающих эпилепсией, нарушен баланс ионов хлора внутри нейронов. Но как именно накопление хлора в сети взаимодействующих клеток может приводить к эпилепсии, было непонятно. Дело в том, что помимо медленного изменения концентрации ионов нейроны обмениваются нервными импульсами, что также меняет концентрацию ионов — как хлора внутри клеток, так и калия снаружи. Чтобы лучше понять механизмы приступа, мы построили подробную модель нейронов сети с динамической концентрацией хлора и других ионов. С ее помощью мы показали, что динамика сети может легко стать эпилептической, если есть около 30% клеток, у которых отсутствует KCC2 котранспортер (рис. 2).
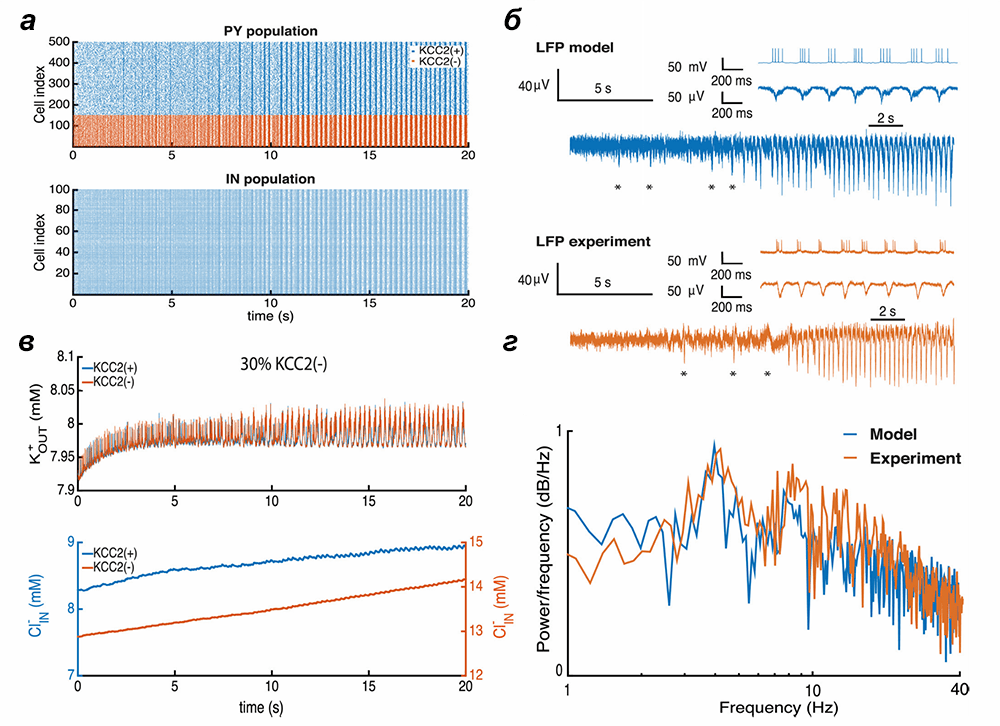
Рисунок 2. КСС2(−)-патология. а — Активность в модели сети возбуждающих (PY) и тормозных (IN) нейронов при переходе к эпилептическому приступу. б — Полевой потенциал (LFP), рассчитанный в модели нейронов (LFP model) и записанный в эпилептогенных срезах мозга (LFP experiment). в — Изменение концентрации внеклеточного калия (K+_OUT) и внутриклеточного хлора (Cl−_IN) при переходе к эпилептическому приступу. г — Спектр полевого потенциала во время приступа в модели и эксперименте.
Более того, наша модель оказалась способна воспроизвести активность, записанную в срезах мозга человека, где была запущена эпилепсия. Людей мы для этого не резали, но использовали данные, полученные после хирургического удаления очага эпилепсии в гиппокампе.
Любопытно, что предсказания, которые мы сделали, косвенно нашли подтверждение в результатах другой научной группы. Независимо от нас было найдено, что у мышей с увеличенной экспрессией KCC2 котранспортера сложнее вызвать эпилепсию, чем у обычных мышей [7]. Что подтверждает нашу идею о том, что отсутствие KCC2 может приводить к приступам.
Более того, с помощью нашей модели мы предсказали, что восстановление KCC2 может прекратить приступ (рис. 3). Для этого необходимо восстановить баланс хлора в пораженных нейронах, что сделает возбуждающие ГАМК-синапсы снова тормозными и в конечном итоге приведет к восстановлению балланса возбуждения и торможения в сети. Правда это или нет — пока неясно, потому что не совсем понятно, с помощью каких веществ можно строго и селективно изменять концентрацию хлора в нейронах. Но будем надеяться, что фармакология и оптогенетика помогут когда-нибудь решить эту проблему.
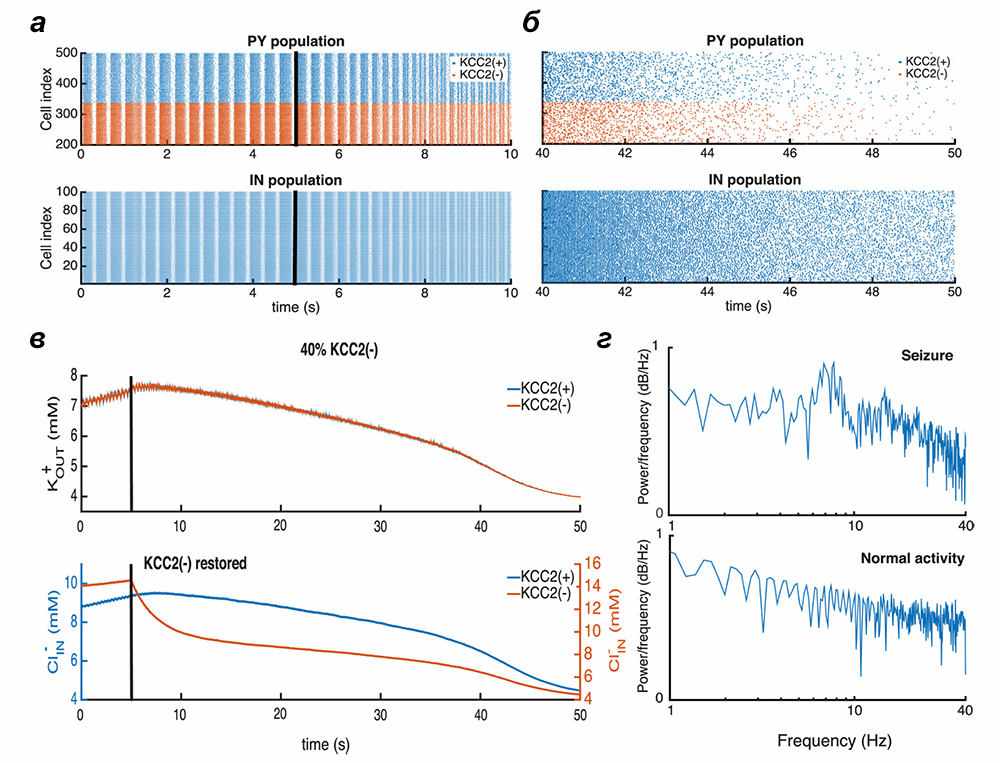
Рисунок 3. Восстановление функции КСС2 предотвращает приступ. а, б — Активность сети нейронов в состоянии эпилепсии до и после восстановления работы KCC2-контранспортера. в — Изменение концентрации ионов калия и хлора после восстановления KCC2. г — Спектр осцилляций полевого потенциала во время приступа и в норме.
P.S. Если интересна техническая сторона модели или просто хотите с ней поиграть, рабочую версию кода в Matlab найдете тут. Оригинальную статью можно посмотреть здесь [1].
Литература
- Buchin A., Chizhov A., Huberfeld G., Miles R., Gutkin B.S. (2016). Reduced efficacy of the KCC2 cotransporter promotes epileptic oscillations in a subiculum network model. J. Neurosci. 36, 11619–11633;
- Формирование мембранного потенциала покоя;
- Метроном: как руководить разрядами?;
- Blaesse P., Airaksinen M.S., Rivera C., Kaila K. (2009). Cation-chloride cotransporters and neuronal function. Neuron. 61, 820–838;
- Лаборатория биофизики возбудимых систем: сердце, его вихри и фотоуправление;
- Macé E., Montaldo G., Cohen I., Baulac M., Fink M., Tanter M. (2011). Functional ultrasound imaging of the brain. Nat. Methods. 8, 662–664;
- Cheung D.L., Goulton C.S., Watanabe M., Nabekura J., Moorhouse A.J. (2016). The effect of upregulated KCC2 expression on chemically induced seizures and diazepam therapy in vivo. Neuroscience 2016.





