Вирусы собирают внутри бактерий псевдоядра, чтобы противостоять их защитным системам
21 февраля 2017
Вирусы собирают внутри бактерий псевдоядра, чтобы противостоять их защитным системам
- 873
- 0
- 2
рисунок Ольги Пташник
-
Автор
-
Редакторы
Правило черной королевы довлеет над всеми живыми организмами биосферы. Особенную актуальность оно имеет для паразитов. Чтобы успеть за эволюцией защиты хозяина им буквально приходится бежать со всех ног, изобретая все новые и новые методы взлома. Не остались в стороне и бактериофаги. Результаты только что опубликованного исследования группы ученых из университета Калифорнии ошеломляют: чтобы скрыть свою ДНК от защитных систем бактерии, фаги научились собирать внутри клетки хозяина полные аналоги эукариотических ядер!
Бактериофаги — обширная и довольно специфическая группа бактериальных вирусов (рис. 1). Большинство бактериофагов относится к ДНК-содержащим вирусам. Именно это обстоятельство объясняет наличие у бактерий целого арсенала ферментных систем, разрезающих специфические последовательности ДНК, характерные для фагов. Это и ферменты рестрикции, открытие которых произвело настоящую революцию в молекулярной биологии во второй половине 70-х, и система CRISPR-Cas , совершающая очередной переворот прямо на наших глазах. Но эволюцию тяжело поставить в тупик, и, по-видимому, то самое псевдоядро, о котором пойдет речь в этом тексте, стало одним из ответов фагов на CRISPR-Cas и рестриктазы.
Узнать, что из себя представляет система CRISPR-Cas, можно из статьи «Просто о сложном: CRISPR/Cas» [1]. Об истории открытия и изучения этой системы рассказывает материал «CRISPR-эпопея и ее герои» [2]. — Ред.
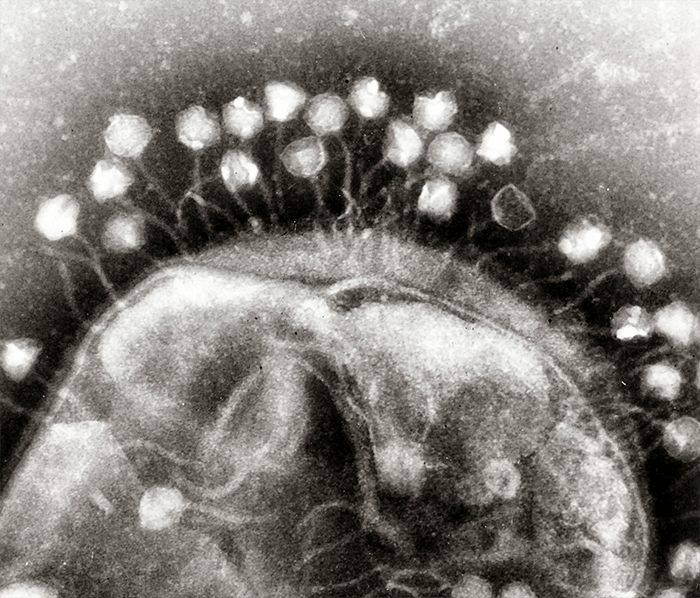
Рисунок 1. Фаги атакуют бактериальную клетку.
При прохождении литического цикла [3] фагом 201φ2-1 в клетках почвенной бактерии Pseudomonas chlororaphis фаговый тубулин PhuZ формирует биполярное веретено, фиксирующее область репликации фаговой ДНК в геометрическом центре клетки [4]. Весь этот процесс удивительно напоминает деление клеток эукариот. Для определения белков, участвующих в этих событиях, исследователями были созданы химерные конструкции белков фага с зеленым белком GFP и красным mCherry. Флуоресцентная микроскопия и криоэлектронная томография инфицированных клеток показали, что химерный белок GFP-gp105 образует сферическую структуру в центре клетки (gp105 — это первый и наиболее сильно экспрессируемый фаговый белок сразу после инфекции). Микросъемка клеток, экспрессирующих mCherry-PhuZ, продемонстрировала, что на первых минутах инфекции белок GFP-gp105 образует фокус на полюсе клетки, после чего mCherry-PhuZ сразу с двух сторон начинает формировать биполярное веретено (рис. 2). Веретено выталкивает растущий фокус GFP-gp105 в центр клетки, одновременно он растет и превращается в сферическую оболочку (у мутанта PhuZD190A, не способного к экспрессии PhuZ и, следовательно, образованию филаментов, оболочка так и остается на полюсе). К 41-й минуте инфекции, формирование оболочки заканчивается и внутри нее начинается репликация фаговой ДНК. Достигая центра клетки, веретено начинает вращать оболочку-псевдоядро за счет роста микротрубочек.
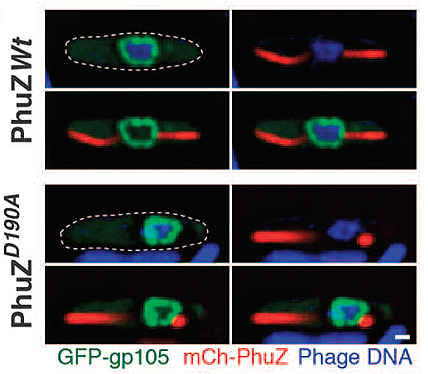
Рисунок 2. Флуоресцентная микрофотография инфицированных фагом 201φ2-1 клеток Pseudomonas chlororaphis. ДНК окрашена красителем DAPI (синяя) и находится в оболочке из химерного белка GFP-gp105 (зеленая). Это пседоядро подпирается с двух сторон веретеном из mCherry-PhuZ (красное). При наличии мутации PhuZD190A правильной сборки веретена не происходит, а псевдоядро остается на периферии клетки.
Описанная оболочка по своей функциональности очень похожа на ядро эукариот . Внутри нее концентрируются белки, участвующие в репликации фага: фаговая ДНК-геликаза (gp197), ДНК-лигаза (gp333), РНКаза Н (gp240), RecA (gp237) и два гомолога β’ субъединицы РНК-полимеразы (gp107 and gp130). В то же время бактериальные рибосомы и факторы трансляции, так же как и некоторые метаболические белки фага (тимидилат-киназа и тимидилат-синтаза), не проникали внутрь псевдоядра.
Некоторые вирусы эукариот тоже формируют псевдоядра. Например, мимивирус CroV образует «вирусную фабрику» в клетках жгутиковых эукариот Cafeteria roenbergensis: «Паразит паразиту враг» [5]. — Ред.
Псевдоядро из GFP-gp105 также играет важную роль в сборке вирионов фага. Микросъемка показала, что капсид фага из белка gp200 (главного белка оболочки) и gp246 (внутреннего белка оболочки) собирается вблизи одного из полюсов клетки, после чего мигрирует к псевдоядру, связывается с оболочкой и какое-то время вращается вместе с ним как одно целое. Скорее всего, в это время в него каким-то образом экспортируется ДНК из псевдоядра. Через некоторое время капсиды теряют связь с псевдоядром и, начиная с 60-й минуты инфекции, их содержимое начинает краситься ДНК-связывающим красителем DAPI.
Трехмерная реконструкция результатов криоэлектронной микроскопии показала, что сферическое псевдоядро имеет нерегулярное строение и толщину стенки около 5 нм (рис. 3). Белки не способны самопроизвольно проходить через ее границы, но механизмы их импорта остаются нераскрытыми.
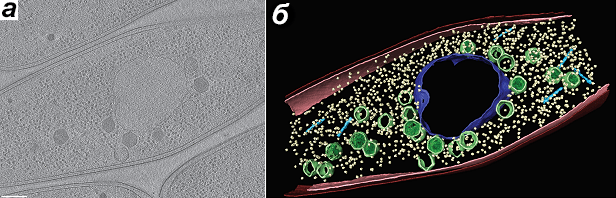
Рисунок 3. Результаты криоэлектронной томографии клеток Pseudomonas chlororaphis, инфицированных фагом 201φ2-1. Приведено отдельное изображение (а) и объемная реконструкция (б). Центральный компартмент — псевдоядро — выделен синим, собираемые капсиды вирусных частиц — зеленые многогранники. Желтые точки — рибосомы.
По-видимому, описанная в статье оболочка-псевдоядро служит для защиты ДНК фага от атаки антивирусных систем клетки-хозяина (рестриктаз и CRISPR-Cas9). Остается непонятным, каким образом мРНК экспортируется наружу изучаемого компартмента, а также как организован транспорт белков через его оболочку. Не выяснено, каким образом капсиды загружаются синтезированной в компартменте ДНК.
Возникновение этой системы вызывает огромное количество захватывающих дух вопросов. Распространена ли она среди других фагов? Как и когда она появилась? И главное — возможно ли, что фаговое псевдоядро и тубулиновое веретено имеют общую эволюционную историю с ядерным аппаратом эукариотической клетки? Ответ на этот вопрос в недалеком будущем вполне способен поменять наши представления о роли вирусов в становлении эукариот.
Литература
- Просто о сложном: CRISPR/Cas;
- CRISPR-эпопея и ее герои;
- «Бактериофаг-1 Бактериофагу-2, приём!»;
- Chaikeeratisak V., Nguyen K., Khanna K., Brilot A.F., Erb M.L., Coker J.K. et al. (2017). Assembly of a nucleus-like structure during viral replication in bacteria. Science. 355, 194–197;
- Паразит паразиту враг.