
Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза
25 февраля 2007
Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза
- 6454
- 2
- 5
Олигомеризация молекул клатрина, участвующих в процессе активного эндоцитоза
-
Автор
-
Редакторы
В статье рассмотрены различные виды рецептор-опосредованного эндоцитоза и стратегии по доставке лекарств внутрь клетки.
Внедрение нового лекарственного соединения в клиническую практику определяется двумя основными факторами — эффективностью его действия на ту или иную клеточную мишень и сохранением высокого уровня активности при использовании in vivo. Зачастую при разработке нового препарата вопросам его доставки к мишени уделяют неоправданно мало внимания. В то же время понятно, что никого не заинтересует лекарство, которое будет обладать изумительной активностью in vitro, однако при этом, например, не будет проникать через гематоэнцефалический барьер или же обладать низкой специфичностью. Тем не менее, современные знания о механизмах внутриклеточного транспорта и молекулярной организации клеточной поверхности позволяют разрабатывать новые эффективные технологии направленной доставки лекарств. Использование таких подходов позволяет увеличить специфичность действия препаратов и тем самым снизить их токсичность, а также уменьшить действующие концентрации. Особое значение эффективная внутриклеточная доставка приобретает при терапии онкологических заболеваний. Низкая избирательность действия, а также первичная и приобретенная в процессе лечения резистентность опухолевых клеток к химиопрепаратам — являются одними из главных причин, существенно ограничивающих эффективность противоопухолевой химиотерапии. Повышение селективности химиопрепаратов может быть достигнуто посредством их направленного транспорта к клеткам-мишеням с помощью различных белковых векторов, которые позволяют доставлять химиопрепараты, а также другие активные соединения внутрь клетки в результате рецептор-опосредованного эндоцитоза. Далее мы поговорим о различных современных стратегиях доставки лекарств, основанных на этом механизме.
Рецептор-опосредованный эндоцитоз
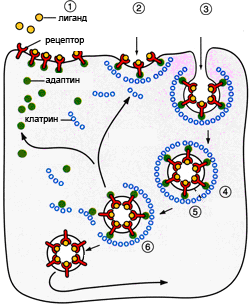
Рисунок 1. Этапы эндоцитоза, опосредованного рецепторами. 1. Связывание лиганда с рецептором. 2. Формирование окаймленной ямки. 3. Образование клатриновой везикулы. 4–6. Внутриклеточная утилизация.
Способность клетки поглощать различные макромолекулы и частицы в результате инвагинации плазматической мембраны называется эндоцитозом. Существует два основных пути такого транспорта. Жидкофазный (конститутивный) эндоцитоз — это неизбирательный процесс, при котором концентрация веществ, поглощаемых в составе везикул, соответствует концентрации веществ во внеклеточной жидкости. Такие везикулы образуются чрезвычайно активно. Расходуемая на везикулы мембрана быстро восстанавливается. Опосредуемый рецепторами эндоцитоз (рис. 1) представляет собой избирательный концентрирующий механизм, позволяющий клеткам захватывать большие количества специфических лигандов без поглощения соответственно большего объема внеклеточной жидкости. При этом поглощаются макромолекулы, для которых на плазмалемме существует ограниченное число связывающих участков. Эти рецепторы, обладают высоким сродством к определенным веществам. Они выборочно поглощают их из среды клетки и концентрируют. При этом жидкости и растворенные в ней посторонние, несвязывающиеся с рецепторами молекулы, почти не поглощаются. Так обеспечивается эффективное поступление специфических молекул в клетку. Везикулы, образующиеся при таком эндоцитозе, формируются в месте инвагинаций плазмалеммы, покрытых с цитоплазматической стороны волокнистым материалом — мембранным белком клатрином. Предварительно на мембране образуются окаймленные клатрином ямки, которые могут занимать до 2% поверхности некоторых клеток. С помощью окаймленных ямок, в которых располагаются соответствующие рецепторы, интернализуются ряд веществ, например, липопротеины низкой плотности, факторы роста, гормоны и пр. [1].
Стратегии внутриклеточной доставки лекарств
Использование белковых векторов, специфичных к клеточным рецепторам
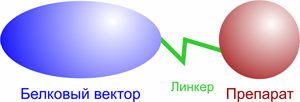
Рисунок 2. Структура конъюгата
В разработке противораковых препаратов широкое распространение получил подход с использованием гибридных конструкций типа белковый вектор + химиопрепарат, ковалентно связанных друг с другом (далее конъюгат, рис. 2.). Избирательность действия конъюгатов достигается либо за счет наличия на поверхности опухолевых клеток специфических рецепторов, «узнаваемых» векторным белком или антителом, либо за счет значительно более высокого уровня рецепторов векторного белка на поверхности опухолевых клеток по сравнению с нормальными. В ряде работ опубликованы данные об успешном применении цитотоксических конъюгатов, созданных на основе цитотоксических антибиотиков и векторных молекул, осуществляющих направленную доставку антибиотика в опухолевые клетки или эндотелиальные клетки сосудов опухоли [2]. В качестве векторов активно используют онкофетальные белки, трансферрин, моноклональные антитела к специфическим опухолевым антигенам, гормоноподобные пептиды (см. далее).
Конъюгация препарата с белковым вектором может быть осуществлена несколькими способами: с помощью химической сшивки (в простейшем случае — дисульфидная или тиоэфирная связь) полиэтиленгликолевого (PEG) или полипептидного линкера, авидин–биотин технологии. В любом случае, способ конъюгации должен удовлетворять двум основным критериям: высокий выход реакции и возможность внутриклеточного расщепления. Структура линкерного фрагмента может не подразумевать его клеточное расщепления, при этом «независимость» препарата от вектора обеспечивается значительной длиной линкера. В этом случае обычно используют PEG, масса которого может достигать 2–3 кДа [3].
В качестве противоопухолевых препаратов обычно используют цитотоксические антибиотики (например, интеркаляты в ДНК, такие как doxorubicin), индукторы апоптоза (напр. camptothecin) и др.
Таким образом, специфичность действия конъюгата будет определяться, прежде всего, структурой и типом белкового вектора, которые мы будем обсуждать далее.
Трансферрин–трансфериновый рецептор
Поскольку ионы Fe3+ нерастворимы, а Fe2+ обладают токсичностью, транспорта железа (Fe3+) в организме осуществляется в комплексе с глобулиновым белком — трансферрином (Trf). Транспорт железа в клетку происходит в результате эндоцитоза, опосредованного взаимодействием Trf со своим рецептором (TfrR) [4]. Трансферрин широко используется как белковый вектор для направленной доставки противораковых препаратов белков и генов опухолевой клетки, которая характеризуется повышенным уровнем экспрессии TfrR. Tfr-специфичная внутриклеточная доставка достигается конъюгацией данного вектор с рядом противоопухолевых препаратов (doxorubicin, daunorubicin) и белковых токсинов (СRM107, ricin) [5]. Использование таких конструкций позволяет существенно снизить токсичность химиотерапии, а также противостоять механизмам приобретенной резистентности раковых клеток.
Гормоны и их рецепторы
В качестве векторов не менее эффективно могут быть использованы пептидные гормоны, имеющие на поверхности клеток специфические к ним рецепторы. В частности установлено, что для рецепторов десятичленного пептида гонадолиберина (LHRH) наблюдается повышенная экспрессия в опухолевых клетках при развитии рака молочной железы, яичников и простаты [6], [7]. Поэтому LHRH может быть использован для направленной доставки лекарств к таким злокачественным образованиям. Так, для конъюгата, состоящего из LHRH, PEG и camptothecin’а была показана хорошая противоопухолевая активность на мышах. Данная конструкция была не токсична, и при этом не наблюдалось существенного физиологического эффекта на репродуктивные функции испытуемых животных, связанного с повышением концентрации LHRH [6].
Онкофетальные белки
Наиболее изученным представителем данного класса является α-фетопротеин (α-FP). Это гликопрпотеин (69 кДа), близкий по структуре к сывороточному альбумину человека. α-FP появляется в развивающемся эмбрионе млекопитающих и полностью исчезает из крови сразу после рождения. Однако он может появляться в крови взрослых особей при развитии рака печени и репродуктивных органов. α-FP в крови способен связывать различные компоненты сыворотки, включая жирные кислоты, стероиды и пр., а также обладает сродством к поверхности раковых клеток [8], [9]. Это позволяет также использовать его в качестве вектора. Конъюгирование α-FP с различными цитотоксическими антибиотиками (doxorubicin, carminomycin) позволяют увеличить их противораковую эффективность. В экспериментах in vivo для таких конъюгатов было показано ингибирование опухолевого роста и заметное увеличение продолжительности жизни мышей, подвергаемых терапии [10], [11].
Моноклональные антитела
Наиболее широко в качестве векторов используются моноклональные антитела (mAB) к различным рецепторам на поверхности раковых клеток (TrfR, рецептор фактора роста эпителия (EGFR), CD-рецепторы). Выработка таких mAB лежит в основе действия онковакцин. Кроме того, иногда используют радиомеченные mAB, которые связываются с клеткой и вызывают ее гибель за счет присутствия в их структуре радионуклидов. Также mAB часто конъюгируют с цитотоксическими антибиотиками и другими лекарственными препаратами с помощью различных линкеров (авидин–биотин, PEG и пр.) [12]. Использование конъюгатов на основе mAB к рецепторам часто бывает эффективней, чем использование в качестве векторов естественных лигандов. Так, например, Tfr обладает ограниченной способностью проникать через гематоэнцефалический барьер, что не позволяет использовать его в терапии онкологических заболеваний мозга. В то же время антитела к TfrR беспрепятственно проникают к различным тканям мозга [13].
«Троянские» пептиды
В качестве альтернативы классическим белковым векторам, которые обеспечивают интернализацию конъюгата с помощью рецептор-опосредованного эндоцитоза, можно использовать «троянские» пептиды (или CPP — cell penetrating peptides). Данные пептиды способны доставлять в клетки различные ковалентно пришитые гидрофильные молекулы (ДНК, белки, лекарства) без нарушения целостности плазматической мембраны, что делает их перспективными объектами современной молекулярной медицины. Пенетратин (pAntp), 16-членный фрагмент гомеодоменного белка Антеннопедии из D. melanogaster [14] является типичным и наиболее изученным представителем CPP. Однако, несмотря на колоссальное число работ, посвященных pAntp, механизм его переноса через клеточную мембрану остается до конца не установленным. Известно, что для pAntp возможно как прямое (за счет дестабилизации бислоя) проникновение в клетку, так и посредством эндоцитоза [15]. Возможно, энергозависимый путь проникновения CPP в клетку связан с рафт-опосредованным эндоцитозом [16]. Использование таких пептидов в качестве вектора является перспективным, поскольку гибридные конструкции зачастую обладают гораздо меньшими размерами, по сравнению с описанными выше конъюгатами, и просты в получении. В частности для pAntp с ковалентно пришитым doxrubicin’ом (рис. 3) было показано эффективное подавление опухолевого роста в мозге мышей [17]. При этом pAntp обеспечивал доставку doxrubicin’а через гематоэнцефалический барьер.
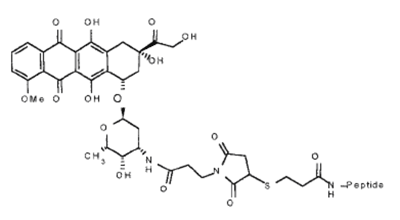
Рисунок 3. Структура гибридной конструкции doxorubicin—D-pAnt. Пептид: RQIKIWFQNRRMKWKK (все D-аминокислоты).
Литература
- Интерактивная база знаний «Биология Человека»;
- W. Arap. (1998). Cancer Treatment by Targeted Drug Delivery to Tumor Vasculature in a Mouse Model. Science. 279, 377-380;
- Misra A., Ganesh S., Shahiwala A., Shah S.P. (2003). Drug delivery to the central nervous system: a review. J. Pharm. Pharm. Sci. 6, 252–273;
- Yifan Cheng, Olga Zak, Philip Aisen, Stephen C Harrison, Thomas Walz. (2004). Structure of the Human Transferrin Receptor-Transferrin Complex. Cell. 116, 565-576;
- Qian Z.M., Li H., Sun H., Ho K. (2002). Targeted drug delivery via the transferrin receptor-mediated endocytosis pathway. Pharmacol. Rev. 54, 561–587;
- S. S. Dharap, Y. Wang, P. Chandna, J. J. Khandare, B. Qiu, et. al.. (2005). Tumor-specific targeting of an anticancer drug delivery system by LHRH peptide. Proceedings of the National Academy of Sciences. 102, 12962-12967;
- Grundker C., Huschmand Nia. A., Emons G. (2005). Gonadotropin-releasing hormone receptor-targeted gene therapy of gynecologic cancers. Mol Cancer Ther. 4, 225–231;
- Абелев Г.И. (1998). Альфа-фетопротеин — взгляд в биологию развития и природу опухолей. Соросовский образовательный журнал. 9, 8–13;
- Mengsen Li, Xinhua Liu, Sheng Zhou, Pingfeng Li, Gang Li. (2005). Effects of alpha fetoprotein on escape of Bel 7402 cells from attack of lymphocytes. BMC Cancer. 5;
- Severin S.E., Moskaleva E.Yu., Shmyrev I.I., Posypanova G.A., Belousova Yu.V., Sologub V.K. et al. (1995). α-fetoprotein-mediated targeting of anti-cancer drugs to tumor cells in vitro. Biochem. Mol. Biol. Int. 37, 385–392;
- S.V. Lutsenko, N.B. Feldman, G.V. Finakova, N.V. Gukasova, S.P. Petukhov, et. al.. (2000). Antitumor Activity of Alpha Fetoprotein and Epidermal Growth Factor Conjugates in vitro and in vivo. Tumor Biology. 21, 367-374;
- R. M. Sharkey, D. M. Goldenberg. (2006). Targeted Therapy of Cancer: New Prospects for Antibodies and Immunoconjugates. CA: A Cancer Journal for Clinicians. 56, 226-243;
- Torben Moos, Evan H. Morgan. (2008). Restricted transport of anti-transferrin receptor antibody (OX26) through the blood-brain barrier in the rat. Journal of Neurochemistry. 79, 119-129;
- Derossi D., Joliot A.H., Chassaing G., Prochiantz A. (1994). The third helix of the Antennapedia homeodomain translocates through biological membranes. J. Biol. Chem. 269, 10444–10450;
- S. Deshayes, M. C. Morris, G. Divita, F. Heitz. (2005). Cell-penetrating peptides: tools for intracellular delivery of therapeutics. CMLS, Cell. Mol. Life Sci.. 62, 1839-1849;
- E. Vives, J.- Richard, C. Rispal, B. Lebleu. (2003). TAT Peptide Internalization: Seeking the Mechanism of Entry. CPPS. 4, 125-132;
- Christophe Rousselle, Philippe Clair, Jeanne-Marie Lefauconnier, Michel Kaczorek, Jean-Michel Scherrmann, Jamal Temsamani. (2000). New Advances in the Transport of Doxorubicin through the Blood-Brain Barrier by a Peptide Vector-Mediated Strategy. Mol Pharmacol. 57, 679-686;
- Alexander Fotin, Yifan Cheng, Piotr Sliz, Nikolaus Grigorieff, Stephen C. Harrison, et. al.. (2004). Molecular model for a complete clathrin lattice from electron cryomicroscopy. Nature. 432, 573-579.






