
Одна последовательность — одна структура: был ли Анфинсен неправ?
31 марта 2008
Одна последовательность — одна структура: был ли Анфинсен неправ?
- 1871
- 6
- 4
Мог ли Анфинсен предположить, что у одного белка может быть сразу две нативных конформации? Перед зеркалом — конформация ltn10 хемокина лимфотактина, существующая при 10 °C (и более высоких) и ионной силе 200 мМ NaCl, а «в зазеркалье» — конформация ltn40, образующая функциональный димер при 40 °C в бессолевом растворе.
-
Автор
-
Редакторы
С 1970-х годов в биохимии господствует представление, что аминокислотная последовательность белка уникальным образом определяет его трёхмерную структуру. Но вот теперь в новом исследовании обнаружено, что лимфотактин — небольшой белок семейства хемокинов — не только «балансирует» в физиологических условиях между двумя различными конформационными состояниями, но и выполняет две разные биохимические функции! Так был ли Анфинсен — один из основоположников теории фолдинга белка — неправ?
В 1972 году Кристиан Анфинсен [1] получил Нобелевскую премию по химии «за работы по рибонуклеазе, в частности, за установление связи между последовательностью аминокислот и конформацией биологически активной молекулы», а его статья в Science [2] стала классикой в теории фолдинга белка. С тех пор считается, что аминокислотная последовательность уникальным образом определяет трёхмерное строение белковой молекулы (хотя во многих случаях фолдинг происходит не сам по себе, а «при поддержке» шаперонов и транслокационного комплекса — для мембранных и секретируемых белков). Механизм фолдинга до сих пор остаётся не понятым [3], хотя многие теоретические выкладки [4] и эксперименты [5] постоянно добавляют новую информацию в «копилку знаний» по этому сложному процессу.
Учёные с кафедры биохимии Медицинского университета Висконсина в Милуоки под руководством Брайана Волкмана (Brian Volkman) сделали удивительное открытие, которое, на первый взгляд, ставит под сомнение концепцию, выдвинутую Анфинсеном. Они обнаружили, что лимфотактин — небольшой белок семейства хемокинов, стимулирующий хемотаксис Т-лимфоцитов, — в физиологических условиях образует сразу две нативные конформации, довольно быстро переходящие одна в другую [6]. При этом одна из конформаций устроена аналогично большинству других хемокинов — трёхлопастной β-лист с α-спиралью на C-конце молекулы, — а другая сворачивается в четырёхлопастной β-лист (неизвестный доселе тип укладки) и функционирует в форме димера (в отличие от первой). Но этим «новости» ещё не оканчиваются: каждая форма молекулы выполняет свою биохимическую функцию, необходимую для хемотаксиса!
«Белки часто имеют несколько функциональных форм, структурно „близких“ к одной нативной структуре, — говорит Волкман [7]. — Однако мы обнаружили, что физиологическая форма лимфотактина образуется двумя примерно равновероятными, но при этом совершенно структурно отличными конформациями, динамически переходящими одна в другую».
Хемокины (или хемотаксические цитокины) — к которым принадлежит лимфотактин — это секретируемые белки сосудистой стенки и клеток иммунитета, активирующие нейтрофилы и моноциты и привлекающие их в очаг воспаления. Механизм действия хемокинов заключается в связывании с гликозаминогликанами эндотелиальных клеток сосудов или активации G-белоксопряжённых рецепторов (GPCR) на поверхности мембраны лейкоцитов. Вместе эти механизмы обеспечивают иммобилизацию лейкоцитов и миграцию их сквозь стенки капилляров в очаг воспаления. Лимфотактин — «герой» описываемого исследования — является единственным членом подсемейства C хемокинов, общее число которых достигает 50.
Одна из физиологически активных конформаций лимфотактина связывается с гликозаминогликанами (то есть, обеспечивает адгезию лейкоцитов к стенкам капилляров), а другая активирует хемокиновый рецептор XCR1 (также известный как GPR5) и отвечает собственно за хемотаксис. Что интересно, ни одна из этих форм не способна выполнять работу другой — и «сотрудничество» обеих конформаций служит на благо важного физиологического процесса.
Исследователями было обнаружено, что, в зависимости от физико-химических условий, удаётся «переключить» молекулу лимфотактина в одно из действующих состояний, сведя вероятность другого практически к нулю (в то время как в физиологических условиях эти формы превращаются друг в друга с периодом ≈100 мс). Так, при 10 °C и ионной силе раствора 200 мМ NaCl, преобладает конформация Ltn10, строение которой очень похоже на устройство других хемокиновых молекул (структура белкá была определена с помощью спектроскопии ядерного магнитного резонанса (ЯМР) раствора лимфотактина). При условиях, более близких к физиологическим, — 25–37 °C и той же ионной силе — в спектре химических сдвигов появляются дополнительные пики, соответствующие равновесию между двумя конформациями. При 40 °C же и без добавления соли (нулевой ионной силе) преобладает конформация, названная Ltn40, состоящая из четырёхлопастного β-слоя и образующая функциональный димер. Что интересно, по сравнению с Ltn10, молекула как бы «выворачивается» наизнанку, и практически все внутримолекулярные контакты заменяются на новые (рис. 1). Что интересно, среди известных белков такого мотива пространственной организации пока не обнаружено.
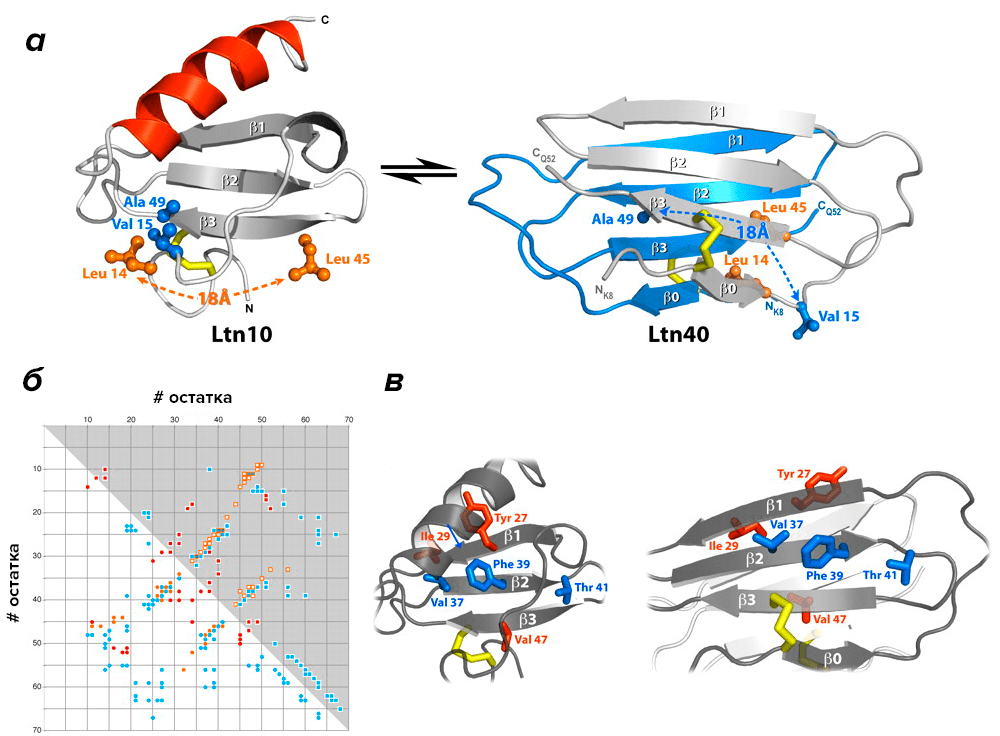
Рисунок 1. Конформационная «двойственность»: в физиологических условиях лимфотактин находится в динамическом равновесии между двумя несхожими структурами, выполняющими каждая свою функцию. а — Переход Ltn10↔Ltn40 полностью перестраивает все внутримолекулярные взаимодействия. Так, в Ltn10 остатки Val15 и Ala49 плотно упакованы друг с другом (слева), а в конформации Ltn40 эти остатки разделены расстоянием 18 Å (справа); для пары остатков Leu14 и Leu45 верно обратное. В целом, структура Ltn10 состоит из трёхлопастного β-листа и C-концевой α-спирали; молекула существует в мономерной форме. Ltn40 же образована четырёхлопастным β-листом и функционирует в виде димера (один показан серым, другой — синим). б — Карта внутримолекулярных контактов остаток–остаток иллюстрирует существенную разницу в упаковке Lnt10 и Ltn40. Выше диагонали показаны близкие контакты (■, Ltn40-внутримолекулярные: ■ и Ltn40-межмолекулярные: ■. Ниже диагонали приведены дальние ЯЭО-контакты — Ltn10: ●, Ltn40-внутримолекулярные: ● и Ltn40-межмолекулярные: ●. в — Несмотря на то, что общий вид элементов вторичной структуры β1–β3 в конформациях Ltn10 и Ltn40 совпадают, «лопасти» β1 и β3 в Ltn40 как бы «вывернуты наизнанку», и показанные в них красным остатки участвуют в образовании димера.
Ядерный эффект Оверхаузера — явление, использующееся в ЯМР-спектроскопии для оценки «дальних» контактов между атомами.
Димеризация Ltn40 опосредована, видимо, ионными мостиками Lys25–Glu31 и Glu31–Lys25, при разрушении которых высокой ионной силой конформация Ltn40 дестабилизируется и между двумя формами лимфотактина устанавливается равновесие. Центральным же элементом молекулы Ltn10 можно считать остаток Trp55, образующий «гидрофобное ядро» этой конформации. Учёные использовали эти данные для получения мутантов лимфотактина, пребывающих только в одном конформационном состоянии: белок с заменой Trp55→Asp из-за потери «гидрофобного ядра» принимает в основном конформацию Ltn40, а образование дисульфидной связи в мутанте Val21→Cys/Val59→Cys, наоборот, стабилизирует Ltn10-конформацию. Эти мутанты использовались для точной идентификации функций, присущих каждой форме in vivo, — о чём уже говорилось двумя абзацами выше.
Исследователи надеются, что их открытие поможет понять и механизм работы других белков, претерпевающих существенные внутримолекулярные перестройки, — таких как белки болезней Альцгеймера, Паркинсона, бокового амиотрофического склероза, спонгиозных энцефалопатий и других. «Хотя пока что наше открытие ставит больше новых вопросов, чем решает уже существующих, мы надеемся, что в результате оно даст начало новой волне исследований против этих страшных болезней», — говорит Волкман [7].
Так всё-таки, был ли Анфинсен неправ? Наверное, всё же, не был: ведь новое исследование только расширяет его представления о самоупаковке белковых молекул. Просто в случае лимфотактина учёные столкнулись с событием, видимо, оцененным самим Анфинсеном как крайне маловероятное, — что сразу две (и при том существенно различные!) конформации молекулы оказались нативными из-за близких энергетических характеристик. Остаётся надеяться, что статья, выходящая в первоапрельском номере Докладов АН США [6], не является шуткой, преподнесённой с серьезным лицом. :-)
Литература
- Нобелевские лауреаты. Кристиан Анфинсен. Электронная библиотека «Наука и техника»;
- C. B. Anfinsen. (1973). Principles that Govern the Folding of Protein Chains. Science. 181, 223-230;
- Ken A Dill, S Banu Ozkan, Thomas R Weikl, John D Chodera, Vincent A Voelz. (2007). The protein folding problem: when will it be solved?. Current Opinion in Structural Biology. 17, 342-346;
- G. D. Rose, P. J. Fleming, J. R. Banavar, A. Maritan. (2006). A backbone-based theory of protein folding. Proceedings of the National Academy of Sciences. 103, 16623-16633;
- Фолдинг «воочию»;
- Robbyn L. Tuinstra, Francis C. Peterson, Snjezana Kutlesa, E. Sonay Elgin, Michael A. Kron, Brian F. Volkman. (2008). Interconversion between two unrelated protein folds in the lymphotactin native state. PNAS. 105, 5057-5062;
- New discovery alters longstanding concept of fixed protein structure. (2008). ScienceDaily.





