Канал эукариотического шаперонина открывается подобно диафрагме фотоаппарата
16 июня 2008
Канал эукариотического шаперонина открывается подобно диафрагме фотоаппарата
- 4828
- 4
- 2
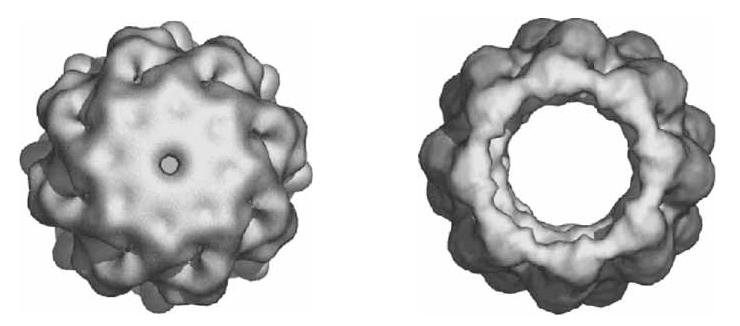
Скомбинировав одночастичную криоэлектронную микроскопию и молекулярное моделирование, учёные обнаружили, что механизм открывания/закрывания эукариотического шаперонина TRiC/CCT напоминает работу диафрагмы фотографического объектива. Слева — закрытая форма; справа — открытая.
-
Автор
-
Редакторы
Шаперонины — белки, работающие «в паре» с шаперонами, — обеспечивают правильное сворачивание полипептидной цепи, временно «изолируя» только что сошедший с рибосомы белок в своей внутренней полости. При этом бактериальные шаперонины «закрываются» с помощью отдельной «крышки», а шаперонины эукариот имеют «встроенную» «задвижку». Учёным из Стэнфорда удалось выяснить, что механизм открывания/закрывания эукариотического шаперонина радикальным образом отличается от механизма его бактериального аналога, — несмотря на очень высокое структурное сходство.
Сворачивание белкá (или фолдинг) — один из наименее понятых процессов во всей последовательности превращений генетической информации, закодированной в хромосомах, в «рабочие» молекулы белкá. В большинстве случаев правильное сворачивание синтезирующейся на рибосомах полипептидной цепи обеспечивается белкáми-«помощниками» — шаперонами и шаперонинами, связывающимися с ещё не до конца «сошедшей» с рибосомы молекулой и не дающими ей раньше времени агрегировать с другими молекулами. Роль шаперонов (существующих в форме мономеров) заключается в поддержании полипептидной цепи в развёрнутой конформации, а функция олигомерных шаперонинов, состоящих из 14–16 субъединиц и образующих что-то вроде «бочонка» с центральной полостью, — временно экранировать белóк от окружающей среды и дать ему время свернуться в нативную конформацию [1]. Работа шаперонов осуществляется за счёт энергии АТФ, а нарушение функций этих консервативных во всех царствах живой природы молекул приводит к многочисленным болезням, среди которых — рак и амилоидные заболевания.
Шаперонины — важнейшая группа шаперонов — бочонкообразные цитоплазматические макромолекулярные комплексы, внутри которых есть полость, через которую проходят сворачивающиеся белки. Шаперонины принимают участие в сворачивании ≈10% белков, для обретения формы которыми вообще требуются шапероны, и в первую очередь это касается белков со сложной структурой, входящих в состав макромолекулярных комплексов. Шаперонины состоят из двух состыкованных колец, каждое из которых содержит семь-восемь субъединиц-мономеров (по-разному в разных организмах). Выделяется две группы шаперонинов, — I и II, — присутствующие в прокариотах (I) и эукариотах и архебактериях (II), причём они радикальным образом отличаются по связыванию белковых субстратов.
К группе I шаперонинов относится хорошо изученный шаперонин GroEL из Escherichia coli, состоящий из 14 идентичных субъединиц, выстроенных в два состыкованных кольца по 7 мономеров в каждом. «Закрывание» этого шаперонина происходит с помощью «крышки» — кофактора-гептамера GroES, присоединяющегося к GroEL после связывания последнего с АТФ. Шаперонины группы II, обнаруженные в эукариотах и архебактериях, хотя и устроены схожим образом, существенно отличаются от бактериальных шаперонинов. Во-первых, они не являются гомоолигомерами — так, каждое из колец шаперонина TRiC (также известного под аббревиатурой CCT) состоит из восьми различающихся, хотя и родственных субъединиц. Во-вторых, у этих шаперонинов нет отдельной «крышки» — доступ во внутреннюю полость может перекрываться апикальными участками тех же молекул, что образуют сам шаперонин. Отличия в устройстве позволяют шаперонинам группы II взаимодействовать со многими исключительно эукариотическими белками — например, актином, который не может быть корректно свёрнут при участии бактериальных шаперонинов.
Стэнфордские учёные из группы Джудит Фридман (Judith Frydman) заинтересовались механизмом, приводящим к «закрыванию» полости в шаперонинах и причинами, по которым в целом близкородственные белки групп I и II имеют совершенно разные механизмы этого закрывания. Этот интерес не возник на пустом месте: именно в группе Фридман в 1992 году был открыт эукариотический шаперонин TRiC/CCT, однако в то время экспериментальные методики ещё не были развиты достаточно хорошо, чтобы изучать такие тонкие различия. Теперь же учёные использовали комбинацию одночастичной криоэлектронной микроскопии и молекулярного моделирования, чтобы получить псевдоатомные модели открытой и закрытой формы шаперонина TRiC/CCT быка и изучить возможный механизм открывания и закрывания полости внутри этой «наномашины» [2].
«Знание того, как открывается „заслонка“ в этом шаперонине крайне важно для понимания работы всего механизма сворачивания в целом», — говорит Фридман [3], приводя также в качестве аргумента то, что некорректно свёрнутые белки токсичны для клетки, а, следовательно, знание механизма их сворачивания может позволить избавиться от болезней, связанных с некорректной упаковкой белковых цепей, в частности — от знаменитых болезней Альцгеймера и Паркинсона, а также некоторых форм рака.
Два кольца шаперонина TRiC работают подобно двухтактному двигателю, — когда одно кольцо замыкается, открывается второе, «выпуская на волю» уже свернувшийся в недрах шаперонина белóк. «Это чрезвычайно сложный механизм, настоящая наномашина, — говорит Фридман. — Когда она закрывается, белок оказывается „пойманным“ внутри, и после того как что-то, чего мы не понимаем, происходит там, внутри этой полости, и когда шаперонин наконец открывается, — „на свет“ появляется уже свёрнутый белок». Время, в течение которого белок находится «в камере», очень важно — ведь и слишком короткий, и слишком длинный «срок» приведёт к получению неработоспособного белкá; однако механизмы, регулирующие эту длительность, пока совсем не изучены.
Новое исследование Фридман, проводимое в сотрудничестве с Национальным центром США по структуре макромолекул, и нацеленное на изучение механизма открывания/закрывания шаперонина TRiC [2], основывается на междисциплинарном подходе, включающем одночастичную криоэлектронную микроскопию и молекулярное моделирование. Экспериментальная методика позволила получить карты электронной плотности TRiC быка в открытой и закрытой форме с пространственным разрешением около 15–18 Å, в которую были «вписаны» компьютерные полноатомные модели субъединиц шаперонина. Карты электронной плотности (см. картинку в заглавии) наглядно показывают наличие канала в открытой форме и отсутствие его в закрытой. Диаметр канала составляет ≈45 Å.
В результате анализа меж- и внутридоменных движений, характерных для моделей открытой и закрытой форм, учёным удалось установить, что механизм закрывания «заслонки» шаперонина напоминает принцип действия диафрагмы в объективе фотоаппарата — «лепестки» апикальных частей каждой из восьми субъединиц совершают поворотные движения, закрывающие доступ в полость (см. пояснительный видеоролик). При этом меняется конформация всей субъединицы, что, возможно, приводит к изменению физико-химических условий внутри шаперонина. Это открытие стало довольно неожиданным, потому что раньше предполагали, что «вход» в шаперонин устроен подобно «створкам» картонной коробки, а такой механизм не подразумевает существенных конформационных перестроек всей молекулы.
Видео. Механизм открывания и закрывания полости шаперонина TRiC/CCT быка. Видео получено в результате компьютерного моделирования колебательных движений моделей открытого и закрытого состояний шаперонина. Выявленные в результате такого анализа «скручивающие» движения позволили предположить, что «заслонка» шаперонина работает аналогично шторке диафрагмы фотообъектива.
Впрочем, механизм работы шаперонина, скорее всего, ещё более сложен и интересен: в компьютерной реконструкции этого процесса было принято упрощение, заключающееся в оси симметрии восьмого порядка, проходящей по оси шаперонина. Это позволило многократно (примерно в 100 раз) сократить требуемые вычислительные ресурсы, но, возможно, оставило «за бортом» интересные и важные явления. Более подобное моделирование исследователи планируют в будущем.
Компьютерная реконструкция работы шаперонина позволила выявить существенно отличные механизмы в эволюционно родственных белках — шаперонинах групп I и II. Однако многие детали работы шаперонинов так и остаются не понятыми, — что оставляет учёным большой простор для дальнейшей работы. «Если бы мы смогли понять, как устроен шаперонин изнутри и как он выполняет свою работу, — а именно, как помогает клетке сворачивать белки, — мы могли бы заняться дизайном белков с медицинскими целями», — комментирует свои достижения Фридман [3].
Литература
- Наградова Н. К. (1996). Внутриклеточная регуляция формирования нативной пространственной структуры белков. «Соросовский журнал». 7, 10–18;
- Christopher R Booth, Anne S Meyer, Yao Cong, Maya Topf, Andrej Sali, et. al.. (2008). Mechanism of lid closure in the eukaryotic chaperonin TRiC/CCT. Nat Struct Mol Biol. 15, 746-753;
- New insights into hidden world of protein folding. (2008). ScienceDaily;
- Торжество компьютерных методов: предсказание строения белков.