Непохожие «гомологичные» белки
05 октября 2008
Непохожие «гомологичные» белки
- 1332
- 3
- 3
Введённое Ричардом Оуэном в 1840-е понятие гомологии обозначает эволюционную общность происхождения óрганов, в отличие от аналогии, обозначающей выполнение одних и тех же функций. Белки тоже могут быть гомологичными, и, в отличие от анатомии, эту гомологию можно «легко» установить — по степени идентичности аминокислотных последовательностей. Теперь же учёные создали белки, практически идентичные друг другу (88%), но совершенно негомологичные, отличающиеся по структуре и выполняющие разные функции.
-
Автор
-
Редакторы
Вопрос, каким образом аминокислотная последовательность кодирует строение белков, остаётся одним из наиболее актуальных в биофизике. Чтобы проникнуть в самую суть механизмов, отвечающих за самосборку белков, учёные сконструировали два белкá, практически идентичные по последовательности (88%), которые сохранили при этом структуру и даже функции «исходных» негомологичных белков, из которых они были получены путём введения множества мутаций. Более того, удалось установить, что за различия в вариантах упаковки — 3-α и α/β мотивы — отвечают всего лишь... три аминокислотных остатка.
Понимание связи между первичной последовательностью и пространственной структурой (а, следовательно, и функцией) биологических макромолекул является одной из интереснейших, но до сих пор неразрешённых задач физико-химической биологии. Давно отмечено, что структура молекул белков в большинстве случаев значительно более консервативна, чем их последовательность: в процессе эволюционной дивергенции именно последовательность накапливает отличия со значительной скоростью, мотивы же структурной укладки иногда остаются практически неизменными, даже когда сравнение последовательностей уже не позволяет напрямую судить о гомологии (эволюционном родстве). Именно гомология, о которой чаще всего судят по степени идентичности последовательностей, лежит в основе возможности предсказания строения белкá, если известна структура его «родственника» [1].
Однако в последнее время исследователи начали сталкиваться с явлениями, немного «не вписывающимися» в одну из догм молекулярной биофизики, предложенную ещё Анфинсеном [2] — что первичная последовательность однозначно определяет структуру. В частности, это касается недавнего открытия того, что лимфотактин обладает сразу двумя нативными структурами при физиологических условиях, да ещё и выполняющими каждая свою функцию [3]. В целом верная, гипотеза о том, что белки с близкими последовательностями имеют близкие структуру и функцию, теперь начинает «обрастать» массой исключений и оговорок. (Как это уже произошло с основной «догмой» молекулярной биологии, вкратце записываемой как «ДНК→РНК→белок».)
Теперь стало известно ещё об одном отклонении от правила: учёным удалось на основе двух негомологичных белков сконструировать пару, практически идентичную друг другу (на 88%!), однако каждый из «новых» белков не только сохранил строение, характерное для «родителя», но ещё и продолжил выполнять ту же функцию [4]! В качестве «исходных» белков были взяты субъединицы GA и GB1 многодоменного стрептококкового белка G, связывающие соответственно альбумин сыворотки человеческой крови и константную часть иммуноглобулина IgG. Расположенные в клеточной стенке бактерий Streptococcus, эти белки, предположительно, предназначены для «маскировки» своего хозяина от иммунной системы заражённого организма — в частности, путём «обвешивания» молекулами альбумина хозяина, захватываемыми субъединицей GA.
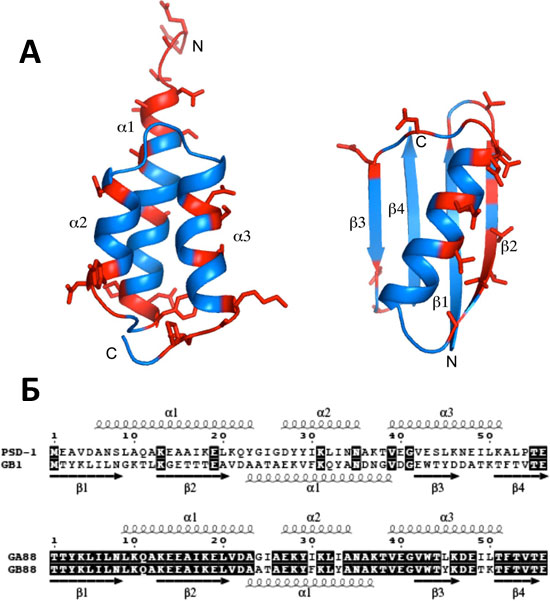
Рисунок 1. Дизайн негомологичных белков с 88%-й идентичностью последовательностей. А — Структуры исходных белков, использованных как основа дизайна GA88 и GB88. Слева — структура альбумин-связывающего модуля GA, обладающая 3-α укладкой. Справа — структура домена GB1, устроенного по типу α/β. Красным показаны позиции, в которые были введены мутации для получения пары GA88/GB88. Б — Выравнивания аминокислотных последовательностей «родительских» белков (сверху) и мутантов GA88/GB88 (снизу). Рядом с последовательностями схематично показана вторичная структура соответствующего белкá; идентичные остатки в каждой паре показаны на чёрном фоне. (Так, в случае «родительской» пары было всего девять идентичных позиций, а в случае GA88/GB88 — всего семь различающихся.)
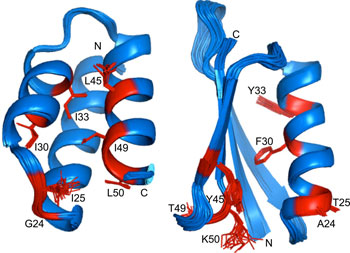
Рисунок 2. Структуры GA88 (слева) и GB88 (справа). Красным показаны семь позиций, в которых последовательности пары белков различаются. Несмотря на большое число введённых мутаций, белки GA88 и GB88 сохранили практически тот же тип укладки, что и их «родители» (среднеквадратичные отклонения по белковому остову всего 1 Å и 0,83 Å, соответственно).
Остатки, различающиеся в паре белков GA95 и GB95 (см. текст), имеют номера 20, 30 и 45.
Белки GA и GB1 негомологичны друг другу (идентичность последовательностей всего 16%) и по-разному упакованы в пространстве: согласно мотивам 3-α и α/β, соответственно (см. рис. 1а). Учёные взяли два этих белкá (точнее, их 56-аминокислотные аналоги) «за основу», и ввели 24 замены в последовательность GA и 17 замен — в GB1. Полученные в результате мутанты оказались идентичными уже на 88% (поэтому из назвали GA88 и GB88; рис. 1б), но при этом сохранили способность связывать те же молекулы, что связывали их «предки», и те же мотивы пространственной укладки. Структура обоих мутантов была получена с помощью спектроскопии ЯМР, что позволило учёным окончательно убедиться в этом (рис. 2). Чтобы подчеркнуть удивительность этого феномена, исследователи даже предложили именовать эту пару не «гомологичными белками», как это обычно делается при высокой доле идентичности последовательностей, а «белками с высокой идентичностью последовательностей».
Все различия по структуре и функциям между белкáми пары GA88 и GB88 обусловлены всего лишь семью остатками, по которым они не совпадают. Точнее, правильнее было бы сказать, не более чем семью. И исследователи пошли ещё дальше: они ввели дополнительные мутации, подняв степень идентичности до 95%, и всё различие между белкáми GA95 и GB95 стало заключаться уже всего в трёх остатках (!), но они продолжали сохранять те же мотивы пространственной упаковки. Определить конкретные молекулярные механизмы, приводящие к «переключению» между структурными семействами 3-α и α/β, учёные рассчитывают в дальнейшем, но уже сейчас они отмечают, что, по-видимому, ключевую роль в этом переходе играют остатки № 30 и № 45 (I30 и L30 в GA95; F30 и Y45 в GB95), которые, скорее всего, в обоих случаях особенно важны для сворачивании белковой глобулы и поддержания её структуры.
Литература
- Торжество компьютерных методов: предсказание строения белков;
- Нобелевские лауреаты. Кристиан Анфинсен. Электронная библиотека «Наука и техника»;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Y. He, Y. Chen, P. Alexander, P. N. Bryan, J. Orban. (2008). NMR structures of two designed proteins with high sequence identity but different fold and function. Proceedings of the National Academy of Sciences. 105, 14412-14417.