
Умелые руки: как доставить полипептид через мембрану?
18 октября 2008
Умелые руки: как доставить полипептид через мембрану?
- 903
- 0
- 2
Гипотетический (до сих пор!) механизм транслокации. Трансмембранный канал SecY1 «пропускает» через себя полипептидную цепь (оранжевым), а «мотор» SecA2 проталкивает его в полость канала, одновременно расширяя её.
1 три субъединицы SecY показаны сплошной разноцветной поверхностью.
2 показан элементами вторичной структуры.
-
Автор
-
Редакторы
Более трети всех синтезируемых клеткой белков секретируется либо встраивается в мембрану, то есть — подвергается трансмембранному переносу. Этот процесс осуществляет специальный транслокационный комплекс, состоящий у бактерий из интегрального мембранного канала SecY и «мотора» SecA, который с помощью энергии АТФ «проталкивает» белóк через узкий канал SecY. До недавнего времени этот процесс был изучен только в самом общем виде (хотя было известно, например, в каких случаях белóк будет «вытолкнут» из клетки, а в каких — останется в мембране). Последние исследования пролили свет на молекулярный механизм взаимодействия SecY–SecA и то, как они осуществляют транспорт белков.
Для интеграции в плазматическую мембрану клетки или секреции во внеклеточное пространство белки используют специализированные трансмембранные каналы, осуществляющие транслокацию, — SecYEG (канал состоит из субъединиц Y, E и G) — для краткости часто называемые просто SecY. (Если речь идёт не про бактерий, а про эукариот, то аналогичный транслокационный комплекс будет называться Sec61, и состоять он будет из субъединиц α, β и γ.) Часто транслокация начинается котрансляционно — то есть, «хвостик» белка, только что сошедший с рибосомы и не успевший ещё образовать какой-либо устойчивой структуры, «захватывается» устьем канала SecY и начинает транспортироваться через мембрану клетки или эндоплазматического ретикулума.
Предназначен ли белок для трансмембранной транспортировки, и если да, то через какую мембрану — определяется сигнальным (лидерным) пептидом, который, сослужив свою роль и «указав» место, куда должен быть доставлен белок, отщепляется за ненадобностью. В случае если транспорт белкá осуществляется не параллельно с синтезом, а уже когда экспортируемая молекула «готова», к процессу может подключаться периплазматический «мотор» SecA, «проталкивающий» белóк через канал SecY (при этом затрачивается энергия АТФ).
Кстати, транслокационный комплекс (транслокон) осуществляет не только экспорт белков, но также и доставку их в мембрану клетки. Определить, следует ли белок «выпускать» наружу или интегрировать его в мембрану, помогает уникальная особенность транслокона «чувствовать» гидрофобность проходящих через его канал белковых сегментов [1]. Если транспортируемый участок достаточно длинный (20–30 а/к остатков) и при этом гидрофобный — то, скорее всего, транслокон отреагирует на это, «вытолкнув» его в липидную фазу вместо внеклеточного пространства.
Интерес к молекулярным механизмам работы транслокона объясняет необходимость знания структуры этого комплекса, и если строение отдельных его частей — SecY [2] и SecA [3] — уже достаточно давно изучено, то как всё это устроено в комплексе и каким образом белóк проходит через канал, до недавнего времени оставалось понятным лишь в самых общих чертах. И вот недавно в одном номере Nature вышло сразу три работы [4–6], посвящённые структуре «целующегося» комплекса SecY и SecA, и механизмам их работы. (Шутливый термин «целующийся» обозначает, видимо, что два белковых комплекса, содержащих каналы, через которые проходит белок, соединяются «ртами».)
Трансмембранный канал SecY функционирует в качестве димера, каждая молекула в составе которого выполняет свою функцию: одна собственно транслоцирует белковые цепи, другая «заякоривает» SecA в нужном положении [2]. «Моторы» SecA тоже работают в паре, и каждый из них состоит из четырёх субъединиц — по два на связывание АТФ (между субъединицами) и на формирование «точки приёмки» белкá (последние для наглядности можно изобразить «руками» — см. рисунок 1а).
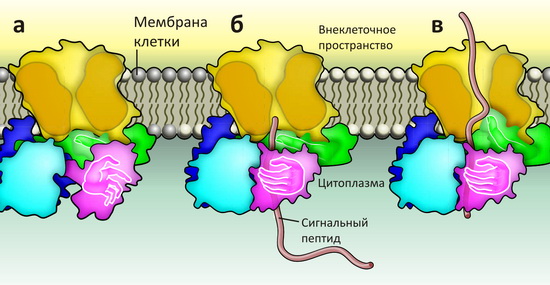
Рисунок 1. Транслокация полипептидной цепи в бактериальных клетках. Трансмембранный канал SecY (жёлтым) присоединяет к своей цитоплазматической стороне «мотор» SecA по схеме «рот в рот» («целующийся» комплекс). «Мотор» состоит из четырёх субъединиц, две из которых связывают АТФ и выполняют энергетическую функцию (синим и голубым), а две другие исполняют роль «точки приёмки» (фиолетовым и зелёным; метафорически изображены в виде рук). а — В «начальной» стадии канал SecY закрыт сужéнием в центральной части и подвижной «крышкой» с внеклеточной стороны (не показана). Субъединица «мотора» SecA, связывающая сигнальный пептид, находится в готовом к «захвату» состоянии. (Это же состояние наблюдается в структуре изолированного SecA [3].) б — Шарнирный поворот этого домена после захвата сигнального пептида переносит его вглубь «точки приёмки» в SecA, в область близкого контакта со второй «рукой». в — При расщеплении АТФ (не показана) конформация «энергетических» субъединиц меняется, и «палец» второй «руки» начинает проталкивать полипептидную цепь через канал, одновременно расширяя его. Схема основана на всех доступных структурных данных [2–6].
Структура комплекса SecY–SecA из бактерии Thermotoga maritima [4], полученная в лаборатории Тома Рапопорта (Tom Rapoport) — профессора медицинского факультета Гарварда и медицинского института имени Ховарда Хьюза, а также автора первой структуры канала SecY [2] — содержит мономеры SecY и SecA, в то время как функциональными единицами являются димеры. Однако даже она даёт много новой информации о механизме взаимодействия этих каналов и способе транслокации. Пóра трансмембранного канала в этой структуре закрыта, а «рука» мотора SecA закрывает полость связывания сигнального пептида (в структуре отсутствует). Чтобы пептид мог связаться, «рука» должна раскрыться, а «палец» второй «руки», прикрывающий устье трансмембранного канала, должен каким-то образом использовать энергию связывания АТФ в «энергетических» субъединицах, чтобы протолкнуть полипептидную цепь в канал.
Чтобы изучить этот процесс, в группе того же Рапопорта провели другое исследование, где модифицированный сигнальный пептид использовался в качестве «молекулярного эндоскопа» для зондирования связывания с «точкой приёмки» в Sec A [5]. Приём этот заключался во введении в сигнальный пептид остатков цистеина и последующем анализе, с каким парным цистеином в транслоконе он образует дисульфидную связь. В результате выяснилось, что в неактивной (закрытой) форме транслокона (без АТФ) N-конец сигнального пептида расположен вблизи кончика «пальца» (рис. 1б), а при добавлении АТФ и запуске работы транслокона пептид постепенно проникает в трансмембранный канал (рис. 1в)! Кроме того, учёные продемонстрировали, что кроме собственно «проталкивания» белковой цепи, «палец» расширяет пору канала, через которую секретируется белок.
Кристаллическая структура белкá, а в особенности такой сложной «машины», как транслокационный канал [4], обладает тем недостатком, что «замораживает» его в какой-то одной конформации, не давая данных обо всех возможных движениях молекулы. Чтобы исправить этот минус, группой японских учёных было проведено ещё одно структурное исследование транслокона [6], которое, возможно, показывает, как устроена его активированная (открытая) конформация.
В этой структуре «мотор» отсутствует; зато присутствует антитело, связывающееся с тем же сайтом на поверхности канала, что и «мотор», и фиксирует его в другой, предположительно — активированной, открытой конформации. При этом часть внутренней поверхности канала оказывается открытой для цитоплазмы, что, возможно, является дополнительным местом связывания сигнального пептида (при котрансляционном транспорте).
Изучение строение мембранных белков, а особенно их комплексов — крайне непростая задача, потому что подобные комплексы часто распадаются, а белки денатурируют при извлечении их из мембран (что необходимо для изучения их организации). Однако для окончательного понимания точнейшего механизма транслокации белковых молекул через мембрану всё же потребуется достичь ещё большего, в частности — получить структуры более высокого разрешения, и уже не мономера SecY–SecA, а димера, связывающего сигнальный пептид и молекулу АТФ; понять, как «мотор» преобразует энергию гидролиза АТФ в механическую работу движения «пальца»; и, в конце концов, изучить динамику этой невероятной молекулярной машины.
Литература
- Tara Hessa, Hyun Kim, Karl Bihlmaier, Carolina Lundin, Jorrit Boekel, et. al.. (2005). Recognition of transmembrane helices by the endoplasmic reticulum translocon. Nature. 433, 377-381;
- Bert van den Berg, William M. Clemons, Ian Collinson, Yorgo Modis, Enno Hartmann, et. al.. (2004). X-ray structure of a protein-conducting channel. Nature. 427, 36-44;
- J. F. Hunt. (2002). Nucleotide Control of Interdomain Interactions in the Conformational Reaction Cycle of SecA. Science. 297, 2018-2026;
- Jochen Zimmer, Yunsun Nam, Tom A. Rapoport. (2008). Structure of a complex of the ATPase SecA and the protein-translocation channel. Nature. 455, 936-943;
- Karl J. Erlandson, Stephanie B. M. Miller, Yunsun Nam, Andrew R. Osborne, Jochen Zimmer, Tom A. Rapoport. (2008). A role for the two-helix finger of the SecA ATPase in protein translocation. Nature. 455, 984-987;
- Tomoya Tsukazaki, Hiroyuki Mori, Shuya Fukai, Ryuichiro Ishitani, Takaharu Mori, et. al.. (2008). Conformational transition of Sec machinery inferred from bacterial SecYE structures. Nature. 455, 988-991;
- Anastassios Economou. (2008). Clamour for a kiss. Nature. 455, 879-880.







