Недоупорядоченные белки
01 декабря 2008
Недоупорядоченные белки
- 4174
- 0
- 5
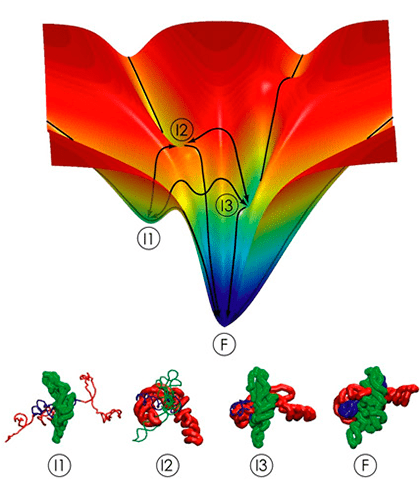
Процесс сворачивания (или фолдинга) биомакромолекул часто описывают с помощью метафоры поверхности свободной энергии, наиболее глубокий «колодец» на которой соответствует нативному (наиболее заселённому) состоянию молекулы. На картинке — схема фолдинга молекулы РНК L–21
сайт wadsworth.org
-
Автор
-
Редакторы
Одна из основных догм структурной биофизики гласит, что строение молекулы определяет её функцию, подразумевая тем самым наличие чётко заданной пространственной структуры. Для большинства белков, организация и функции которых хорошо изучены, — таких, как «классические» ферменты, — хорошо известно, как именно должны быть расположены те или иные фрагменты белковой молекулы, чтобы она выполняла свою функцию. Однако в последнее время было открыто довольно много белков, структура которых не столь чётко задана, — которые, выражаясь в терминах физики белка, пребывают в состоянии расплавленной глобулы, вообще не имея «плотно упакованного» состояния и обладая аномально высокой подвижностью. И, что самое интересное, такие белки, тем не менее, выполняют важные функции, и некоторые особенности такой их «несовершенной» организации, возможно, играют особенную роль в таких биологических процессах как регуляция транскрипции и передача сигналов.
В течение уже, по крайней мере, века, умы биохимиков и молекулярных биологов заняты загадкой ферментативного катализа, а в особенности самой главной его чертой — способностью к невероятному ускорению практически любой биологически важной химической реакции. Современное представление о механизме ферментативного катализа основывается на идее Лайнуса Полинга о том, что фермент имеет сродство к переходному состоянию реакции (существующему очень короткое время), снижая тем самым энергетический барьер для данного превращения. Обычно, говоря о белковом катализе, исходят из представления о практически статичном активном сайте фермента, «вылепленном» эволюцией для идеального соответствия (пространственного и электростатического) структуре переходного состояния. Впрочем, недавно в экспериментах по ЯМР-спектроскопии было наглядно продемонстрировано, что активные сайты обладают динамической подвижностью, и что характерные времена этих движений тесно связаны с временами соответствующей ферментативной реакции [1]. И хоть само по себе открытие динамической подвижности не сотрясает основ структурной биологии (центральная догма — «структура определяет функцию»), в качестве такого «сотрясения» можно выделить открытие того, что от 1/6 до 1/3 эукариотических белков не имеют чётко заданной структуры — они либо слабо упорядочены, либо содержат довольно большие неупорядоченные области [2]. Классификация слабо упорядоченных белков показала, что они принимают участие во многих регуляторных процессах, связанных с транскрипцией и передачей сигналов.
(Кстати, открытие «не до конца свёрнутых» белков — уже не первое событие, претендующее на то, чтобы расширить традиционные представления о фолдинге: недавно показано, что белок лимфотактин имеет сразу две нативные структуры, выполняющие каждая свою функцию [3], а путём введения мутаций в изначально негомологичные белки можно добиться идентичности последовательностей 90–95%, сохранив, тем не менее, первоначальные упаковку и биохимические свойства [4].)
Эксперименты по определению строения «не до конца свёрнутых» белков показали, что они находятся в состоянии «расплавленной глобулы» [5], — то есть в форме, традиционно считающейся промежуточной на пути к нативной, «плотно упакованной», структуре. И, тем не менее, такие белки, для которых характерна аномально высокая подвижность главной цепи, обладают ферментативной активностью [6] (!), что было довольно-таки непросто объяснить, учитывая, что чётко заданной структуры у них просто-напросто нет. Фермент, для которого были проведены эти исследования, называется хоризматмутазой — это катализатор превращения хоризмовой кислоты (важного метаболита растений и микроорганизмов) в префеновою кислоту (промежуточное соединение в биосинтезе ароматических аминокислот). Фермент выделен из бактерии Methanococcus jannaschii. Точнее, свойствами расплавленной глобулы обладает не сама хоризматмутаза (существующая в виде стабильного димера), а её генно-инженерный мономерный вариант (mMjCM), сохраняющий те же биохимические свойства, что и димер, но обладающий при этом очень высокой подвижностью главной цепи молекулы [6] (рис. 1а, б). Нужно добавить, что в несвязанном с лигандом состоянии определить структуру mMjCM вообще не удаётся из-за очень высокой подвижности. Но если в раствор добавить специальную молекулу — аналог переходного состояния реакции, — с которой фермент связывается, но не может расщепить, это приводит к некоторой стабилизации молекулы и позволяет изучить её структуру и подвижность с помощью методики ЯМР-спектроскопии [6].
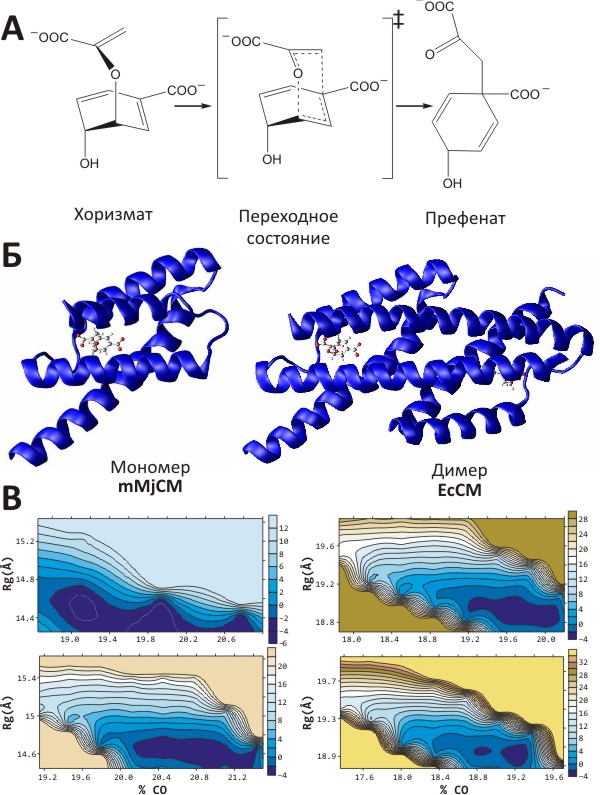
Рисунок 1. Исследование энергетического ландшафта мономерного варианта хоризматмутазы. А. Химическая реакция, катализируемая харизматмутазой Methanococcus jannaschii. Согласно представлению о ферментативном катализе, переходное состояние реакции обладает сродством к ферменту, её катализирующему. Б. Нативная форма хоризматмутазы представляет слитый димер (справа; структура фермента E. coli), однако с помощью генно-инженерных модификаций его можно превратить в мономер, функционирующий в состоянии расплавленной глобулы [6] (слева; структура фермента M. jannaschii). В обоих случаях в активном сайте находится молекула аналога переходного состояния (АПС). В. Упрощённый энергетический ландшафт, рассчитанный для обоих ферментов в присутствии (снизу) или отсутствии АПС (сверху) с помощью метода молекулярной динамики [7]. Хорошо заметна бóльшая протяжённость области низкой энергии (показана тёмно-синим) для мономера (mMjCM) по сравнению с димером (EcCM), что согласуется с данными о высокой конформационной подвижности mMjCM (вверху слева). При связывании с АПС (снизу) размер низкоэнергетических областей сокращается для обоих ферментов, но в случае mMjCM — особенно выраженно (внизу слева).
В качестве «пространственных» координат выступают радиус гирации молекулы (Rg) и порядок внутримолекулярных контактов (% CO); соответствующие значения энергии показаны с помощью изолиний. Шкалы (в ккал/моль) даны справа от карт.
Объяснить (пока, видимо, только предварительно) наличие ферментативной активности у белкá, не обладающего фиксированной трёхмерной структурой, удалось с помощью компьютерных расчётов, позволяющих получить упрощённый вариант гиперповерхности потенциальной энергии молекулы и понять некоторые особенности её функционирования [7]. Получавшиеся в таких расчетах энергетические поверхности были уже не «гипер», а «обычными», то есть описывались всего тремя измерениями — по сравнению с астрономическим числом координат, необходимых для характеристики «честной» гиперповерхности (рис. 1в). На основании анализа молекулярной динамики димерной и мономерной (mMjCM) форм хоризматмутазы в присутствии и отсутствии аналога переходного состояния (АПС), учёные построили характерные для этих систем упрощённые энергетические карты и сделали интересные наблюдения:
- во-первых, низкоэнергетическая область для мономера значительно более обширна (вытянута вдоль оси абсцисс на рисунке 1в), что хорошо согласуется с тем фактом, что mMjCM существует в виде расплавленной глобулы и, следовательно, может в широких пределах варьировать свою структуру. Для нативной же формы такой возможности нет: «колодец» потенциальной энергии, определяющий характеристики нативного состояния, имеет достаточно крутые «стенки» и небольшую площадь, — что обозначает чётко определённую и стабильную трёхмерную структуру;
- во-вторых, при связывании лиганда — АПС катализируемой реакции — в случае обоих ферментов низкоэнергетический «колодец» сужается, свидетельствуя о стабилизации молекулы. И, опять же, в соответствии с экспериментом, этот эффект намного более выражен в случае мономера: если в отсутствие лиганда он не обладает вообще никакой стабильной структурой, то при связывании АПС достигается определённая стабилизация.
Каким же образом хаотически свёрнутому белку, не обладающему чётко заданной трёхмерной структурой, удаётся выполнять вполне конкретные биологические функции? Одним из возможных объяснений является стабилизация неупорядоченной белковой цепи при взаимодействии со специфической мишенью или лигандом [8], — то есть, мы имеем дело с фолдингом, происходящим одновременно со связыванием с другой молекулой. Расчёты подтверждают, что такое специфическое взаимодействие способно вызвать образование устойчивых структурных элементов в практически хаотической (до связывания) структуре (рис. 1в).
В отличие от «классического» примера глобулярных белков, на которых были выработаны современные представления о фолдинге биополимеров (сильно изрезанная энергетическая гиперповерхность с одним чётко выраженным глубоким «колодцем», соответствующим нативному состоянию (рис. 2, слева)), энергетический ландшафт слабо упорядоченных белков выглядит по-другому. Для таких белков «колодец» не очень «глубокий», но зато достаточно «широкий», что и определяет динамические свойства молекулы (рис. 2, в центре). «Углубить» этот «колодец» (и вызвать образование стабильной нативной структуры) могут специфические межмолекулярные взаимодействия, такие как взаимодействие с лигандом в случае мономерной формы хоризматмутазы. Однако остаётся ещё одна проблема: такой процесс неизбежно будет связан с уменьшением энтропии по мере того, как хаотически устроенная цепь белка будет сворачиваться в нативную форму с участием другой молекулы, — а это невыгодно с термодинамической точки зрения. Так что же привело к появлению таких невыгодных форм существования белковых молекул?
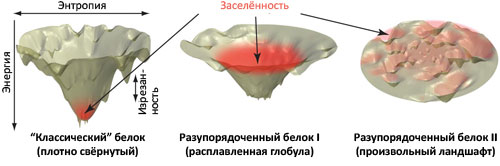
Рисунок 2. Взаимосвязь между фолдингом белкá и профилем поверхности свободной энергии. Слева: схема энергетического ландшафта «классического» глобулярного белкá, имеющего один ярко выраженный «колодец» на энергетической поверхности, где находится нативная конформация, соответствующая в данном случае глобальному термодинамическому минимуму свободной энергии и доступная с позиций кинетики фолдинга. Подобные схемы подразумевают разделение свободной энергии системы на структурную энтропию белкá (по горизонтальной оси) и эффективную энергию (или просто энергию). Последняя, впрочем, тоже содержит энтропийное слагаемое, но оно относится уже не к белку, а к растворителю. В центре: энергетические ландшафты слабо упорядоченных белков характеризуются меньшей изрезанностью, малой «глубиной» и большей «шириной» энергетического «колодца» [2]. Возникающая при этом сила, управляющая сворачиванием молекулы, достаточно слаба, и белок может оставаться разупорядоченным. Однако специфические взаимодействия с другими молекулами (белкáми, лигандами) могут способствовать образованию дополнительных контактов, углубляющих энергетический «колодец» и вызывающих одновременное со связыванием сворачивание [2], [6]. Справа: произвольно организованный энергетический ландшафт, для которого «поиск» каталитической конформации занял бы неопределённо большое время. Красным цветом на всех трёх схемах показана «заселённость» различных областей конфигурационного пространства.
На этот счёт существует несколько гипотез относительно преимуществ, которыми обладают слабо упорядоченные белки, например — более быстрая или специфическая кинетика реакции или разнообразие выполняемых функций [8] — способность взаимодействовать более чем с одной мишенью и/или связывать более одного лиганда. Однако предсказать или экспериментально определить, какой же именно функцией обладает слабо упорядоченный белок, очень сложно: динамика расплавленной глобулы, фактически, «размазывает» функциональную конформацию белка среди обширного ансамбля произвольных структур.
Может ли расплавленная глобула катализировать ферментативную реакцию? Ответ на этот вопрос положителен ([6] и рисунок 1). Однако может ли белок с произвольным образом организованным энергетическим ландшафтом также осуществлять катализ? Это уже вряд ли: в этом случае белку потребовалось бы астрономически большое время, чтобы случайно принять конформацию, способную катализировать превращение (см. рис. 2, справа). Тут возникает аналогия с парадоксом Левинталя (см. «Торжество компьютерных методов: предсказание строения белков» [10]), но этот парадокс уже не кажущийся: ведь в этом случае отсутствуют выделенные направления на поверхности потенциальной энергии, которые как раз и обеспечивают выход из парадокса Левинталя.
Из этих рассуждений следует, что в слабо упорядоченных белкáх всё-таки важна именно упорядоченность, а точнее — профиль энергетического ландшафта, отличающийся от поверхности произвольного рельефа наличием области низкой энергии, пусть и значительно менее выраженной, чем в случае плотно упакованных белков. Достижение каталитической конформации будет дополнительно «стоить» «не до конца свёрнутым» белкáм сопутствующего этому снижения энтропии, и катализ с участием таких ферментов, при прочих равных, будет менее эффективным. Среди возможных преимуществ слабо упорядоченных белков в качестве ферментов или регуляторов можно в дополнение к уже названному добавить их меньшую стабильность (т. е., более быструю деградацию на протеасомах), что может быть плюсом, если требуется очень короткий «всплеск» определённой активности.
Похоже, что эти странные, слабо упорядоченные белковые молекулы могут играть важную роль в регуляции клеточных процессов. И чтобы более пóлно понять их функции и механизмы, по которым они осуществляют катализ и другие процессы, потребуется ещё много лабораторных и компьютерных экспериментов.
Статья написана по материалам журнала PNAS [9].
Литература
- Katherine A. Henzler-Wildman, Ming Lei, Vu Thai, S. Jordan Kerns, Martin Karplus, Dorothee Kern. (2007). A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450, 913-916;
- Garegin A. Papoian, Peter G. Wolynes. (2003). The physics and bioinformatics of binding and folding?an energy landscape perspective. Biopolymers. 68, 333-349;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Непохожие «гомологичные» белки;
- Финкельштейн А.В. Введение в физику белкá. Лекция 17;
- Konstantin Pervushin, Katherina Vamvaca, Beat Vögeli, Donald Hilvert. (2007). Structure and dynamics of a molten globular enzyme. Nat Struct Mol Biol. 14, 1202-1206;
- M. Roca, B. Messer, D. Hilvert, A. Warshel. (2008). On the relationship between folding and chemical landscapes in enzyme catalysis. Proceedings of the National Academy of Sciences. 105, 13877-13882;
- H.Jane Dyson, Peter E Wright. (2002). Coupling of folding and binding for unstructured proteins. Current Opinion in Structural Biology. 12, 54-60;
- G. A. Papoian. (2008). Proteins with weakly funneled energy landscapes challenge the classical structure-function paradigm. Proceedings of the National Academy of Sciences. 105, 14237-14238;
- Торжество компьютерных методов: предсказание строения белков.