Рецептор для сперматозоида
06 декабря 2008
Рецептор для сперматозоида
- 1582
- 0
- 5
Дробление зиготы — одна из распространённых метафор развития и начала новой жизни
заставка к анимационному фильму «Призрак в доспехах: Невинность»
-
Автор
-
Редакторы
Новая жизнь начинается с оплодотворения — слияния мужской и женской половых клеток. Это слияние происходит не само собой: ооцит покрывает гликопротеиновый слой, называемый zona pellucida, который не только «захватывает» сперматозоид, но и предотвращает множественные слияния, а также межвидовое оплодотворение. Учёные из Стокгольма определили пространственное строение консервативного домена одного из белков, образующих филаменты zona pellucida, — ZP3, служащего рецептором для «захвата» сперматозоида. Эти данные, впервые позволившие на молекулярном уровне взглянуть на строение оболочки яйцеклетки, могут быть использованы в репродуктивной медицине, а также дать ключ к пониманию многих болезней, связанных с внеклеточными белкáми, также содержащих домен ZP-N.
Яйцеклетка млекопитающих покрыта довольно толстым слоем гликопротеинов (zona pellucida), образующих сложную сеть филаментов, служащую для «захвата» сперматозоида и слияния его мембраны с мембраной яйцеклетки (рис. 1). У мыши эта оболочка состоит из трёх белков, называемых ZP1, ZP2 и ZP3 (как акроним от латинского названия оболочки яйцеклетки), два последних из которых отвечают за рецепцию сперматозоида в процессе оплодотворения. Каждый из этих белков, а также родственные белки амфибий, рептилий, рыб и птиц, содержит консервативный ZP-домен, встречающийся, кроме того, в сотнях внеклеточных белков (не связанных с оплодотворением) практически всех многоклеточных организмов. Мутации в ZP-домене приводят к бесплодию или тяжёлым врождённым порокам.
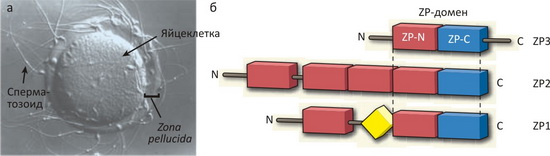
Рисунок 1. Белки оболочки яйцеклетки мыши. а — Яйцеклетка и сперматозоид мыши в процессе оплодотворения. б — Zona pellucida ооцита мыши состоит из трёх белков: ZP1, ZP2 и ZP3. Каждый из этих белков содержит ZP-домен, состоящий из одного или нескольких ZP-N поддоменов (красные) и ZP-C поддомена (синий). Кроме того, в ZP1 содержится трилистниковый (trefoil) домен (жёлтый). Учёные из Медицинского университета в Швеции докладывают о расшифровке структуры ZP-N домена ZP3 [1].
Эти белки отличаются способностью к спонтанной полимеризации (что и позволяет им образовывать оболочку клетки), и подвергаются посттрансляционным модификациям (таким как множественное гликозилирование). Из-за такого сложного устройства долгое время никому не удавалось получить структуру ни одного из этих белков, но теперь исследователи из Медицинского университета в Швеции (Karolinska Institutet) сообщают о том, что они «решили» структуру консервативного ZP-N домена белкá ZP3 мыши [1].
Домен размером около 260 аминокислотных остатков содержит четыре консервативных дисульфидных мостика и состоит из восьми β-тяжей, уложенных в два слоя наподобие «сэндвича» (рис. 2). Хотя структура ZP-N домена напоминает иммуноглобулиновый тип укладки (фолд), гомологии эти белки не имеют и в целом слишком сильно различаются, чтобы можно было утверждать, что ZP-N представляет собой новый тип фолда, и что из-за этого его структура не могла быть предсказана на основе гомологии с каким-либо другим белком. (См.: «Торжество компьютерных методов: предсказание строения белков» [3].)
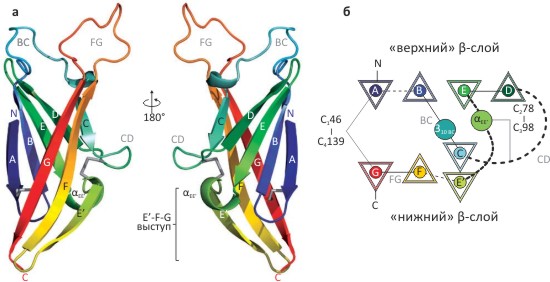
Рисунок 2. Структура ZP-N домена мышиного ZP3. а — Общий мотив трёхмерной укладки, напоминающий иммуноглобулиновый фолд. Образующие структуру β-тяжи пронумерованы (A-E, E’, F и G), консервативные дисульфидные связи показаны серым. б — Схема топологии белкá. β-тяжи показаны треугольниками, две присутствующие в структуре короткие α-спирали — кругами.
Несмотря на все различия с иммуноглобулиновым фолдом, домен ZP-N, как и иммуноглобулины, участвует в межмолекулярных взаимодействиях: учёные идентифицировали два консервативных остатка тирозина, отвечающих за полимеризацию белков, содержащих ZP-домен. Способность белков ZP к полимеризации является ключевой для образования zona pellucida: ZP3 и ZP2 формируют длинные фибриллы, соединяющиеся между собой при помощи ZP1.
Было обнаружено, что только белки, напрямую участвующие в процессе оплодотворения, могут содержать несколько копий ZP-N домена (рис. 1б). Шведские учёные предлагают также модель строения ZP2, согласно которой последовательные домены образуют «столбики», взаимодействию между которыми приписывают компактизацию и деградацию оболочки ооцита после оплодотворения, что предотвращает множественные слияния яйцеклетки со сперматозоидами. Кроме того, обнаружилось, что копии ZP-N белка ZP2 необычайно сильно отличаются по последовательности даже в очень близких видах, и этому открытию приписывают роль половой специализации, предотвращающей возможность межвидовых скрещиваний.
Точный механизм связывания сперматозоида с белкáми ZP3 и ZP2, а также причина видовой специализации яйцеклетка–сперматозоид пока не понятны, но существует предположение, что первичное связывание осуществляет ZP3, а последующее «закрепление» идёт с участием ZP2 и его повторяющихся ZP-N доменов. Чтобы понять всё это лучше, как всегда, требуются дополнительные исследования: только будущие структуры целого ZP-домена разных белков позволят окончательно разобраться в деталях.
По материалам рубрики News & Views Nature [2].
Литература
- Magnus Monné, Ling Han, Thomas Schwend, Sofia Burendahl, Luca Jovine. (2008). Crystal structure of the ZP-N domain of ZP3 reveals the core fold of animal egg coats. Nature. 456, 653-657;
- Paul M. Wassarman. (2008). Welcome to the fold. Nature. 456, 586-587;
- Торжество компьютерных методов: предсказание строения белков.