
Великому комбинатору и не снилось: комбинаторика токсинов пауков
23 мая 2009
Великому комбинатору и не снилось: комбинаторика токсинов пауков
- 3224
- 2
- 3
Паук аргиопа дольчатая (Argiope lobata) распространён почти во всех странах Азии, и, из-за необычной формы тельца и красивой окраски, является излюбленным объектом многих фотографов-натуралистов. Часто аргиопа украшает свою сеть отчётливыми зигзагами.
-
Автор
-
Редакторы
В настоящее время о ядах змей, скорпионов, пауков, морских моллюсков и анемон сложилось представление как о комбинаторных библиотеках биологически активных соединений, редактируемых в ходе эволюции этих животных. В очерке рассказывается о подобных «библиотеках», созданных пауками.
Некоторые группы животных разнообразного систематического положения — например, змеи (тип Vertebrata), пауки и скорпионы (Arthropoda), моллюски конусы (Mollusca) и морские анемоны (Cnidaria) — в ходе эволюции приобрели ядовитый аппарат. У более организованных форм он состоит из ядовитых желёз и специализированных органов, позволяющих впрыскивать секрет желёз (яд) в тело жертвы или обидчика. Яды животных — источник уникальных по специфичности и эффективности действия молекул (токсинов), влияющих на различные физиологические процессы в организме жертвы или агрессора. Часто мишенью действия этих компонентов служат рецепторы в нервной системе (главным образом ионотропные), а сами компоненты в таких случаях называют нейротоксинами. Например, так называемые α-нейротоксины из яда многих змей конкурентно блокируют никотиновые ацетилхолиновые рецепторы, препятствуя тем самым передаче сигнала в холинэргических синапсах (в том числе и в нервно-мышечных контактах) [1]. Латротоксины, содержащиеся в яде пауков чёрной вдовы или каракурта, вызывают истощающий выброс нейромедиаторов из нервных окончаний вследствие распознавания ряда специальных белков-рецепторов и последующего формирования пор в мембранах нейронов, что в итоге приводит к блокированию передачи нервного импульса [2]. Стоит отметить, что приоритет в исследованиях этих токсинов принадлежит Институту биоорганической химии РАН. Помимо возможности создания эффективных противоядий, исследования природных ядов представляют большой интерес с фундаментальной точки зрения. Нейротоксины — точные и, пожалуй, незаменимые инструменты исследования соответствующих рецепторов — компонентов нервной системы. Например, высокоспецифичные блокаторы кальциевых каналов из ядов морских моллюсков и пауков позволили охарактеризовать различные типы этих каналов, ответственных за регуляцию выброса нейромедиаторов из нервных окончаний [3], а чувствительность к тетродотоксину из рыбы фугу стала главным свойством, используемым для структурных и функциональных исследований натриевых каналов — важнейших белков, обусловливающих проведение нервных импульсов [4].
Оказывается, что компонентный состав природных ядов чрезвычайно разнообразен. Медоносная пчела, к примеру, «полагается» на сравнительно небольшое число токсинов: это, прежде всего, мембраноактивный пептид мелиттин и гидролизующий липиды фермент фосфолипаза A2, вместе составляющие бóльшую часть яда и обусловливающие его токсичность, основанную на разрушении клеточных мембран (цитолизе) [5], [6]. Многие другие животные, как те, что перечислены в самом начале статьи, используют более сложные по составу яды, содержащие от нескольких десятков до сотен и даже свыше тысячи различных компонентов разнообразной химической природы — от солей до больших многодоменных белков. Например, в случае яда пауков (их яд, похоже, отличается наибольшим молекулярным разнообразием) это могут быть соли, сахара, карбоновые и аминокислоты, нуклеотиды, биогенные амины, полиамины, линейные и дисульфид-содержащие пептиды, белки и т. д. При этом, как правило, один-два структурных типа соединений являются наиболее представленными; очень часто, хотя и не всегда, основную часть яда занимают вещества полипептидной природы (пептиды и белки) [7–10].
Наблюдаемое в ядах разнообразие компонентов одного структурного типа сегодня принято описывать термином «эволюционно отредактированная комбинаторная библиотека» биологически активных молекул [11–18]. Её отличие от комбинаторных библиотек веществ, получаемых химиками-синтетиками, заключается в «эволюционной редактуре»: по-видимому, среди всего возможного разнообразия вариантов в ходе эволюции отбираются наиболее эффективные. Для иллюстрации сказанного, остановимся далее на конкретных примерах.
Пауки из семейств кругопрядов (Araneidae), нефиловых (Nephilidae) и агеленовых воронковых (Agelenidae) пауков производят разнообразные нейротоксины из класса ацилполиаминов (или просто полиаминов). Биологическая функция этих токсинов состоит в нарушении нервно-мышечной передачи (а, следовательно, параличе) у членистоногих в результате блокирования глутаматных рецепторов в мышечных клетках [19], [20]. (У членистоногих нейромедиатором, служащим для передачи сигнала от нейронов к мышцам, является глутамат, в отличие от позвоночных, где эту функцию выполняет ацетилхолин.) Структура ацилполиаминных токсинов состоит из нескольких «модулей»; её основой является полиаминная цепь. В яде одного паука одновременно может присутствовать сразу несколько различных ацилполиаминов, различающихся модификациями, вводимыми в стандартный остов молекулы (рис. 1). Например, ещё в ходе пионерских исследований 1980-х гг., проведённых в Институте биоорганической химии, с помощью спектроскопии ядерного магнитного резонанса и масс-спектрометрии была установлена структура аргиопина из яда паука Argiope lobata (Araneidae) — первого соединения из этого класса, и обнаружены восемь других антагонистов глутаматных рецепторов — аргиопининов и псевдоаргиопининов, обладающих сходным механизмом действия, но имеющих разную эффективность взаимодействия с глутаматными рецепторами [21–23]. В более поздних работах было показано, что яде Agelenopsis aperta (Agelenidae), к примеру, содержатся свыше 30 различных ацилполиаминов (α-агатоксинов), структура которых была установлена масс-спектрометрически [24]. Пауки как будто бы следуют принципам комбинаторной химии: получаемые молекулы обладают различной эффективностью и специфичностью в отношении разных рецепторов, а результирующая смесь токсинов эффективна в отношении широкого круга мишеней. Для сравнения отметим, что некоторые насекомые синтезируют комбинаторные библиотеки макроциклических полиаминов в защитных целях [25].
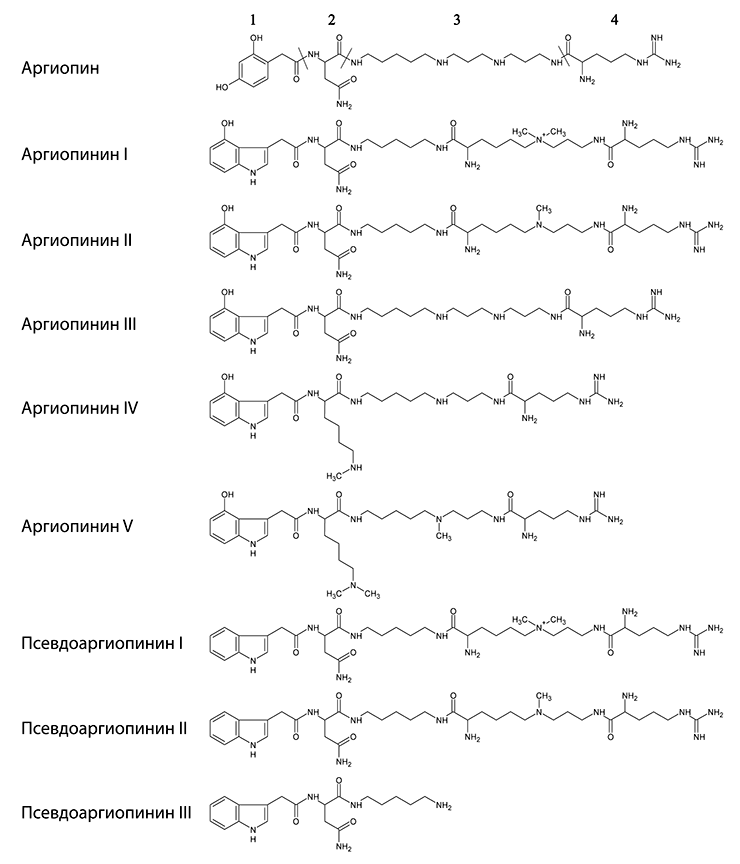
Рисунок 1. Комбинаторика ацилполиаминных токсинов в яде паука (на примере Argiope lobata). Структурной основой ацилполиаминов является полиаминная цепь, которая имеет первичную, четвертичную амино-, или гуанидиновую группу или остаток аргинина на одном конце молекулы, и в подавляющем большинстве случаев ароматическую группировку, соединённую с полиамином через аминокислотный остаток либо непосредственно при помощи амидной связи, — с другой стороны. В молекулы могут вводиться и другие модификации. На рисунке приведены структурные формулы ацилполиаминов из яда Argiope lobata, слева указаны соответствующие названия. В структуре аргиопина отмечены «модули»: 1 — ацильный радикал, 2 — промежуточная группа (аминокислотный остаток), 3 — полиаминная цепь, 4 — концевая группа (остаток аргинина).
Большинство изученных пауков производят яд с преобладанием дисульфид-содержащих пептидных нейротоксинов. Многие из этих веществ, в свою очередь, характеризуются общим цистеиновым мотивом первичной структуры и относятся к т. н. «ноттинам» (от англ. knottins) — пептидным молекулам, формирующим в пространстве укладку типа «цистинового узла» (англ. cystine knot): C1–X3–7–C2–X3–8–C3–X0–7–C4–X1–4–C5–X4–13–C6, где C — остаток цистеина, а Х — любой аминокислотный остаток [26], [27]. На основании сходства последовательностей всё многообразие ноттинов в яде разделяют на семейства. На рисунке 2а приведены последовательности представителей различных семейств ноттинов из яда тарантула Chilobrachys jingzhao (Theraphosidae) [28]. Видно, что в ряде случаев между последовательностями отсутствует сходство за исключением расположения остатков цистеина. На рисунке 2б, напротив, приводятся последовательности представителей одного семейства токсинов из яда Agelena orientalis (Agelenidae) [29]. Хорошо заметно, что реализуется своеобразный перебор остатков, заключённых между инвариантными остатками цистеина. Расположение дисульфидных связей для всех молекул этого типа следующее: C1–C4, C2–C5, C3–C6. Пространственная структура ноттинов характеризуется наличием β-шпильки и своеобразного «узла» (отсюда их название): третья по счёту дисульфидная связь (C3–C6) пронизывает кольцо, образованное двумя другими дисульфидами и атомами основной цепи, их соединяющими (рис. 3). В одном яде могут присутствовать до нескольких сотен родственных молекул ноттинов со сходной пространственной структурой, стабилизированной инвариантными остатками полуцистина. Специфичность действия каждой молекулы определяется уникальной комбинацией вариабельных аминокислотных остатков, расположенных в петлевых участках между дисульфидными мостами. Например, JzTx–I является ингибитором инактивации потенциал-зависимых натриевых каналов, действуя аналогично некоторым «классическим» токсинам скорпионов (в их яде, как правило, содержатся три основных типа токсинов: блокаторы калиевых каналов и модуляторы натриевых каналов, приводящие к ингибированию инактивации и облегчению активации последних; действие этих токсинов приводит к спонтанной активации нейронов и, как следствие, к судорогам и «возбуждающему» параличу [30]), а JzTx–III, JzTx–V и JzTx–XI ингибируют некоторые потенциал-зависимые натриевые и калиевые каналы. Аналогично ацилполиаминным токсинам, смесь молекул различной специфичности обеспечивает действие яда на широкий круг мишеней. Отметим, что похожие «библиотеки» полипептидных компонентов встречаются в ядах других животных, однако в этих случаях характерны другие мотивы аминокислотной последовательности и реализуются иные типы пространственной укладки молекул.

Рисунок 2. Комбинаторика дисульфид-содержащих пептидов в яде паука (на примере Chilobrachys jingzhao и Agelena orientalis). Аминокислотные последовательности пептидных токсинов, относящихся к различным (а, пептиды из яда тарантула Chilobrachys jingzhao) и одному и тому же (б, пептиды из яда воронкового паука Agelena orientalis) семейству. Остатки цистеина и соответствующие дисульфидные связи образуют так называемые цистиновые узлы (рис. 3). На панели б отдельно отмечены остатки, отличающиеся от общего мотива, в то время как на а (токсины различных семейств) кроме цистеинов совпадающих остатков почти нет.
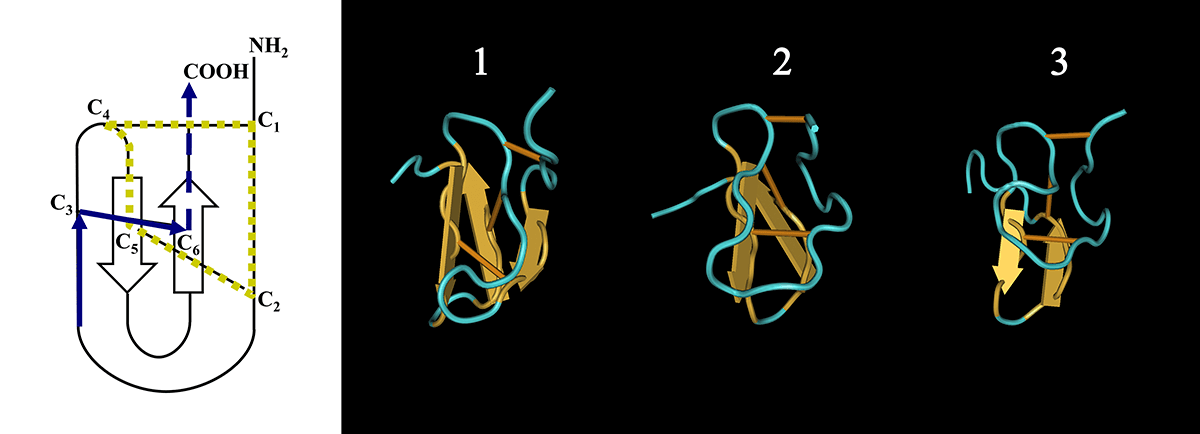
Рисунок 3. Структура дисульфид-содержащих пептидов в яде паука (на примере Chilobrachys jingzhao). Слева приведена топологическая диаграмма укладки «цистинового узла». Отмечены N- и C-концевые области молекулы, консервативные остатки полуцистина и дисульфидные связи. Показаны воображаемые элементы «узла»: кольцо и «продеваемая» дисульфидная связь. Справа показаны модели пространственной структуры пептидов из яда паука Chilobrachys jingzhao: JzTx–III (1), JzTx–VII (2) и JzTx–XI (3) (соответствующие аминокислотные последовательности приведены на рис. 2).
Результатом комбинаторики и разнообразия компонентов яда служит то, что исследователи имеют дело, по сути, с громадной природной фармакопеей. Простой расчёт, учитывающий 40 тыс. известных сегодня видов пауков и среднее значение в 2–3 сотни разных молекул на яд, приводит к результату в ~10 млн. биологически активных соединений. Такое многообразие позволяет думать, что к практически любому наперёд заданному ионотропному рецептору нервной системы в ходе скрининга природных ядов удастся подобрать взаимодействующий с ним токсин. Этот подход был с успехом реализован, например, при поиске лигандов для кислоточувствительных каналов (ASICs, от англ. acid-sensing ion channels) [31] и ваниллоидных рецепторов TRPV1 (transient receptor potential vanilloid receptor subtype 1) [32], [33]. ASICs активируются при закислении внеклеточной среды и служат, таким образом, физиологическими сенсорами pH [34]. TRPV1 являются сенсорами высокой температуры (они активируются также капсаицином — компонентом красного перца, и именно потому при добавлении его в пищу чувствуется жжение) [35]. (Подробнее об этом мы уже писали в заметке «Жгучий перец облегчит боль» [36], а о другом ваниллоидном рецепторе, отвечающем за восприятие холода, рассказывается в статье «„Мятный холодок“: почему ментол создаёт ощущение прохлады во рту» [37].) Оба типа рецепторов (ASICs и TRPV1) — ключевые компоненты системы восприятия боли, а их модуляторы, по-видимому, станут новым поколением анальгетиков.
В заключение стоит отметить, что механизм формирования молекулярного разнообразия природных ядов в настоящее время исследован недостаточно. Как происходит биосинтез ацилполиаминных токсинов? Как возникли и эволюционировали пептидные нейротоксины с разным типом укладок? Каким образом вносятся множественные замены в петлевые участки пептидных молекул и при этом не затрагиваются остатки цистеина? На эти и другие вопросы ещё предстоит ответить.
Литература
- V.I Tsetlin, F Hucho. (2004). Snake and snail toxins acting on nicotinic acetylcholine receptors: fundamental aspects and medical applications. FEBS Letters. 557, 9-13;
- E.V. Grishin. (1998). Black widow spider toxins: the present and the future. Toxicon. 36, 1693-1701;
- B M Olivera, G P Miljanich, J Ramachandran, M E Adams. (1994). Calcium Channel Diversity and Neurotransmitter Release: The ω-Conotoxins and ω-Agatoxins. Annu. Rev. Biochem.. 63, 823-867;
- Toshio NARAHASHI. (2008). Tetrodotoxin. Proc. Jpn. Acad., Ser. B. 84, 147-154;
- E. Habermann. (1972). Bee and Wasp Venoms. Science. 177, 314-322;
- Justin O. Schmidt. (1995). Toxinology of venoms from the honeybee genus Apis. Toxicon. 33, 917-927;
- Eugene Grishin. (1999). Polypeptide neurotoxins from spider venoms. Eur J Biochem. 264, 276-280;
- G. Corzo, P. Escoubas. (2003). Pharmacologically active spider peptide toxins. Cellular and Molecular Life Sciences (CMLS). 60, 2409-2426;
- Lachlan D. Rash, Wayne C. Hodgson. (2002). Pharmacology and biochemistry of spider venoms. Toxicon. 40, 225-254;
- Georgina Estrada, Elba Villegas, Gerardo Corzo. (2007). Spider venoms: a rich source of acylpolyamines and peptides as new leads for CNS drugs. Nat. Prod. Rep.. 24, 145-161;
- P. Escoubas, L. Quinton, G. M. Nicholson. (2008). Venomics: unravelling the complexity of animal venoms with mass spectrometry. J. Mass Spectrom.. 43, 279-295;
- Pierre Escoubas. (2006). Molecular diversification in spider venoms: A web of combinatorial peptide libraries. Mol Divers. 10, 545-554;
- Pierre Escoubas, Lachlan Rash. (2004). Tarantulas: eight-legged pharmacists and combinatorial chemists. Toxicon. 43, 555-574;
- Brianna L. Sollod, David Wilson, Olga Zhaxybayeva, J. Peter Gogarten, Roger Drinkwater, Glenn F. King. (2005). Were arachnids the first to use combinatorial peptide libraries?. Peptides. 26, 131-139;
- Baldomero M. Olivera, David R. Hillyard, Maren Marsh, Doju Yoshikami. (1995). Combinatorial peptide libraries in drug design: lessons from venomous cone snails. Trends in Biotechnology. 13, 422-426;
- Silvestro G. Conticello, Yoav Gilad, Nili Avidan, Edna Ben-Asher, Zehava Levy, Mike Fainzilber. (2001). Mechanisms for Evolving Hypervariability: The Case of Conopeptides. Molecular Biology and Evolution. 18, 120-131;
- B. G. Fry. (2004). Assembling an Arsenal: Origin and Evolution of the Snake Venom Proteome Inferred from Phylogenetic Analysis of Toxin Sequences. Molecular Biology and Evolution. 21, 870-883;
- Bryan G. Fry, Holger Scheib, Louise van der Weerd, Bruce Young, Judith McNaughtan, et. al.. (2008). Evolution of an Arsenal. Mol Cell Proteomics. 7, 215-246;
- Ian R. Mellor, Peter N.R. Usherwood. (2004). Targeting ionotropic receptors with polyamine-containing toxins☆. Toxicon. 43, 493-508;
- Рогоза Л.Н., Салахутдинов Н.Ф., Толстиков Г.А. (2006). Алкалоиды животного происхождения — производные полиметиленаминов. II. Полиаминные нейротоксины. «Биоорган. химия». 32, 27–41;
- Гришин Е.В., Волкова Т.М., Арсеньев А.С., Решетова О.С., Оноприенко В.В., Магазаник Л.Г., Антонов С.М. (1986). Структурно-функциональная характеристика аргиопина — блокатора ионных каналов из яда паука Argiope lobata. «Биоорган. химия». 8, 1121–1124;
- Grishin E.V., Volkova T.M., Arseniev A.S. (1989). New antagonists of glutamate receptors. J. Protein Chem. 8, 320–322;
- Grishin E.V., Volkova T.M., Arseniev A.S. (1989). Isolation and structure analysis of components from venom of the spider Argiope lobata. Toxicon. 27, 541–549;
- Sergiy Chesnov, Laurent Bigler, Manfred Hesse. (2001). The Acylpolyamines from the Venom of the SpiderAgelenopsis aperta. HCA. 84, 2178-2197;
- F. C. Schröder. (1998). Combinatorial Chemistry in Insects: A Library of Defensive Macrocyclic Polyamines. Science. 281, 428-431;
- Raymond S. Norton, Paul K. Pallaghy. (1998). The cystine knot structure of ion channel toxins and related polypeptides. Toxicon. 36, 1573-1583;
- David J. Craik, Norelle L. Daly, Clement Waine. (2001). The cystine knot motif in toxins and implications for drug design. Toxicon. 39, 43-60;
- J. Chen, M. Deng, Q. He, E. Meng, L. Jiang, et. al.. (2008). Molecular diversity and evolution of cystine knot toxins of the tarantula Chilobrachys jingzhao. Cell. Mol. Life Sci.. 65, 2431-2444;
- Sergey Kozlov, Anton Malyavka, Bill McCutchen, Albert Lu, Eric Schepers, et. al.. (2005). A novel strategy for the identification of toxinlike structures in spider venom. Proteins. 59, 131-140;
- L Possani. (2000). Peptides and genes coding for scorpion toxins that affect ion-channels. Biochimie. 82, 861-868;
- Pierre Escoubas, Jan R. De Weille, Alain Lecoq, Sylvie Diochot, Rainer Waldmann, et. al.. (2000). Isolation of a Tarantula Toxin Specific for a Class of Proton-gated Na+Channels. J. Biol. Chem.. 275, 25116-25121;
- Jan Siemens, Sharleen Zhou, Rebecca Piskorowski, Tetsuro Nikai, Ellen A. Lumpkin, et. al.. (2006). Spider toxins activate the capsaicin receptor to produce inflammatory pain. Nature. 444, 208-212;
- Yaroslav A. Andreev, Sergey A. Kozlov, Sergey G. Koshelev, Ekaterina A. Ivanova, Margarita M. Monastyrnaya, et. al.. (2008). Analgesic Compound from Sea AnemoneHeteractis crispaIs the First Polypeptide Inhibitor of Vanilloid Receptor 1 (TRPV1). J. Biol. Chem.. 283, 23914-23921;
- Eric Lingueglia. (2007). Acid-sensing Ion Channels in Sensory Perception. J. Biol. Chem.. 282, 17325-17329;
- Arpad Szallasi, Daniel N. Cortright, Charles A. Blum, Samer R. Eid. (2007). The vanilloid receptor TRPV1: 10 years from channel cloning to antagonist proof-of-concept. Nat Rev Drug Discov. 6, 357-372;
- Жгучий перец облегчит боль;
- «Мятный холодок»: почему ментол создаёт ощущение прохлады во рту;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам.






