
Белоксинтезирующая Нобелевская премия по химии (2009)
08 октября 2009
Белоксинтезирующая Нобелевская премия по химии (2009)
- 3643
- 2
- 3
Белоксинтезирующий центр живой клетки — рибосома — настолько многофункционален и сложно устроен, что сложно не прийти к метафоре клеточной фабрики (ну или конвейера)
научный журнал «1663», выпускаемый Лос-Аламосской национальной лабораторией (США)
-
Автор
-
Редакторы
Еще в начале XX века молекулярные основы жизни были совершенно неведомы, — и тем более впечатляет скорость, с которой человечеству удаётся постигать эти тончайшие явления в наши дни. В 2009 году Нобелевская премия по химии вручена за исследования, возможно, самой сложной молекулярной машины — рибосомы, являющейся клеточной «фабрикой» белка. Лауреатами премии стали Ада Йонат, Томас Стейц и Венкатраман Рамакришнан.
Общая теория эволюции, опубликованная Чарльзом Дарвином в 1859, базируется на предпосылках наследуемости признаков организма и наличии постоянных случайных изменений (мутаций) в генетическом материале особи. Изменения, дающие организму конкурентные преимущества, закрепляются в результате отбора и передаются будущим поколениям. Когда общественность более-менее осознала идеи Дарвина, возник другой вопрос: что именно передаётся по наследству, где возникают пресловутые случайные изменения и как они могут выражаться на уровне организма?
Нобелевская премия по химии за 2009 год — уже третья по счету, которая иллюстрирует работу эволюционной теории на молекулярном уровне. Эта трилогия стартовала со знаменитой премии 1962 года, когда Джеймс Уотсон, Фрэнсис Крик и Морис Уилкинс удостоились награды за свою модель двойной спирали ДНК. Вторая премия из этой серии была вручена в 2006 году Роджеру Корнбергу за рентгеноструктурные исследования транскрипции (механизма «копирования» генетической информации с ДНК на матричную РНК).
Рибосома: от «слов» к «делу»
Трое лауреатов Нобелевской премии по химии за 2009 год — Ада Йонат (Ada Yonath), Томас Стейц (Thomas Steitz) и Венкатраман Рамакришнан (Venkatraman Ramakrishnan) — награждены за картирование рибосомы — одной из наиболее сложно устроенных органелл клетки — на атомном уровне. Рибосома «считывает» информацию с матричной РНК (мРНК) и, основываясь на этой информации, синтезирует белок. (По-научному этот процесс называют трансляцией.) В процессе этого информация переходит с «языка» нуклеиновых кислот на язык белков, и жизнь предстаёт во всей красоте своей изящной сложности.
Рибосомы присутствуют в клетках всех организмов — от бактерий до человека. Поскольку эти органеллы жизненно необходимы для любого существа, рибосомы являются прекрасной мишенью для фармацевтического действия. Множество современных антибиотиков воздействует на бактериальные рибосомы, оставляя рибосомы человека в покое, — а, следовательно, знания, добытые нынешними нобелевскими лауреатами, открывают прямую дорогу к антибиотикам нового поколения. Однако подробнее об этом чуть позже, а пока — немного о химических основах жизни.
Аминокислоты в белкé — как жемчуг на нитке
В начале 1940-х уже было известно, что наследственная информация содержится в хромосомах, состоящих из ДНК и белкá, однако большинство учёных считало, что генетическую функцию несут белки, а не ДНК, поскольку они устроены сложнее, и, как на тот момент казалось, именно поэтому должны играть эту важную роль.
Научная общественность была в восторге от белков. Было известно, что они выполняют массу различных функций в клетке — от строительной и каталитической до сигнальной. И, несмотря на это, они состоят из одних и тех же 20 «строительных блоков» — аминокислот, образующих линейную молекулу, подобно жемчужинам в ожерелье (рис. 2). Соединяет аминокислоты между собой очень прочная пептидная связь.
ДНК: слишком простая для наследственности
В тех же 1940-х ДНК привлекала мало внимания. (А впервые ДНК была выделена из ядер клеток в 1871 году швейцарским учёным Фридрихом Мишером, назвавшим вещество нуклеиновой кислотой от латинского nucleus — ядро.)
Аналогично белкáм, ДНК линейна и состоит из повторяющихся «блоков» — только тут их даже не 20, а всего четыре: аденин (А), цитозин (Ц), гуанин (Г) и тимин (Т). Четыре — как казалось, слишком мало для такого важного дела, как наследственность. Поэтому долгое время считалось, что генетическую функцию несут белки хромосом, а функция ДНК — лишь структурная.
В 1944-м, впрочем, ДНК взяла своё: в результате экспериментов Эвери-Маклеода-Маккарти по переносу ДНК из мёртвых бактерий в живые — после чего последние трансформировались — стало ясно, какая именно молекула отвечает за генетическую функцию. ДНК стала привлекать всё больше и больше внимания, пока, наконец, не была установлена её пространственная организация.
Элегантная. Двойная
28 февраля 1953 года Джеймс Уотсон и Фрэнсис Крик в Кавендишской лаборатории в Кембридже (Великобритания) разгадали, наконец-то, секрет ДНК. В течение нескольких предшествующих лет они тщетно пытались разобраться, как молекула, состоящая из четырёх видов нуклеотидов, организована в трёхмерном пространстве.
По данным рентгенографического эксперимента, проведённого Розалинд Франклин в Кингз-колледже в Лондоне, ДНК должна была образовывать спираль, состоящую из двух нитей. А из опытов Эрвина Чаргаффа следовало, что — независимо от организма — количества нуклеотидов А-Т и Г-Ц в ДНК всегда совпадают, и что количество пуринов равно количеству пиримидинов.
Имея в руках все эти данные, Уотсон и Крик догадались, что аденин образует пару с тимином, а гуанин — с цитозином, и всё это — в рамках двойной спирали. Учёным всего мира стало ясно, что именно ДНК передаёт наследственную информацию, и информация эта закодирована в последовательности нуклеотидов.
РНК — сестрица ДНК
В то же самое время, пока Уотсон и Крик делали своё знаменитое открытие, внимание исследователей обратилось и на другую нуклеиновую кислоту, встречающуюся преимущественно в цитоплазме, — РНК. Её строение схоже с ДНК, только вместо тимина (Т) РНК содержит урацил (У).
В начале 1950-х стало понятно, что бóльшая часть РНК находится в маленьких частицах в цитоплазме, содержащих кроме РНК ещё и белóк (рис. 1). Тогда же открыли, что это то самое место, где синтезируется весь белóк клетки. В 1958 году эти частицы получили название рибосом.
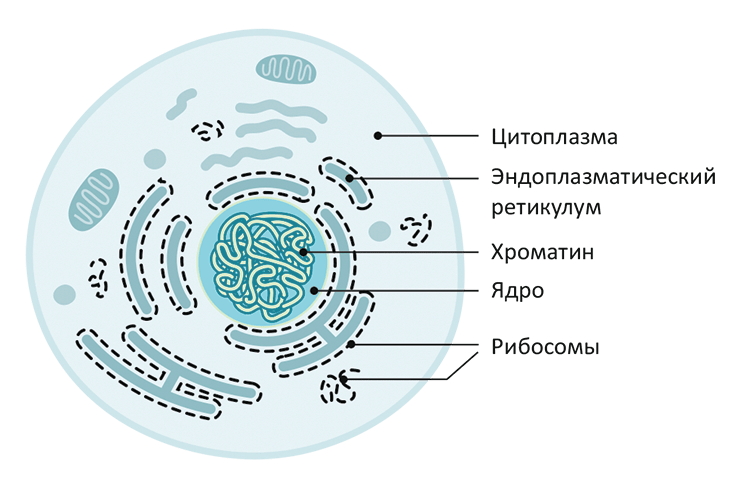
Рисунок 1. Схема строения клетки. Рибосома имеет в поперечнике около 25 нм. Некоторые рибосомы ассоциированы с эндоплазматическим ретикулумом. Одна клетка содержит десятки тысяч рибосом.
1960-е: расшифровка генетического кода
Итак, через 100 лет после знаменательной публикации Дарвина молекула, несущая наследственные признаки, была найдена. Последовательность нуклеотидов задаёт последовательность аминокислот в белкé, производимом рибосомой в цитоплазме клетки. Однако какова связь между ДНК и рибосомой? Ведь они находятся по разные стороны ядерной мембраны и никогда не встречаются (рис. 1).
Ответ на этот вопрос появился в начале 1960-х: открыли, что генетическая информация копируется с ДНК на молекулу РНК, называемую матричной РНК (мРНК) (рис. 2). мРНК выходит за пределы ядра, захватывается рибосомой и служит последней в качестве инструкции для белкового синтеза.
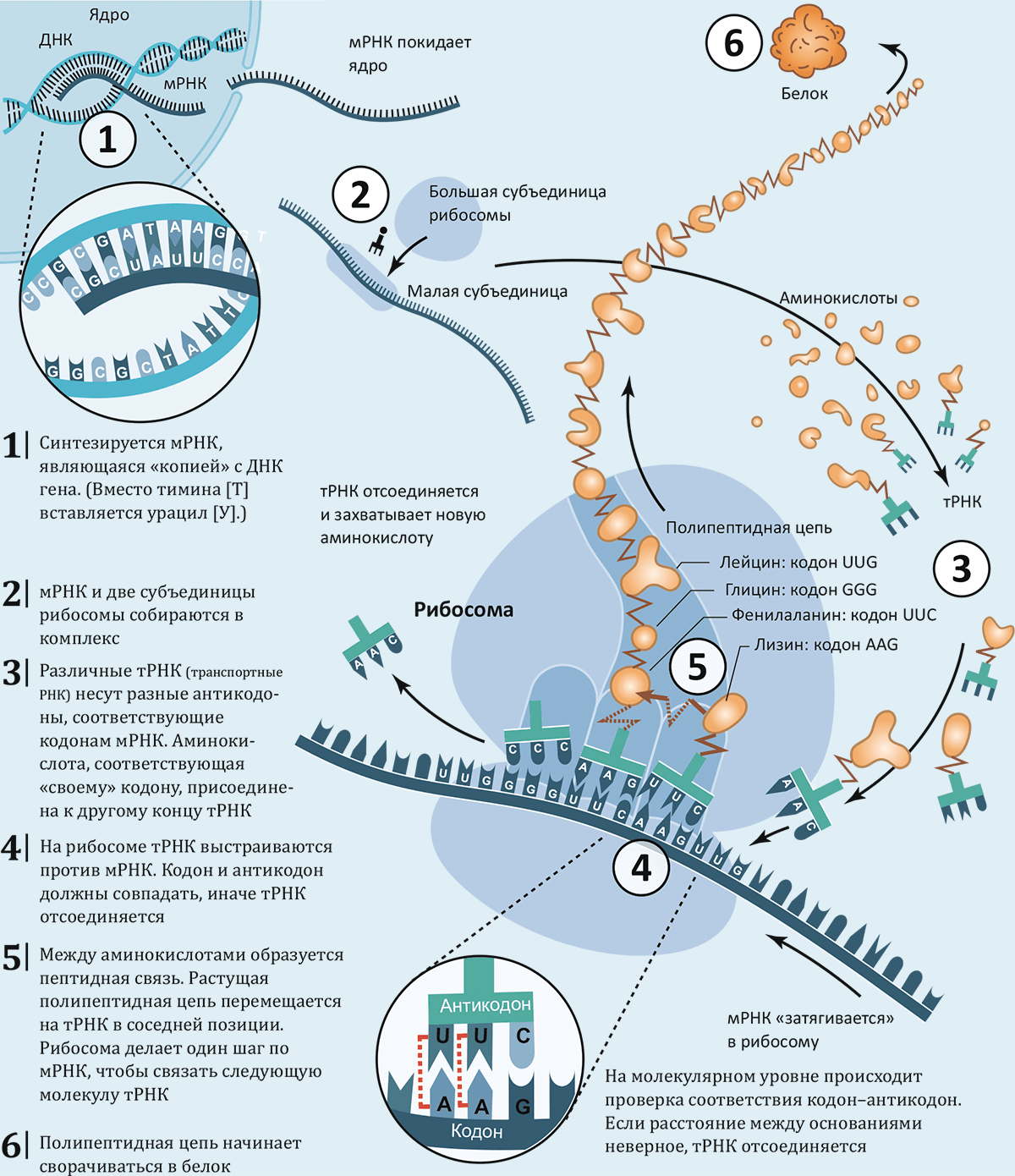
Рисунок 2. От ДНК к белку. Изображённый процесс — один из фундаментальных во всей живой Природе.
Когда всё это стало понятно, генетический код был довольно быстро расшифрован при помощи синтетических мРНК и рибосом «в пробирке». Оказалось, что рибосома считывает мРНК по триплетам (или кодонам); первым открытым кодоном стал UUU, транслирующийся на рибосоме в аминокислоту фенилаланин. Всего существует 64 различных кодона, что при 20 типах аминокислот означает, что многие из них кодируются несколькими кодонами.
Считывание кодонов осуществляется ещё одним типом РНК — транспортной (тРНК): с одной стороны у неё находится антикодон, распознающий по принципу комплементарности кодон мРНК, а с другой стороны — соответствующий «текущему» кодону аминокислотный остаток.
Эти открытия заложили основу центральной догме молекулярной биологии: направленному переносу информации от ДНК к РНК и от РНК к белку. Однако схема существовала лишь на пальцах, что справедливо было отмечено Уотсоном: «К сожалению, мы не можем дать детального химического описания, как функционируют эти молекулы, до тех пор, пока не появится их структура». Появления такой структуры пришлось ждать до 2000 года.
Ада Йонат — пионер рибосомальных исследований
Частенько самые впечатляющие открытия делаются пионерами в области, ещё совершенно «не истоптанной» другими исследователями. В случае рибосомы, этим пионером была Ада Йонат. В конце 1970-х она решила получить рентгенографическую структуру рибосомы. В то время большинство считало эту задачу неразрешимой.
В рентгеновской кристаллографии луч жёсткого излучения направляют на исследуемый образец (например, высокоупорядоченное состояние белкá — кристалл) и изучают возникающее при этом рассеяние, регистрируя дифракционную картину (рис. 3). Первоначально для регистрации использовалась светочувствительная плёнка, отдельные участки которой под действием излучения затемнялись; сейчас для этого используются ПЗС-матрицы (за которые, кстати, дали Нобелевку-2009 по физике). Анализируя дифракционную картину, можно определить точное расположение атомов в образце. Однако качественную картину может дать только практически идеальный кристалл, получение которого может быть затруднено, и чем больше белóк — тем сложнее подобрать адекватные условия для кристаллизации.
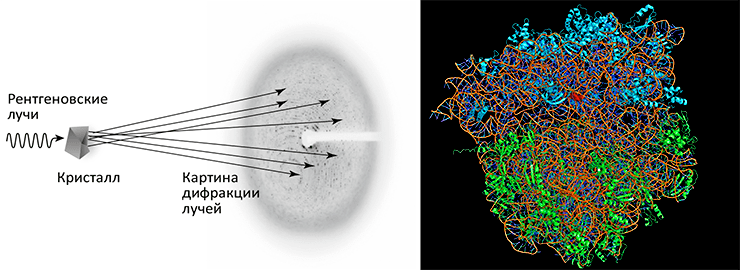
Рисунок 3. Рентгеновская кристаллография. Рентгеновское излучение получают в основном на синхротронах (ускорителях элементарных частиц). Когда лучи сталкиваются с кристаллом, они начинают рассеиваться, вырисовывая на детекторе картину дифракции, состоящую из миллионов отдельных точек (рефлексов). Используя сложные математические методы, по картине дифракции можно установить трёхмерное строение молекулы.
В силу перечисленных обстоятельств, большинство отнеслось к начинаниям Йонат скептически. Рибосома — один из сложнейших существующих комплексов РНК/белок, состоящий из большой субъединицы (одна большая молекула РНК, «инкрустированная» примерно 32 белкáми) и малой субъединицы (три молекулы РНК и около 36 белков). В сумме это составляет сотни тысяч атомов, и Йонат задалась целью определить положение каждого из них.
Горячие источники, Мёртвое море: навстречу кристаллам
Когда Ада Йонат решила закристаллизовать рибосому, её выбор пал на бактерию, живущую в экстремальных условиях: Geobacillus stearothermophilus может обитать в источниках с температурой до 75 °C. По предположениям Йонат, если уж рибосомы работают в таких жёстких условиях, то и кристаллизацию они как-нибудь перенесут.
В 1980-м были получены первые кристаллы, и это было действительно крупным достижением, несмотря на то, что их дифракционное качество было невысоким. После этого потребовалось ещё 20 лет работы, чтобы определить структуру рибосомы, в которой было бы чётко определено положение каждого атома. Йонат использовала много разных приёмов, — в частности замораживание при −196 °C; также в экспериментах «участвовали» и другие бактерии — например, Haloarcula marismortui из чрезвычайно солёных вод Мёртвого моря.
Успехи Йонат вдохновили многих, и теперь к погоне за структурой рибосомы присоединились другие учёные, — и среди них Томас Стейц и Венкатраман Рамакришнан.
Скрытый смысл в мозаике из миллионов чёрных точек
К началу 1990-х кристаллы Йонат уже имели вполне удовлетворительное качество, чтобы по ним установить положение каждого атома в структуре, однако оставалось ещё затруднение, называемое у кристаллографов «проблемой фаз». Чтобы по картине дифракции восстановить структуру, необходимо знать фазовый угол для каждого рефлекса на картине, и как найти эти фазы, было непонятно.
Часто для аналогичной задачи в кристалл добавляют тяжёлые металлы вроде ртути и по различию дифракционных картин кристалла с металлом и без него вычисляют фазу. Однако в случае огромной рибосомы, к образцу присоединялось сразу много атомов тяжёлого металла, и вычислить фазы было сложно. Для решения проблемы требовалась дополнительная информация.
Решение проблемы предложил Томас Стейц, который использовал электронно-микроскопические изображения рибосомы, полученные Иоахимом Франком. Эти изображения помогли установить положение и примерную ориентацию рибосомы в кристалле, и, хотя не позволяли «увидеть» отдельных атомов, были использованы для восстановления набора фаз и получения рентгеновской структуры.
По итогам двадцатилетней работы
В 1998 году Томас Стейц опубликовал первую структуру большой субъединицы рибосомы, на которой можно было различить положение молекул РНК и белков, но не больше: разрешение не превышало 9 Å. Но и это стало настоящим прорывом.
Основные проблемы были решены, и оставалось только улучшать качество кристаллов и накапливать статистику. К «финишу» лауреаты Нобелевской премии пришли практически одновременно: в августе и сентябре 2000 года они опубликовали кристаллические структуры рибосомы с атомным разрешением: Стейц — большой субъединицы Haloarcula marismortui, а Йонат и Рамакришнан — малой субъединицы Thermus thermophilus.
Малая субъединица: «двойная проверка»
Учёных всегда чрезвычайно удивляла та беспрецедентная точность, с которой рибосома транслирует «нуклеиновую» информацию в белóк: ведь неправильный синтез белкá сделает его неактивным, или, ещё хуже — активным в непредсказуемом направлении.
Специфичность и точность синтеза определяется главным образом распознаванием мРНК–тРНК (рис. 2), однако этого всё же недостаточно, чтобы объяснить высочайшую точность рибосомы. Структура малой субъединицы, полученная Рамакришнаном, даёт объяснение этому феномену. Оказывается, в рибосоме есть что-то вроде «молекулярной линейки», которая измеряет расстояние между кодоном мРНК и антикодоном тРНК. В случае если это расстояние отличается от требуемого, тРНК немедленно диссоциирует. Двойная проверка — залог точности синтеза белка на рибосоме: не более одной ошибки на 100 000 аминокислотных остатков.
Большая субъединица «нанизывает» жемчужины на нить
Роль большой субъединицы рибосомы — главным образом, синтез белка: она катализирует образование пептидной связи между аминокислотами. Скорость рибосомы составляет примерно 20 синтезированных звеньев полипептидной цепи в минуту, и «поймать» рибосому на промежуточной стадии очень непросто.
Однако Томасу Стейцу удалось сделать и это. Он проводил кристаллизацию большой субъединицы с аналогами аминокислот, и с помощью этих структур были найдены каталитические центры рибосомы и предложена схема процесса.
Исследования лауреатов помогли понять, как что-то настолько простое как цепочка из четырёх типов звеньев превращается в такую сложную вещь как жизнь, и, как это часто бывает, фундаментальные исследования находят применения на практике: в этом случае речь идёт о новых антибиотиках.
Рибосома — мишень для новых антибиотиков
На сегодняшний день человечество располагает арсеналом антибиотиков, способных уничтожать болезнетворные бактерии; многие из них блокируют функции рибосом бактерий. Однако какое-то время спустя, бактерии выработали устойчивость против многих из этих веществ, и человечеству опять нужны новые антибиотики.
Все трое лауреатов Нобелевской премии этого года получили структуры рибосом со связанными с ними различными антибиотиками. Некоторые из них блокируют «туннель», по которому растущая полипептидная цепь покидает рибосому, другие нарушают образование пептидной связи, третьи — вносят критические ошибки в трансляцию.
Некоторые фармацевтические компании уже используют пространственную модель рибосомы (рис. 4) для разработки новых антибиотиков, и ряд препаратов уже проходит клинические испытания.
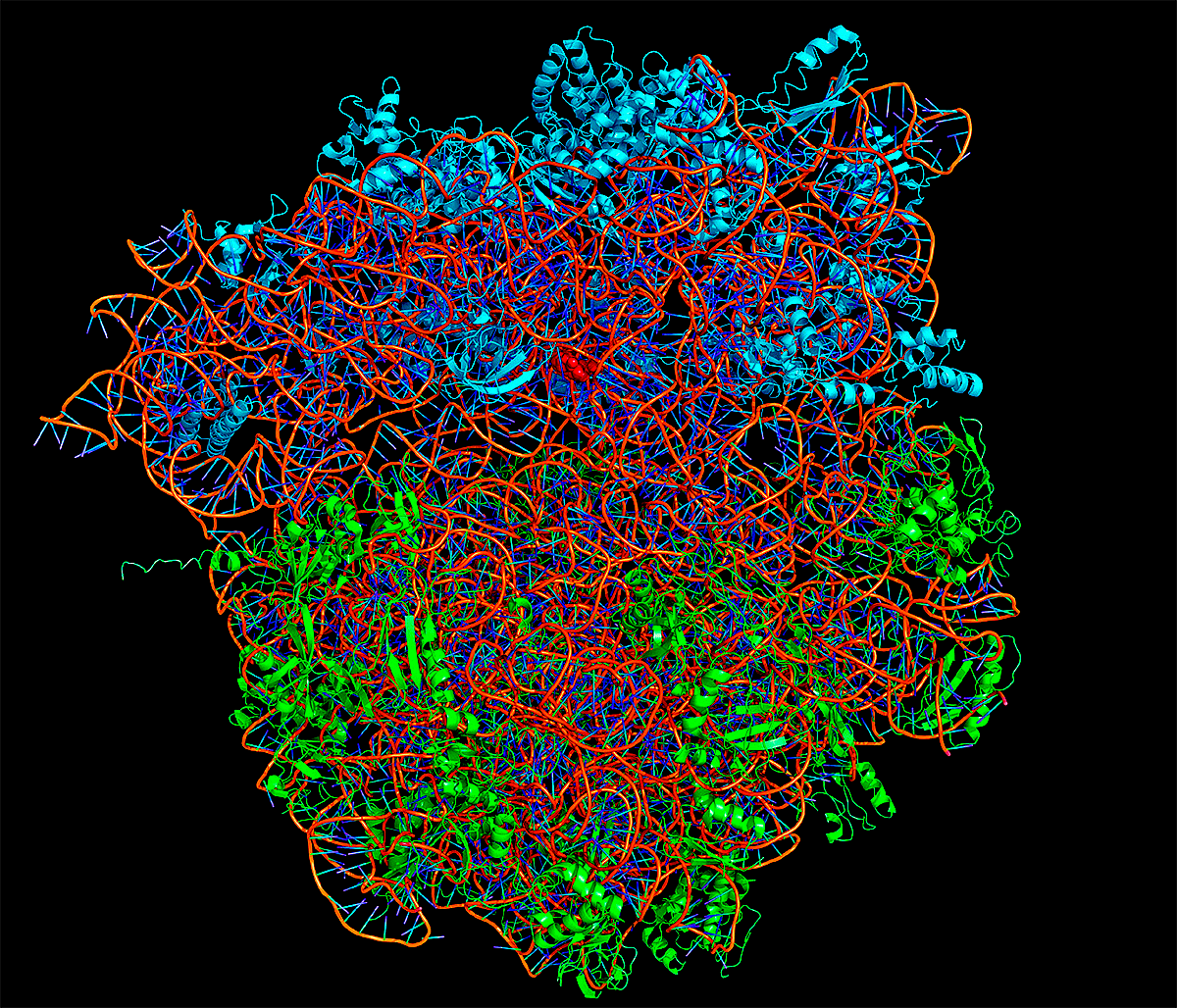
Рисунок 4. Кристаллографическая структура бактериальной рибосомы. Молекула рибосомальной РНК (рРНК) показана оранжевым, белки малой субъединицы — голубым, большой — зелёным. С малой субъединицей связана молекула антибиотика. Изучение этих структур позволит разработать более эффективные антибиотики.
Понимание принципов строения рибосом и их функций чрезвычайно полезно и нужно не только для сообщества биологов, но и для всего человечества. Открытия Ады Йонат, Томаса Стейца и Венкатрамана Рамакришнана внесли солидный вклад и в фундаментальное понимание одного из базовых процессов во всех царствах живого, и в спасение жизней людей.
По материалам Нобелевского Комитета.
См. также: «“Нестареющая” Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе» [1].





