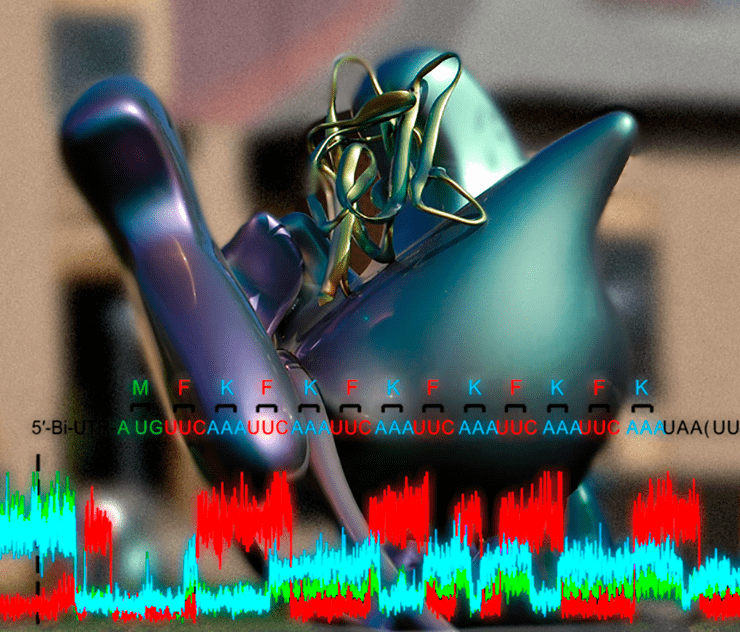
Рибосома за работой
21 апреля 2010
Рибосома за работой
- 4614
- 2
- 7
Беспрецедентная чувствительность флуоресцентных инструментов наблюдения позволяет «быть в курсе» каждой операции, проделанной отдельно взятой рибосомой
коллаж по Matt_Smith @ Flickr
-
Автор
-
Редакторы
Большинство биохимических и биофизических экспериментов позволяют измерить какую-либо величину лишь «в среднем по палате», не достигая чувствительности, необходимой для регистрации событий на уровне отдельных молекул. Однако в последнее время всё большее распространение получают методики наблюдения за молекулами по отдельности. Недавно подобная технология была использована для «подглядывания» за работой отдельной рибосомы в реальном времени, наглядно выстраивая в цепочку события, происходящие при синтезе белковой молекулы.
Синтез белкá (трансляция) происходит при точно скоординированном участии множества клеточных компонентов, а в центре всего процесса находятся рибосомы — «клеточные фабрики». Они представляют собой белковые частицы с «начинкой» из РНК; их диаметр составляет ≈25 нм, а молекулярная масса — примерно 2.5 млн. Да. Рибосомы взаимодействуют с матричной РНК (мРНК), служащей «шаблоном» для синтеза; аминоацилированными транспортными РНК (тРНК), выполняющими роль адапторов между триплетами мРНК и аминокислотными остатками; и разнообразными кофакторами, служащими для инициации синтеза, удлинения белковой цепи (элонгации) и высвобождения «новосинтезированной» молекулы с рибосомы (терминации).
Открытие механизма синтеза белка и атмосфера хиппи породили небольшой спектакль «из жизни рибосомы», разыгранный на лужайке Стэнфорда в 1971 году
Проблемой трансляции белкá занимаются сотни лабораторий по всему миру уже более половины столетия, а за исследования белоксинтезирующей машины — рибосомы — в прошлом (2009) году вручена Нобелевская премия [1]. Структура рибосомы изучена уже довольно хорошо; в подробностях исследован и механизм синтеза — «нанизывание» рибосом на линейную молекулу мРНК, распознавание нуклеотидных триплетов (кодонов), связывание тРНК, реакция синтеза пептидной связи, коррекция ошибок, терминация синтеза и роль многочисленных кофакторов во всём этом. В рибосоме найдены три основных сайта, с которыми последовательно связывается каждая тРНК — А-сайт (сюда приходит аминоацил-тРНК), P-сайт (здесь находится пептидил-тРНК с растущей белковой цепью) и E-сайт (exit, куда перемещается «отработанная» тРНК перед отсоединением от рибосомы).
Несмотря на то, что работа рибосомы изучена довольно хорошо, процесс биосинтеза белкá продолжает привлекать пристальное внимание учёных. Исследователи из Стэнфорда в сотрудничестве с японскими учёными применили методику одномолекулярных наблюдений, чтобы в ещё больших деталях проникнуть в процессы, приводящие к синтезу «молекулы жизни» [2]. (Кстати, одномолекулярные методы уже использовались, например, для изучения фолдинга отдельных молекул РНК [3].) Уникальная флуоресцентная методика позволила в реальном времени проследить за перемещением отдельных тРНК между тремя сайтами на рибосоме, а значит, и за всем процессом синтеза белкá. Важность этого достижения можно объяснить тем, что результаты измерений представляют не «усреднённую» картину по ансамблю, но отражают события, происходящие на уровне отдельной работающей рибосомы. Только такая чувствительность позволит не пропустить некоторые редкие, но очень важные для более тонкого понимания проблемы молекулярные события.
Эксперимент был основан на регистрации флуоресцентного сигнала с отдельных молекул тРНК, меченных различными флуоресцентными красителями (методика резонансной миграции энергии флуоресценции, FRET), что позволяет в реальном времени наблюдать присоединение той или иной тРНК, а, значит и «видеть» весь процесс трансляции. Всё действо проходит в чрезвычайно маленьких (можно сказать, по размеру рибосомы) резервуарах — безмодовых волноводах (рис. 1), которые получают распространение и в других «одномолекулярных» задачах (например, секвенировании одиночных молекул ДНК).
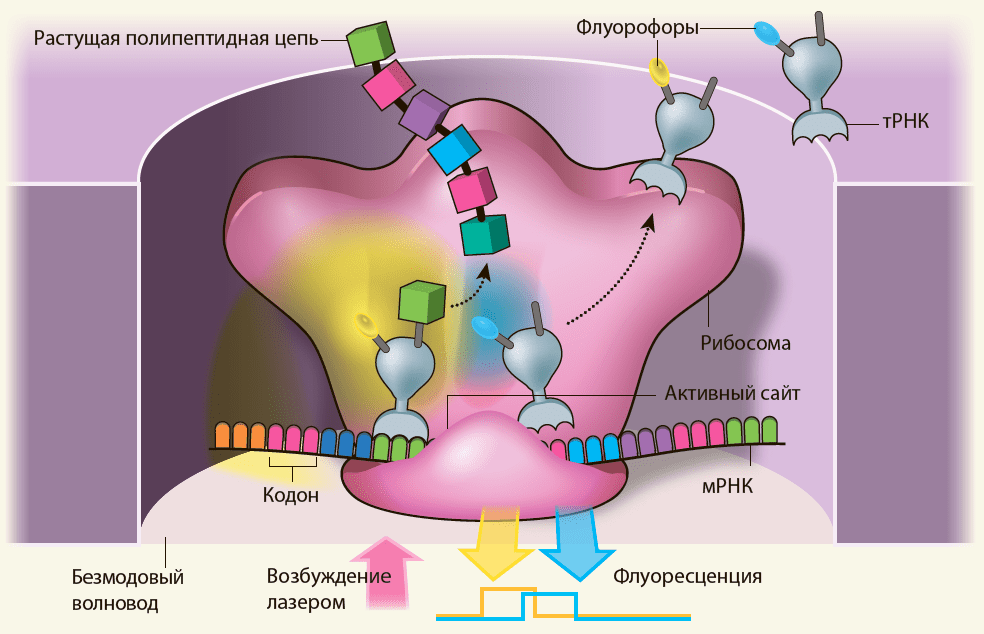
Рисунок 1. Наблюдение за работой отдельной рибосомы. Основой всего эксперимента является безмодовый волновод — тончайшая алюминиевая плёнка с перфорацией радиусом 50–200 нм и прозрачной подложкой (исследователи контролировали, чтобы на донышке «лунки» закреплялось ровно по одной рибосоме). При столь малом диаметре и объёме всего 10−21 л (зептолитр!) становится возможным «отсеивать» фоновую флуоресценцию и сосредоточиться на происходящем именно в этой «лунке». Последовательное связывание на рибосоме флуоресцентно меченных молекул тРНК порождает последовательность цветных вспышек, содержащую в себе подробную информацию о чередовании тРНК и о ходе трансляции в целом.
В модельных экспериментах наблюдали за синтезом пептидов длиной 4–13 аминокислотных остатков, причём концентрации тРНК и кофакторов элонгации были эквивалентны естественным (на уровне микромоль, что в десятки раз выше, чем удавалось использовать ранее). Варьирование этих концентраций пропорционально меняет скорость синтеза белкá, максимальный уровень которой — около одного кодона в секунду — достигается при физиологических значениях концентраций тРНК и фактора элонгации EF-G (рис. 2). Регистрация флуоресценции позволяет наблюдать за особенностями протекания биосинтеза: например, при отсутствии фактора EF-G трансляции не происходит, при добавлении антибиотика фусидовой кислоты блокируется диссоциация EF-G от рибосомы, а антибиотик эритромицин останавливает синтез на стадии 7 аминокислот.
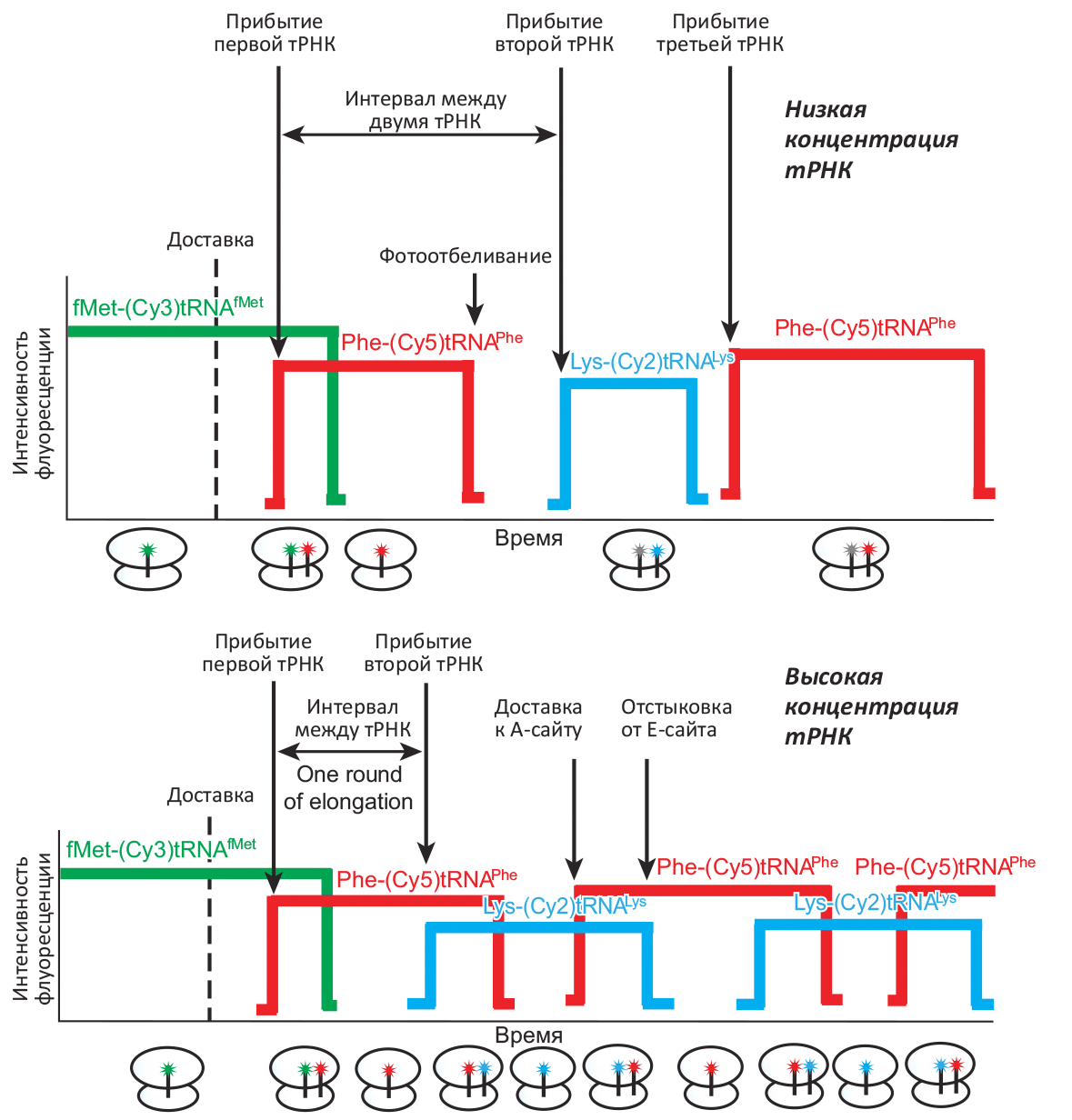
Рисунок 2. Последовательность флуоресцентных вспышек, кодирующая информацию о ходе транскрипции. Готовность «стартового» состояния рибосомы определяется по флуоресценции меченной тРНК fMet–(Cy3)–тРНКfMet, связанной со старт-кодоном. Прибытие Phe–(Cy5)–тРНКPhe или Lys–(Cy2)–тРНКLys отмечается красной или голубой вспышкой, соответственно. При низкой концентрации тРНК (сверху) связывание с рибосомой происходит достаточно редко (существенно реже одного раза в секунду), и флуорофор иногда успевает «отбелиться» под влиянием лазерного излучения, индуцирующего флуоресценцию. При высоких (близких к физиологическим) концентрациях тРНК (снизу) связывание происходит чаще одного раза в секунду, и фотоотбеливания не происходит (вспышки накладываются). Это соответствует состоянию с двумя молекулами тРНК, связанными с рибосомой (схематически показано под осью времени).
Наблюдение за трансляцией на уровне отдельных молекул в реальном времени открывает новые горизонты в изучении биосинтеза белкá, механизмов его регуляции и конформационных переходов в рибосоме. Остроумная флуоресцентная технология, разработанная изначально для секвенирования одиночных молекул ДНК в пóрах [7], несомненно, найдет применение и в других передовых исследованиях — секвенировании РНК, изучении метилирования генома и определении временных характеристик различных регуляторных процессов.
При написании статьи использованы материалы рубрики «News & Views» Nature [6].
Литература
- Белоксинтезирующая Нобелевская премия по химии (2009);
- Sotaro Uemura, Colin Echeverría Aitken, Jonas Korlach, Benjamin A. Flusberg, Stephen W. Turner, Joseph D. Puglisi. (2010). Real-time tRNA transit on single translating ribosomes at codon resolution. Nature. 464, 1012-1017;
- Фолдинг «воочию»;
- Jin-Der Wen, Laura Lancaster, Courtney Hodges, Ana-Carolina Zeri, Shige H. Yoshimura, et. al.. (2008). Following translation by single ribosomes one codon at a time. Nature. 452, 598-603;
- R. Andrew Marshall, Colin Echeverría Aitken, Magdalena Dorywalska, Joseph D. Puglisi. (2008). Translation at the Single-Molecule Level. Annu. Rev. Biochem.. 77, 177-203;
- Susanne Brakmann. (2010). Single-molecule analysis: A ribosome in action. Nature. 464, 987-988;
- J. Eid, A. Fehr, J. Gray, K. Luong, J. Lyle, et. al.. (2009). Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323, 133-138.