Антимикробные пептиды — возможная альтернатива традиционным антибиотикам
25 апреля 2007
Антимикробные пептиды — возможная альтернатива традиционным антибиотикам
- 10691
- 4
- 12
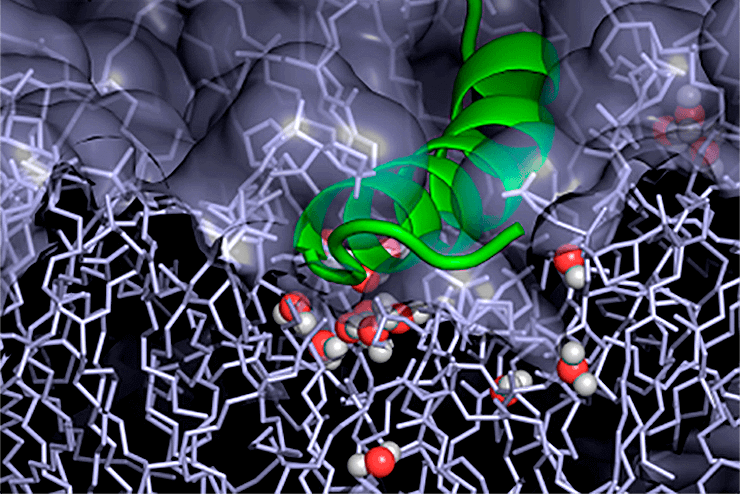
Антимикробный пептид на поверхности модели бактериальной мембраны. Связывание пептида приводит к дестабилизации мембраны и проникновению воды внутрь бислоя.
-
Автор
-
Редакторы
После появления пенициллина более чем 80 лет человечество ведет ожесточенную борьбу с патогенными микроорганизмами. Широкое использование антибиотиков в терапии инфекционных заболеваний породило новые устойчивые к ним формы бактерий. На пороге XXI века медики и фармацевты столкнулись с проблемой поиска альтернативы традиционным антибиотикам. Для этой цели использование антимикробных пептидов может оказаться весьма эффективным.
Уроки «80-летней войны»
Со времен открытия Флемингом пенициллина в 1928 г. фармацевтами были созданы тысячи различных антибиотиков. Во второй половине XX века бытовало мнение, что, благодаря вакцинации и активному использованию антибиотиков, с инфекционными заболеваниями будет покончено раз и навсегда. Однако быстрой и легкой победы над патогенными микроорганизмами достичь не удалось. Фактически, человечество простилось только с оспой. В цивилизованных странах в последние годы часто наблюдаются рецидивы ряда «забытых болезней» (бубонная чума, коклюш и пр.), в то время как в странах «третьего мира» ни о какой, даже временной победе над инфекциями, говорить не приходиться. И это не единственная проблема. Оказалось, что любые бактерии способны достаточно быстро (от нескольких месяцев до нескольких лет) выработать устойчивость (резистентность) к практически любому антибиотику [1]. Таким образом, стремительный рост числа вводимых в клиническую практику структурно новых антибиотиков, наблюдавшийся в середине прошлого столетия, сменился длительным инновационным кризисом, который продолжается и сегодня [2]. Более того, широкое применение антибиотиков в качестве лекарственных препаратов привело к накоплению устойчивых форм микроорганизмов. Распространены случаи устойчивости целого ряда патогенов человека (Enterococcus faecalis, Mycobacterium tuberculosis, Pseudomonas aeruginosa, Salmonella typhi, Staphylococcus aureus, Streptococcus pneumoniae, Vibrio cholerae и пр.) практически к любому из применяемых препаратов [3].
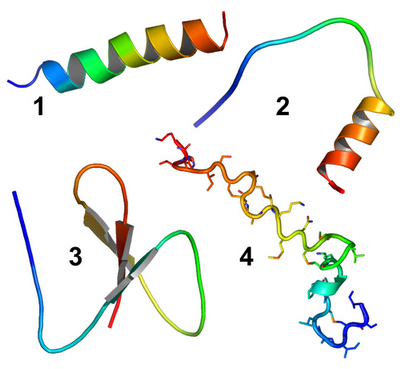
Рисунок 1. Представители различных групп антимикробных пептидов.
1 — Линейные α-спиральные; 2 — не имеющие характерной структуры, напр. богатые определенной аминокислотой; 3 — дефензины; 4 — лантибиотики (низин).
Основная цепь пептидов изображена в виде ленты (1, 2). Фрагменты β-слоя представлены стрелками (3). Для низина (4) показаны также боковые цепи остатков.
Антимикробные пептиды
По-видимому, принципиально новым классом природных антибиотиков, которые могут прийти на смену традиционным препаратам, являются так называемые антимикробные пептиды [4]. Это относительно короткие молекулы (в среднем порядка 30–40 аминокислот), способные убивать клетки микроорганизмов. Антимикробные пептиды служат первичной мерой защиты от патогенов и задействованы в системе врожденного иммунитета. На сегодняшний день охарактеризовано более 800 таких пептидов. Они включают в себя молекулы из многих тканей и типов клеток беспозвоночных, позвоночных, растений и грибов; некоторые хемокины, цитокины, нейропептиды, нейрогормоны и фрагменты белков. Также ряд пептидов производится собственно микроогранизмами. Например, Lactococcus casea, молочнокислые бактерии — популярная добавка ко всяким «иммунизирующим» йогуртам, — продуцируют высокоактивный пептид низин.
Несмотря на огромное разнообразие, на основании структурной организации антимикробные пептиды можно разделить на несколько групп:
- линейные α-спиральные пептиды (напр., магаинин, меллитин, цекропин);
- пептиды, богатые определенной аминокислотой, напр., гистидином или пролином;
- пептиды, имеющие сложную пространственную организацию, содержащие дисульфидные мостики, тиоэфирные циклы и др. К ним относятся дефензины, протегрины и лантибиотики — высокоактивные бактериальные пептиды (напр., низин — см. выше).
Тем не менее, для большинства таких пептидов характерно несколько общих черт: высокий положительный заряд (+2 — +9), пространственное разделение гидрофобных и гидрофильных участков молекулы (амфифильность). Амфифильность является важной особенностью антимикробных пептидов, которая обеспечивает возможность одновременно выгодно взаимодействовать с гидрофобным ядром липидной мембраны и полярным окружением (например, с водой).
Механизмы действия
Выделяют два основных типа воздействия антимикробных пептидов на клетки: ингибирование метаболитических процессов или нарушение целостности клеточной мембраны [5]. Большинство антимикробных пептидов вызывают гибель клетки по второму механизму. Лишь для некоторых пептидов показано действие по первому типу, среди них лантибиотики, которые селективно связываются с предшественником бактериальной стенки [6]. Для того, чтобы достигнуть плазматической бактериальной мембраны, пептиды предварительно должны преодолеть несколько слоев клеточной стенки. В случае грам-отрицательных бактерии она состоит из внешней липополисахаридной мембраны и пептидогликанового слоя. У грам-положительных бактерий внешняя мембрана отсутствует, однако пептидогликановый слой развит гораздо сильнее. Пептиды обычно беспрепятственно достигают плазматической мембраны, и именно ее разрушение приводит гибели клетки.
Перспективы использования антимикробных пептидов в медицине
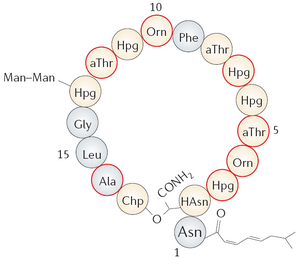
Рисунок 2. Антимикробный пептид рамопланин (Ramoplanin).
Продукт нерибосомального синтеза в микроорганизмах рода Actinomycetes spp. Механизм действия основан на связывании с предшественником бактериальной стенки липидом II. На данный момент находится на клинических испытаниях фазы III в качестве антибиотика против инфекций дыхательных путей (в первую очередь, стафилококков).
Несмотря на то, что для антимикробных пептидов характерно довольно высокие действующие концентрации (~10−7—10−6 моль, 10−9 моль у лантибиотиков) и низкая селективность, они обладают некоторыми преимуществами: способность быстро убивать клетки-мишени, широкий спектр действия, активность в отношении штаммов, резистентных к другим антибиотикам, а также относительная трудность в развитии устойчивости. Поскольку некоторые антимикробные пептиды обладают цитотоксическим эффектом (действуют на эукариотические клетки), наиболее эффективно они могут быть использованы при лечении заболеваний наружных покровов, слизистых — без введения в кровь пациента. На сегодняшний день такие пептиды активно используются для создания новых лекарственных препаратов. Наиболее успешным примером, является циклический пептидный антибиотик рамопланин, который уже находится на стадии клинических испытаний для лечения инфекционных заболеваний дыхательных путей. Также показано, что ингаляции смеси, содержащей антимикробные пептиды, являются эффективными в терапии туберкулеза.
Все это позволяет рассматривать описанные выше молекулы в качестве основы для создания эффективных лекарств, особенно на фоне снижения потенциала обычных антибиотиков.
Литература
- «Сопротивление бесполезно» — новые пути преодоления развития резистентности у бактерий;
- Christopher Walsh. (2003). Where will new antibiotics come from?. Nat Rev Micro. 1, 65-70;
- Christopher Walsh. (2000). Molecular mechanisms that confer antibacterial drug resistance. Nature. 406, 775-781;
- B. Brett Finlay, Robert E. W. Hancock. (2004). Can innate immunity be enhanced to treat microbial infections?. Nat Rev Micro. 2, 497-504;
- Kim A. Brogden. (2005). Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria?. Nat Rev Micro. 3, 238-250;
- Eefjan Breukink, Ben de Kruijff. (2006). Lipid II as a target for antibiotics. Nat Rev Drug Discov. 5, 321-323.