Миллисекундный барьер взят!
17 октября 2010
Миллисекундный барьер взят!
- 1434
- 7
- 2
Использование специализированных процессоров и оптимизированного программного обеспечения позволяет суперкомпьютеру Anton проводить имитации молекулярной динамики длиной до миллисекунды — что в сотни раз дольше, чем доступно на «обычных» суперкомпьютерах
-
Автор
-
Редакторы
Миллиардер Давид Шоу (David Shaw) в исследовательском центре имени себя с командой сотрудников собрал компьютер Anton, разработанный специально под расчеты молекулярной динамики (МД) биологических молекул, и с его помощью провёл расчет динамики нескольких небольших белков длительностью в миллисекунду. Хотя для «непосвящённых» эта цифра может показаться смехотворной, никогда ещё планка вычислительных экспериментов в молекулярной биологии не была установлена столь высоко.
Современная биология без компьютеров как без рук — практически во всех молекулярных областях компьютерные (или «in silico») эксперименты позволяют получить важную информацию о происходящем на уровне отдельных молекул при помощи вычислительных алгоритмов. Один из них — метод молекулярной динамики (МД) [1] — описывает молекулярные события «в реальном времени», и даже — гипотетически — позволяет проследить за процессом самопроизвольного сворачивания молекулы белка в нативную форму. Гипотетически — потому что до недавнего времени вычислительных мощностей суперкомпьютеров не хватало для моделирования в таком временном диапазоне, чтобы сравняться со временем, за которое молекулы белков сворачиваются в действительности. (В этой связи для теоретического предсказания пространственного строения белков используют не МД, а более «окольные» методы [2].)
Недавно в журнале Science опубликовали работу, в которой описаны расчеты МД нескольких белковых молекул в водном окружении длительностью 0,1–1 миллисекунды [3] (а миллисекунды (10−3 с) — это как раз то время, за которое многие белки сворачиваются в реальности). При этом все молекулы в этой работе были заданы максимально детально (полно-атомное описание). Траектория такой длительности позволила авторам «в реальном времени» наблюдать процесс сворачивания небольших α-спирального (виллин) и β-структурного белков (FiP35), причём за это время было отмечено несколько актов сворачивания-разворачивания. Для более крупного белка — ингибитора бычьего панкреатического трипсина (БПТИ) — получены более скромные результаты: вблизи нативного состояния проследили конформационные переходы, по ряду параметров соответствующие происходящим в реальности. В результате виртуального сворачивания получены модели виллина и FiP35, максимально близко соответствующие экспериментальным структурам (рис. 1). Наблюдаемая конформационная динамика БПТИ также хорошо согласуется с имеющимися данными спектроскопии ЯМР.
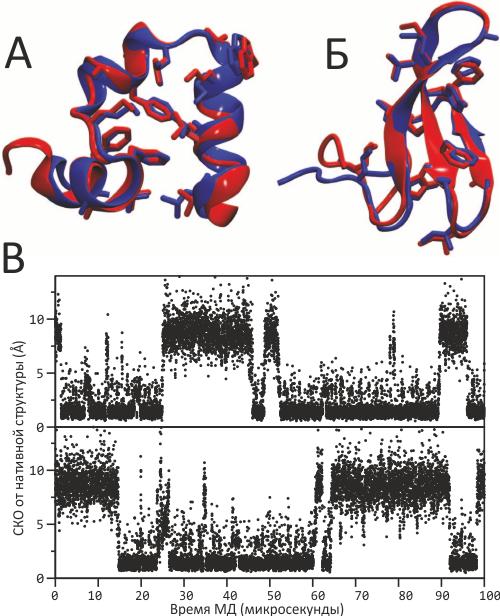
Рисунок 1. Компьютерное сворачивание небольших белков. Расчёт молекулярной динамики пептидов виллина (А) и FiP35 (Б) позволяет найти структуру, близкую к нативной (среднеквадратичное отклонение (СКО) на 68-й (виллин) и 38-й (FiP35) микросекунде расчёта, а начинали МД с полностью вытянутой конформации белков. «Для верности» счёт продолжили ещё на 20 мкс после достижения нативной конформации, чтобы подтвердить стабильность молекулы. В — Обратимое сворачивание FiP35 в двух независимых запусках МД длительностью по 100 мкс. При этом наблюдалось семь переходов из свёрнутого состояния в развёрнутое (и наоборот), а путь сворачивания представляется различным.
До этого самые длительные опубликованные аналогичные расчеты для FiP35 имели длительность «всего» 10 микросекунд. Таким образом, Шоу и его сотрудники увеличили эффективность расчётов на два порядка. Примечательно, что подобное достижение было получено в частном исследовательском центре, где уровень дохода научных работников немногим уступает финансистам с Уолл-стрит, — откуда, собственно, и «переквалифицировался» Шоу после почти полутора десятков лет управления собственным хеджевым фондом.
Стоит отметить, что 33 года назад МакКэмонн и Карплюс опубликовали пионерскую работу в Nature [4], в которой была описана МД БПТИ длительностью всего несколько пикосекунд (10−12 с). Таким образом, современная компьютерная техника сделала существенный прогресс за эти годы — мы на 9 порядков (в миллиард раз!) приблизились к процессам, происходящим в живой клетке.
Литература
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- Торжество компьютерных методов: предсказание строения белков;
- D. E. Shaw, P. Maragakis, K. Lindorff-Larsen, S. Piana, R. O. Dror, et. al.. (2010). Atomic-Level Characterization of the Structural Dynamics of Proteins. Science. 330, 341-346;
- J. Andrew McCammon, Bruce R. Gelin, Martin Karplus. (1977). Dynamics of folded proteins. Nature. 267, 585-590;
- R. F. Service. (2010). Custom-Built Supercomputer Brings Protein Folding Into View. Science. 330, 308-309.