Лазерно-интерференционная слежка за мембранными белками
04 мая 2011
Лазерно-интерференционная слежка за мембранными белками
- 717
- 0
- 1
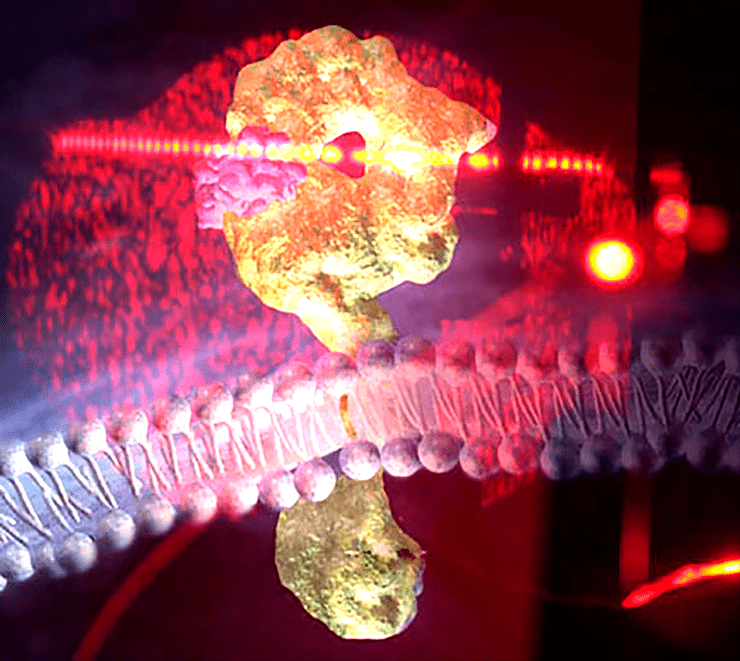
Анализ дифракционной картины рассеянного луча лазера — такого же, как в сканерах штрих-кода, — даст детальную информацию о взаимодействиях белков в мембране и связывании лигандов рецепторами. Коллаж: картина интерференции на приборе интерферометрии обратного рассеяния и схема строения мембранного рецептора ErbB, слишком активная димеризация которого способна вызвать рак.
-
Автор
-
Редакторы
Своим фантастическим прогрессом за последнее столетие биология обязана неслыханному развитию биофизических методов, позволяющих наблюдать за живой материей на уровне отдельных молекул. Однако, несмотря на широчайший арсенал, доступный исследователю, новые способы изучения биологических объектов все продолжают появляться, — причем, основной акцент теперь делается на неинвазивность, то есть минимальное нарушение условий, в которых существуют живые клетки или работают биомолекулы. Интерферометрия обратного рассеяния — новый метод изучения взаимодействия биологических молекул в мембране клеток между собой — основана на изменении параметров лазерного луча, отраженного от взаимодействующих молекул.
Один из самых старых методов наблюдения биологических объектов — оптическая микроскопия — получил свое название еще в XVII веке, когда Джованни Фабер, по аналогии со словом телескоп, предложил назвать изобретение своего друга Галилео Галилея микроскопом. Популярность этот прибор получил благодаря Роберту Гуку, который в 1664 году издает книгу «Микрография» со множеством впечатляющих рисунков (таких как известное изображение блохи) и, кроме прочего, впервые включавшую термин «клетка».
С тех пор появилось множество биофизических методов, о которых лет сто назад ещё и подумать было невозможно, — электронная и атомно-силовая микроскопия, рентгеноструктурный анализ, плазмонный резонанс, — да всего и не упомнишь. Однако все это многообразие часто имеет один существенный недостаток по сравнению со старой доброй микроскопией, — использование большей части этого арсенала требует убивать изучаемый образец, разделять его на составляющие части и даже модифицировать их согласно требованиям эксперимента. Так, рентгеновская кристаллография, хоть и позволяет «разглядеть» строение молекулы до отдельного атома, но для этого молекулу нужно сначала извлечь из своего естественного окружения и, следовательно, потерять информацию о том, как она на самом деле работает. А технология использования флуоресцентных меток [1] — хоть и необыкновенно сильно продвинула всю биологию за последние 20 лет [2] — требует «пришивания» к биологическому образцу светящейся молекулы, неизвестно насколько сильно меняя при этом его свойства.
В связи с этим все бóльшую популярность приобретают методы исследования, которые позволяют наблюдать образец неинвазивно (прижизненно) — если речь идет о целых клетках или даже организмах — или, по крайней мере, в молекулярном окружении, минимально отличающемся от «привычного» для биомолекулы. Так, например, оригинальное применение эффекта индуктивного резонансного переноса энергии позволило вдохнуть вторую жизнь в оптическую спектроскопию [3] — тоже, прямо скажем, не молодой метод, — позволив ему действовать прямо на живой клетке, в которой концентрации большинства исследуемых белков намного ниже, чем может «почувствовать» обычная спектроскопия.
Одна из основных задач биохимии — изучать взаимодействие биологических молекул и реакции между ними. В частности, при характеристике какого-нибудь рецептора (для определенности, будем рассматривать рецепторы мембраны клетки, такие как адреналиновый рецептор [4]) очень важно знать, с какими молекулами (лигандами) он взаимодействует и с какой «силой» происходит это взаимодействие. Для характеристики этой «силы» в биохимии существует понятие константы диссоциации (Kd), равное той концентрации лиганда, при которой половина молекул белка-рецептора уже связалась с лигандом. Чем меньше эта константа — тем сильнее связывание; в биологии константы −9 М (1 наномоль на литр) соответствуют очень «сильному» и селективному связыванию. Самым прочным связыванием среди биомолекул отличаются пары биотин—стрептавидин и рибонуклеаза барназа—барстар: их константы связывания около 10−15 М (!).
Используется два основных способа измерения Kd: по производимому лигандом посредством рецептора биологическому ответу (если он известен и его легко померить, как например активацию аденилатциклазы) или по конкурентному замещению «стандартного» радиоактивного лиганда. Оба этих способа имеют недостатки: в первом необходимо знать, какой именно ответ должна вызвать молекула, ну и, кроме того, данные все равно получаются косвенными. Второй же требует использования радиоактивных веществ и, что самое главное, измерения проводят уже не на живых клетках, а на образцах разрушенных (лизированных) мембран, содержащих исследуемый рецептор.
Ученые из университета Вандербильта (Теннесси, США) разработали уникальный способ изучать взаимодействия между биологическими молекулами в мембранах, например — определять параметр Kd для взаимодействия рецепторов с лигандами [5], [6]. Самое важное преимущество метода — что молекулы не нужно изменять ни генетическим, ни химическим путем, а значит и условия проведения эксперимента могут быть очень близкими к естественным.
Используемая технология основана на интересном физическом эффекте: изменении коэффициента преломления жидкости в микрогидродинамической ячейке, содержащей исследуемую систему, — причем только в том случае, если произошло специфическое взаимодействие двух молекул. (Похожее явление наблюдается и в плазмонном резонансе [3].) Это событие регистрируется при помощи луча лазера, который, отражаясь от экспериментальной ячейки с раствором везикул с изучаемыми молекулами и рассеиваясь в зависимости от измененного показателя преломления среды, интерферирует сам с собой, что и регистрируется цифровой камерой. Компьютерный алгоритм, анализирующий изображение, с помощью обратного преобразования Фурье вычисляет изменение фазы лазерного луча, по которой (проведя эксперимент при различных концентрациях) можно рассчитывать константу взаимодействия Kd (рис. 1). Метод получил название интерферометрии обратного рассеяния [5].
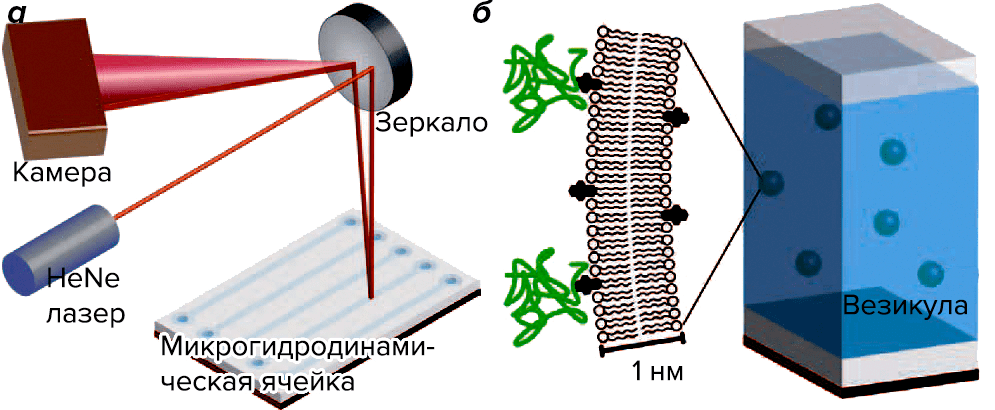
Рисунок 1. Установка для интерферометрии обратного рассеяния. а — Особая конструкция микрогидродинамической ячейки позволяет исследовать зависимость обратного рассеяния лазерного луча от молекулярных событий, происходящих в системе. Очень чувствительная к изменениям интерференционная картина позволяет регистрировать малейшие изменения показателя преломления среды в ячейке в ответ на специфическое взаимодействие молекул. б — В ячейке содержится взвесь однослойных везикул примерно одинакового размера, полученных из нативных клеточных мембран с целью регистрации межмолекулярных взаимодействий в мембране. Несмотря на то, что везикулы в миллионы раз мельче самих клеток, состав мембраны в обоих случаях практически идентичен, что очень важно для точности измерений.
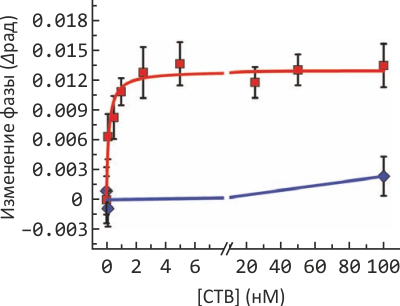
Рисунок 2. Изменение показателя преломления среды в зависимости от «силы» взаимодействия токсина холеры и ганглиозида GM1. Эксперимент при нескольких концентрациях токсина (красная кривая) позволил вычислить для него константу связывания Kd; выбранный для отрицательного контроля и не связывающийся с GM1 столбнячный токсин показан синим.
В качестве «простого» примера для измерения межмолекулярного распознавания использовали синтетические липидные везикулы, содержащие моносиалоганглиозид GM1, участвующий в развитии нервной ткани и играющий по совместительству роль «троянского коня», выступая «якорем» для токсина холеры и родственных ему, начинающих проникновение в клетку именно со связывания с этим ганглиозидом. «Партнером» для GM1 выступал не целиковый токсин холеры, а только его нетоксичный B-домен, отвечающий за специфическое связывание с «якорем». Проведя измерения при нескольких концентрациях холерного токсина (и другого, «контрольного», вещества, которое не связывается с GM1), исследователи получили простую и очень характерную для биохимии кривую с насыщением, из которой легко вычисляется Kd≈130 пМ. Это значение несколько отличается от результатов, полученных в других экспериментах (например, по данным флуоресцентной микроскопии в искусственных липидных бислоях на подложке). Исследователи объясняют это более нативным (приближенным к существующему в природе) состоянием мембраны в используемых в этом эксперименте везикулах, поскольку в мембранах на подложке (используемых, например, в атомно-силовой микроскопии) подвижность белков существенно снижена.
Дальнейшие эксперименты проводили уже с тремя «настоящими» мембранными рецепторами, для которых измеряли константы Kd связывания с различными лигандами:
- Гидролазой амидов жирных кислот, участвующей в работе нейронов и являющейся мишенью некоторых новых анальгетических лекарств.
- Хемокиновым рецептором CXCR4, пространственная структура которого была опубликована в 2010 году [7] (везикулы с рецептором получали из мембран клеток лимфомы T, где он содержится в большом количестве).
- Рецептором γ-аминомасляной кислоты GABAB, известным тем, что его очень сложно выделить и очистить, а, следовательно, и работать с ним.
Во всех случаях методика интерферометрии обратного рассеяния позволила определить константы связывания лигандов с рецепторами в нативных мембранах, чего, как отмечают ученые, не позволяет сделать ни один другой метод, в котором не используется мечение образцов и/или различная их фиксация на твердой подложке. Тем самым эта технология становится уникальным способом регистрации межмолекулярных взаимодействий в мембране, приближенной к мембранам клеток, а значит, и получаемые результаты больше соответствуют действительности, чем когда либо.
Ученые уже запатентовали этот метод измерения и готовятся выпустить коммерческий прибор, действующий на принципе интерферометрии обратного рассеяния. Если методика и в реальной лабораторной работе окажется надежной, точной и не капризной, ей можно предсказать большое будущее не только в фундаментальных биологических исследованиях, но и в таких индустриальных применениях, как фармакология и дизайн новых лекарственных субстанций [8].
Первоначально в сильно сокращенном виде статья была опубликована в «Науке и жизни» [9].
Литература
- Рулетка для спектроскописта;
- Флуоресцирующая Нобелевская премия по химии;
- Миграция энергии плазмонного резонанса: вторая жизнь оптической спектроскопии;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Michael M Baksh, Amanda K Kussrow, Mauro Mileni, M G Finn, Darryl J Bornhop. (2011). Label-free quantification of membrane-ligand interactions using backscattering interferometry. Nat Biotechnol. 29, 357-360;
- New laser technique opens doors for drug discovery. (2011). ScienceDaily;
- Структуры рецепторов GPCR «в копилку»;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Чугунов А.О. (2011). Как общаются белки? Возьмите лазер и узнайте! «Наука и жизнь». 5, 3–4.